Похожие презентации:
Коллигативные свойства растворов. Лекция №12
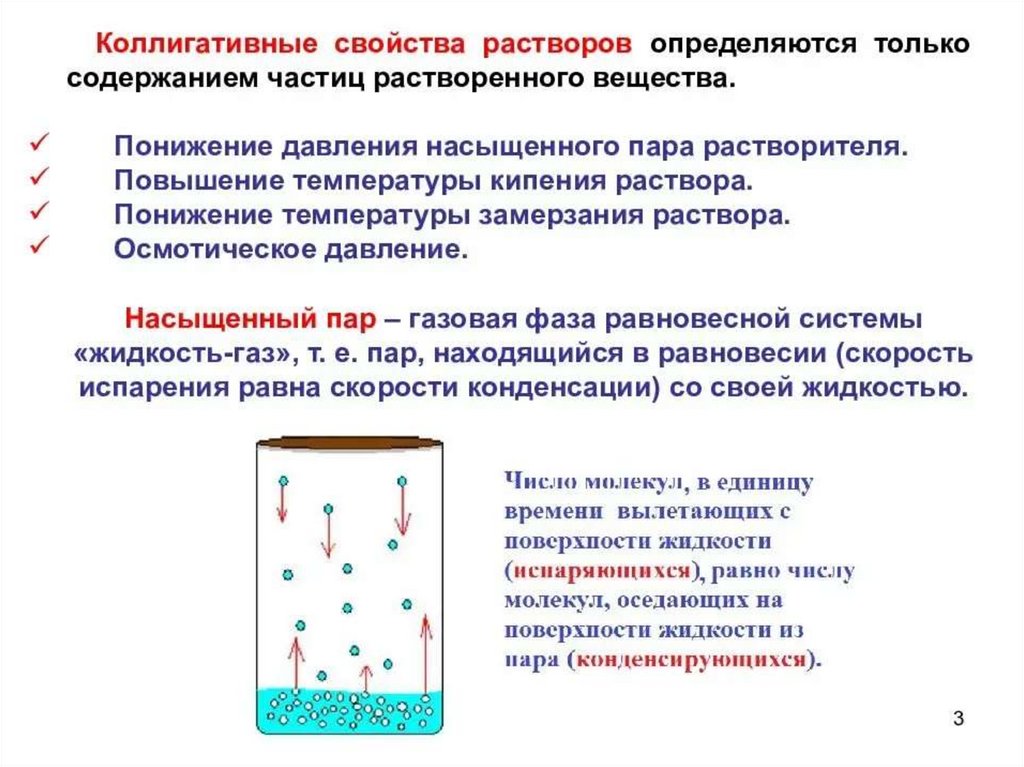
1.
2.
3.
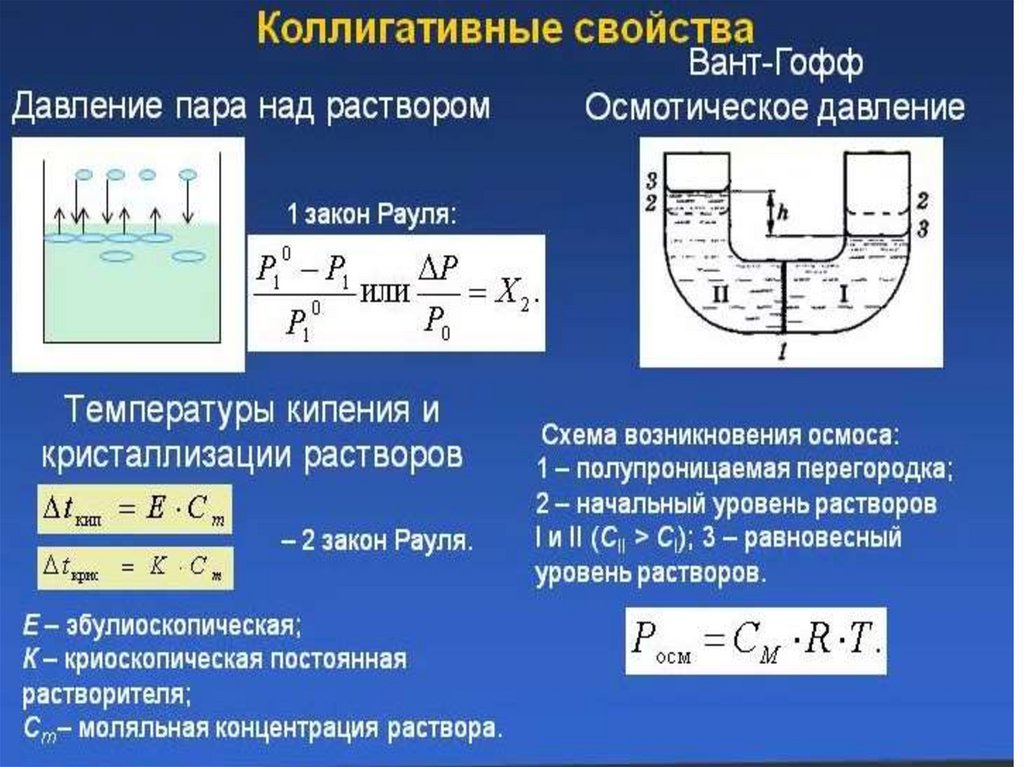
Парциальное давление – это давление, котороеоказывал бы газ, входящий в состав газовой смеси, если бы
он один занимал объём, равный объёму смеси при той же
температуре. Общее давление смеси газов равно сумме
парциальных давлений отдельных составляющих смеси.
В растворе концентрация молекул
растворителя в поверхностном слое
меньше, чем в чистом растворителе
(молекулы растворенного вещества
сольватируясь
(гидратируясь)
занимают
часть
поверхности
раствора),
поэтому
равновесие
достигается при меньшем давлении
насыщенного пара. Экспериментально
доказано,
что
такое
понижение
давления паров напрямую зависит от
количества растворенного вещества.
4.
5.
Изотонический коэффициент (фактор Вант-Гоффа) — это параметр,не имеющий размерности, который характеризует поведение какого
– либо вещества в растворе. То есть, изотонический коэффициент
показывает, разницу содержания частиц в растворе электролита по
сравнению с раствором неэлектролита такой же концентрации. Он
тесно связан со степенью диссоциации и выражается следующим
выражением:
i =1+α(n—1), где
N – количество ионов, на которые диссоциирует вещество.
α – степень диссоциации.
6.
Второй закон РауляДавление насыщенных паров над раствором при
любой температуре будет меньше, чем над
чистым растворителем, и равенство его
внешнему давлению будет достигаться при
более высокой температуре. Таким образом,
температура кипения раствора нелетучего
вещества всегда выше, чем температура кипения
чистого растворителя при том же давлении.
Повышение температуры кипения бесконечно
разбавленных растворов нелетучих веществ не
зависит от природы растворённого вещества и
прямо пропорционально моляльной
концентрации раствора
7.
Ткип.р-ра - Ткип.р-ля = ∆ Ткип = Е‧ CmE—эбулиоскопическая константа,
Cm – моляльная концентрация растворенного
вещества.
Физический смысл коэффициента Е
(эбулиоскопической постоянной растворителя) это повышение температуры кипения раствора с
концентрацией 1 моль/кг. Для воды она равны 0.52
K·моль/1·кг соответственно. Поскольку одномоляльный раствор не является бесконечно
разбавленным, второй закон Рауля для него не
выполняется, и величины этих констант получают
экстраполяцией зависимости из области малых
концентраций до m = 1 моль/кг.
8.
ΔTкип = i·E· Cm для электролитовПовышение температуры кипения растворов
даёт возможность экспериментально
определять молярные массы соединений,
неспособных к диссоциации в данном
растворителе; его можно использовать также
для определения степени диссоциации
электролитов. Этот метод называется
эбулиоскопическим.
9.
Задача.Определите
температуры
кипения
раствора, содержащего 18 г. глюкозы (C6H12O6)в
180 г. воды.
Решение. Эбулиоскопическая постоянная воды Е
= 0,52. Определим моляльность раствора.
По определению моляльной концентрации Сm =
1000mв-во/M×mрастворитель= 1000×18/180×180 = 0,556
моль/кг.
М(C6H12O6) = 12×6 + 12 + 16×6 = 180
Определим температуру кипения:
Δ Ткип = Cm×Е = 0,556×0,52 = 0,289 о. Ткип = 100 +
Δt = 100,289оС.
10.
Задача. Сколько граммов глюкозы С6Н12О6 былорастворено в 0,5л воды, если температура кипения
полученного раствора составила 1020С?
Решение. Запишем имеющие данные:
Е (воды) = 0,52
Ткип (воды) = 100ºС
M(С6Н12О6) = 12·6+1·12+16·6 = 180 г/моль
Сm = 1000mв-во/M×mрастворитель
Из этой формулы следует, что mглюк. = Сm
М×mрастворитель/1000
Δ Ткип = Cm×Е Δ Ткип = 102 – 100 = 20
Объединяя эти формулы, получаем mглюк. =
500·2·180/1000·0,52 = 348,8 г.
11.
Определитетемпературы
кипения
раствора,
содержащего 111 г. хлорида кальция в 1000 г. воды.
Степень диссоциации 75%.
Решение. Для электролитов следует учитывать
изотонический коэффициент.
CaCl2 = Ca2+ + 2Clпри диссоциации хлорида
кальция образуется 3 иона.
i (CaCl2) = 1 + α(k - 1) = 1 + 0,75(3 - 1) = 2,5.
М(CaCl2) = 111
Определим моляльность раствора.
Сm = 1000mв-во/M×mрастворитель = 1000×111/111×1000 = 1.
Определим температуру кипения.
Δt = i×Cm×Е = 2,5×1×0,52 = 1,3 о. Ткип = 100 + Δt =
101,3оС.
12.
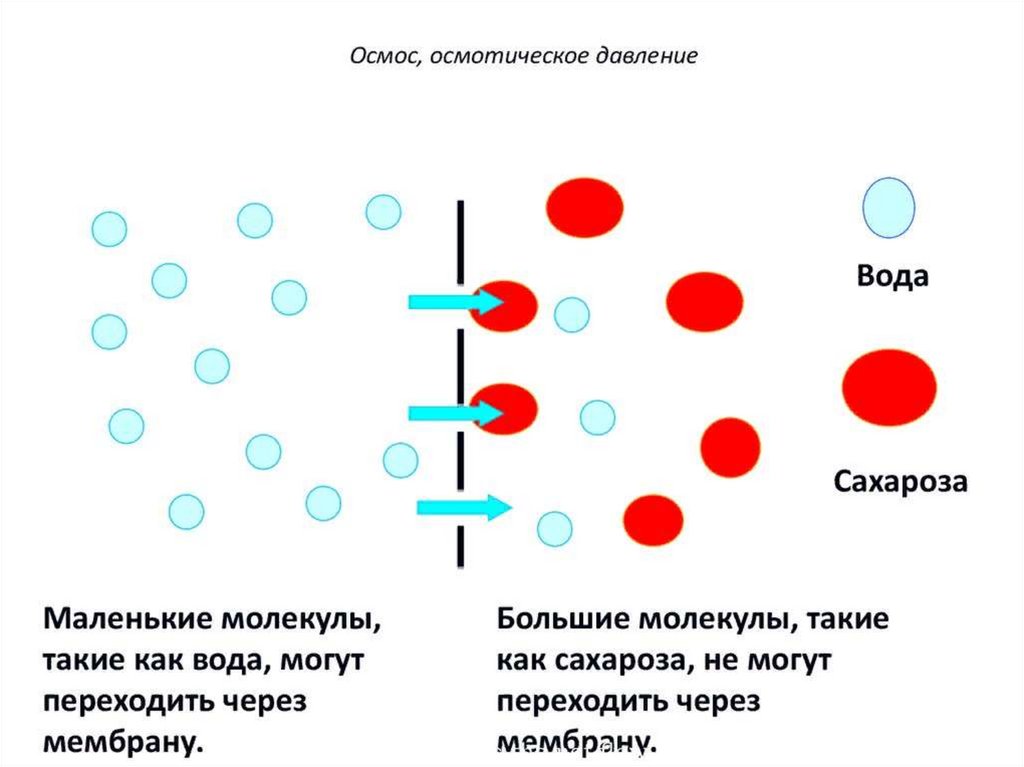
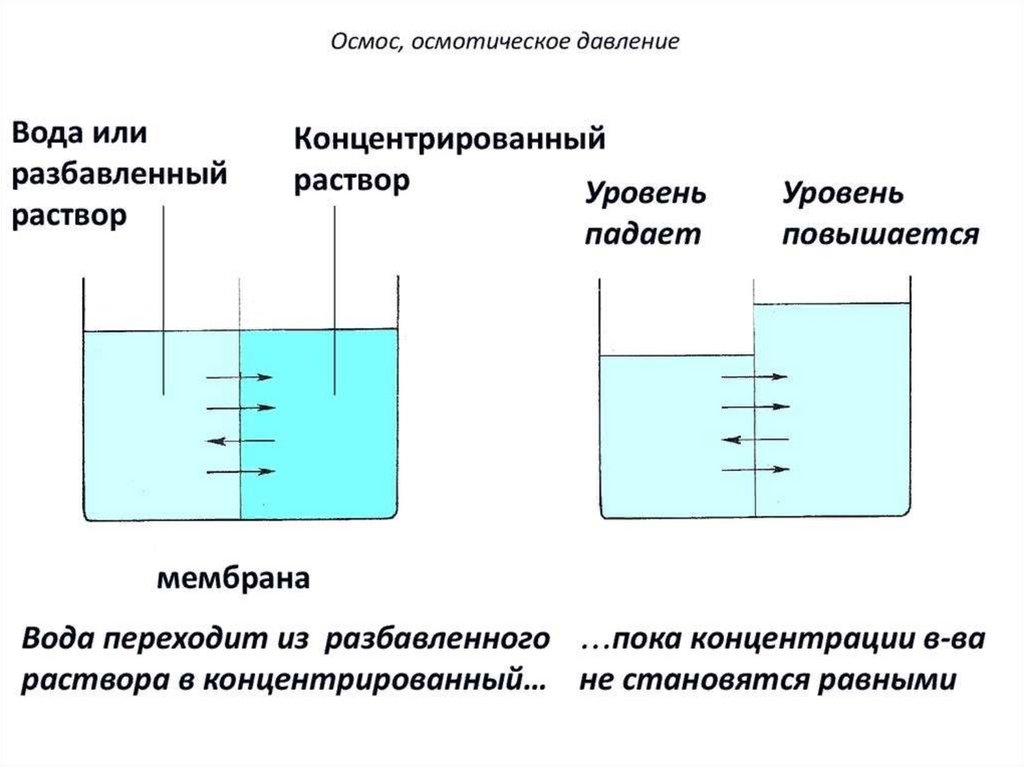
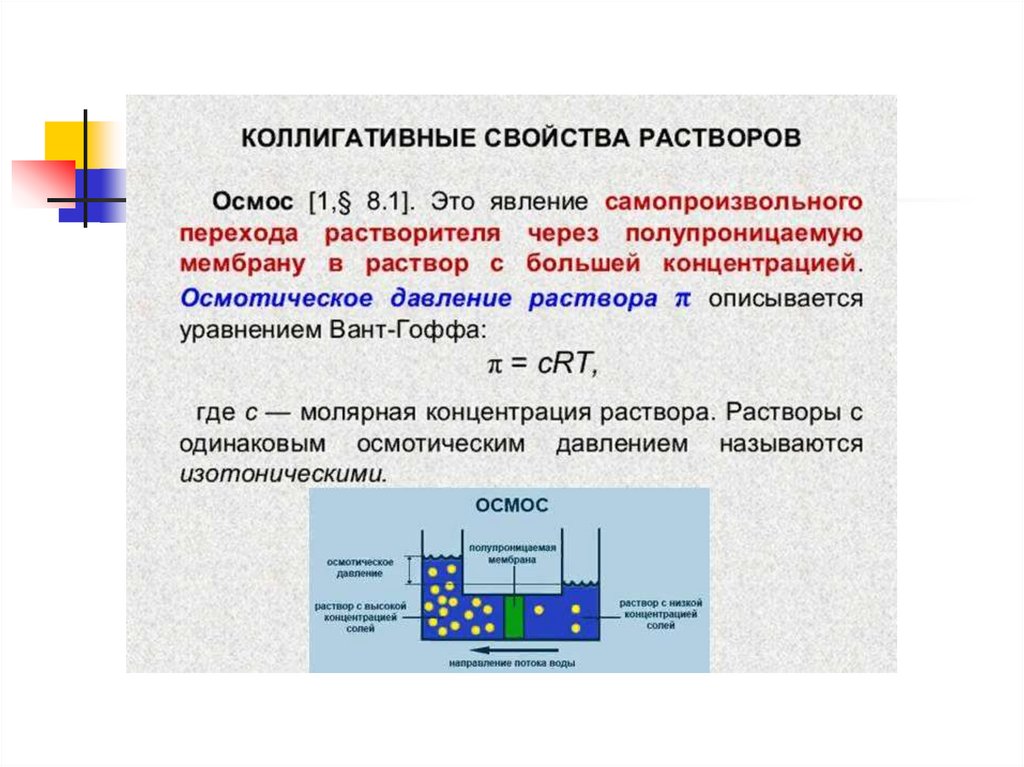
Парциальное давление паров над раствором отличается отдавления паров над чистым растворителем, что существенно
влияет на процессы кристаллизации (замерзания) растворителя.
Условием кристаллизации является равенство давления
насыщенного пара растворителя над раствором давлению пара
над твёрдым растворителем. Поскольку давление пара
растворителя над раствором всегда ниже, чем над чистым
растворителем, это равенство всегда будет достигаться при
температуре более низкой, чем температура замерзания
растворителя. Так, океанская вода начинает замерзать при
температуре около минус 2 °C.
Разность между температурой кристаллизации растворителя и
температурой начала кристаллизации раствора есть понижение
температуры кристаллизации. Поскольку по мере кристаллизации
растворителя из раствора концентрация последнего возрастает,
растворы не имеют определённой температуры замерзания и
кристаллизуются в некотором интервале температур.
13.
Понижение температуры кристаллизации бесконечноразбавленных
растворов
не
зависит
от
природы
растворённого вещества и прямо пропорционально моляльной
концентрации раствора (II закон Рауля ).
Ткр..р-ра - Ткр.р-ля = ∆ Ткр = К‧ Cm
К—криоскопическая константа,
Cm – моляльная концентрация растворенного вещества.
Физический смысл коэффициента К (криоскопическая
постоянной растворителя) это понижение температуры
замерзания раствора с концентрацией 1 моль/кг. Для воды она
равны Ккр = 1,86. K·моль/1·кг соответственно. Поскольку
одномоляльный раствор не является бесконечно разбавленным,
второй закон Рауля для него не выполняется, и величины этих
констант получают экстраполяцией зависимости из области
малых концентраций до m = 1 моль/кг.
14.
Задача. Определить температуру замерзания раствора,содержащего 18 г. глюкозы в 180 г. воды при 100 оС.
Решение.
По справочнику определим криоскопическую константу
воды.
Кк = 1,86.
Определим моляльность раствора.
Сm = 1000mв-во/Mr*mрастворитель = 1000*18/180*180 = 0,556
моль/кг.
Определим температуру замерзания.
Δt = Cm*Kk = 0,556*1,86 = 1,034 o. Тзам = 0 - Δt = - 1,034 оС.



























 Химия
Химия








