Похожие презентации:
Строение вещества. Первый закон термодинамики
1.
СТРОЕНИЕ ВЕЩЕСТВА.Первый закон термодинамики
1. Функции состояния и процесса (перехода)
2. Первый закон термодинамики
3. Теплоёмкость. Нагрев вещества
4. Закон Кирхгофа. Расчёт теплового эффекта
1
2.
СТРОЕНИЕ ВЕЩЕСТВА.1. Функции состояния. Внутренняя энергия и энтальпия
ΔT1 ΔT2 ΔT3 ΔT4 ΔT5
T2
T3
T4
T5
T1
T1
T2
T3
T4
T5
dT dT dT dT dT
Внутренняя энергия U (1850) – это функция состояния,
равная сумме кинетической энергии движения и
потенциальной энергии взаимодействия всех микрочастиц
в системе без учёта кинетической энергии всей системы в
целом и её потенциальной энергии положения.
dT 0
U2
dU ΔU
U1
Изменение функции состояния при круговом
процессе (цикле) на примере температуры T
dU 0
Ek Etr Erot Evib
Хейке Камерлинг-Оннес
(1853–1926), 1913
Нобелевская премия по физике
1913 г.
«за исследование свойств
вещества при низких
температурах, которые привели
к производству жидкого гелия»
Виды механического движения
двухатомной молекулы
Энтальпия H (1909, от гр. ενθαλπω – нагреваю) – функция
состояния, определяемая как тепловая функция или
теплосодержание системы.
H2
H U PV
dH dU d PV
dH ΔH
H1
dH 0
2
3.
СТРОЕНИЕ ВЕЩЕСТВА.1. Функции процесса (перехода). Работа и теплота
Vк
Жан Виктор Понселе
(1788–1867)
δW 0
δQ 0
Vк
W1 PdV
W2 PdV
Vн
Vн
W1 W2
3
4.
СТРОЕНИЕ ВЕЩЕСТВА.1. Функции процесса (перехода). Работа и теплота
Факторы интенсивности X и экстенсивности x для некоторых видов работ
Фактор
интенсивности Х
(обобщённая сила)
Сила перемещения
Fl, Н
Изменение фактора
экстенсивности dx
(обобщённая координата)
Бесконечно малое перемещение
dl, м
Работа поднятия системы в поле
земного тяготения – Wh
(совершается над системой)
Сила тяжести Fh, Н
Бесконечно малая высота dh, м
Работа изменения поверхности
раздела фаз системы – Ws
(совершается над системой)
Межфазное
натяжение , Н/м
Бесконечно малое увеличение
площади поверхности раздела
фаз ds, м2
Работа увеличения заряда системы –
Wq
(совершается над системой)
Работа против внешнего давления
WV
(совершается системой)
Электрический
потенциал , В
Бесконечно малое увеличение
заряда системы dq, Кл
Внешнее давление
Р, Па
Бесконечно малое увеличение
объёма системы dV, м3
Вид элементарной работы
W, Дж
Работа механического линейного
перемещения системы – Wl
(совершается над системой)
W Xdx
W W WV W PΔV
W W WV W PdV
4
5.
СТРОЕНИЕ ВЕЩЕСТВА.2. Первый закон термодинамики (закон сохранения энергии)
Формулировка Клаузиуса – Ранкина (1850)
Рудольф Юлиус
Эмануэль Клаузиус
(Готтлиб)
(1822–1888), 1888
ΔU Q W
dU Q W
ΔU Q PΔV
dU Q PdV
1. Изохорный процесс (V=const)
2. Изобарный процесс (P=const)
QP ΔU Δ PV Δ U PV ΔH
QV ΔU
QP dU d PV d U PV dH
QV dU
PV nRT
ΔH ΔU Δ PV ΔU ΔnRT
dH dU d PV dU dnRT
3. Изотермический процесс (T=const)
Уильям Джон
Макуорн Ранкин
(1820–1872), 1872
4. Адиабатический процесс (Q= 0)
T const U f T const
QT PΔV
QT PdV
nRT
dV
V
V
nRT
QT
dV nRTln 2
V
V1
V1
PΔV ΔU Q
PdV dU Q
V2
Сосуд Дьюара
5
6.
СТРОЕНИЕ ВЕЩЕСТВА.3. Теплоёмкость
Джозеф Блэк
(1728–1799)
Теплота Q – экстенсивное свойство системы
(зависит от количества вещества).
Температура Т – интенсивное свойство системы
(не зависит от количества вещества).
Теплоёмкость С – характеристика вещества.
Когда определённое количество теплоты Q подаётся к веществу,
находящемуся в одной фазе, температура вещества увеличится на
величину Т. Соотношение Q/ΔT называют теплоёмкостью.
Теплоёмкость
Дж
К
Удельная теплоёмкость
Дж
кг К
Молярная теплоёмкость Дж
моль К
Истинная теплоёмкость
Средняя теплоёмкость
СV
δQV U
dT T V
СV
QV
U
T2 Т1 T
СP
δQP H
dT T P
СP
QP
H
T2 Т1 T
6
7.
СТРОЕНИЕ ВЕЩЕСТВА.3. Связь между CP CV
H U
С P CV
T P T V
H U PV
H
U
V
P
T
T
T
P
P
P
U U
V
С P CV
P
T
T P T V
Юлиус Роберт фон Майер
(1814–1878)
Газы
PV RT
V
С P CV P
T P
Конденсированная фаза
(жидкости, твёрдые вещества)
V
T
P R R
T P
T P
С P CV R
V
P 0
T P
С P CV 0
Уравнение Майера
С P CV
7
8.
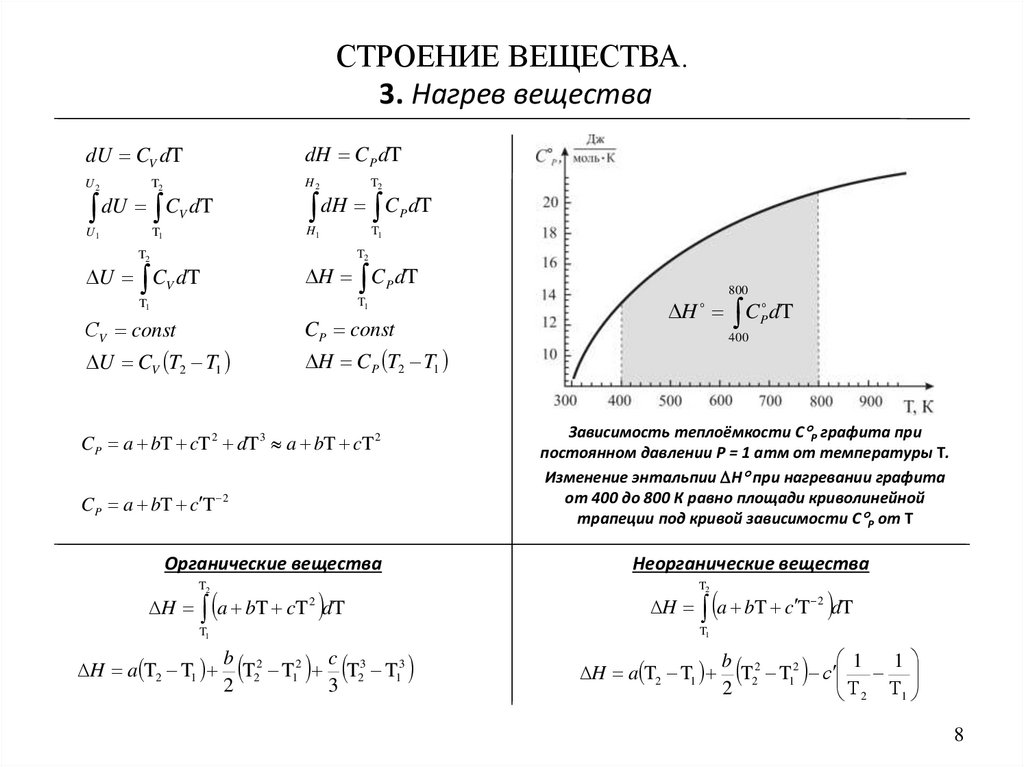
СТРОЕНИЕ ВЕЩЕСТВА.3. Нагрев вещества
dU CV dT
dH C P dT
U2
H2
T2
H1
T1
T2
dH C dT
dU C dT
P
V
U1
T1
T2
T2
H C P d T
U CV dT
T1
T1
C P const
СV const
400
Зависимость теплоёмкости С Р графита при
постоянном давлении P = 1 атм от температуры Т.
Изменение энтальпии Н при нагревании графита
от 400 до 800 К равно площади криволинейной
трапеции под кривой зависимости С Р от Т
C P a bT cT 2 dT 3 a bT cT 2
C P a bT c T 2
Органические вещества
Неорганические вещества
T2
2
T1
T1
b 2
c
T2 T12 T23 T13
2
3
ΔH a bT c T 2 dT
ΔH a bT cT dT
ΔH a T2 T1
ΔH CP dT
H C P T2 T1
U CV T2 T1
T2
800
ΔH a T2 T1
1
b 2
1
T2 T12 с
2
Т 2 Т1
8
9.
СТРОЕНИЕ ВЕЩЕСТВА.4. Закон Кирхгофа (1858)
aA bB cC dD
H Н
ΔС P С Р , прод СР , исх прод исх
T P Т Р
Дифференциальные уравнения
Густав Роберт Кирхгоф
(1824–1887)
Интегральное уравнение
Δ r H
T ΔС P
P
Δ rU
T ΔСV
V
Δ r H T2
T2
d Δ H ΔС dT
r
P
Δ r H T1
T1
Δ r H T2 Δ r H T1 ΔСP T2 T1
n
m
Развёрнутое уравнение
i 1
i 1
n
m
ΔC P Δa ΔbT ΔcT 2 Δc T 2
a pi ai прод pi ai исх
b pi bi прод pi bi исх
Δ r H T2
T2
d Δ H Δa ΔbT ΔcT Δc T dT
i 1
n
m
Δ r H T1
i 1
i 1
n
m
Δ r H T2 Δ r H T1 Δa T2 T1
i 1
i 1
c pi ci прод pi ci исх
c pi ci прод pi ci исх
2
2
i 1
r
T1
1 1
Δb 2
Δc 3
T2 T12
T2 T13 Δc
2
3
T2 T1
9








 Физика
Физика








