Похожие презентации:
Высокомолекулярные соединения. Общие понятия
1.
Высокомолекулярныесоединения. Общие понятия
2.
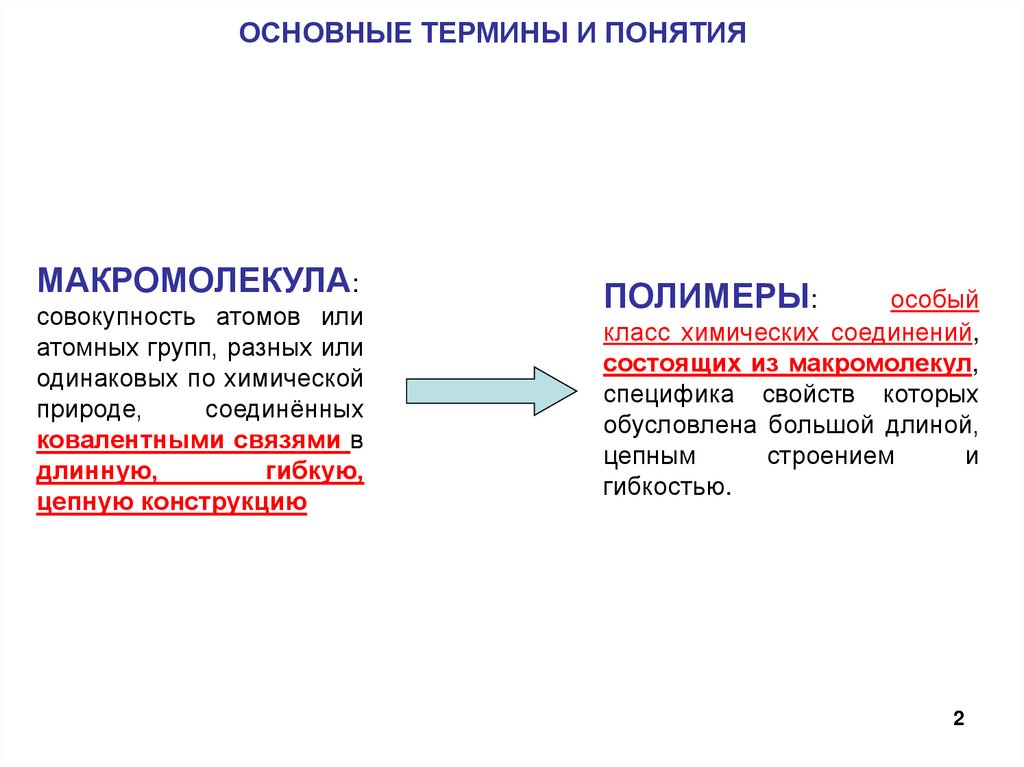
ОСНОВНЫЕ ТЕРМИНЫ И ПОНЯТИЯМАКРОМОЛЕКУЛА:
совокупность атомов или
атомных групп, разных или
одинаковых по химической
природе,
соединённых
ковалентными связями в
длинную,
гибкую,
цепную конструкцию
ПОЛИМЕРЫ:
особый
класс химических соединений,
состоящих из макромолекул,
специфика свойств которых
обусловлена большой длиной,
цепным
строением
и
гибкостью.
2
3.
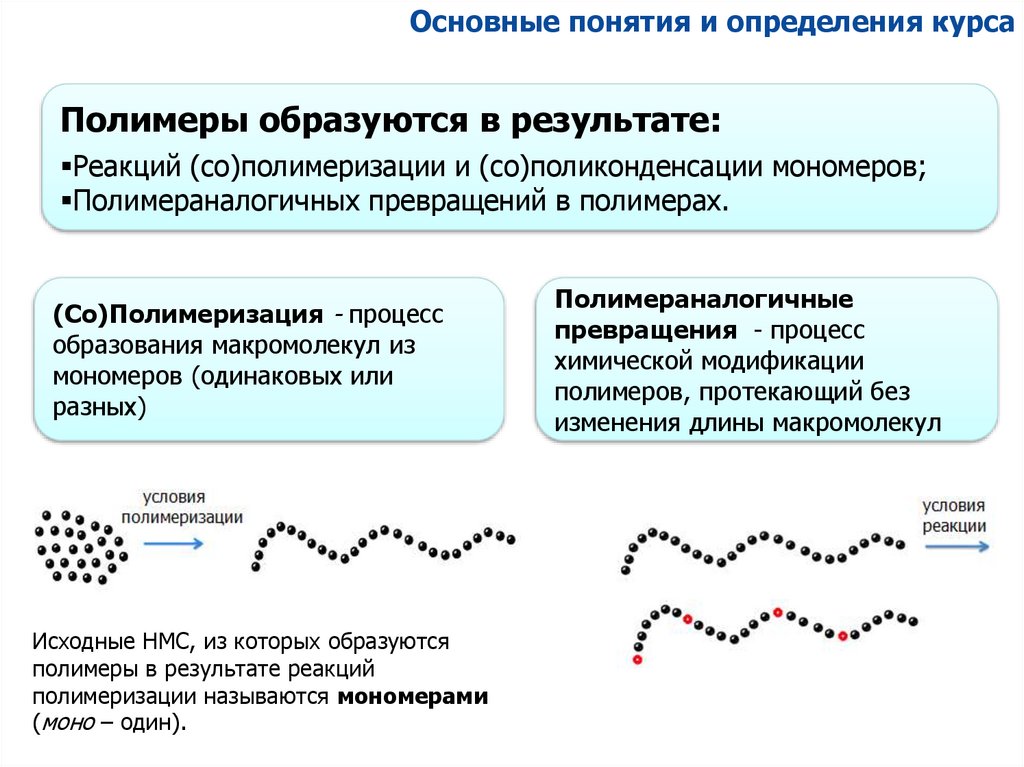
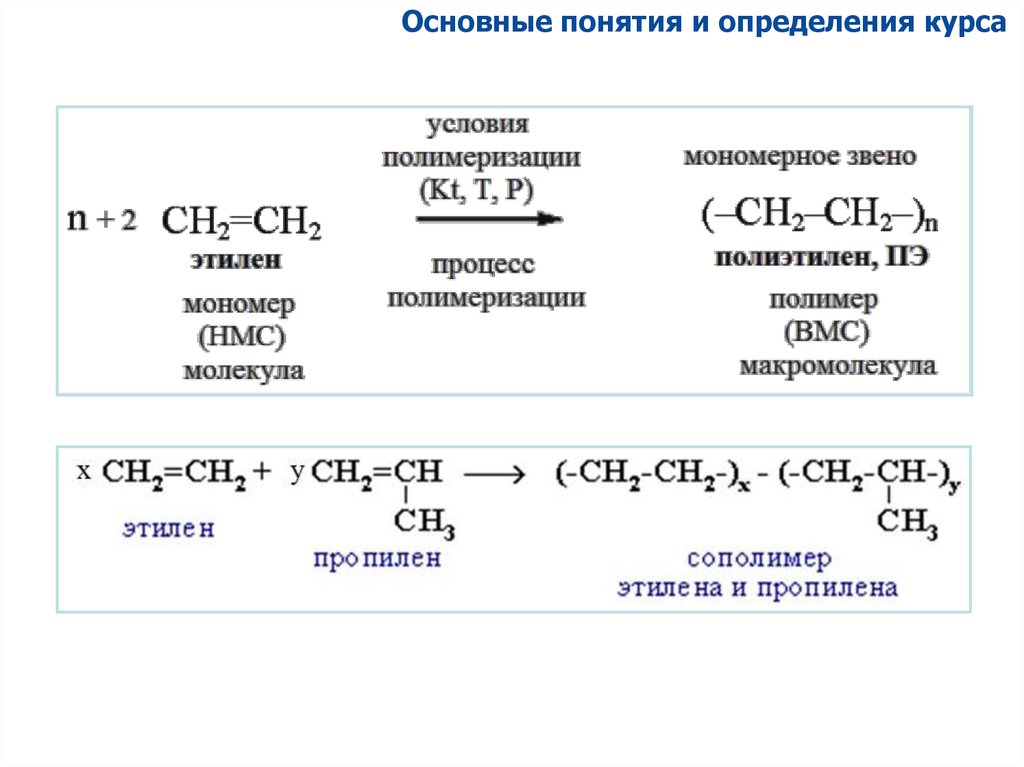
Основные понятия и определения курсаПолимеры образуются в результате:
Реакций (со)полимеризации и (со)поликонденсации мономеров;
Полимераналогичных превращений в полимерах.
(Со)Полимеризация - процесс
образования макромолекул из
мономеров (одинаковых или
разных)
Исходные НМС, из которых образуются
полимеры в результате реакций
полимеризации называются мономерами
(моно – один).
Полимераналогичные
превращения - процесс
химической модификации
полимеров, протекающий без
изменения длины макромолекул
4.
Основные понятия и определения курсаСтруктурная формула полимера –
строение повторяющегося звена, заключенное в скобки
(круглые, квадратные) с указанием n,
где n – степень полимеризации
ПЭ
(рац. ном-ра)
Если строение повторяющегося звена совпадает
по природе атомов,
по количеству атомов,
порядку связи атомов
со строением мономера, то повторяющееся звено называется
мономерным.
5.
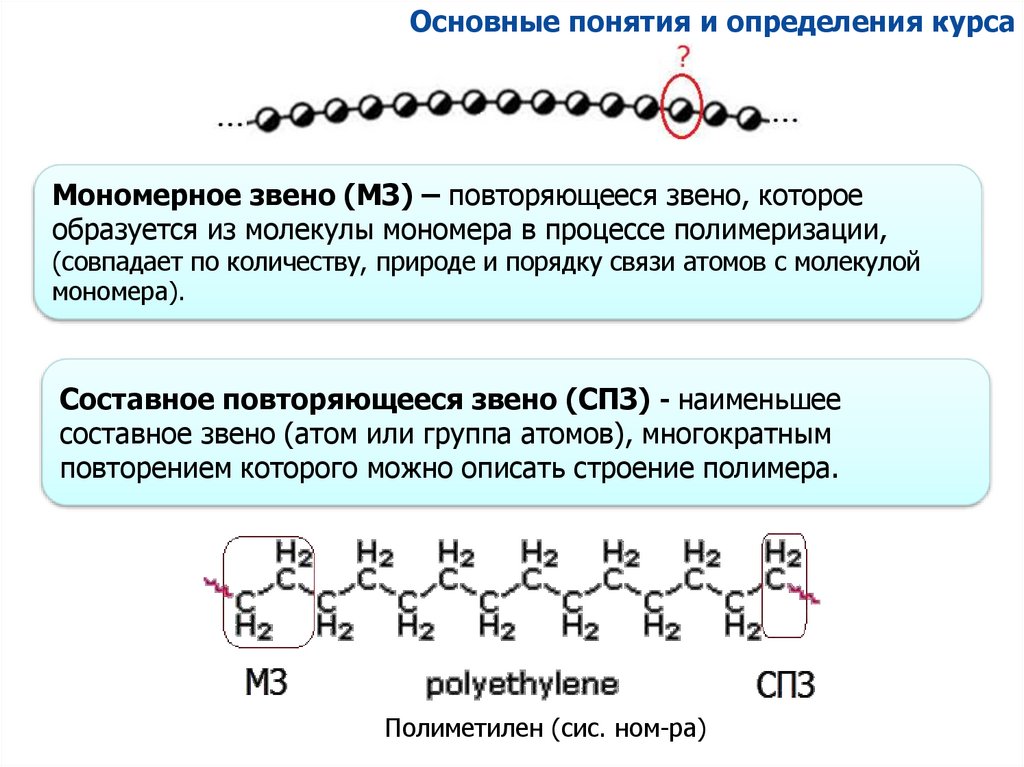
Основные понятия и определения курсаМономерное звено (МЗ) – повторяющееся звено, которое
образуется из молекулы мономера в процессе полимеризации,
(совпадает по количеству, природе и порядку связи атомов с молекулой
мономера).
Составное повторяющееся звено (СПЗ) - наименьшее
составное звено (атом или группа атомов), многократным
повторением которого можно описать строение полимера.
Полиметилен (сис. ном-ра)
6.
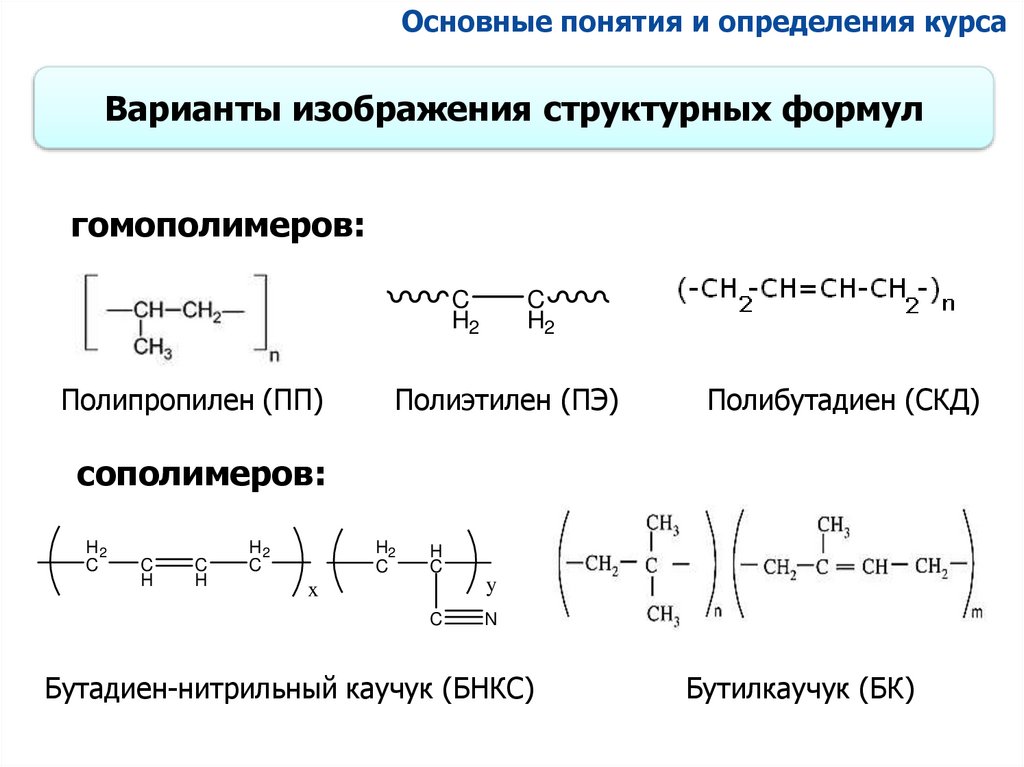
Основные понятия и определения курсаВарианты изображения структурных формул
гомополимеров:
C
H2
Полипропилен (ПП)
C
H2
Полиэтилен (ПЭ)
Полибутадиен (СКД)
сополимеров:
H2
C
C
H
C
H
H2
C
H2
C
H
C
y
x
C
N
Бутадиен-нитрильный каучук (БНКС)
Бутилкаучук (БК)
7.
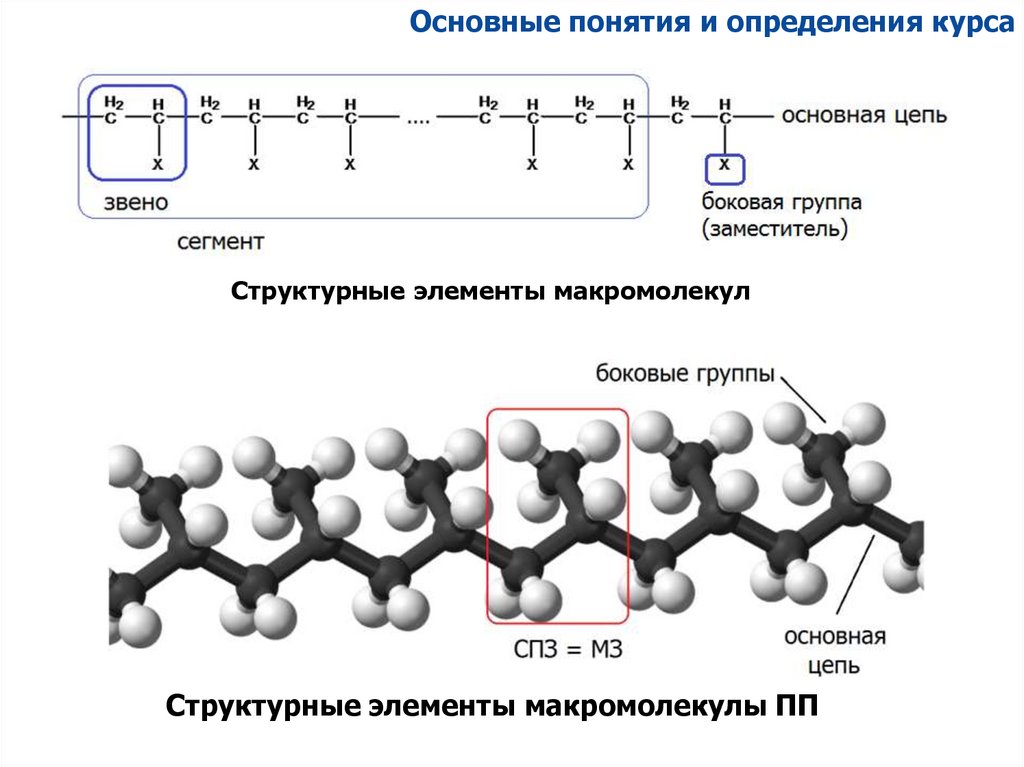
Основные понятия и определения курсаСтруктурные элементы макромолекул
Структурные элементы макромолекулы ПП
8.
Основные понятия и определения курса9.
Основные понятия и определения курсаСтепень полимеризации n (m, x, y в случае сополимеров)
отражает количество структурных единиц в молекулах,
может достигать сотни, тысячи единиц.
Молекулы полимеров имеют большую молекулярную
массу 104 – 106, чаще называются макромолекулами.
ММпол = nМзв
n = ММпол /Мзв
где ММпол - молекулярная масса полимера
Мзв - молекулярная масса повторяющегося звена
Свойства полимера (физические и химические) не изменяются
при добавлении или удалении одного или нескольких повторяющихся
(мономерных) звеньев.
10.
Основные понятия и определенияОлигомеры - соединения, построенные из
повторяющихся мономерных единиц, при этом степень
полимеризации невелика (олигос – немного), ММ ~103.
Сходство с полимерами:
состоят из повторяющихся
структурных единиц
Отличия от полимеров:
имеют меньшую ММ
при добавлении или
удалении одного или
нескольких
мономерных звеньев
свойства олигомера
изменяются
11.
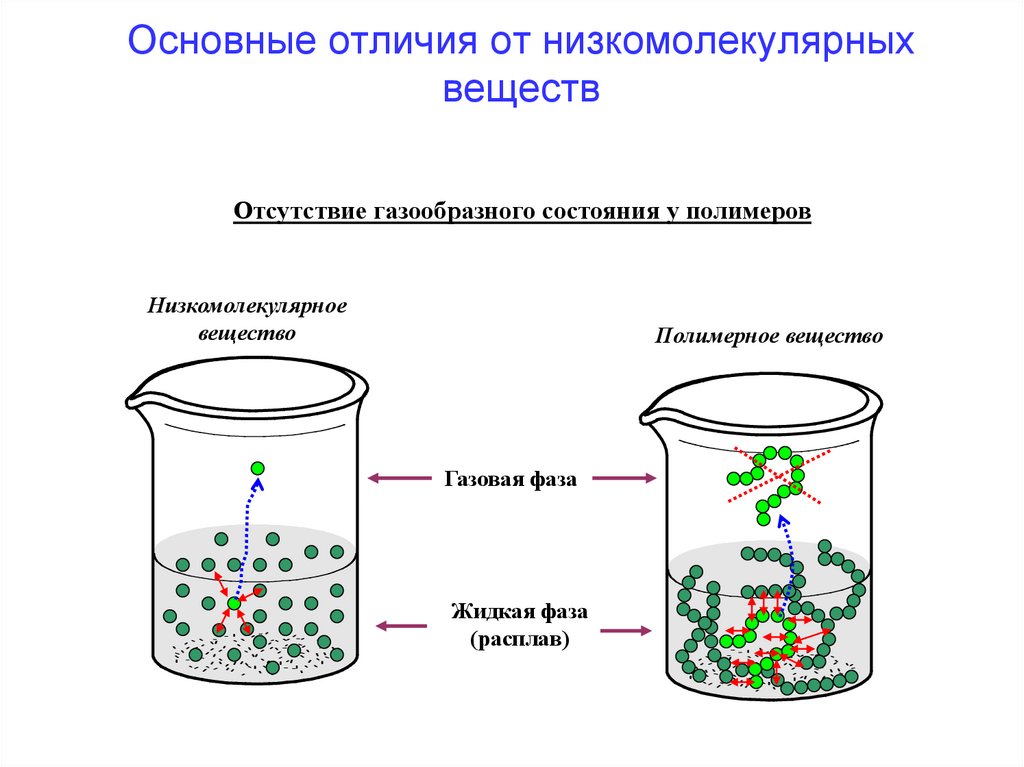
Основные отличия от низкомолекулярныхвеществ
Отсутствие газообразного состояния у полимеров
Низкомолекулярное
вещество
Полимерное вещество
Газовая фаза
Жидкая фаза
(расплав)
12.
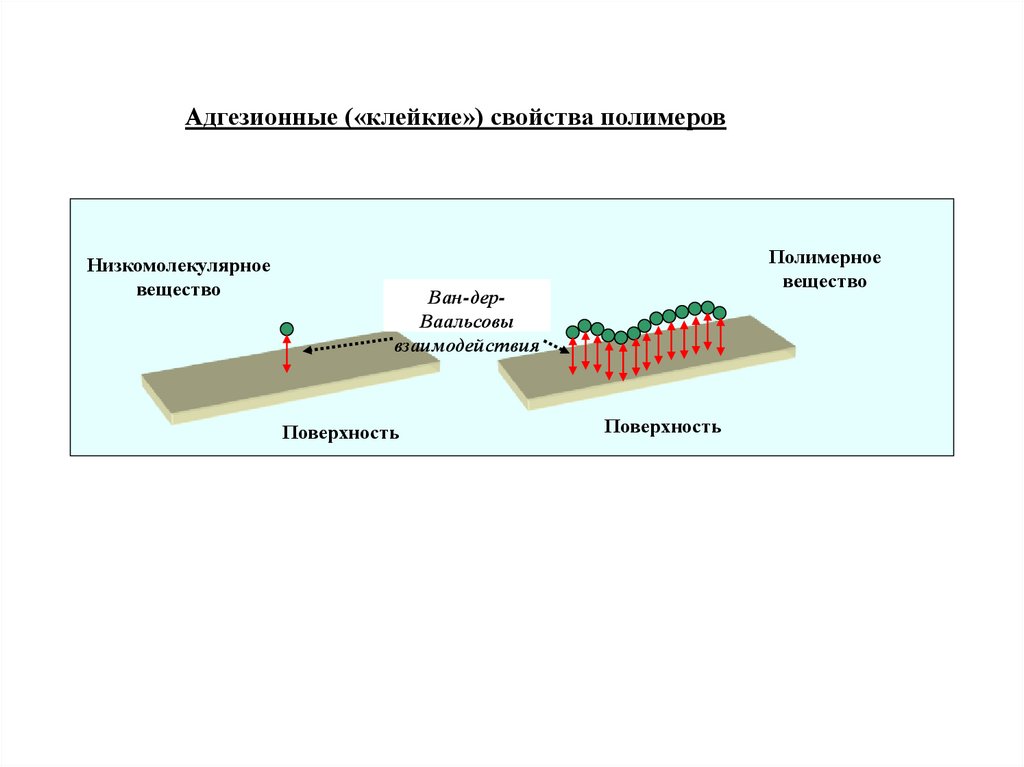
Адгезионные («клейкие») свойства полимеровНизкомолекулярное
вещество
Полимерное
вещество
Ван-дерВаальсовы
взаимодействия
Поверхность
Поверхность
13.
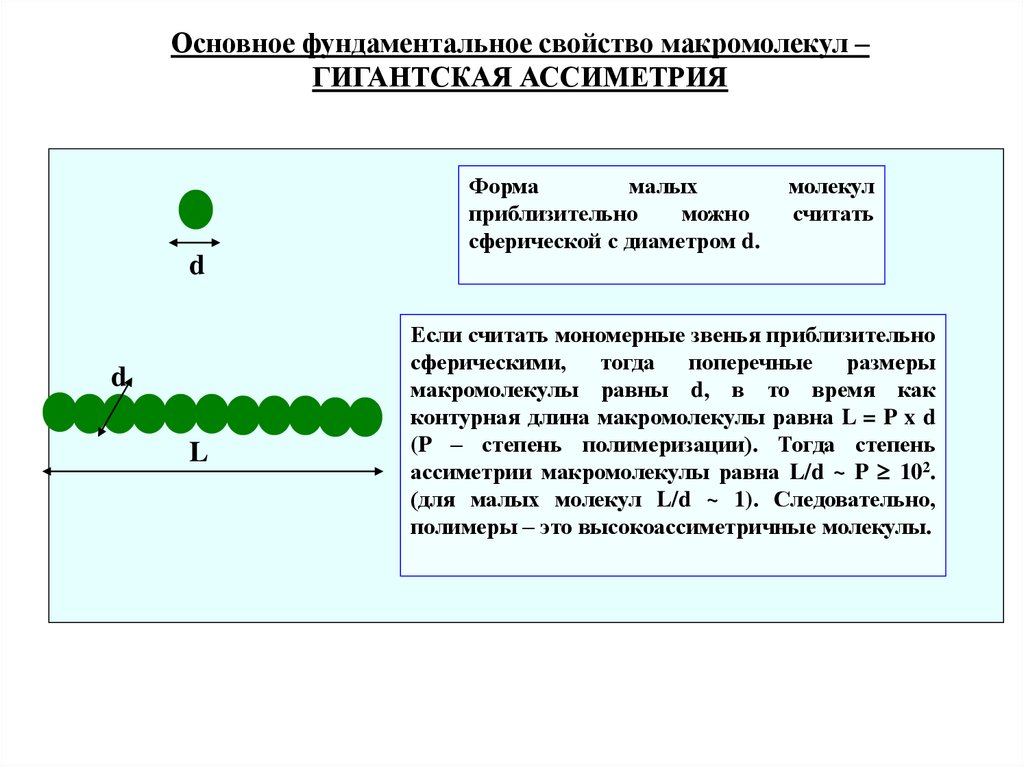
Основное фундаментальное свойство макромолекул –ГИГАНТСКАЯ АССИМЕТРИЯ
Форма
малых
приблизительно
можно
сферической с диаметром d.
молекул
считать
d
d
L
Если считать мономерные звенья приблизительно
сферическими, тогда поперечные размеры
макромолекулы равны d, в то время как
контурная длина макромолекулы равна L = P x d
(P – степень полимеризации). Тогда степень
ассиметрии макромолекулы равна L/d ~ P 102.
(для малых молекул L/d ~ 1). Следовательно,
полимеры – это высокоассиметричные молекулы.
14.
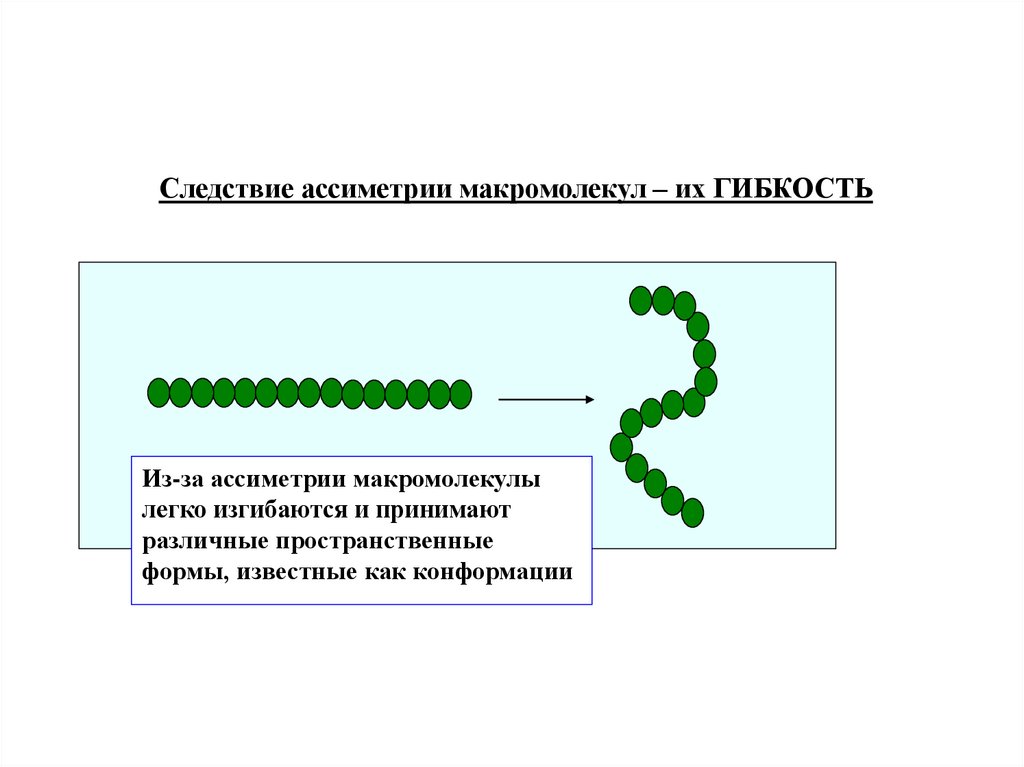
Следствие ассиметрии макромолекул – их ГИБКОСТЬИз-за ассиметрии макромолекулы
легко изгибаются и принимают
различные пространственные
формы, известные как конформации
15.
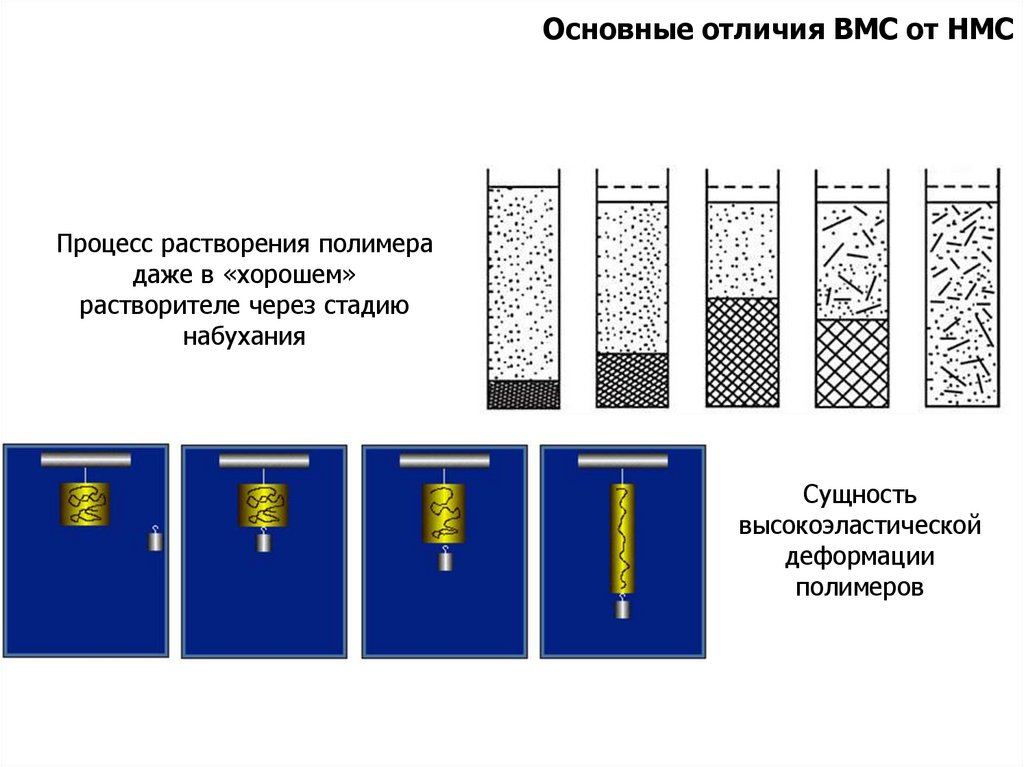
Основные отличия ВМС от НМССпособны существовать только в конденсированном
(твердом или жидком) состоянии.
Растворы полимеров (даже разбавленные) имеют вязкость
намного выше, чем более концентрированные растворы НМС.
Растворение полимеров даже в термодинамически хороших
растворителях проходит через стадию набухания.
Полимеры способны к пленко- и волокнообразованию.
Полимеры способны к развитию высокоэластической
деформации, большой по величине и обратимой по своему
характеру (каучуки).
Химические реакции полимеров носят сложный характер;
протекают неравномерно по длине макромолекулы.
16.
Основные отличия ВМС от НМСПроцесс растворения полимера
даже в «хорошем»
растворителе через стадию
набухания
Сущность
высокоэластической
деформации
полимеров
17.
Классификация, строение, номенклатура,изомерия полимеров
по происхождению
1. природные
2. искусственные
3. синтетические
по геометрии основной цепи
по типу атомов в
1. линейные
молекуле
2. разветвленные
органические
3. гребнеобразные
элементоорганические
4. лестничные
неорганические
5. дендритные и др.
по типу мономерных
звеньев
1. гомополимеры
2. сополимеры
а) статистические
б) чередующиеся
в) блочные
г) привитые
по отношение к
температуре
1. термоплатичные
2. термореактивные
2222
18.
Классификация полимеровПо происхождению
Природные (натуральные) – полимеры, выделенные из сырья
животного, растительного, микробиологического, минерального
происхождения. Образуются в ходе фото-, биосинтеза из
простейших соединений под действием ферментов, света и других
факторов;
Искусственные - природные полимеры, подвергнутые химической,
физической или биологической модификации;
Синтетические – полимеры, полученные путем химического синтеза из
молекул мономеров или путем полимераналогичных превращений в
полимерах.
18
19.
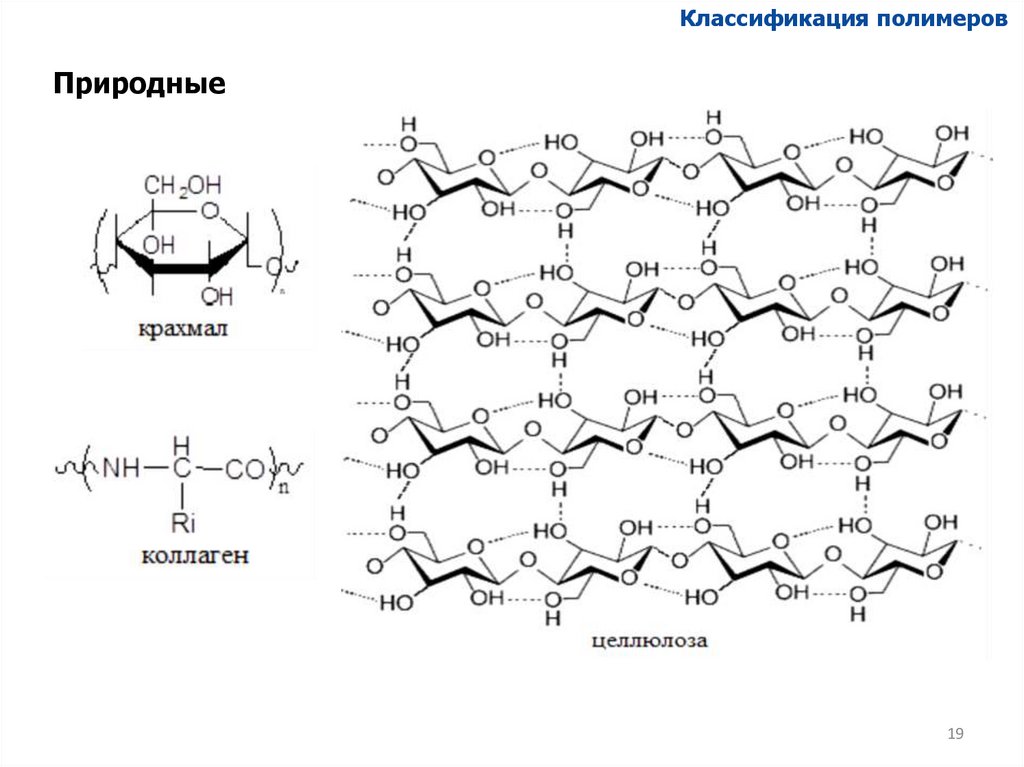
Классификация полимеровПриродные
19
20.
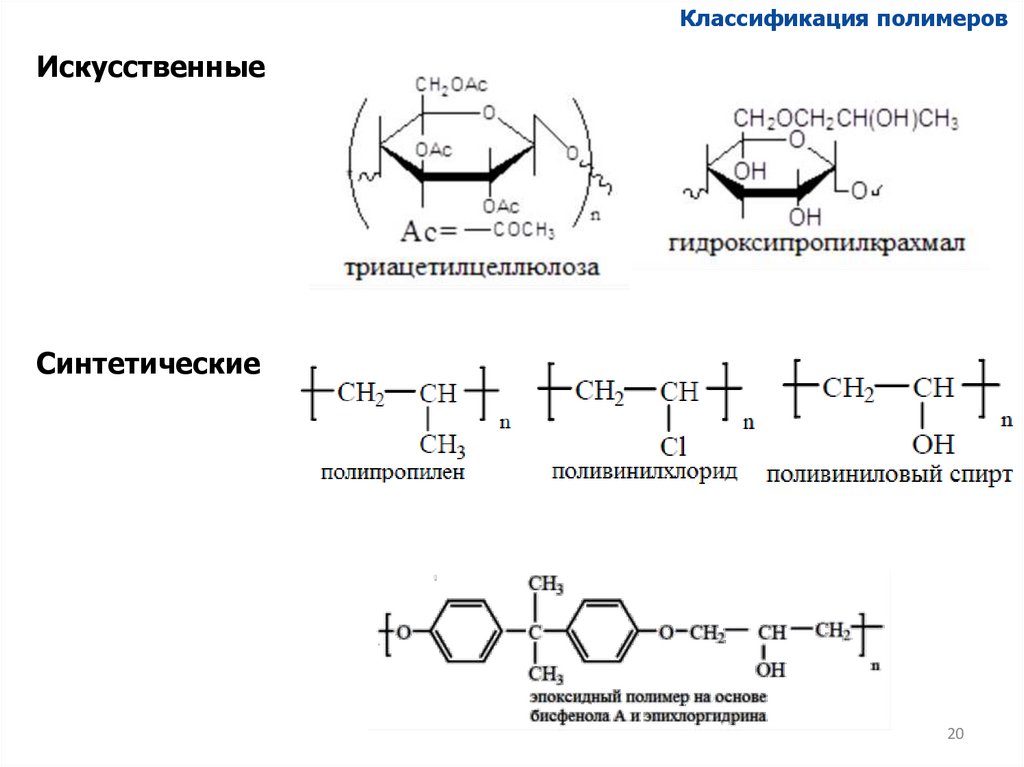
Классификация полимеровИскусственные
Синтетические
20
21.
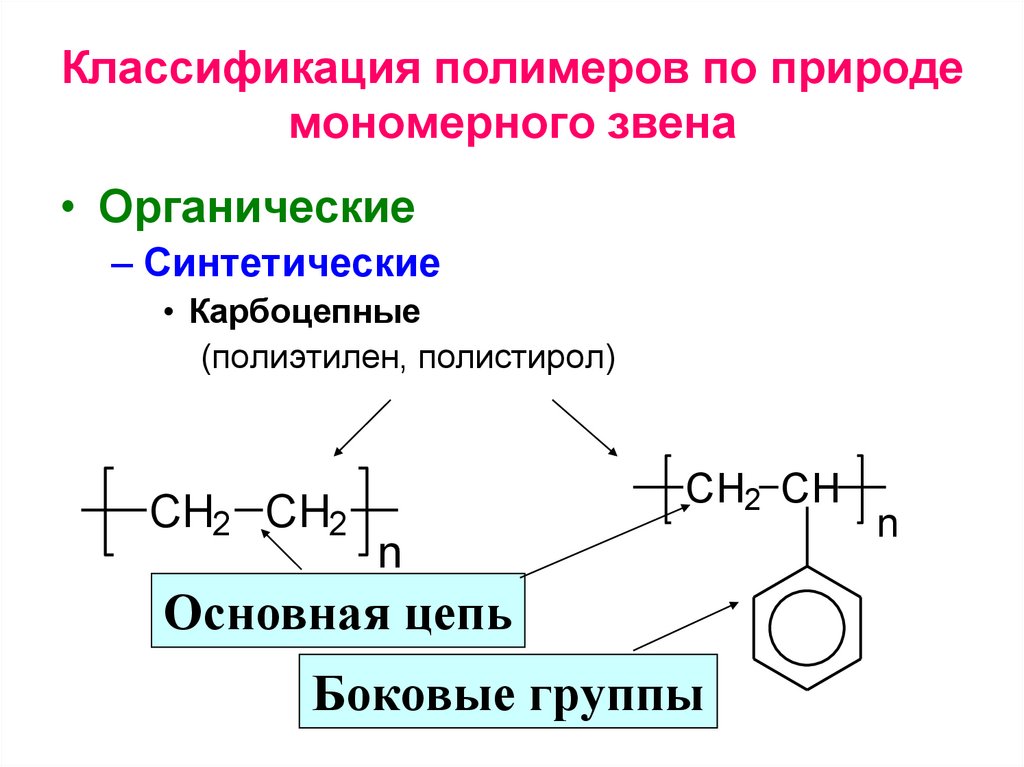
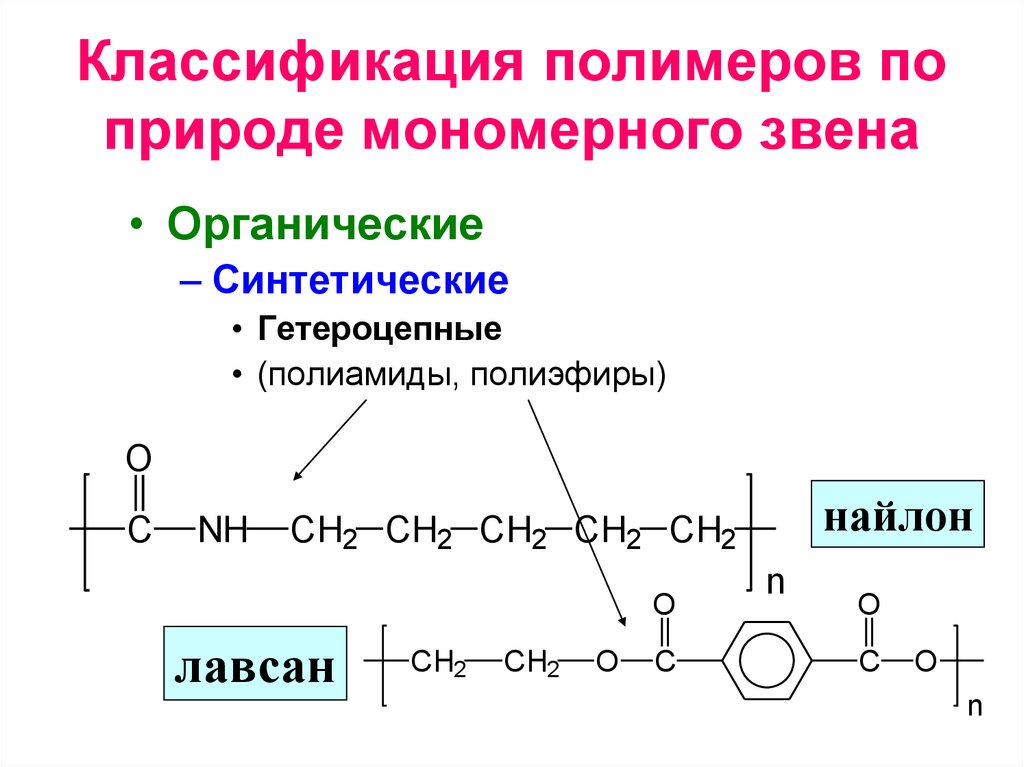
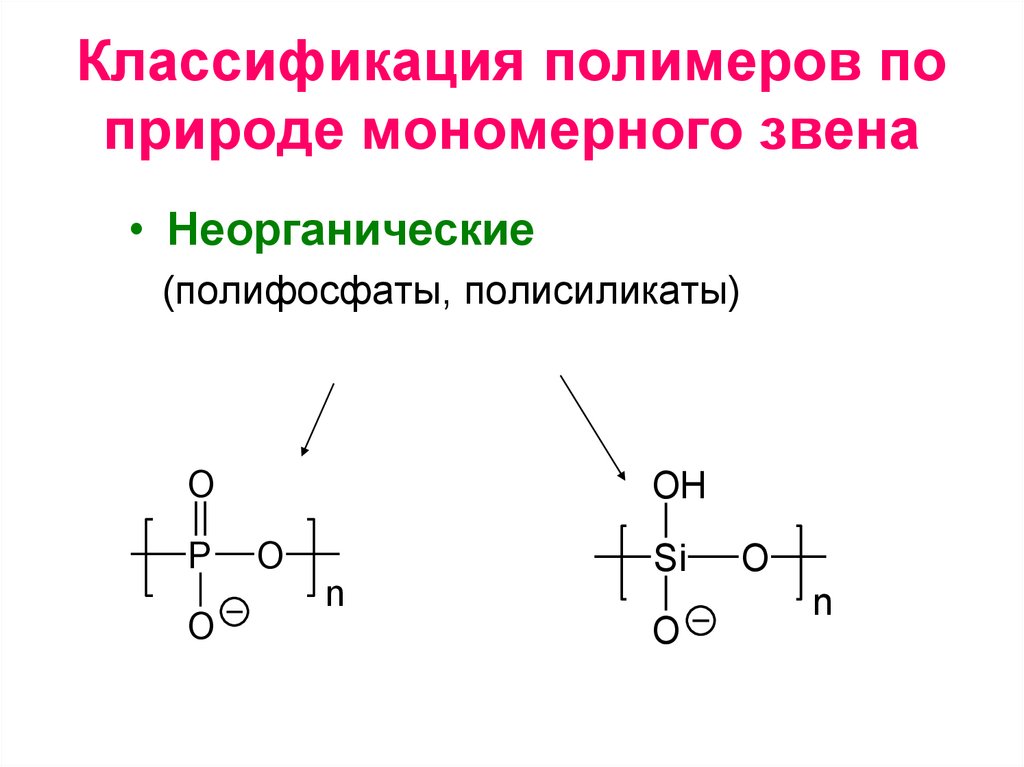
Классификация полимеров по природемономерного звена
• Органические
• Карбоцепные (полиэтилен, полистирол)
• Гетероцепные (полиамиды, полиэфиры)
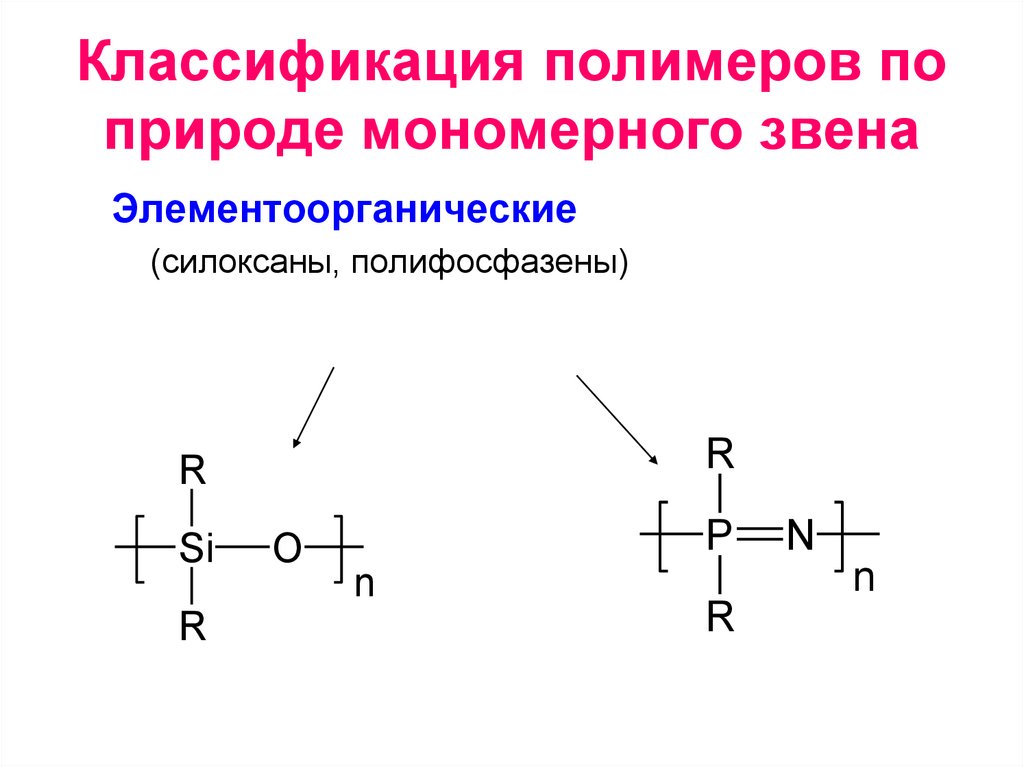
• Элементоорганические (силоксаны,
полифосфазены)
• Неорганические (полифосфаты,
полисиликаты)
22.
Классификация полимеров по природемономерного звена
• Органические
– Синтетические
• Карбоцепные
(полиэтилен, полистирол)
CH2 CH2
CH2 CH
n
Основная цепь
Боковые группы
n
23.
Классификация полимеров поприроде мономерного звена
• Органические
– Синтетические
• Гетероцепные
• (полиамиды, полиэфиры)
O
C
NH
найлон
CH2 CH2 CH2 CH2 CH2
O
лавсан
CH2
CH2
O
C
n
O
C
O
n
24.
Классификация полимеров поприроде мономерного звена
Элементоорганические
(силоксаны, полифосфазены)
R
R
Si
R
O
P
n
R
N
n
25.
Классификация полимеров поприроде мономерного звена
• Неорганические
(полифосфаты, полисиликаты)
O
P
O
OH
O
n
Si
O
O
n
26.
Термопластичные и термореактивныеполимеры
• Термопластичные полимеры
При нагревании плавятся.
По достижении определенной температуры
переходят в вязкие жидкости без химических
превращений.
При охлаждении они возвращаются в
исходное состояние, сохраняя
первоначальные свойства.
К термопластичным полимерам относятся
полимеры линейной и разветвлённой
структуры.
27.
• Термореактивные полимерыПри нагревании не плавятся.
При достижении определенной температуры
начинается разрыв полимерных цепей,
сопровождающийся химическими
превращениями. После охлаждения свойства
полимера не восстанавливаются, т.е.
происходит его деструкция.
К термореактивным относятся полимеры
пространственной структуры.
28.
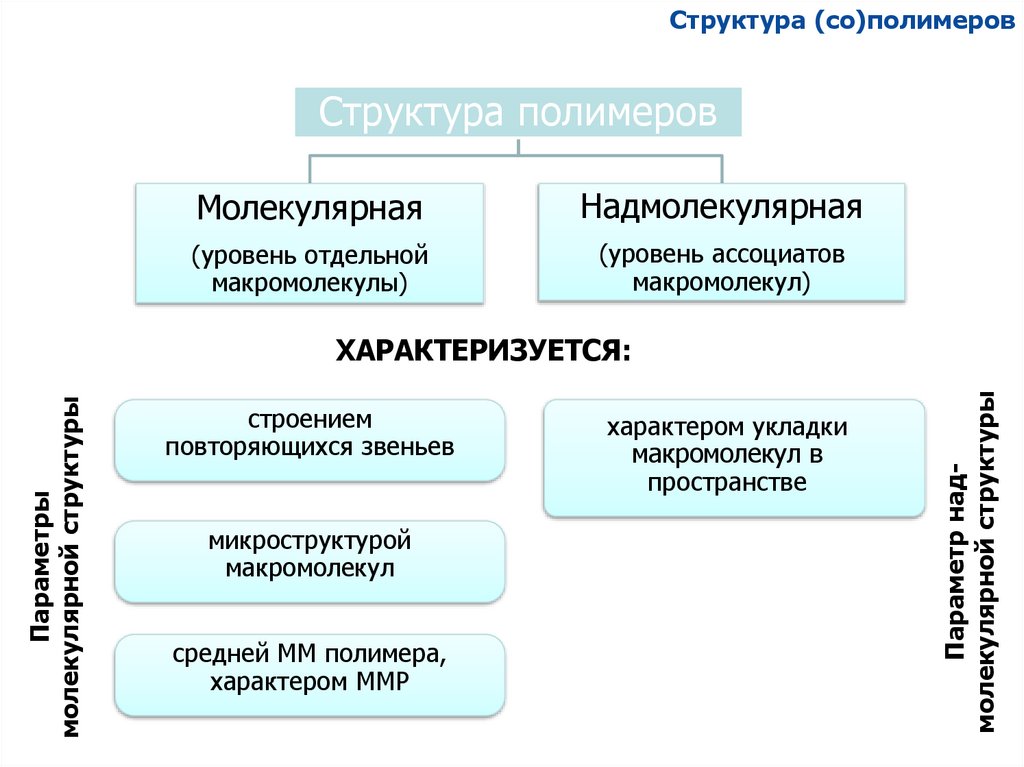
Структура (со)полимеровСтруктура полимеров
Молекулярная
Надмолекулярная
(уровень отдельной
макромолекулы)
(уровень ассоциатов
макромолекул)
строением
повторяющихся звеньев
микроструктурой
макромолекул
средней ММ полимера,
характером ММР
характером укладки
макромолекул в
пространстве
Параметр надмолекулярной структуры
Параметры
молекулярной структуры
ХАРАКТЕРИЗУЕТСЯ:
29.
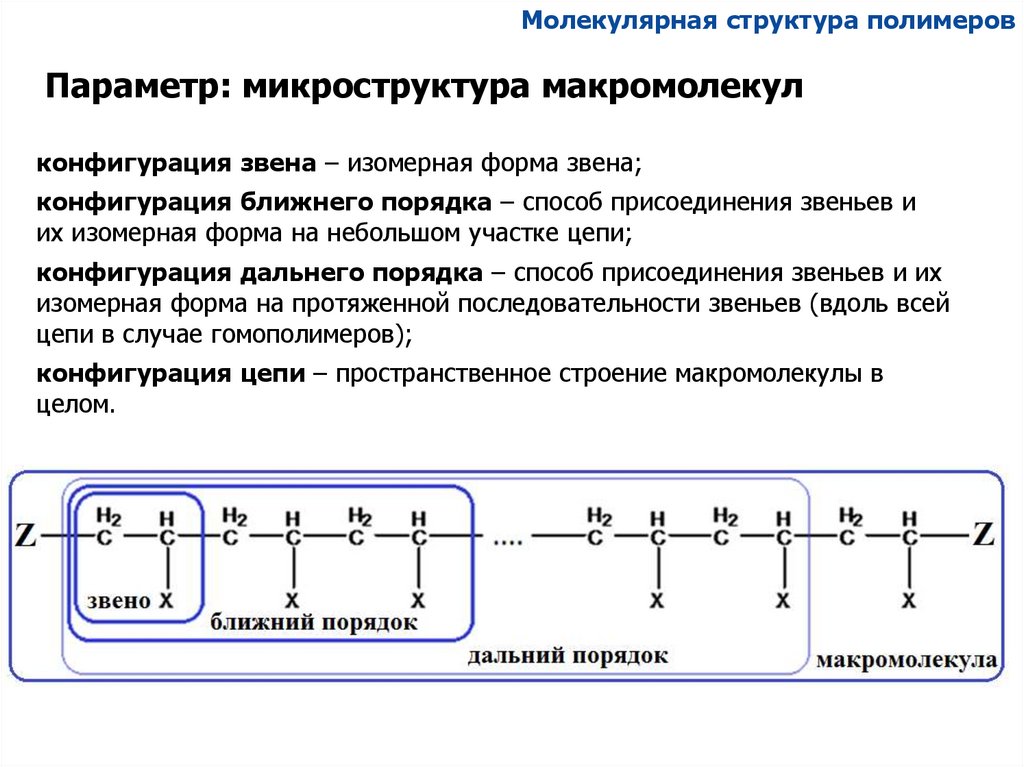
Молекулярная структура полимеровПараметр: микроструктура макромолекул
конфигурация звена – изомерная форма звена;
конфигурация ближнего порядка – способ присоединения звеньев и
их изомерная форма на небольшом участке цепи;
конфигурация дальнего порядка – способ присоединения звеньев и их
изомерная форма на протяженной последовательности звеньев (вдоль всей
цепи в случае гомополимеров);
конфигурация цепи – пространственное строение макромолекулы в
целом.
30.
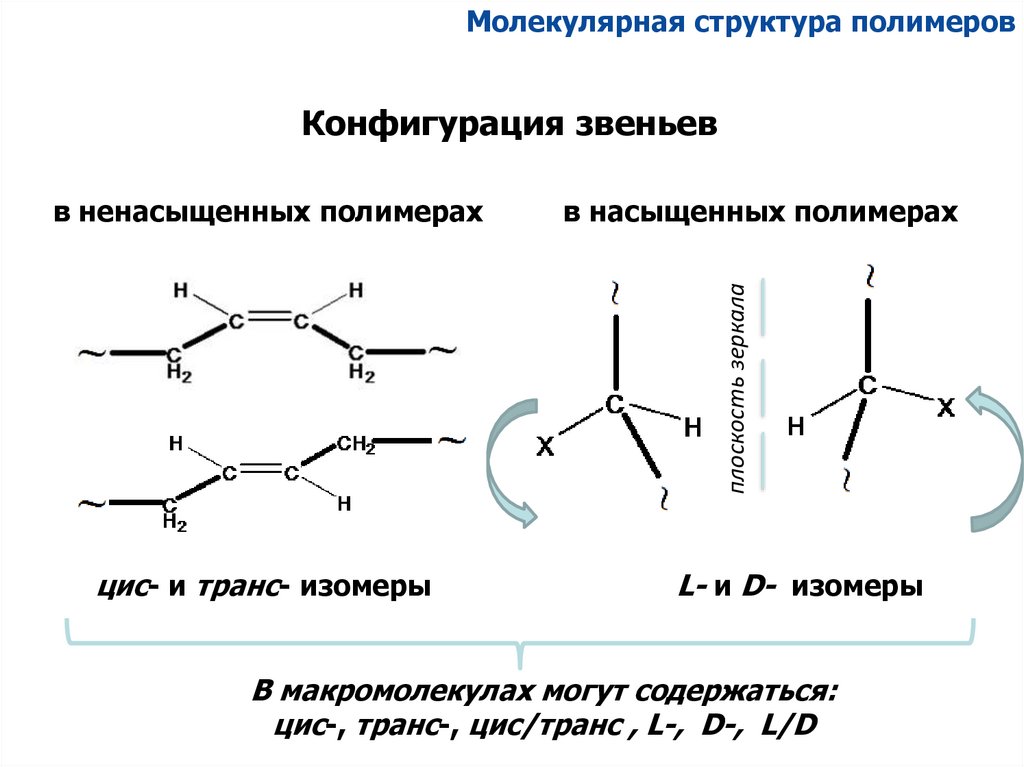
Молекулярная структура полимеровКонфигурация звеньев
в насыщенных полимерах
плоскость зеркала
в ненасыщенных полимерах
цис- и транс- изомеры
L- и D- изомеры
В макромолекулах могут содержаться:
цис-, транс-, цис/транс , L-, D-, L/D
31.
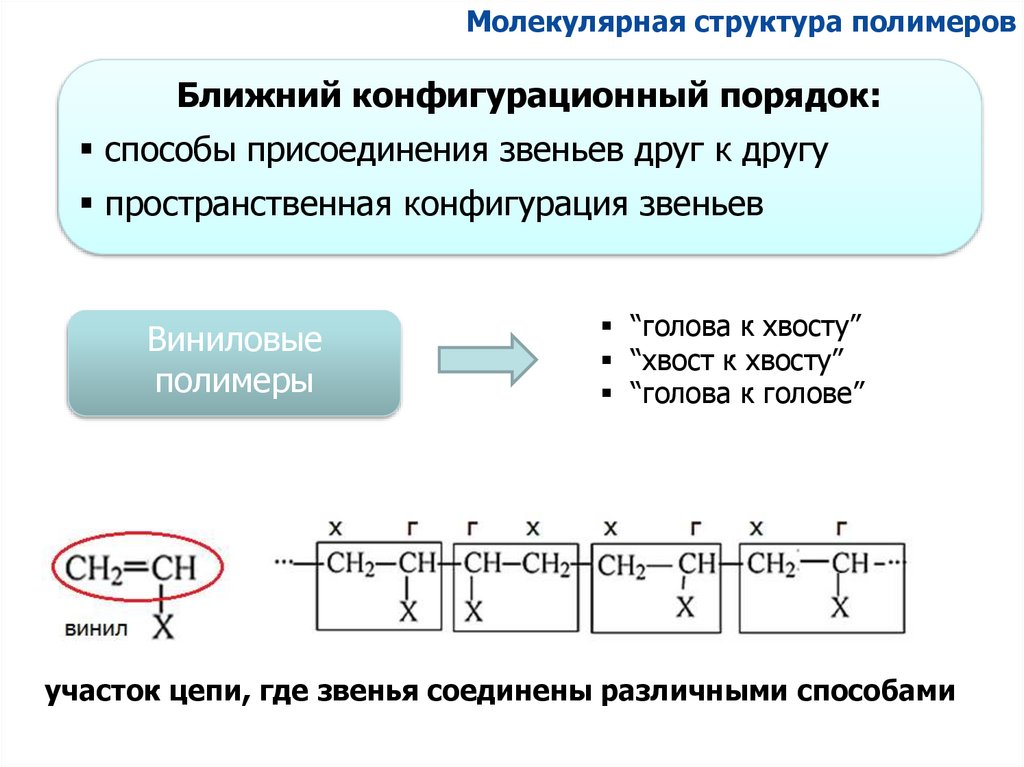
Молекулярная структура полимеровБлижний конфигурационный порядок:
способы присоединения звеньев друг к другу
пространственная конфигурация звеньев
Виниловые
полимеры
“голова к хвосту”
“хвост к хвосту”
“голова к голове”
участок цепи, где звенья соединены различными способами
32.
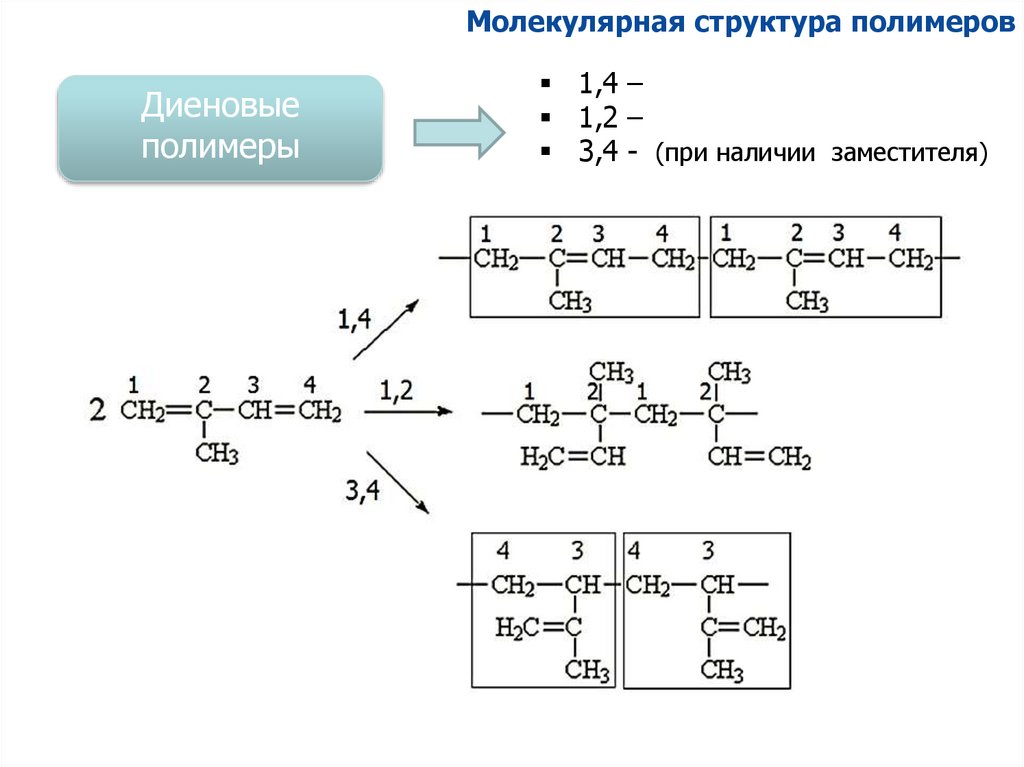
Молекулярная структура полимеровДиеновые
полимеры
1,4 –
1,2 –
3,4 - (при наличии заместителя)
33.
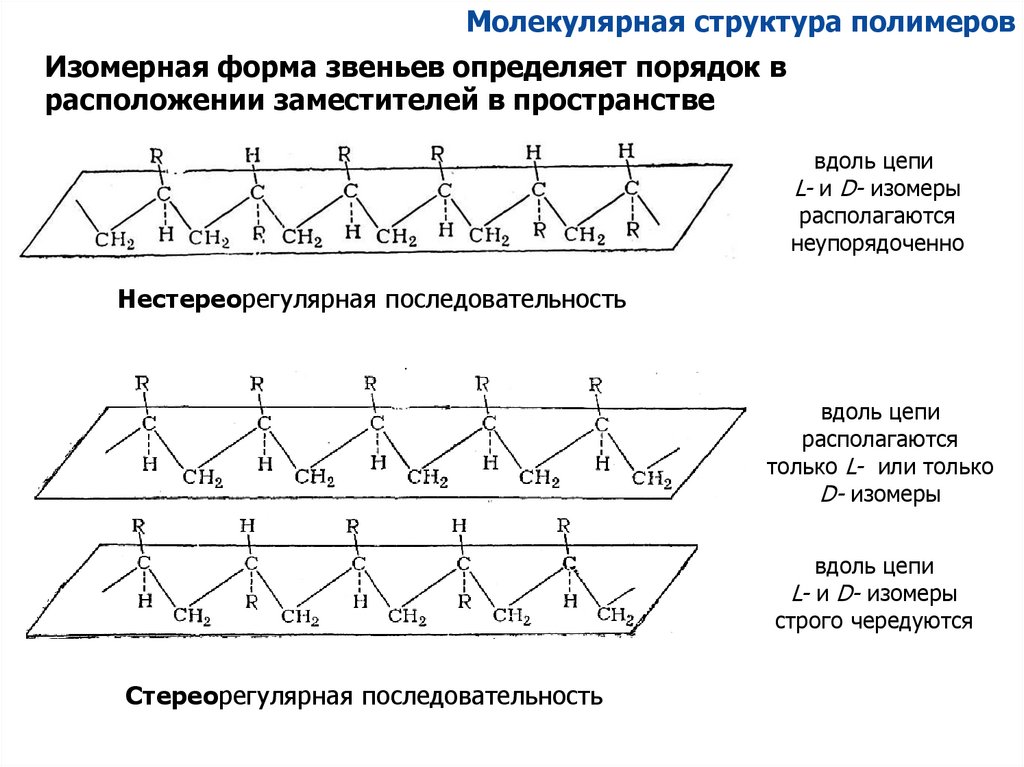
Молекулярная структура полимеровИзомерная форма звеньев определяет порядок в
расположении заместителей в пространстве
вдоль цепи
L- и D- изомеры
располагаются
неупорядоченно
Нестереорегулярная последовательность
вдоль цепи
располагаются
только L- или только
D- изомеры
вдоль цепи
L- и D- изомеры
строго чередуются
Стереорегулярная последовательность
34.
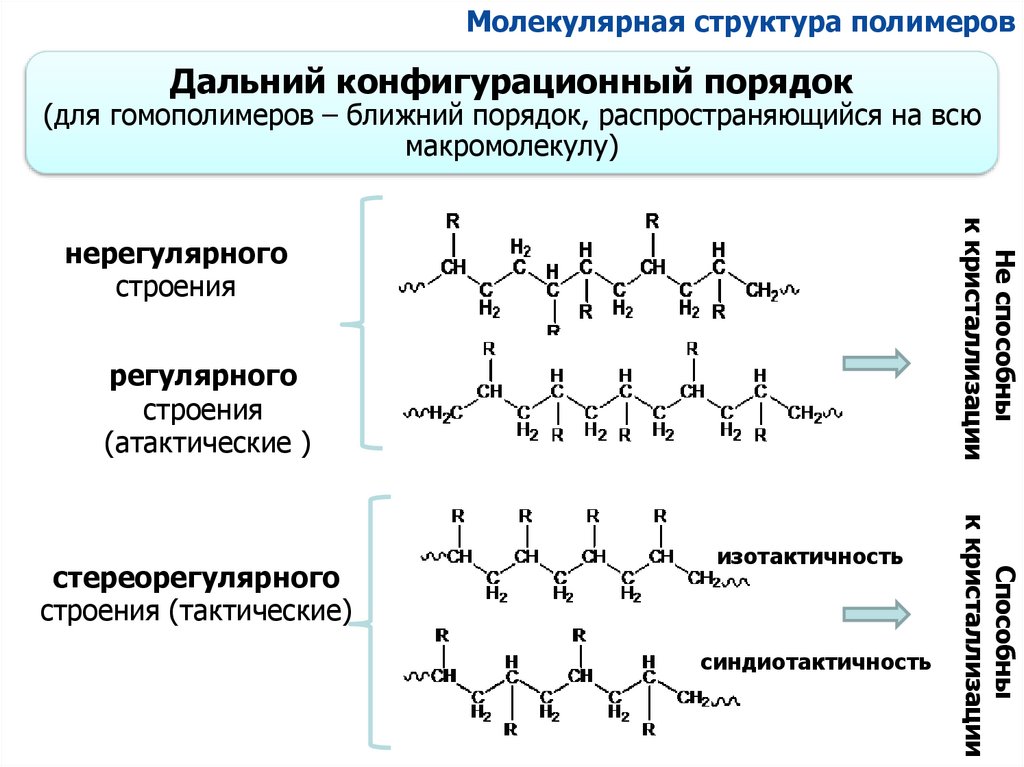
Молекулярная структура полимеровДальний конфигурационный порядок
(для гомополимеров – ближний порядок, распространяющийся на всю
макромолекулу)
Не способны
к кристаллизации
нерегулярного
строения
регулярного
строения
(атактические )
синдиотактичность
Способны
к кристаллизации
стереорегулярного
строения (тактические)
изотактичность
35.
Влияние стереоизомерии на свойстваполимеров
• изо-ПММА (Тст = 40 С);
• синдио-ПММА (Тст = 160 С);
• атактический-ПММА (Тст = 110 С).
ПММА - полиметилметакрилат
36.
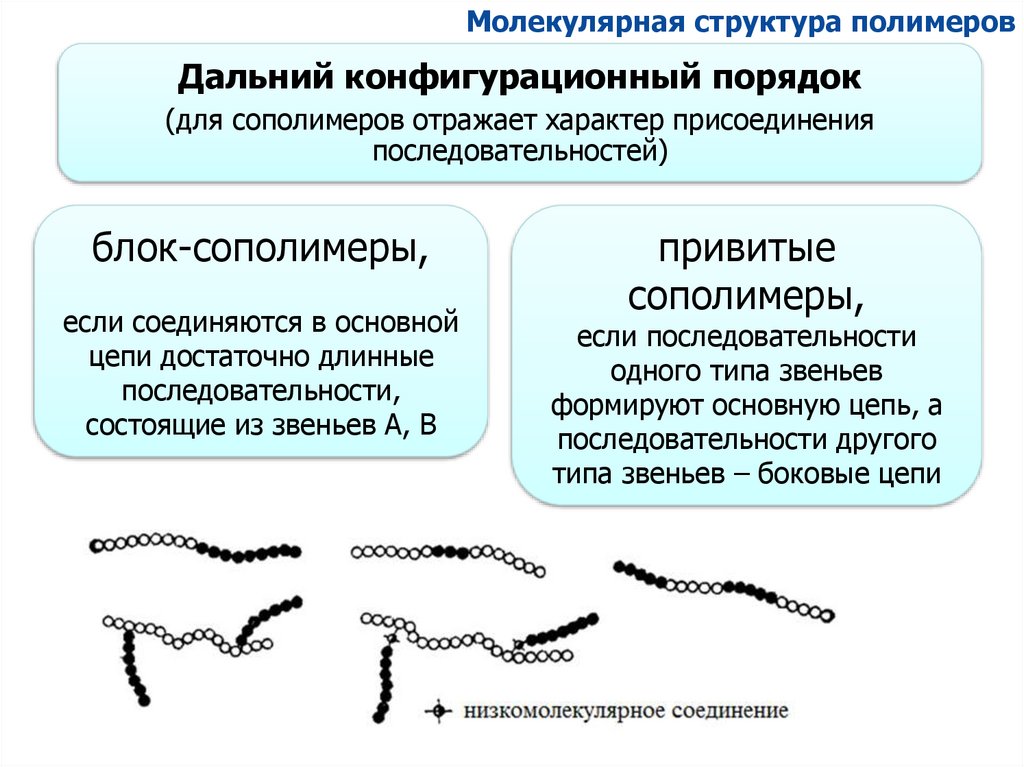
Молекулярная структура полимеровДальний конфигурационный порядок
(для сополимеров отражает характер присоединения
последовательностей)
блок-сополимеры,
если соединяются в основной
цепи достаточно длинные
последовательности,
состоящие из звеньев А, В
привитые
сополимеры,
если последовательности
одного типа звеньев
формируют основную цепь, а
последовательности другого
типа звеньев – боковые цепи
37.
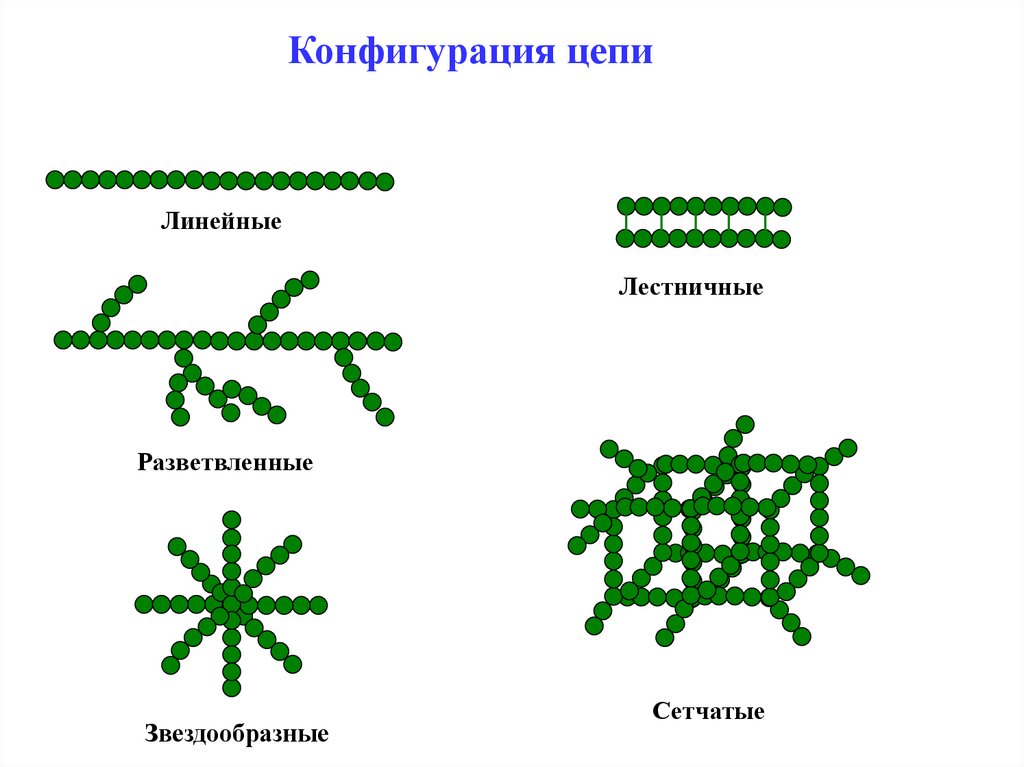
Молекулярная структура полимеровКонфигурация цепи
отражает геометрию макромолекулы
линейные
разветвленные
сшитые (сетчатые)
лестничные
звездообразные
Разветвленные полимеры - наряду с основной цепью имеют
боковые цепи, связанные с ней химическими связями и состоящие,
как правило, из звеньев того же состава.
Сшитые (сетчатые) полимеры – цепи макромолекул соединены
между собой химическими связями в единую сетку.
38.
Конфигурация цепиЛинейные
Лестничные
Разветвленные
Звездообразные
Сетчатые
39.
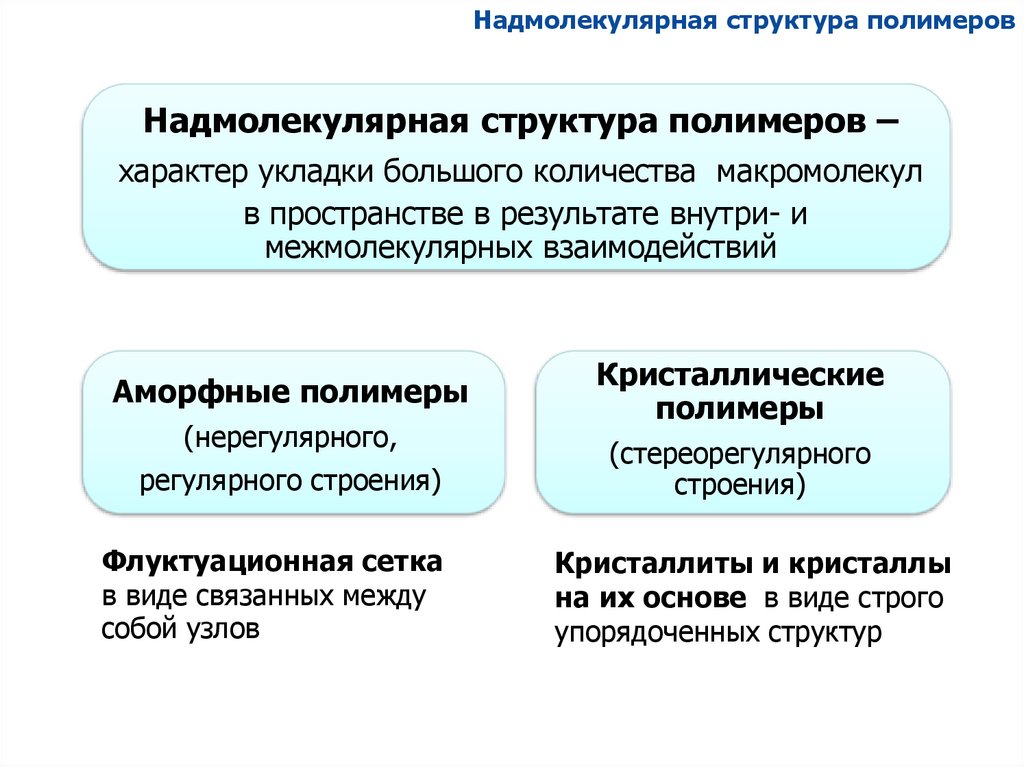
Надмолекулярная структура полимеровНадмолекулярная структура полимеров –
характер укладки большого количества макромолекул
в пространстве в результате внутри- и
межмолекулярных взаимодействий
Аморфные полимеры
(нерегулярного,
регулярного строения)
Флуктуационная сетка
в виде связанных между
собой узлов
Кристаллические
полимеры
(стереорегулярного
строения)
Кристаллиты и кристаллы
на их основе в виде строго
упорядоченных структур
40.
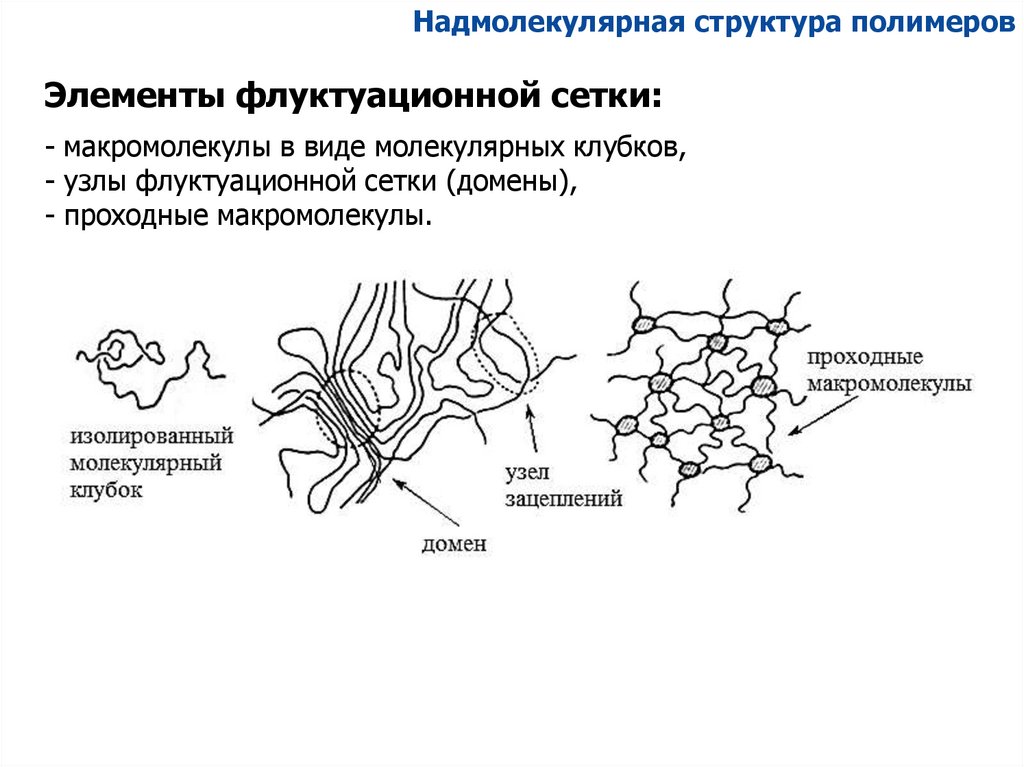
Надмолекулярная структура полимеровЭлементы флуктуационной сетки:
- макромолекулы в виде молекулярных клубков,
- узлы флуктуационной сетки (домены),
- проходные макромолекулы.
41.
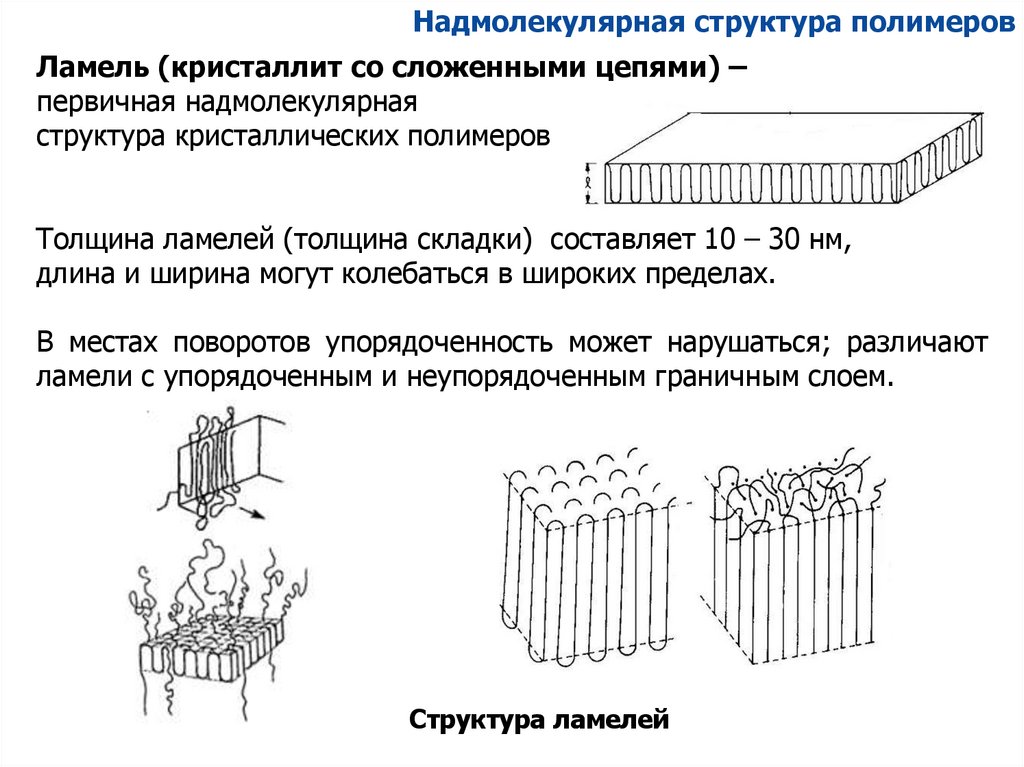
Надмолекулярная структура полимеровЛамель (кристаллит со сложенными цепями) –
первичная надмолекулярная
структура кристаллических полимеров
Толщина ламелей (толщина складки) составляет 10 – 30 нм,
длина и ширина могут колебаться в широких пределах.
В местах поворотов упорядоченность может нарушаться; различают
ламели с упорядоченным и неупорядоченным граничным слоем.
Структура ламелей
42.
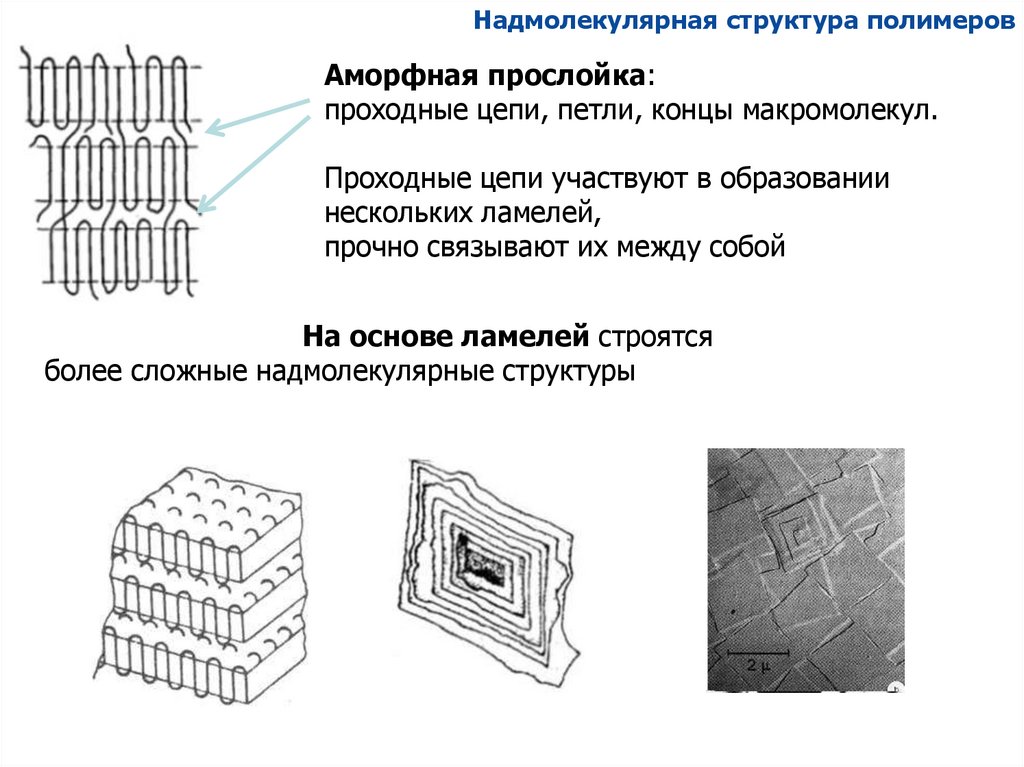
Надмолекулярная структура полимеровАморфная прослойка:
проходные цепи, петли, концы макромолекул.
Проходные цепи участвуют в образовании
нескольких ламелей,
прочно связывают их между собой
На основе ламелей строятся
более сложные надмолекулярные структуры
43.
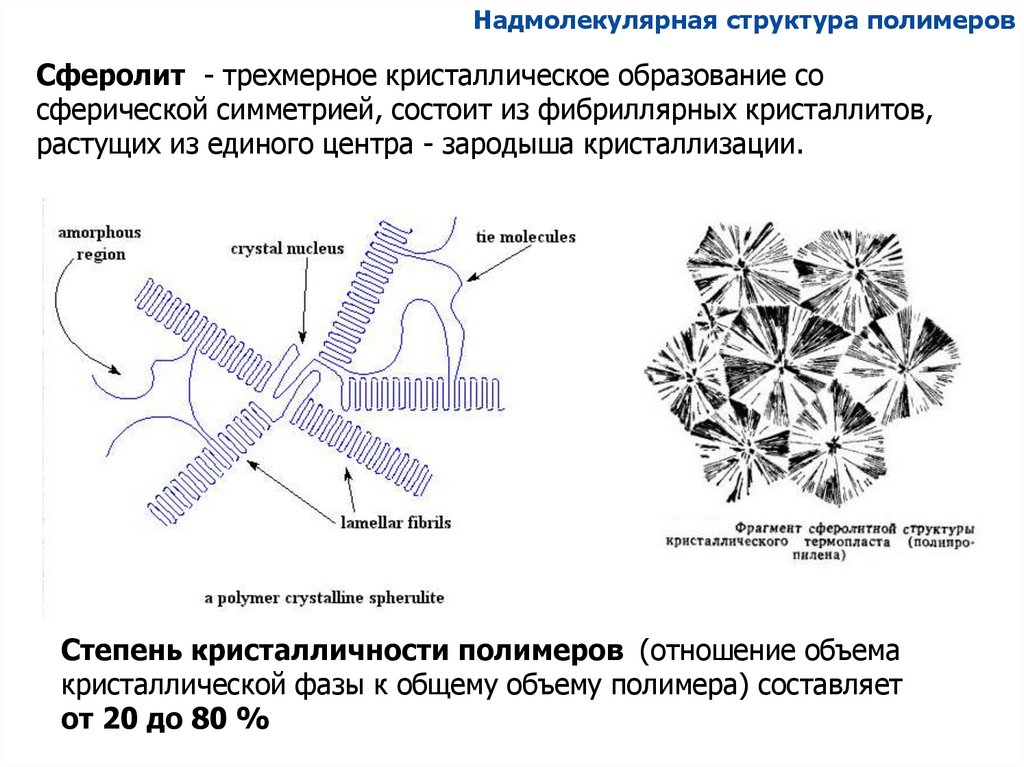
Надмолекулярная структура полимеровСферолит - трехмерное кристаллическое образование со
сферической симметрией, состоит из фибриллярных кристаллитов,
растущих из единого центра - зародыша кристаллизации.
Степень кристалличности полимеров (отношение объема
кристаллической фазы к общему объему полимера) составляет
от 20 до 80 %
44.
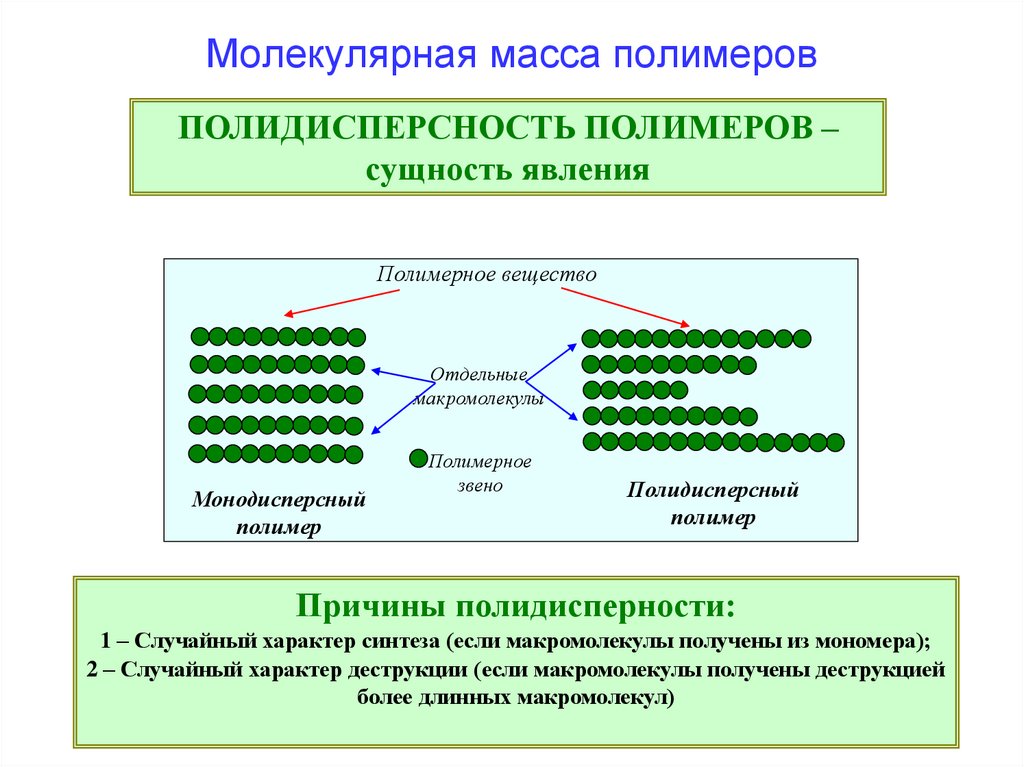
Молекулярная масса полимеровПОЛИДИСПЕРСНОСТЬ ПОЛИМЕРОВ –
сущность явления
Полимерное вещество
Отдельные
макромолекулы
Монодисперсный
полимер
Полимерное
звено
Полидисперсный
полимер
Причины полидисперности:
1 – Случайный характер синтеза (если макромолекулы получены из мономера);
2 – Случайный характер деструкции (если макромолекулы получены деструкцией
более длинных макромолекул)
45.
МОЛЕКУЛЯРНО-МАССОВЫЕ ХАРАКТЕРИСТИКИ ПОЛИМЕРОВСРЕДНИЕ МОЛЕКУЛЯРНЫЕ МАССЫ
-среднечисловая молекулярная масса Mn
-средневесовая молекулярная масса Mw
MN
M
M n
N
i
i
n
i i
i
Mw
2
M
i Ni
M N
i
i
M i wi
Числовая доля
ni
Ni
Ni
Массовая доля
wi
M i Ni
M i Ni
46.
ПОЛИДИСПЕРСНОСТЬ ПОЛИМЕРОВ –количественное описание
коэффициент полидисперсности
Mn < Mw
Mn = Mw
Полидисперсный образец
Монодисперсный образец
Mw
Kd
Mn
Kd 1 – коэффициент полидисперсности;
Количественно характеризует полидисперность полимерного
вещества;
Чем больше Кd – тем больше полидисперсность (тем шире
разброс по молекулярным массам среди макромолекул)
47.
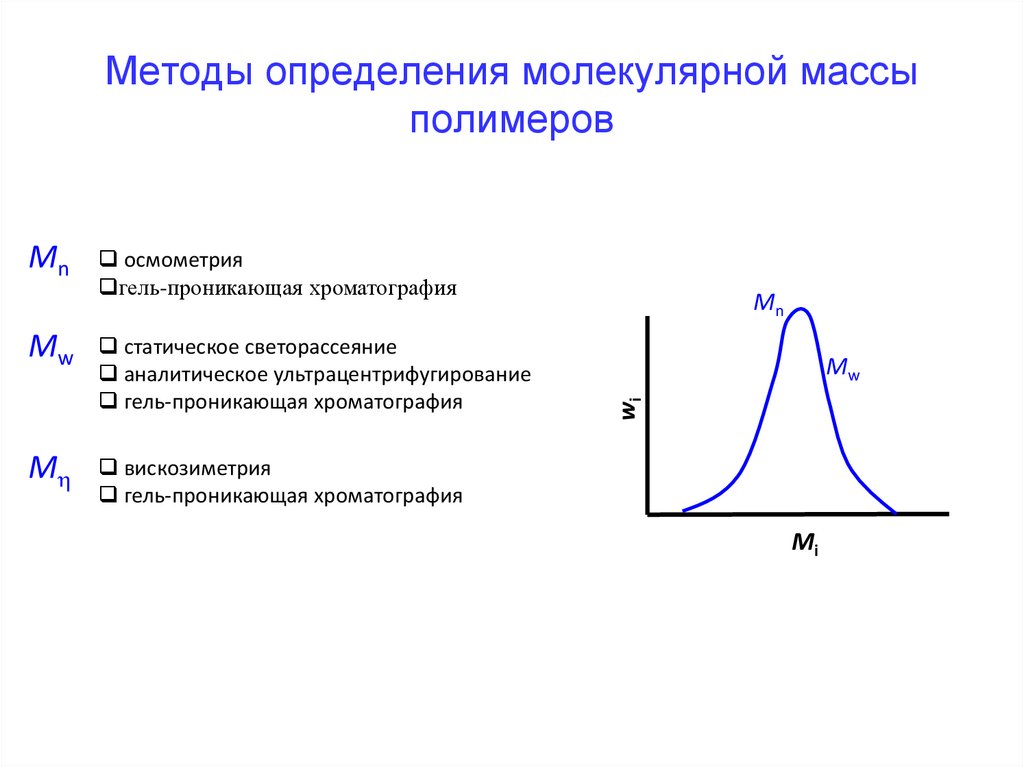
Методы определения молекулярной массыполимеров
осмометрия
гель-проникающая хроматография
Mw
статическое светорассеяние
аналитическое ультрацентрифугирование
гель-проникающая хроматография
M
вискозиметрия
гель-проникающая хроматография
Mn
Mw
wi
Mn
Mi
48.
Аналитическое центрифугированиеЦентрифугирование поводят при больших скоростях, так что
частицы, вначале равномерно распределенные по всему объёму
раствора, начинают упорядоченно перемещаться по радиусу от
центра вращения. Между областью растворителя, уже
свободной от частиц, и той его частью, которая их содержит,
образуется четкая граница раздела. Эта граница при
центрифугировании перемещается, что дает возможность
определять скорость седиментации частиц при помощи
оптических датчиков. Исходя из скорости седиментации по
соответствующим уравнениям рассчитывают средневесовую
молекулярную массу полимера.
49.
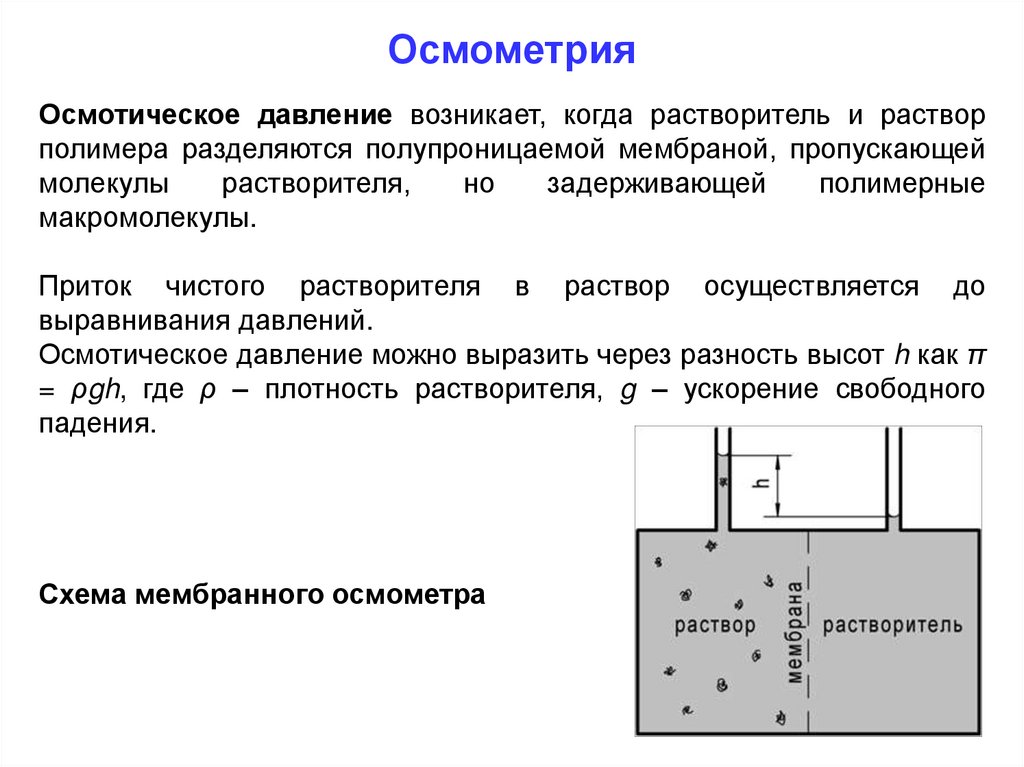
Осмометрия. Осмос50.
ОсмометрияОсмотическое давление возникает, когда растворитель и раствор
полимера разделяются полупроницаемой мембраной, пропускающей
молекулы
растворителя,
но
задерживающей
полимерные
макромолекулы.
Приток чистого растворителя в раствор осуществляется до
выравнивания давлений.
Осмотическое давление можно выразить через разность высот h как π
= ρgh, где ρ – плотность растворителя, g – ускорение свободного
падения.
Схема мембранного осмометра
51.
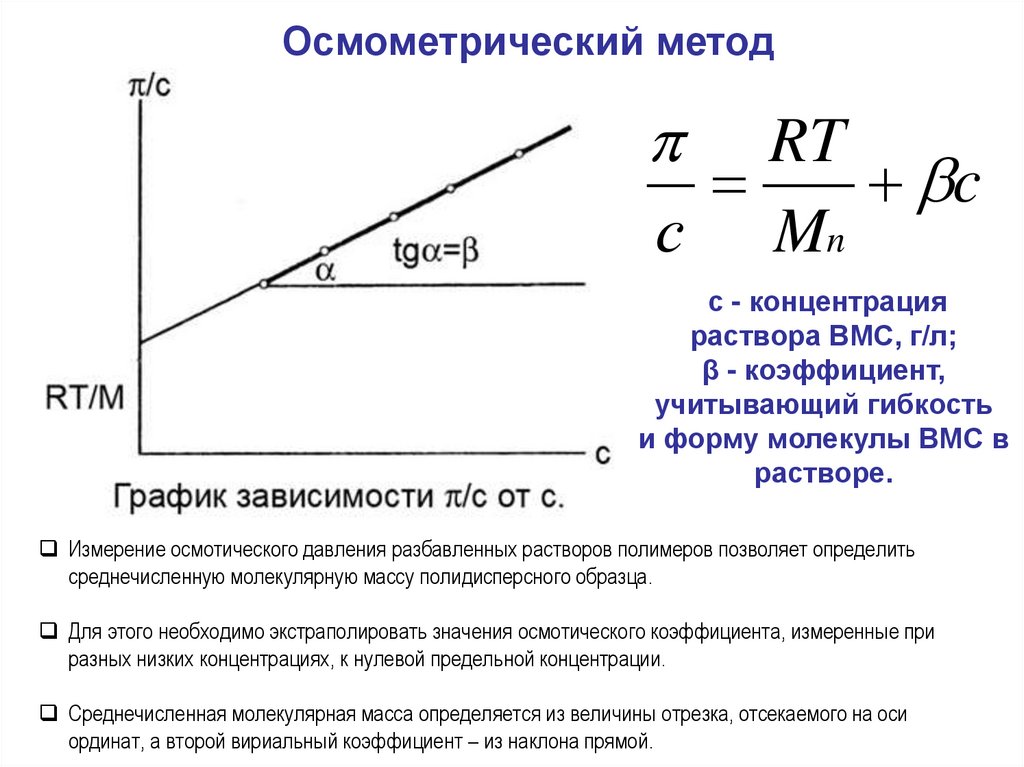
Осмометрический методRT
c
с Mn
с - концентрация
раствора ВМС, г/л;
β - коэффициент,
учитывающий гибкость
и форму молекулы ВМС в
растворе.
Измерение осмотического давления разбавленных растворов полимеров позволяет определить
среднечисленную молекулярную массу полидисперсного образца.
Для этого необходимо экстраполировать значения осмотического коэффициента, измеренные при
разных низких концентрациях, к нулевой предельной концентрации.
Среднечисленная молекулярная масса определяется из величины отрезка, отсекаемого на оси
ординат, а второй вириальный коэффициент – из наклона прямой.
52.
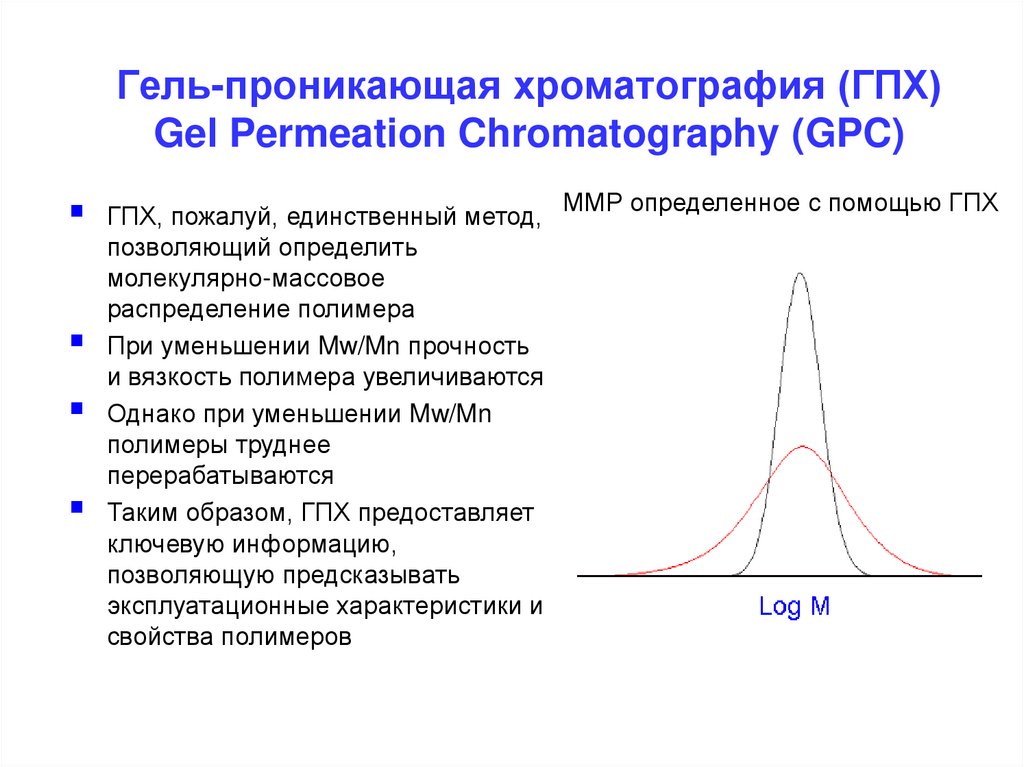
Гель-проникающая хроматография (ГПХ)Gel Permeation Chromatography (GPC)
ГПХ, пожалуй, единственный метод, ММР определенное с помощью ГПХ
позволяющий определить
молекулярно-массовое
распределение полимера
При уменьшении Mw/Mn прочность
и вязкость полимера увеличиваются
Однако при уменьшении Mw/Mn
полимеры труднее
перерабатываются
Таким образом, ГПХ предоставляет
ключевую информацию,
позволяющую предсказывать
эксплуатационные характеристики и
свойства полимеров
53.
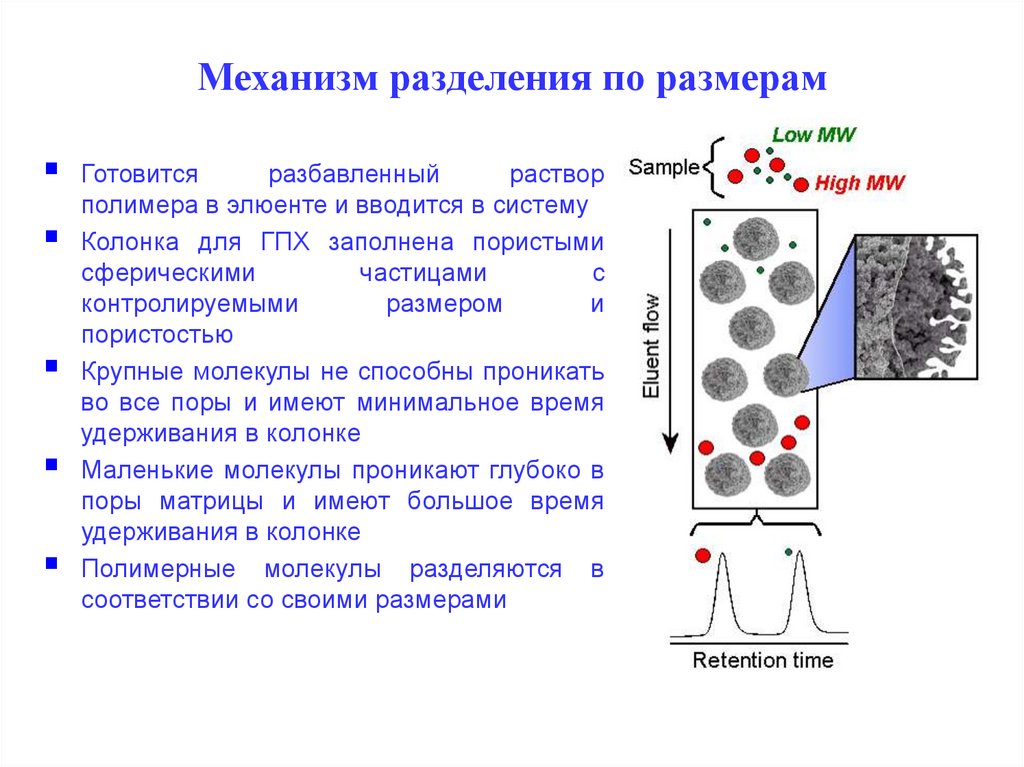
Механизм разделения по размерам54.
Механизм разделения основан на разнице в размерах55.
Механизм разделения по размерамГотовится
разбавленный
раствор
полимера в элюенте и вводится в систему
Колонка для ГПХ заполнена пористыми
сферическими
частицами
с
контролируемыми
размером
и
пористостью
Крупные молекулы не способны проникать
во все поры и имеют минимальное время
удерживания в колонке
Маленькие молекулы проникают глубоко в
поры матрицы и имеют большое время
удерживания в колонке
Полимерные молекулы разделяются в
соответствии со своими размерами
56.
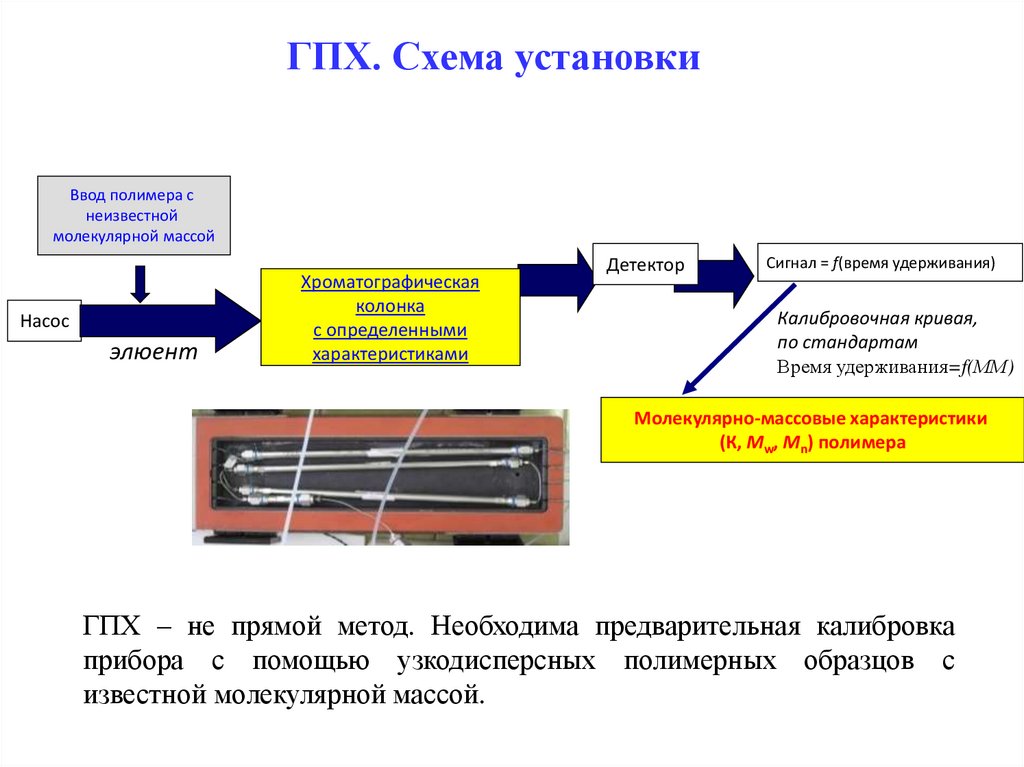
ГПХ. Схема установкиВвод полимера с
неизвестной
молекулярной массой
Насос
элюент
Хроматографическая
колонка
с определенными
характеристиками
Детектор
Сигнал = f(время удерживания)
Калибровочная кривая,
по стандартам
Время удерживания=f(ММ)
Молекулярно-массовые характеристики
(К, Mw, Mn) полимера
ГПХ – не прямой метод. Необходима предварительная калибровка
прибора с помощью узкодисперсных полимерных образцов с
известной молекулярной массой.
57.
ГПХ. ПриборДетекторы
Насос
Дегазатор
Ввод пробы
колонки
58.
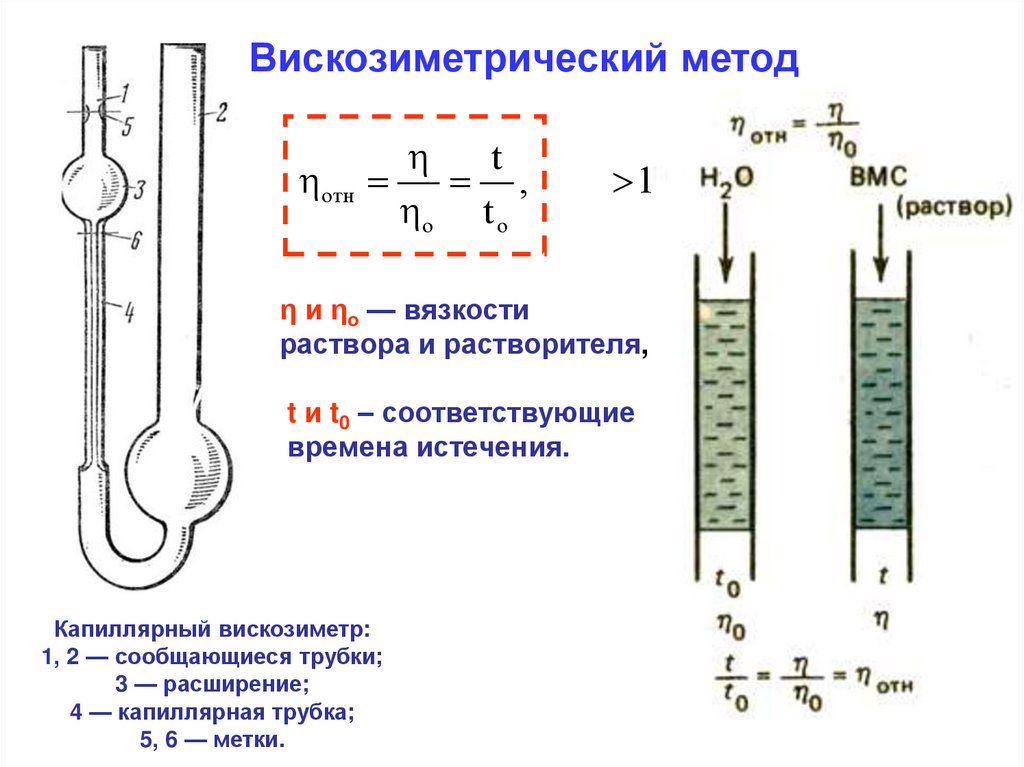
Вискозиметрический методt
отн
,
o t o
1
η и ηо — вязкости
раствора и растворителя,
t и t0 – соответствующие
времена истечения.
Капиллярный вискозиметр:
1, 2 — сообщающиеся трубки;
3 — расширение;
4 — капиллярная трубка;
5, 6 — метки.
59.
Удельная вязкостьУдельная вязкость показывает, насколько увеличилась вязкость
раствора ВМС по сравнению с вязкостью растворителя:
o
уд
отн 1
o
При неизменной концентрации полимера ηуд увеличивается с
ростом молекулярной массы.
60.
Приведенная вязкостьЧтобы учесть влияние концентрации раствора (оценить,
насколько велика удельная вязкость, отнесенная к единице
концентрации растворенного вещества ) ηуд делят на с.
ηпривед
η уд.
с
Приведенная вязкость раствора полимера не должна зависеть
от концентрации, однако у большинства из них она возрастает с
увеличением концентрации в результате взаимодействия
макромолекул
61.
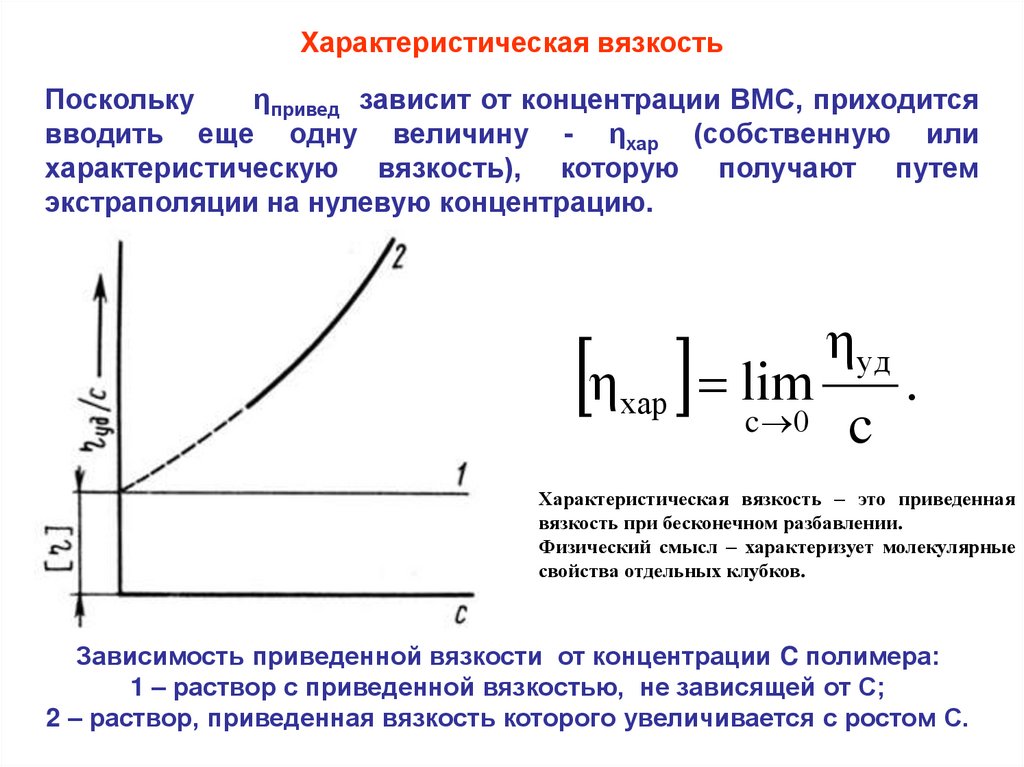
Характеристическая вязкостьПоскольку
ηпривед зависит от концентрации ВМС, приходится
вводить еще одну величину - ηхар (собственную или
характеристическую вязкость), которую получают путем
экстраполяции на нулевую концентрацию.
η уд
η lim c .
хар
c 0
Характеристическая вязкость – это приведенная
вязкость при бесконечном разбавлении.
Физический смысл – характеризует молекулярные
свойства отдельных клубков.
Зависимость приведенной вязкости от концентрации C полимера:
1 – раствор с приведенной вязкостью, не зависящей от С;
2 – раствор, приведенная вязкость которого увеличивается с ростом С.
62.
Уравнение Марка-Куна-ХаувинкаСвязывает характеристическую вязкость и молекулярную массу
полимера (К определяется экспериментально, зависит от
природы растворителя и молекулярной массы полимера)
η КМ
α
хар
Величина α зависит от формы макромолекул ( 0.5< α <1).
В общем случае, с увеличением жесткости макромолекул
величина α приближается к 1. Для жестких (палочки)
полимеров α=1
Для макромолекул, форма которых близка к шарообразной,
показатель α составляет около 0.5.
63.
Уравнение Марка-Куна-ХаувинкаKM
a
К и а – постоянные для данной
системы полимер-растворитель при
постоянной температуре
Как получить значения К и а? Они берутся из калибровки: для серии полимерных образцов
разных молекулярных масс (определенных другими методами) экспериментально
определяются значения [ ]. Строится зависимость lg[ ] от lgM. Полученные значения К и а
заносятся в справочники и используются для определения молекулярной массы
полимерных образцов данной химической структуры.
lg[ ]
lg[ ] lg K a lg M
lg K
lg M
tg = a
Mn M M w
M - Средневязкостная молекулярная масса
64.
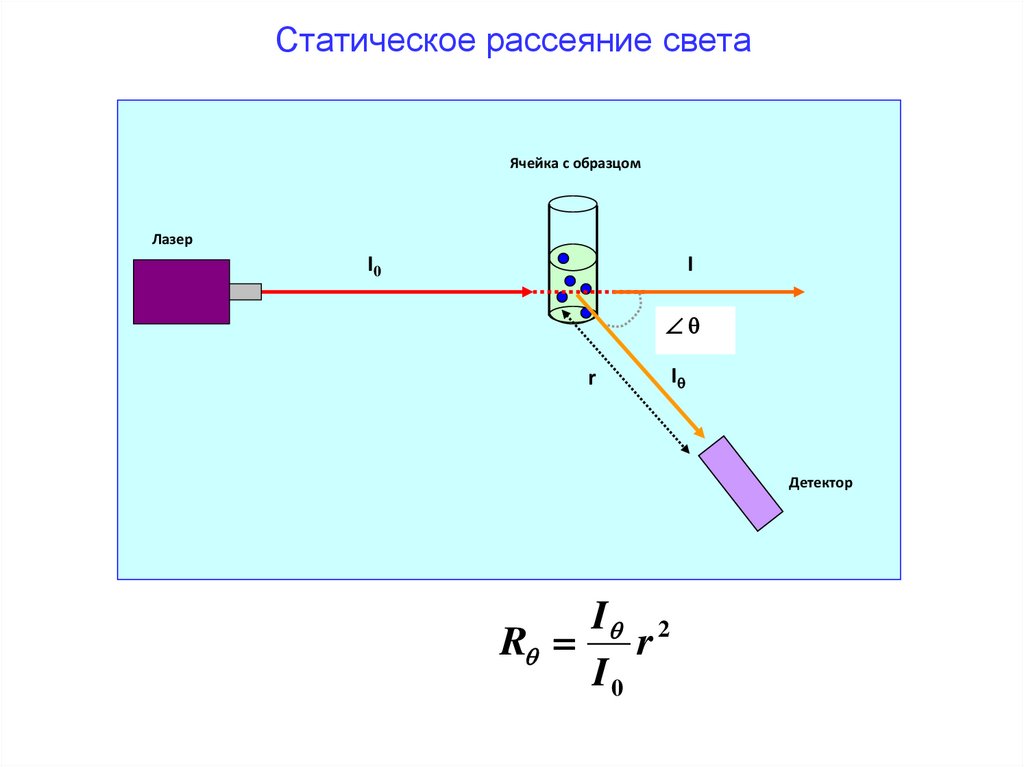
Статическое рассеяние светаЯчейка с образцом
Лазер
I0
I
r
I
Детектор
I 2
R
r
I0
65.
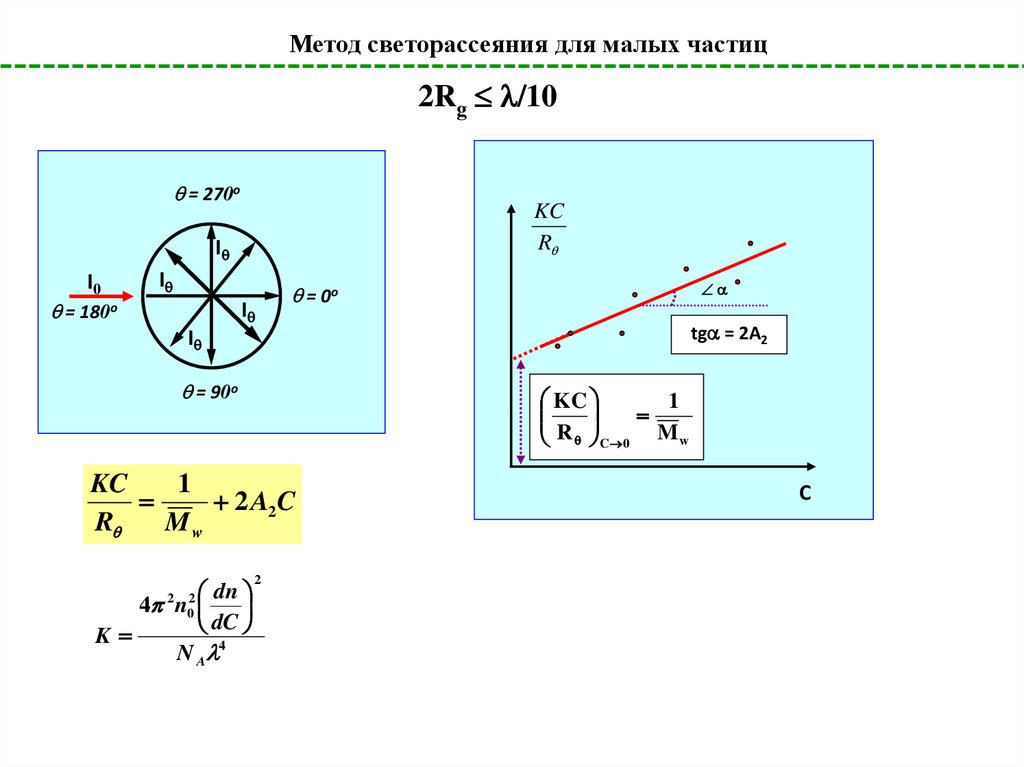
Метод светорассеяния для малых частиц2Rg /10
= 270o
KC
R
I
I0
I
= 180o
I
= 0o
tg = 2A2
I
= 90o
KC
1
R C 0 M w
KC
1
2 A2C
R
Mw
dn
4 n
dC
K
4
N A
2
2
0
2
C
66.
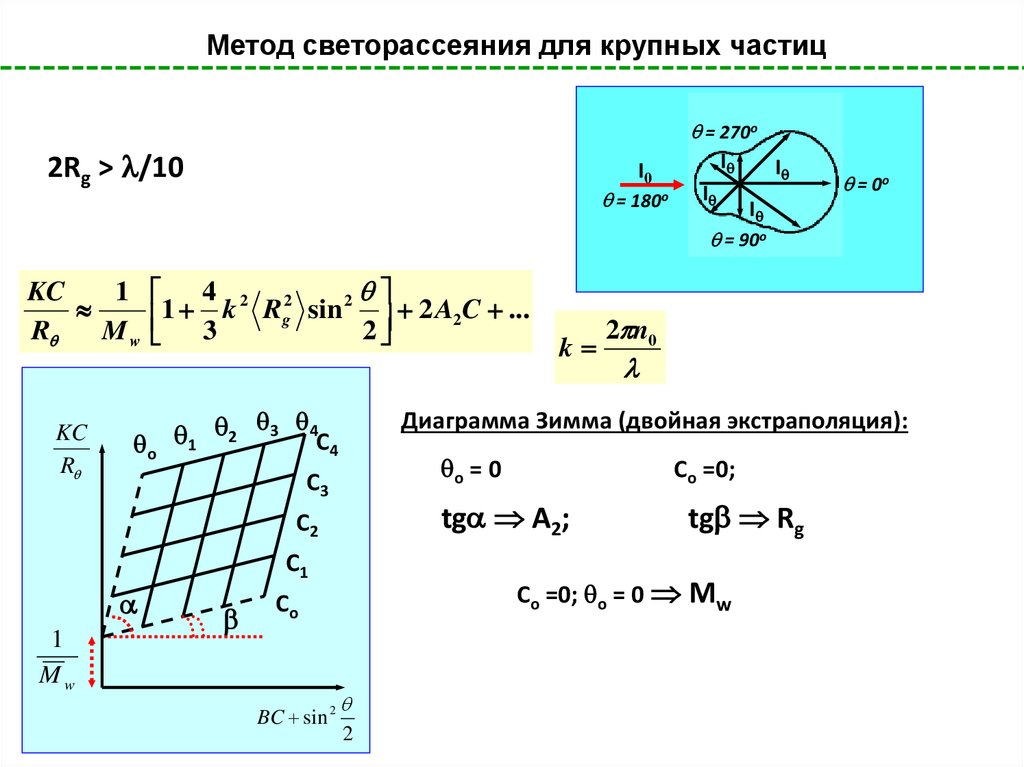
Метод светорассеяния для крупных частиц= 270o
2Rg > /10
I0
= 180o
I
I
I
= 0o
I
= 90o
KC
1 4 2 2
2
1 k Rg sin 2 A2C ...
R
M w 3
2
KC
R
o
1 2 3 4C4
C2
C1
1
Mw
о = 0
Со =0;
tg A2;
tg Rg
Со =0; о = 0 Mw
Co
BC sin 2
2 n0
Диаграмма Зимма (двойная экстраполяция):
C3
k
2
67.
Получение полимеров68.
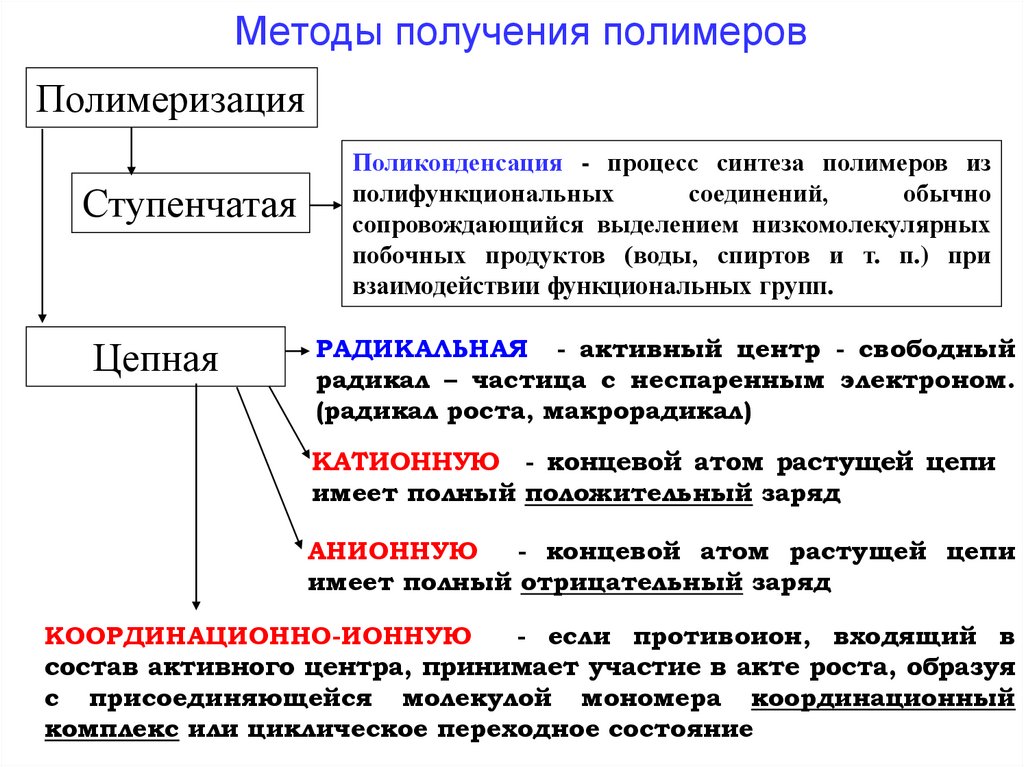
Методы получения полимеровПолимеризация
Ступенчатая
Цепная
Поликонденсация - процесс синтеза полимеров из
полифункциональных
соединений,
обычно
сопровождающийся выделением низкомолекулярных
побочных продуктов (воды, спиртов и т. п.) при
взаимодействии функциональных групп.
РАДИКАЛЬНАЯ - активный центр - свободный
радикал – частица с неспаренным электроном.
(радикал роста, макрорадикал)
КАТИОННУЮ - концевой атом растущей цепи
имеет полный положительный заряд
АНИОННУЮ
- концевой атом растущей цепи
имеет полный отрицательный заряд
КООРДИНАЦИОННО-ИОННУЮ
- если противоион, входящий в
состав активного центра, принимает участие в акте роста, образуя
с присоединяющейся молекулой мономера координационный
комплекс или циклическое переходное состояние
69.
РАДИКАЛЬНАЯ ПОЛИМЕРИЗАЦИЯОсновные стадии полимеризации:
1. Инициирование
2. Рост цепи
3. Обрыв цепи
4. Передача цепи
Инициирование – включает 2 элементарных акта:
а) генерирование радикалов R. из инициатора I
б) взаимодействие радикала R. с мономером
R +CH2
CH
X
k'и
R
kг 2 R
I
CH2 CH
X
Часть радикалов R. может расходоваться на побочные реакции, для учета
этого вводят параметр эффективности инициирования f, равный
отношению числа радикалов, участвовавших в реакции (б) к числу
радикалов, образовавшихся по реакции (а).
Скорость инициирования
Vи = kг 2f [I]
70.
71.
ИНИЦИИРОВАНИЕИнициирование – превращение небольшой доли молекул мономера в активные центры под
действием специально вводимых веществ (инициаторов и катализаторов) или излучения
высоких энергий (радиационная полимеризация), или света (фотополимеризация) и др.
Радикальная полимеризация
1. Термический распад инициаторов
азоинициаторы:
перекиси:
азо-бис-изобутиронитрил
перекись бензоила
CH3
CH3
CH3
CH3
C N=N C
CN
CH3
CN
2
CH3
.
C + N2 C6H5-C-O-O-C-C6H5
CN
O
O
.
2C6H5-C-O
.
2C6H5 + 2CO2
O
2. Фотохимическое инициирование
чистый мономер
M+h M*
фотолитическая диссоциация инициаторов
I+h I*
3. Инициирование окислительно-восстановительными системами
H2O2 + Fe2+ HO- +HO +Fe3+ реактив Фентона
ROOR + Fe2+ RO- + RO +Fe3+ (Cr2+, V2+, Ti3+, Co2+)
RCH2OH + Ce4+ RC HOH + H+ + Ce3+
-O S-O-O-SO - + S O 2- SO 2- +SO +S O
3
3
2 3
4
4
2 3
C6H5NR2 + C6H5CO(O)-OC(O)C6H5 C6H5N+ R2 + C6H5C(O)O + C6H5C(O)O-
72.
Рост цепиR CH2
R M
Rn 1
n
kp
CH + CH2
CH
X
X
kр
]
V p k p[M ][Rn
R CH2
CH CH2 CH
X
X
Реакционная способность мономера и макрорадикала
определяется
Сопряжением кратной связи с заместителем
Полярностью заместителя
Объёмом заместителя (стерический фактор)
Сопряжение с заместителем снижает активность
макрорадикала в большей степени, чем повышает
активность мономера.
АКТИВНЫЕ МОНОМЕРЫ: с большой энергией сопряжения
(мономеры, у которых двойная связь сопряжена с ненасыщенной
группой заместителя).
НЕАКТИВНЫЕ МОНОМЕРЫ: сопряжение отсутствует или его
энергия мала.
73.
МОНОМЕРЫв радикальной полимеризации:
- образуются высокомолекулярные продукты, если использованы:
Виниловые мономеры CH2=CH-X
Винилиденовые мономеры CH2=C(X)-Y
X, Y - алкил, галоген, COOH, COOR, OCOR, CN, CONH2, C6H5,
арил, CH=CH2
- образуются олигомерные продукты, если использованы:
Аллиловые мономеры CH2=CH-CH2-X
Виниловые эфиры CH2=CH-OR
- не полимеризуются, если использованы :
Виниленовые мономеры CHX=CHX (за исключением X = F)
Соединения с кратной связью С = гетероатом
73
74.
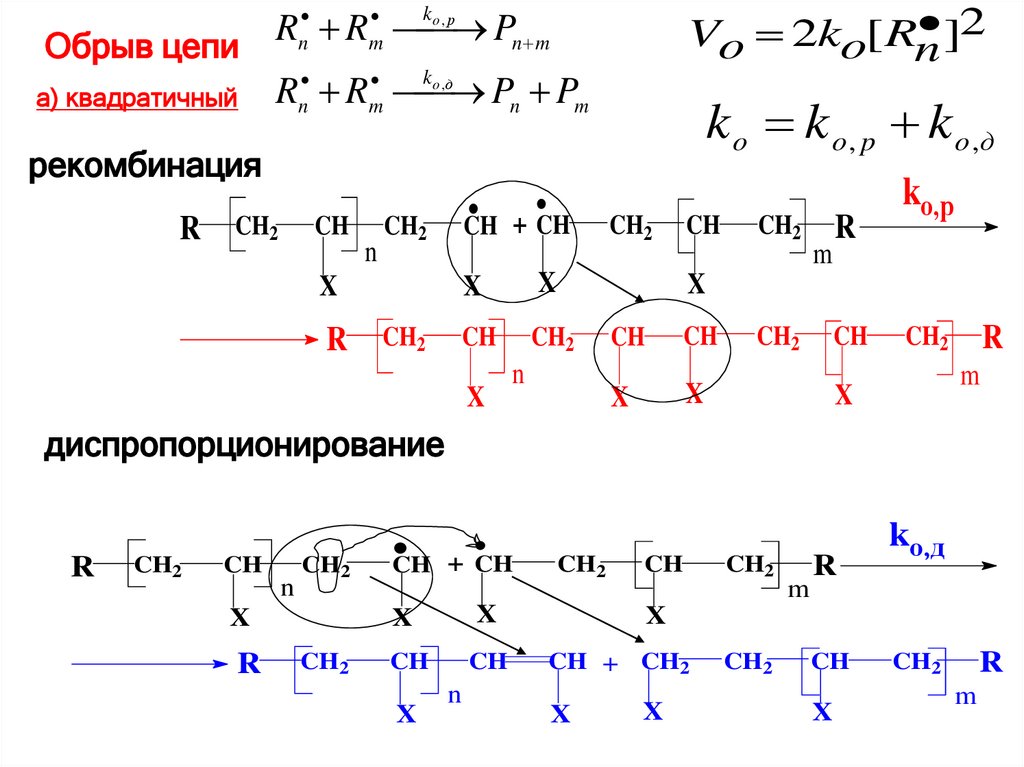
]2Vo 2ko[ Rn
R R Pn m
Обрыв цепи
k
Pn Pm
а) квадратичный Rn Rm
n
m
ko , р
o ,д
k o k o , p k o ,д
рекомбинация
R
CH2
CH
n
CH + CH
CH2
X
R
CH2
X
X
CH
CH2
X
CH2
CH
CH2
m
R
kо,р
X
n
CH
CH
X
X
CH2
CH
R
CH2
m
X
диспропорционирование
R
CH2
CH
n
CH2
X
R
CH2
CH + CH
X
X
CH
CH
X
n
CH2
CH
CH2
m
R
kо,д
X
CH + CH2
X
X
CH2
CH
X
R
CH2
m
75.
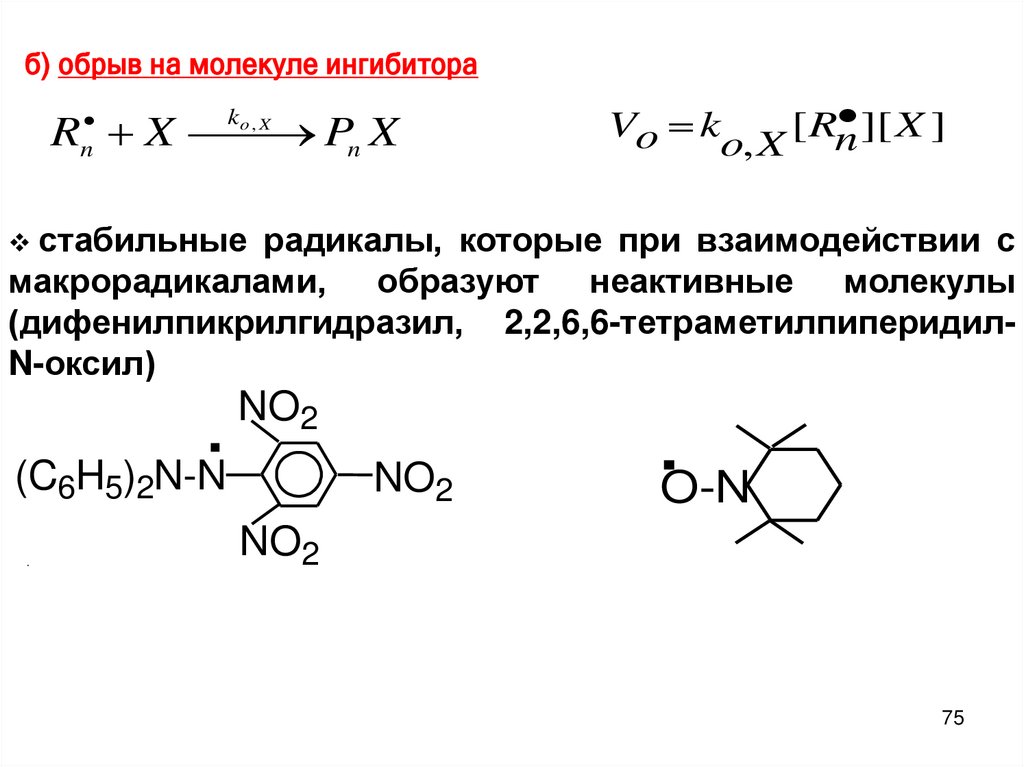
б) обрыв на молекуле ингибитораRn X Pn X
ko , X
][ X ]
Vo k
[ Rn
o, X
стабильные радикалы, которые при взаимодействии с
макрорадикалами, образуют неактивные молекулы
(дифенилпикрилгидразил, 2,2,6,6-тетраметилпиперидилN-оксил)
.
(C H ) N-N
NO2
NO2
6 5 2
.O-N
NO2
75
76.
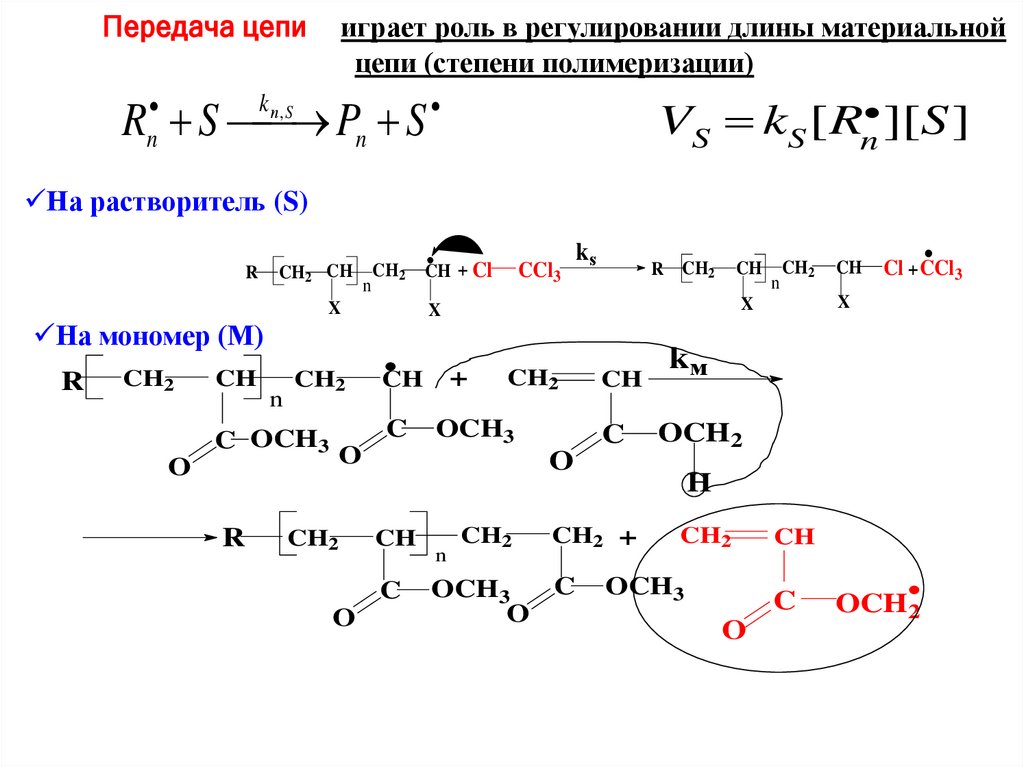
Передача цепииграет роль в регулировании длины материальной
цепи (степени полимеризации)
R S Pn S
n
kп , S
VS kS [ Rn ][S ]
На растворитель (S)
R
CH2
CH
n
CH2
X
R
CH
n
CH2
C OCH3
R
CH2
+
C
OCH3
R CH2
CH2
CH
CH
kм
C
OCH2
O
CH
C
O
ks
n
n
CH2
CH2
Cl + CCl3
H
CH2 +
C
OCH3
O
CH
X
X
CH
O
O
CCl3
X
На мономер (М)
CH2
CH + Cl
CH2
OCH3
CH
C
O
OCH2
77.
Передача цепииграет роль в регулировании длины материальной
цепи (степени полимеризации)
На другую макромолекулу
R
CH2
CH
n
CH2
CH + R
C OC4H9 C OC4H9
O
O
R
CH2
CH
n
CH2
CH2
CH
n
CH2
kп
CH2
C OC4H9 C OC4H9
O
O
CH2 + R
C OC4H9 C OC4H9
O
O
CH2
CH
n
CH2
C
CH2
CH2
C OC4H9 C OC4H9 C OC4H9
O
O
O
77
78.
МЕХАНИЗМ И КИНЕТИКА ПОЛИМЕРИЗАЦИИДопущения, принимаемые для вывода кинетических
уравнений полимеризации
1. Малые конверсии мономера
2. Pn >>1 (действительно идёт реакция полимеризации)
3. Активность растущих макромолекул не зависит от их
степени полимеризации (принцип Флори)
4.
Если время жизни активных частиц мало
сравнению
со
временем
полимеризации
по
используют принцип квазистационарности –
скорость инициирования равна скорости обрыва
цепи
79.
КИНЕТИКА РАДИКАЛЬНОЙ ПОЛИМЕРИЗАЦИИПоскольку мономер расходуется в основном на стадии роста, то
скорость этой реакции совпадает с общей скоростью
полимеризации
V p d M k p[M ][ Rn ]
dt
d
R
n
dt
0
Условие квазистационарности
Vи Vo
2 fkи [ I ] 2ko [ Rn ]2
kи1/ 2 [I]1/ 2
[Rn ]
1/ 2
ko
kи1/ 2k p 1/ 2
полимеризации
V p 1/ 2 [I] [M] Скорость
ko
пропорциональна [I]0.5 и [M]
80.
ДЛИНА КИНЕТИЧЕСКОЙ И МАТЕРИАЛЬНОЙ ЦЕПИn
Кинетическая цепь
– число
V p k p [ R ][M ]
молекул мономера,
Vи
2 fk г [ I ]
присоединившихся к одному
образовавшемуся радикалу Rn
до его гибели при обрыве цепи
Материальная цепь
(среднечисловая степень
Vp
полимеризации) Pn – число
P
n
элементарных актов
Vo Vп
присоединения мономеров на один
акт гибели радикала Rn при
обрыве и передаче цепи
81.
Доля обрыва цепей диспропорционированиемk о ,д
k о ,д k о , р
Доля обрыва цепей рекомбинацией 1-
Vp
Pn
Vo Vп
Pn
k p[ Rn ][M ]
1(1 )k [ R ]2 k [ R ]2 k [ R ][M ] k [ R ][S ]
o n
o n
п.м n
п.s n
2
1
(1 )k o1 / 2 k и1 / 2 [ I ]1 / 2
k п. м k п. s [ S ]
1 2
Pn
k p [M ]
k p k p [M ]
1
1
[S ]
CM CS
Pn Pn , 0
[M ]
82.
11/ 2 1/ 2
1/ 2
(1 )k o k и [ I ]
k п. м k п. s [ S ]
1 2
Pn
k p [M ]
k p k p [M ]
1
1
[S ]
CM CS
Pn Pn , 0
[M ]
Pn ~ [ M ]
1
[ I ]1 / 2
1
Pn ~
CМ
Pn ~
Степень полимеризации прямо пропорциональна М,
обратно пропорциональна кв.корню из концентрации
инициатора и обратно пропорциональна константе
самопередачи цепи (передачи на мономер)
83.
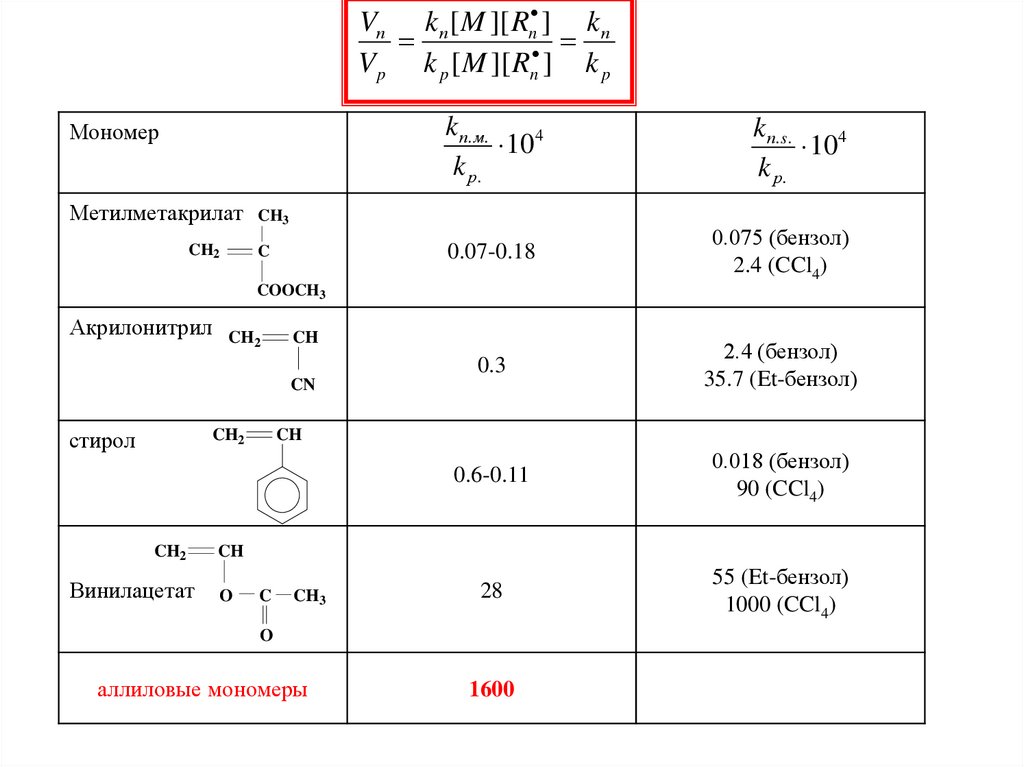
Vп k п [ M ][ Rn ] k пV p k p [ M ][ Rn ] k p
Мономер
k п. м.
104
k р.
k п. s .
104
k р.
0.07-0.18
0.075 (бензол)
2.4 (CCl4)
0.3
2.4 (бензол)
35.7 (Et-бензол)
0.6-0.11
0.018 (бензол)
90 (CCl4)
28
55 (Et-бензол)
1000 (CCl4)
Метилметакрилат CH3
CH2
C
COOCH3
Акрилонитрил CH
2
CH
CN
стирол
CH2
CH2
CH
Винилацетат
O
CH
C
CH3
O
аллиловые мономеры
1600
84.
Полимеризация аллиловых мономеров.Инициирование:
I + CH2
CH
CH2Cl
I
CH
CH2Cl + CH2
CH2
I2 2I
I
CH2
CH
CH2Cl
CH
CH2Cl
H
полимеризация Должна быть, НО!!!
I
CH2
CH
CH2Cl + CH2
CH
CHCl
I
CH2
CH2
CH2Cl + CH2
CH
CHCl
Неактивный аллильный радикал
Вырожденная (деградационная) передача цепи на
мономер, который превращается в неактивный
аллильный радикал, неспособный присоединять
к себе мономер.
85.
Полимеризация при термическоминициировании:
Vин=Vo
kин[M]2=ko[R ]2
1/ 2
2 kин
V p k p [ M ]
ko
Pn
1/ 2
kин
[ R ] [ M ]
k
o
Vp
Vo
kp
( kин ko )1 / 2
Полимеризация в присутствии ингибитора
Vин=Vz
kин[I]=kz[R ][Z]
Vp k p [M ]
kин [ I ]
kz[ Z ]
[R ]
Pn
Vp
Vo
k ин [ I ]
kz[ Z ]
k p [M ]
k z [Z ]
86.
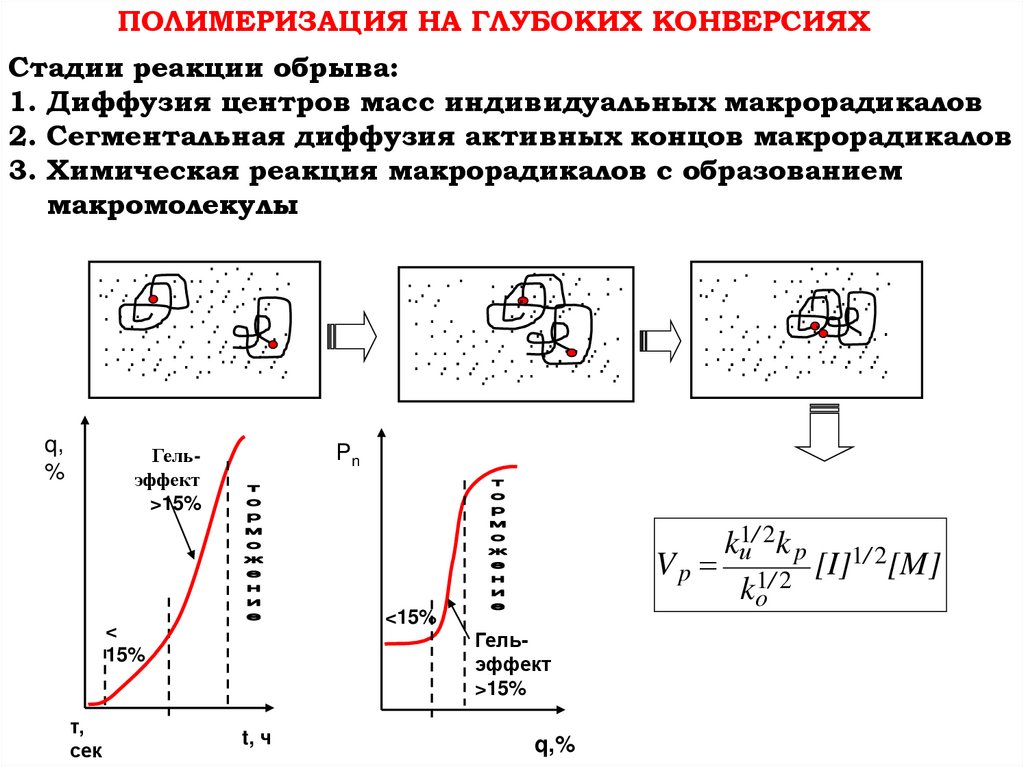
ПОЛИМЕРИЗАЦИЯ НА ГЛУБОКИХ КОНВЕРСИЯХСтадии реакции обрыва:
1. Диффузия центров масс индивидуальных макрорадикалов
2. Сегментальная диффузия активных концов макрорадикалов
3. Химическая реакция макрорадикалов с образованием
макромолекулы
q,
%
Pn
Гельэффект
>15%
<15%
<
15%
τ,
сек
kи1/ 2k p 1/ 2
V p 1/ 2 [I] [M]
ko
Гельэффект
>15%
t, ч
q,%
87.
• Ионная полимеризация88.
АНИОННАЯ ПОЛИМЕРИЗАЦИЯМономеры
ВИНИЛОВЫЕ мономеры с электроноакцепторными заместителями
CH2
CH
Роль X – стабилизация аниона
X – нитрил, сложноэфирная группа, арил, винил.
X
CH3
CH2
CH
CN
CH2
CH2
CH
C
COOCH3
акрилонитрил метилметакрилат стирол
CH2
CH
CH
CH2
1,3-бутадиен
Образование обобщенной единой ароматической системы ПИсвязей (бензольного ядра) приводит к значительному энергетическому
повышению устойчивости системы примерно на 40 ккал\моль по
сравнению с системой с тремя изолированными кратными связями. Это
является одной из причин того, что в зависимости от конкретных
условий реакции, ароматическое кольцо проявляет либо электроноакцепторные, либо электроно-донорные свойства
88
89.
АНИОННАЯ ПОЛИМЕРИЗАЦИЯОсновные стадии полимеризации:
1. Инициирование
2. Рост цепи
3. Обрыв цепи
4. Передача цепи
часто отсутствуют, но характерны для
полярных сред и полярных мономеров
Инициирование присоединение к мономеру :
а) части молекулы инициатора (A –B+) + M AM- + B+ (алкилы, алкоксиды
щелочных металлов)
Б) свободного аниона
A- + M AM- (NaNH2 в NH3 (жидк.))
в) перенос на молекулу мономера электрона с инициирующего анион-радикала
A. + M AM. (щелочные металлы с полициклическими ароматическими
углеводородами )
Г)металла
Ме + M Ме+ + M. (щелочные металлы в эфирных растворителях)
90.
Анионная полимеризацияИНИЦИИРОВАНИЕ
Инициируют металлалкилы, алкоксиды и амиды металлов, щелочи и
другие реагенты основного характера.
K+ + NH2-
KNH2
kин
C4H9-Li + CH2=CH
C4H9 CH2 CH Li
k
NH2- + CH2=CH ин NH2 CH2 CH K+
C6H5
C6H5
C6H5
C6H5
При использовании щелочных металлов или систем на основе щелочного
металла с полициклическими углеводородами (дифенил, нафталин,
антрацен) инициирование происходит по механизму переноса электрона. В
результате образуются анион-радикалы мономера, которые
рекомбинируют с образованием дианиона.
.
k
e
Na + CH2=CH ин CH2
C6H5
.
2 CH2
CH Na
C6H5
CH Na
C6H5
Na CH
C6H5
CH2
CH2
CH Na
C6H5
91.
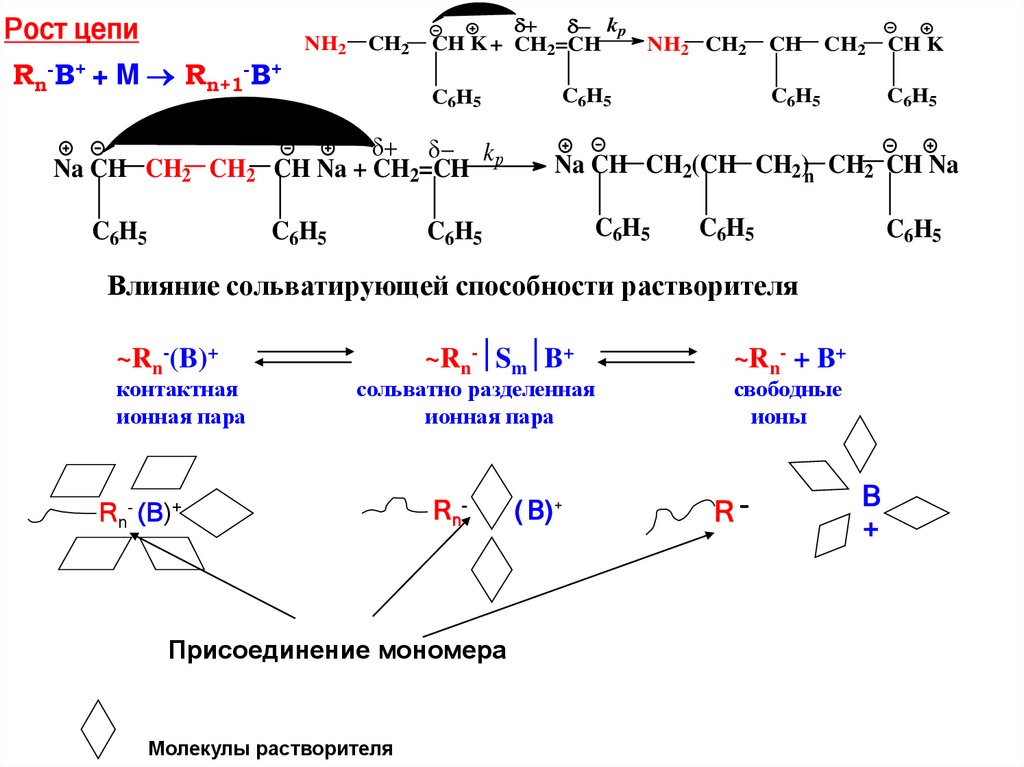
Рост цепиRn-B+ + M Rn+1-B+
Na CH CH2 CH2
C6H5
NH2
CH2
kp
CH K + CH2=CH
NH2 CH2
CH
C6H5
C6H5
C6H5
kp
CH Na + CH2=CH
C6H5
CH2
C6H5
Na CH CH2(CH CH2)n CH2 CH Na
C6H5
C6H5
C6H5
C6H5
Влияние сольватирующей способности растворителя
~Rn-(B)+
контактная
ионная пара
~Rn- Sm B+
сольватно разделенная
ионная пара
Rn- (B)+
Rn -
Присоединение мономера
Молекулы растворителя
CH K
( B) +
~Rn- + B+
свободные
ионы
R-
B
+
92.
Реакции обрыва в анионной полимеризации1. перенос гидрид-иона с конца растущей цепи на противоион
(полимеризация акрилонитрила)
~(CH2-CH)n
CN
CH
CH Li
H
CN
~(CH2-CH)n
CH
CH + LiH
CN
CN
2. перенос гидрид-иона с конца растущей цепи на мономер
(винилхлорид, винилиденхлорид, хлоропрен – перенос хлорид иона)
~(CH2-CH)n
CH2
~(CH2-CH)n
CH Li
На мономер
Cl
CH
CH2 + LiCl
Cl
Cl
3. отрыв протона растущей цепью от растворителя (полимеризация
стирола или бутадиена в толуоле или жидком аммиаке)
NH2-(CH2-CH)n
C6H5
CH2
CH K
C6H5
H
NH2
NH2-(CH2-CH)n
C6H5
CH2
+
-
CH2 + K NH2
C6H5
Реакции обрыва в анионной полимеризации реализуются с очень
большим трудом, они энергетически не выгодны
живые цепи
93.
Полимеризация ненасыщенных углеводородов(стирол, диены)
отсутствие
реакций
кинетического
обрыва
цепи
при
незначительной роли или полном отсутствии актов передачи цепи. Живые
цепи, способные к реакции роста вплоть до исчерпания мономера.
Кинетика такого процесса определяется соотношением констант
скоростей инициирования kи и роста цепи kp.
При kи >> kp
Vp = kp[M][I]0
Все цепи зарождаются практически одновременно. Образующиеся
полимеры характеризуются узким ММР (Mw/Mn~1).
Pn=nq[M]0/[I]0,
q – конверсия, n – число растущих концов в макромолекуле (n=1 или 2).
При kи << kp процесс протекает нестационарно и образующиеся
полимеры характеризуютя широким ММР.
94.
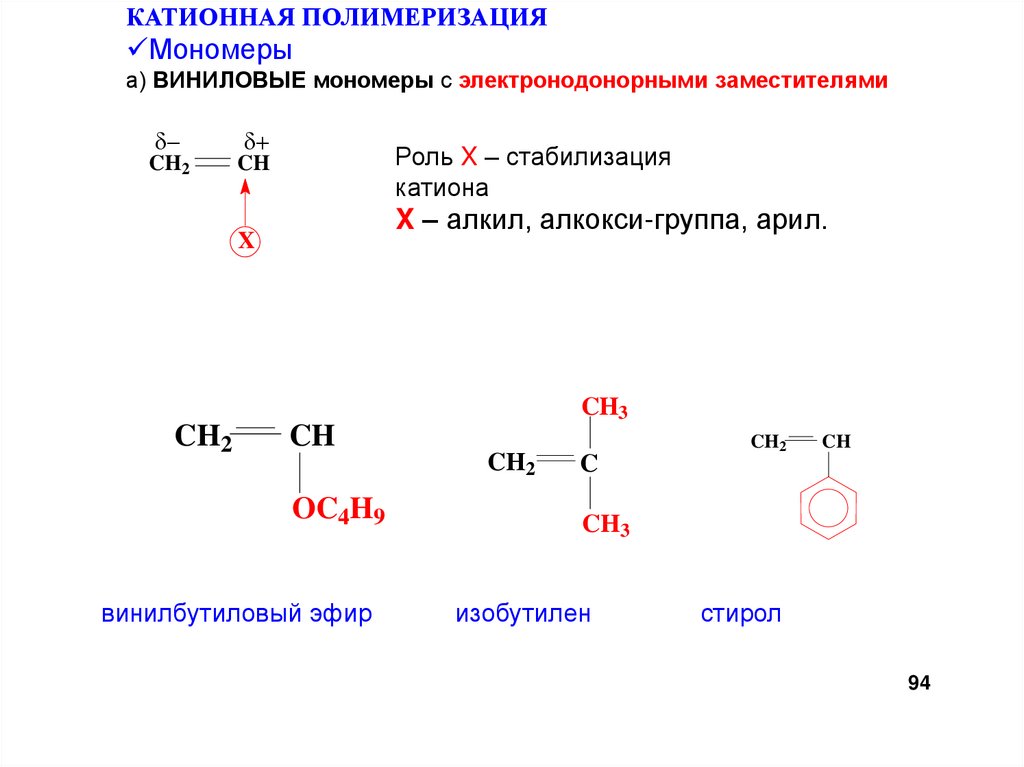
КАТИОННАЯ ПОЛИМЕРИЗАЦИЯМономеры
а) ВИНИЛОВЫЕ мономеры с электронодонорными заместителями
CH2
CH
Роль X – стабилизация
катиона
X – алкил, алкокси-группа, арил.
X
CH3
CH2
CH
CH2
OC4H9
винилбутиловый эфир
C
CH2
CH
CH3
изобутилен
стирол
94
95.
КАТИОННАЯ ПОЛИМЕРИЗАЦИЯОсновные стадии полимеризации:
1. Инициирование
2. Рост цепи
3. Обрыв цепи
в ряде случаев могут отсутствовать
4. Передача цепи
Инициирование – 1) образование
первичных активных частиц:
а) катионы, реагирующие свободно или в составе
ионной пары
б)
кислоты
Льюиса
сокатализаторов
BF3
в
присутствии
и 2) их присоединение к мономеру
96.
Катионная полимеризация1.протонодонорные кислоты
ИНИЦИИРОВАНИЕ
H2SO4, H3PO4, HClO4
2. Инициирование комплексом катализатор–сокатализатор –
кислоты Льюиса BF3, AlCl3, SnCl4 и др. в присутствии доноров протонов
(вода, галогенводородные кислоты, спирты) или галогеналкилов.
CH3
BF3 + CH2
Инициатор-соинициатор !!!
полимеризация не идет
C
CH3
CH3
BF3 + H2O + CH2
C
CH3
полимеризация идет
97.
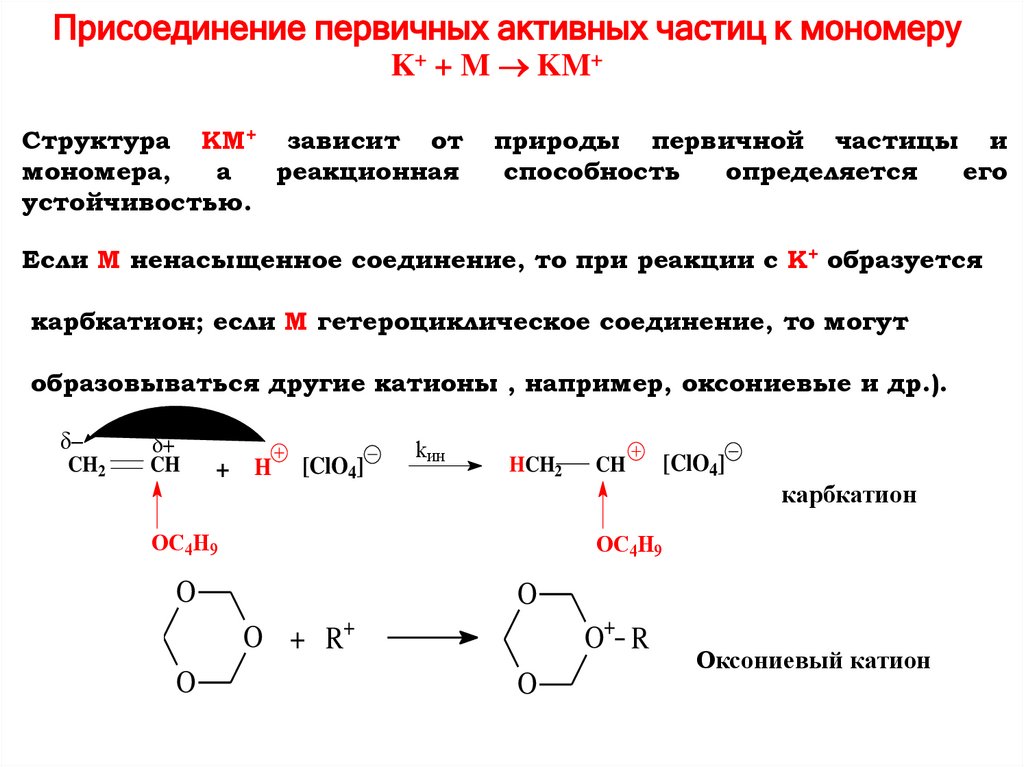
Присоединение первичных активных частиц к мономеруK+ + M KM+
Структура KM+ зависит от
мономера,
а
реакционная
устойчивостью.
природы первичной частицы и
способность
определяется
его
Если M ненасыщенное соединение, то при реакции с K+ образуется
карбкатион; если M гетероциклическое соединение, то могут
образовываться другие катионы , например, оксониевые и др.).
CH2
CH
+ H
[ClO4]
kин
HCH2
OC4H9
[ClO4]
карбкатион
OC4H9
O
O
O+ R
O + R+
O
CH
O
Оксониевый катион
98.
Обрыв цепи При катионной полимеризации реакции обрыва и передачицепи можно разделить условно, т.к. при обрыве часто происходит
регенерация катализатора (инициатора), способного
реинициировать полимеризацию.
Нейтрализация заряда на конце цепи (истинный
кинетический обрыв).
~CH2
CH[BF3OH]
ko
~CH2
CH[BF3OH]
OC4H9
OH + BF3
OC4H9
OC4H9
CH3Cl + ~CH2
CH
ko'
~CH2
CH
Cl
OC4H9
+ CH3+[BF3OH]-
99.
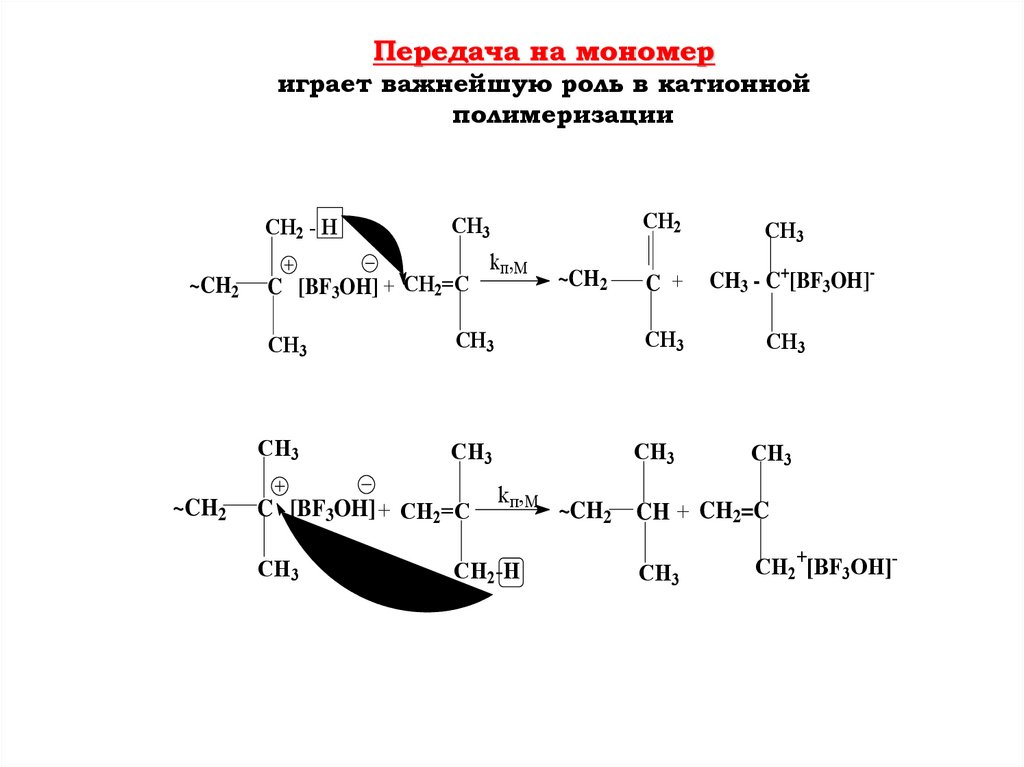
Передача на мономериграет важнейшую роль в катионной
полимеризации
CH2 - H
~CH2
~CH2
CH3
C [BF3OH] + CH2=C
kп,М
~CH2
CH2
CH3
C +
CH3 - C+[BF3OH]-
CH3
CH3
CH3
CH3
CH3
CH3
CH3
CH3
C [BF3OH] + CH2=C
CH3
kп,М
CH2-H
~CH2
CH + CH2=C
CH3
CH2+[BF3OH]-
100.
СОПОЛИМЕРИЗАЦИЯ – совместная полимеризация 2-х или болеемономеров (классификация).
Распределение звеньев в макромолекулах сополимеров
Статистические
сополимеры:
в
макромолекуле
сополимера
распределение мономерных звеньев описывается известным законом
статистики
~M1M1M2M1M2M2M1M1M1M2M1M1M2 ~
Чередующиеся (для 2-х мономерных
сополимера мономерные звенья чередуются
~ M1M2M1M2M1M2M1M2M1M2M1M2~
звеньев):
в
макромолекуле
Периодические: упорядоченная последовательность из более, чем двух
мономерных звеньев
~ M1M2М3M1M2М3M1M2М3M1M2М3M1M2М3M1M2М3~
101.
СополимеризацияГрадиентные: состав макромолекулы изменяется непрерывно вдоль цепи
~ M1M1М2M1M1М1M1M2М1M1M2М2M1M1М2M2M2М2~
Блок-сополимеры: линейные макромолекулы с длинными (полимерными)
блоками одинаковых звеньев, разделенными длинными (полимерными)
блоками других звеньев
~M1M1M1M1M1M1M1M1M1M1M1M1M2M2M2M2M2M2M2M2~
Привитые сополимеры: разветвленные макромолекулы, у которых
основная цепь состоит из звеньев одного мономера, а к ней ковалентно
присоединены одна или более боковых макромолекул, построенных из звеньев
другого мономера
~M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1M1~
M2M2M2M2M2M2M2M2M2M2M2M2M2M2~
102.
Композиционная неоднородностьмакромолекул сополимеров
Различают :
Мгновенную неоднородность, которая возникает в
результате статистического характера реакций обрыва цепи.
Конверсионную
неоднородность,
изменением
состава
сополимеризации.
мономерной
При
азеотропной
обусловленную
смеси
в
ходе
сополимеризации
составы
сополимера и мономерной смеси не меняются по ходу
реакции
и
остаются
равными
исходному
составу
мономерной смеси, что приводит к получению продуктов,
композиционная неоднородность которых минимальна и
связана только с ее мгновенной составляющей.
103.
Композиционная неоднородность макромолекулсополимеров
Эксплуатационные свойства
сополимеров зависят от:
бинарных
среднего состава сополимера,
композиционной неоднородности
распределения мономерных звеньев в
макромолекулах.
Состав отдельной макромолекулы
может отличаться от среднего состава
всего
образца,
что
приводит
к
композиционной
неоднородности
сополимера.
104.
Реакция роста цепиКинетика реакции роста цепи определяет состав сополимеров
и весь комплекс их химических и физико-механических свойств
Концевая модель (Майо и Льюис, Алфрей и Голдфингер)
учитывает влияние концевого звена на реакционную способность
активного центра по отношению к молекулам мономеров.
M1* + M1 M1M1*
k11
V p ,11 k11[ M 1* ][ M 1 ]
M1* + M2 M1M2*
k12
V p ,12 k12 [ M 1* ][ M 2 ]
M2* + M2 M2M2*
k22
V p , 22 k 22 [ M 2* ][ M 2 ]
M2* + M1 M2M1*
k21
V p , 21 k 21[ M 2* ][ M 1 ]
d[M1 ]
[m1 ] V p ,11 V p , 21 k11[ M 1* ][ M 1 ] k 21[ M 2* ][ M 1 ]
dt
d[M 2 ]
[m2 ] V p , 22 V p ,12 k 22 [ M 2* ][ M 2 ] k12 [ M 1* ][ M 2 ]
dt
m1 k11 [ M 1* ][ M 1 ] k 21 [ M 2* ][ M 1 ]
m2 k 22 [ M 2* ][ M 2 ] k12 [ M 1* ][ M 2 ]
105.
Допущения для вывода уравнения состава сополимераPn >>1 (действительно реакция полимеризации)
Реакционная способность M1* и M2* не зависит от Pn
Условие квазистационарности: Vp,12=Vp,21 k [M *][M ]= k [M *][M ]
12
1
2
21
2
1
малые конверсии
Уравнение описывает состав «мгновенного» сополимера, образующегося на
начальных конверсиях, когда изменением концентраций мономеров можно
пренебречь.
k11
[M 1 ] [M 2 ]
m1 [ M 1 ] k12
[ M 1 ] r1 [ M 1 ] [ M 2 ]
m2 [ M 2 ] k 22
[ M 2 ] r2 [ M 2 ] [ M 1 ]
[M 2 ] [M 1 ]
k 21
r1 и r2 – константы сополимеризации
k 22
r2
k 21
k11
r1
k12
k11, k22 – константы скорости присоединения радикала к своему мономеру
k12, k21 – константы скорости присоединения радикала к чужому мономеру
106.
Диаграмма составов сополимеровr 1= k11 / k12
r2 = k22 / k21 Если r >1 и r <1, то сополимер обогащен
1
2
1) r1>1, r2<1
2) r1<1, r2>1
3) r1=1, r2=1
4) r1<1, r2<1
5) 6) r1 =0, r2=0
звеньями М1
Если r1<1 и r2>1, то сополимер обогащен
звеньями М2
Если r1=r2=1, то состав сополимера всегда равен
составу исходной смеси.
Если r1<1 и r2<1, то при малых содержаниях M1
в исходной смеси мономеров сополимер обогащен
звеньями М1, а при больших — звеньями M2
(тенденция к чередованию в сополимере звеньев
М1 и М2, которая тем больше, чем ближе к нулю
значения r1 и r2).
Если кривая состава пересекает диагональ
диаграммы составов; в точке пересечения,
называемой азеотропной, состав сополимера
равен составу сомономерной смеси.
Если r1>1 и r2>1, то наблюдается тенденция к
раздельной полимеризации мономеров в смеси.
Если r1=0, r2=0 образуется чередующийся
сополимер
107.
Радикальная сополимеризацияЗначения r1 , r2 и состав сополимера обычно слабо
зависят от природы растворителя и мало меняются с
температурой.
Исключение составляют
явления, связанные c донорно-акцепторными взаимодействиями
реагентов. Если один из мономеров оказывается сильным донором,
а другой – сильным акцептором, образуются чередующиеся
сополимеры.
Дополнительно
еще
сказываются
и
стерические
затруднения
Стирол – малеиновый ангидрид
r1=0
r2=0
сополимеризация ионогенных мономеров в зависимости от pH
Акриловая кислота – акриламид
pH =2
r1=0.9 r2=0.25,
pH =9
r1=0.3 r2=0.95
108.
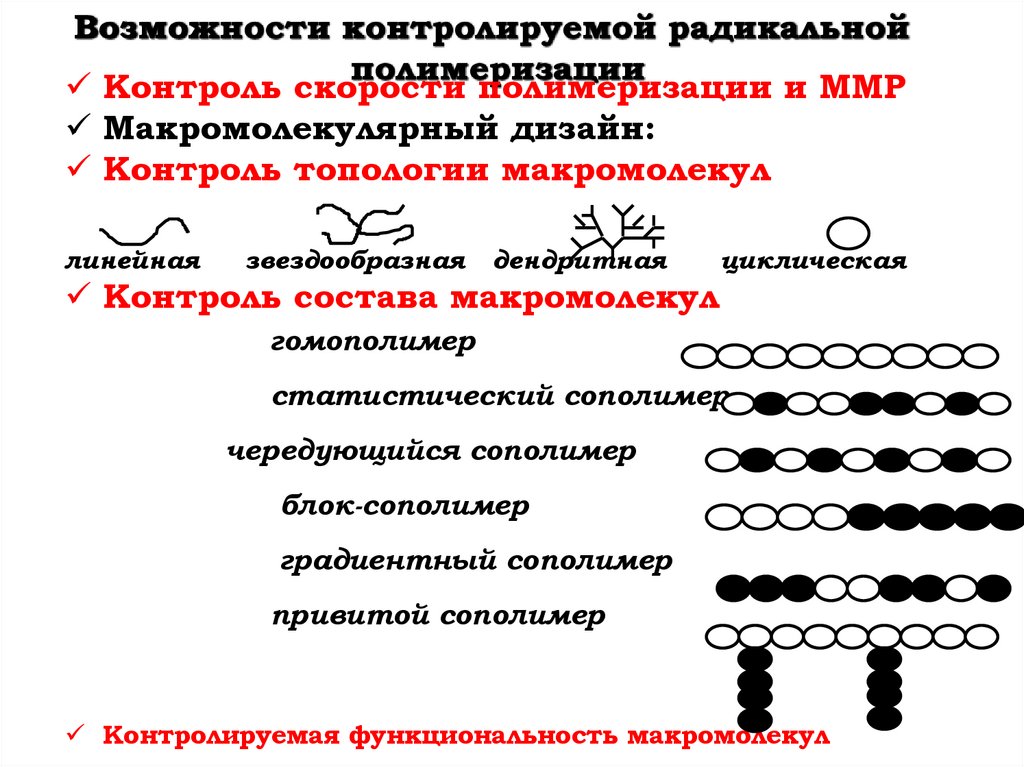
Возможности контролируемой радикальнойполимеризации
Контроль скорости полимеризации и ММР
Макромолекулярный дизайн:
Контроль топологии макромолекул
линейная
звездообразная
дендритная
циклическая
Контроль состава макромолекул
гомополимер
статистический сополимер
чередующийся сополимер
блок-сополимер
градиентный сополимер
привитой сополимер
Контролируемая функциональность макромолекул
109.
Новые возможности радикальнойполимеризации в контролируемом синтезе
макромолекул
Классическая радикальная
полимеризация
инициирование
I 2 R1 .
рост
R1 . + M P .
P . + nM Pn+1 .
обрыв
Pp . + Pn. P
передача
P . + SH PH +S .
110.
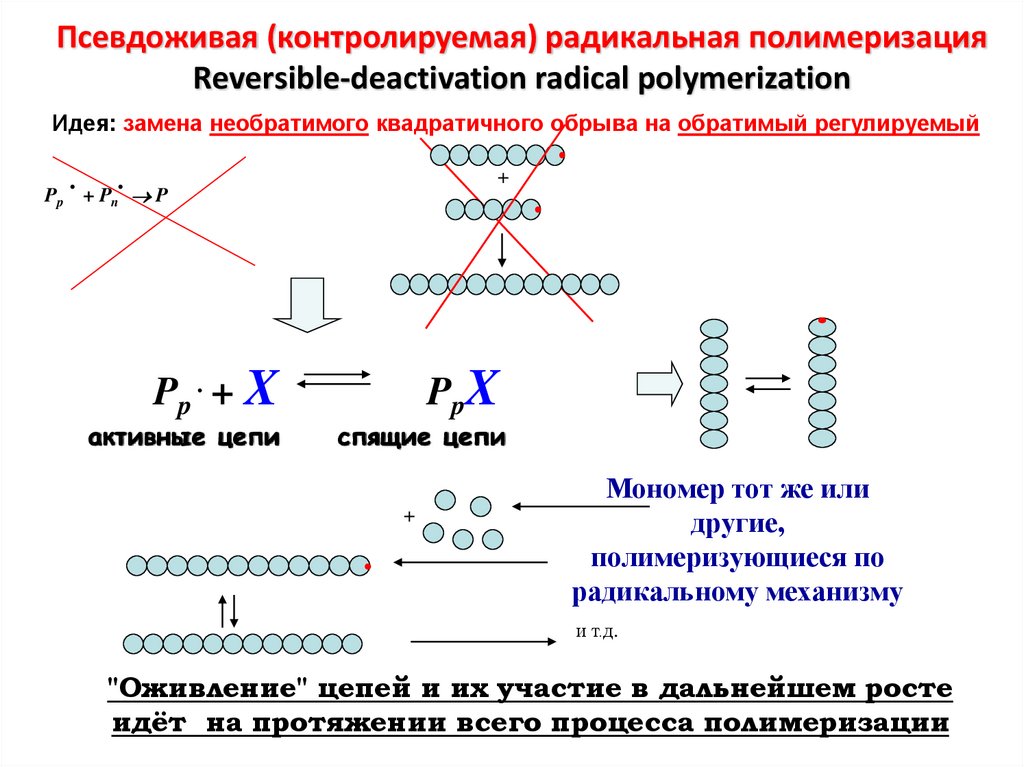
Псевдоживая (контролируемая) радикальная полимеризацияReversible-deactivation radical polymerization
Идея: замена необратимого квадратичного обрыва на обратимый регулируемый
.
.
+
Pp + Pn P
Pp . + X
активные цепи
PpX
спящие цепи
+
Мономер тот же или
другие,
полимеризующиеся по
радикальному механизму
и т.д.
"Оживление" цепей и их участие в дальнейшем росте
идёт на протяжении всего процесса полимеризации
111.
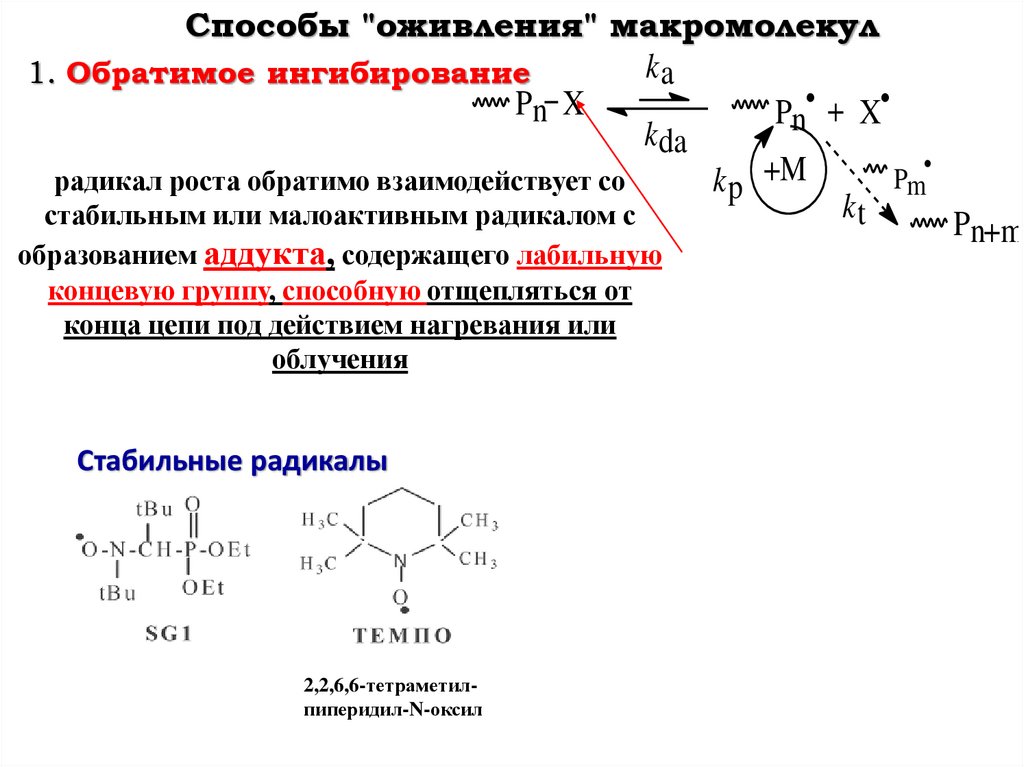
Способы "оживления" макромолекулka
1. Обратимое ингибирование
Pn X
Pn• + X
k da
Pm
радикал роста обратимо взаимодействует со
k p +M
kt
стабильным или малоактивным радикалом с
Pn+m
образованием аддукта, содержащего лабильную
концевую группу, способную отщепляться от
конца цепи под действием нагревания или
облучения
Стабильные радикалы
2,2,6,6-тетраметилпиперидил-N-оксил
112.
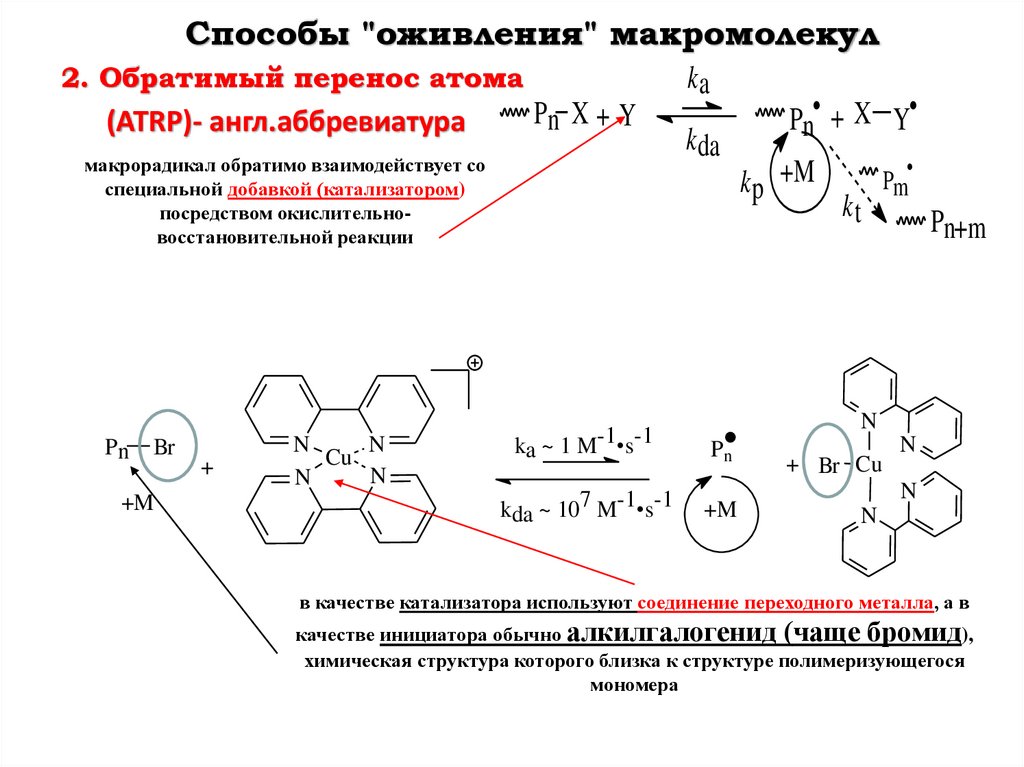
Способы "оживления" макромолекул2. Обратимый перенос атома
(ATRP)- англ.аббревиатура
ka
Pn X + Y
макрорадикал обратимо взаимодействует со
специальной добавкой (катализатором)
посредством окислительновосстановительной реакции
Pn
Br
+M
+
N
N
Cu
N
N
k da
Pn• + X Y
k p +M
kt
Pm
Pn+m
N
ka ~ 1 M-1•s-1
Pn
kda ~ 107 M-1•s-1
+M
+ Br Cu
N
N
N
в качестве катализатора используют соединение переходного металла, а в
качестве инициатора обычно алкилгалогенид (чаще бромид),
химическая структура которого близка к структуре полимеризующегося
мономера
113.
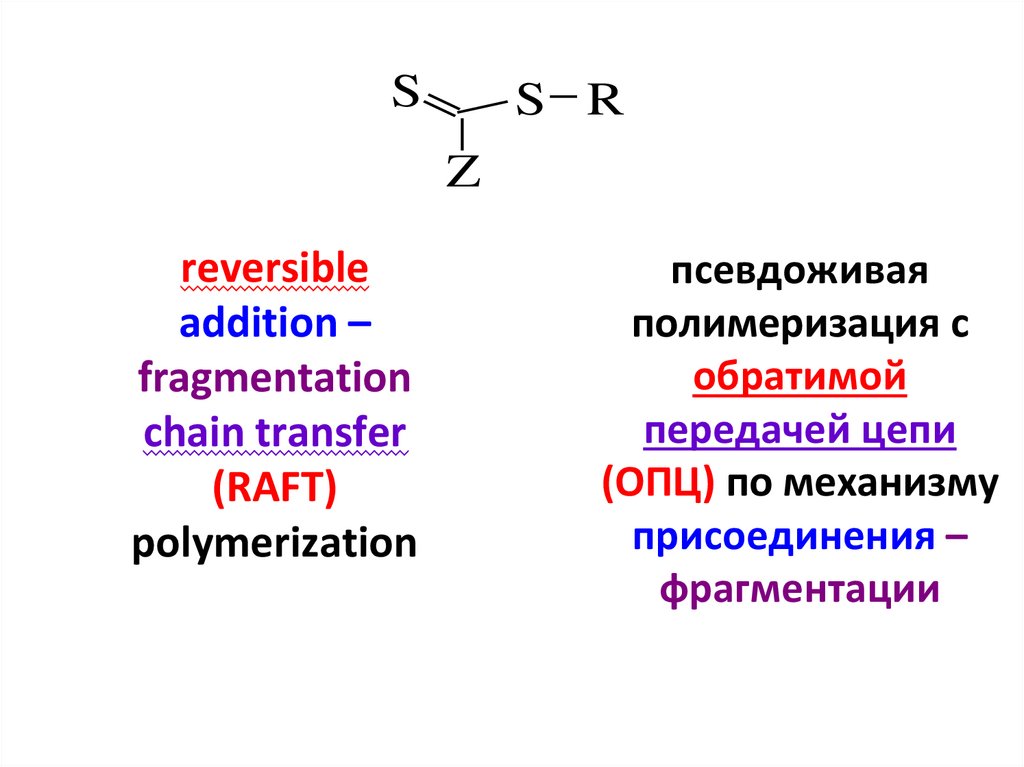
SS R
Z
reversible
addition –
fragmentation
chain transfer
(RAFT)
polymerization
псевдоживая
полимеризация с
обратимой
передачей цепи
(ОПЦ) по механизму
присоединения –
фрагментации
114.
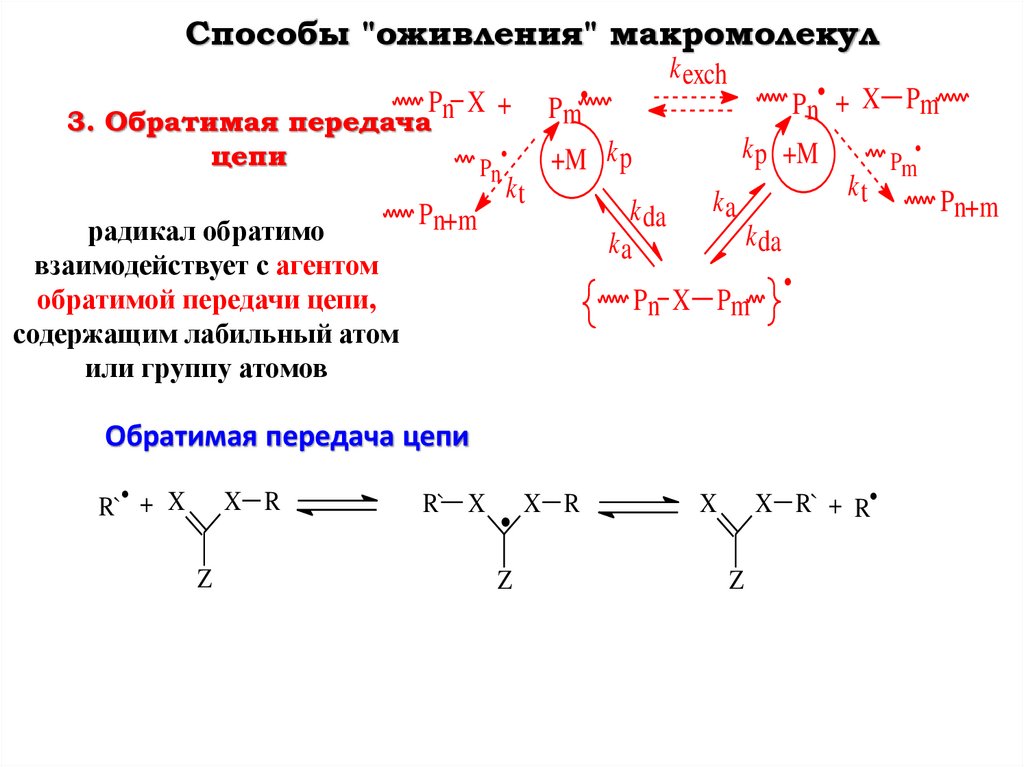
Способы "оживления" макромолекулPm
Pn X +
3. Обратимая передача
цепи
радикал обратимо
взаимодействует с агентом
обратимой передачи цепи,
содержащим лабильный атом
или группу атомов
Pn
Pn+m
k exch
Pn• + X Pm
k p +M
+M k p
kt
k da
ka
kt
ka
k da
Pn X Pm
Обратимая передача цепи
R`• + X
X R
Z
R` X
X R
Z
X R` + R
X
Z
Pm
Pn+m
115.
Поликонденсация116.
Сравнительные характеристики реакций полимеризации иполиконденсации
полимеризация
• 1. цепная реакция
присоединения активных
центров (радикалов, анионов ,
катионов) к кратным связям
мономеров.
• 2.не выделяется
низкомолекулярное вещество.
• 3. молекулярная масса
образующегося полимера
практически не зависит от
конверсии.
• 4. практически нет
промежуточных олигомеров.
поликонденсация
• 1.Ступенчатая реакция между
функциональными группами
многофункциональных
мономеров.
• 2.выделяется
низкомолекулярное вещество,
которое необходимо удалять
из реакционной среды.
• 3.молекулярная масса
полимера зависит от
конверсии, от константы
равновесия, от Са\Св, от конц.
низкомолекулярного
вещества.
• 4. промежуточные олигомеры
стабильны и способны к
дальнейшим реакциям.
117.
118.
ПОЛИКОНДЕНСАЦИЯПоликонденсация
–
процесс
образования
макромолекул
в
результате
ступенчатого химического взаимодействия функциональных групп
многофункциональных мономеров и
реакции, а также молекул
n-меров, накапливающихся в ходе
n-меров между собой.
По типу участвующих в реакции мономеров
поликонденсацию подразделяют на:
ГОМОПОЛИКОНДЕНСАЦИЮ (1 мономер)
простые полиэфиры
n CH2
CH2
OH
OH
H+
CH2
o
CH2
O
TC
n H2O
n +
полиамиды
n NH2
R COOH
H+
o
NH
R
TC
n NH2
R COCl
H+
o
TC
CO
n H2O
n +
O
NH
R
CO
O
n HCl
n +
119.
СОПОЛИКОНДЕНСАЦИЮ (2 и более мономеров)простые полиэфиры
OH R OH + OH R"
OH
O R O
R"
n+
n H2O
полиамиды
NH2
R COOH + NH2
R" COOH
NH
R
CO
NH R"
O
NH2
R COCl + NH2
R" COCl
NH
R
CO
O
CO
+ n H2O
n
O
NH R"
CO
O
+ n HCl
n
120.
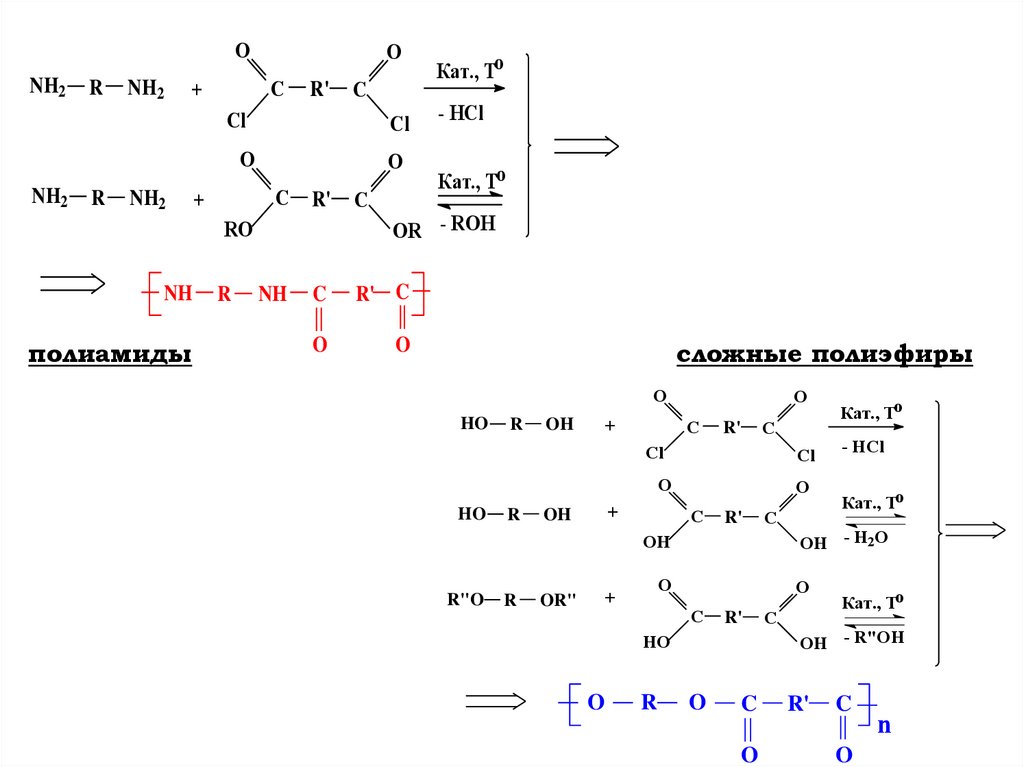
ONH2
NH2
R
R
NH2
O
Кат., To
Cl
Cl
- HCl
O
O
C
+
NH2
C
+
R'
R'
C
C
R' C
O
O
RO
NH
полиамиды
R
NH
C
Кат., To
OR - ROH
сложные полиэфиры
O
HO
HO
R
R
OH
O
Кат., To
Cl
Cl
- HCl
O
O
+
C
+
OH
C
R'
R'
C
C
OH
R"O
R
OR"
O
+
R'
HO
O
R
OH - H2O
O
C
O
C
O
C
Кат., To
Кат., To
OH - R"OH
R'
C
O
n
121.
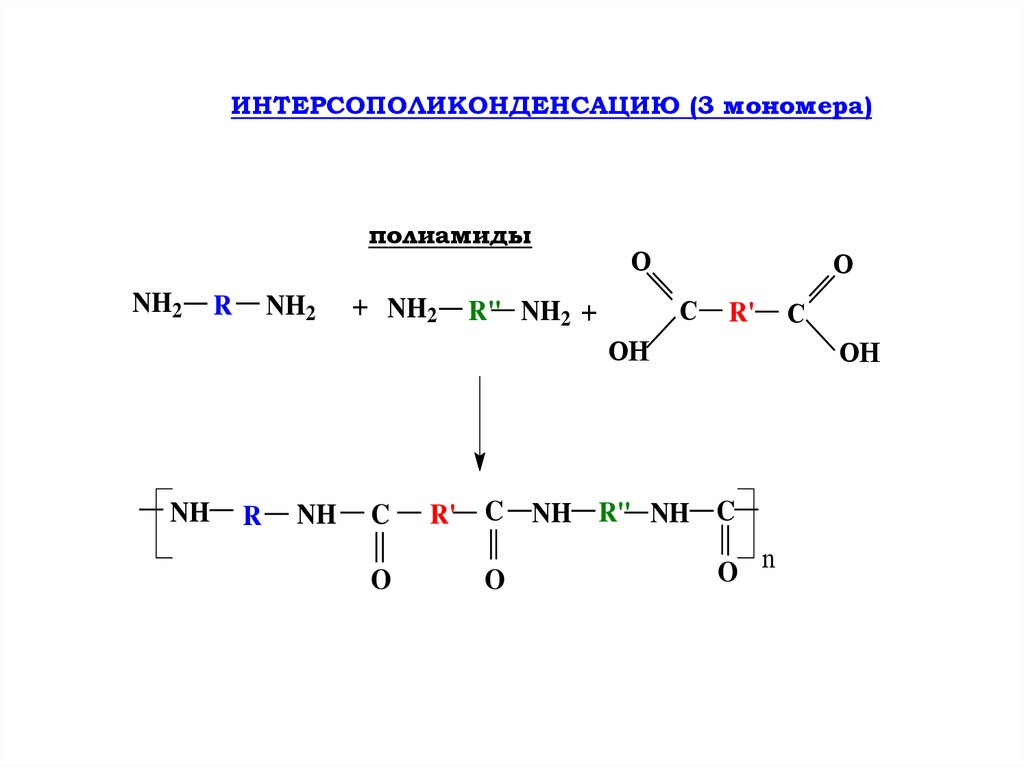
ИНТЕРСОПОЛИКОНДЕНСАЦИЮ (3 мономера)полиамиды
NH2
R
NH2
+ NH2
O
O
C
R" NH2 +
R'
OH
NH
R
NH
C
O
R' C
O
C
OH
NH R" NH C
O n
122.
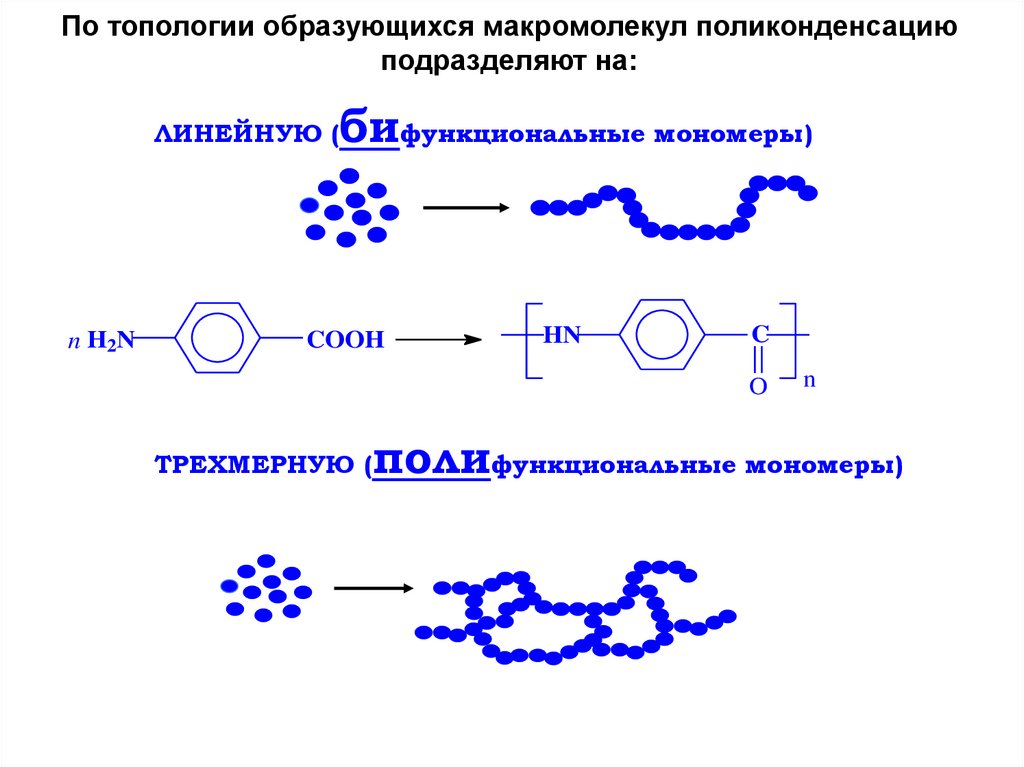
По топологии образующихся макромолекул поликонденсациюподразделяют на:
ЛИНЕЙНУЮ (
n H2N
бифункциональные мономеры)
COOH
HN
C
O
ТРЕХМЕРНУЮ (
n
полифункциональные мономеры)
123.
По значению константы поликонденсационного равновесия Kполиконденсацию подразделяют на:
n A+ n B
k1
A B A B A B
K = k1/k-1
k-1
равновесную (обратимую)
K 10 100
Степень завершенности реакции и степень
полимеризации лимитируются равновесными
концентрациями реагентов и продуктов реакции
неравновесную (необратимую)
К 103
Степень завершенности реакции и степень
полимеризации лимитируются не
термодинамическими, а кинетическими факторами
124.
Значения констант равновесия (К) для некоторыхслучаев поликонденсации
Необратимая поликонденсация
Тип
поликонденсации
Мономеры
К
полиэтерификация
бисфенол+бисбензоилхлорид (модельная
реакция)
4260
полиамидирование
Тетрамины+диангидриды ароматических
тетракарбоновых кислот
1015 –1025
Диамины+дихлорангидриды
ароматических дикарбоновых кислот
> 1015
Обратимая поликонденсация
Тип
поликонденсации
Мономеры
К
полиэтерификация
пентаметиленгликоль+адипиновая кислота
6.0
полиамидирование
-аминоундекановая кислота
8.9
125.
Побочные химические реакции , в результате которыхфункциональные группы утрачивают способность участвовать в
реакции роста.
1.
Взаимодействие
функциональных
групп
мономеров
с
монофункциональным соединением,
присутствующим в виде примеси
или специально введенной добавки – обрыв цепи.
2. Химическое превращение функциональных групп вследствие
протекания побочных реакций:
HOOC–R-COOH HR-COOH + CO2
ClOC-R-COCl + 2H2O HOOC-R-COOH + 2HCl
3. Циклизацияа) внутримолекулярная (реагируют функциональные
группы одной молекулы, 5–7 и 20–40 членные циклы) NH CH2 CH2
NH2(CH2)5COOH
C
CH2
CH2 CH2
O
б) межмолекулярная (реагируют функциональные группы разных
молекул)
HOCH2CH2OH + C2H5OOC-COOC2H5
O
CH2
CH2
C
C
O
O
O
+ 2C2H5OH
4. Деструкционные процессы – реакции, приводящие к разрыву
основной цепи макромолекул
126.
Кинетика поликонденсацииДля поликонденсации характерно исчезновение мономера
уже на ранних стадиях процесса, когда молекулярная масса
продукта реакции ещё очень мала.
Дальнейший рост цепи происходит при практически
полном отсутствии мономера в системе (при полимеризации
на ВСЕХ стадиях наряду с макромолекулами, активными
макрорадикалами (анионами и катионами) присутствует
мономер).
При количественном анализе кинетики поликонденсации
используют принцип Флори: активность реагирующих групп
не зависит от длины цепи макромолекулы.
Реакционная
способность
функциональных
групп
бифункционального
мономера
не
зависит
от
того,
прореагировала ли его другая функциональная группа.
Вязкость системы практически не влияет на скорость
реакции, т.к. такие реакции проводят при повышенных
температурах.
127.
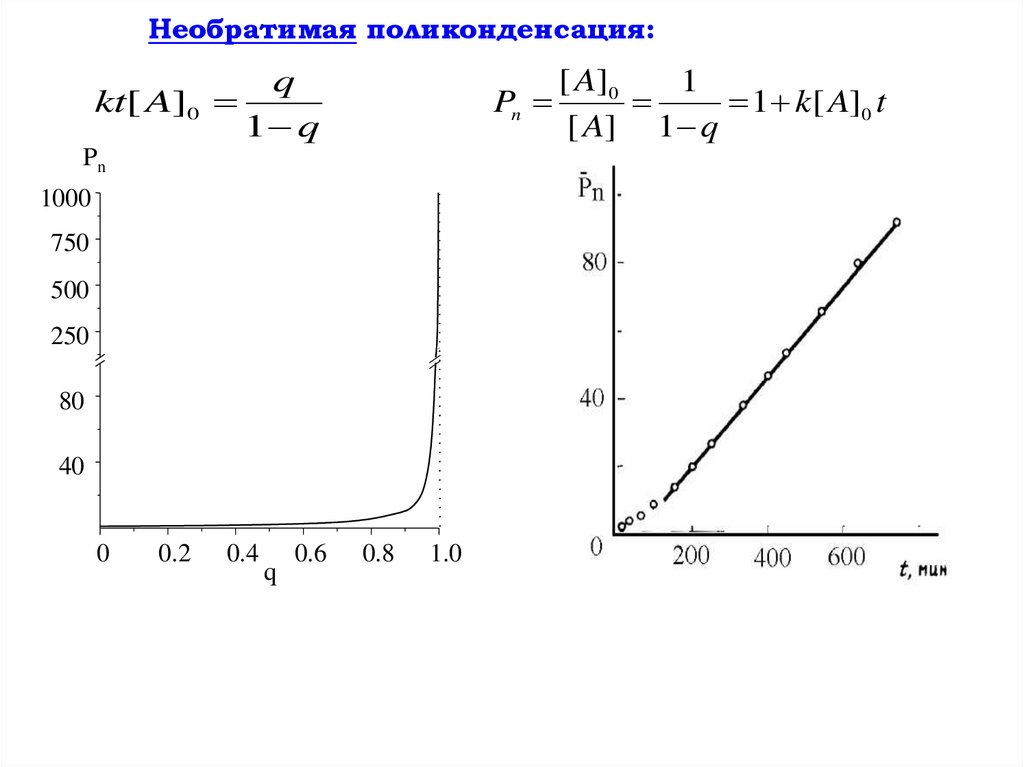
Кинетика поликонденсацииДля необратимой поликонденсации и начальных стадий обратимой
поликонденсации, когда обратной реакцией можно пренебречь:
Мономеры взяты в эквимолярных количествах
Уравнение изменения концентрации
функциональных групп:
k – константа скорости реакции
d [ A]
d [ B]
k[ A][ B] k[ A]2
dt
dt
После интегрирования , введения начальной концентрации
функциональных групп [A]0 и глубины превращения q (доли
прореагировавших
к
данному
моменту
времени
функциональных групп):
[ A]0 [ A]
q
[ A]0
q
kt[ A]0
1 q
Для необратимой поликонденсации характерны высокие
скорости (k до 105 л/моль.с), низкие значения энергии
активации (8 – 40 кДж/моль); как правило, эти процессы
сильно экзотермичны.
128.
Необратимая поликонденсация:kt[ A]0
q
1 q
Pn
Pn
1000
750
500
250
80
40
0
0.2
0.4
q
0.6
0.8
1.0
[ A]0
1
1 k[ A]0 t
[ A] 1 q
129.
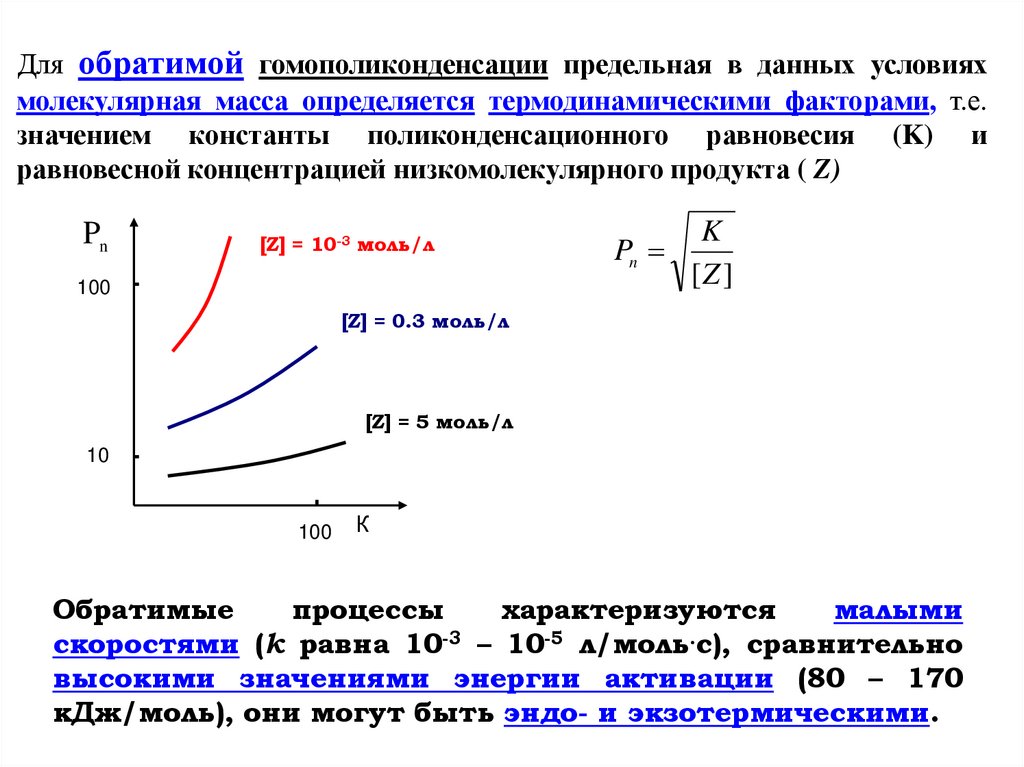
Для обратимой гомополиконденсации предельная в данных условияхмолекулярная масса определяется термодинамическими факторами, т.е.
значением константы поликонденсационного равновесия (K) и
равновесной концентрацией низкомолекулярного продукта ( Z)
Pn
[Z] = 10-3 моль/л
100
Pn
K
[Z ]
[Z] = 0.3 моль/л
[Z] = 5 моль/л
10
100
К
Обратимые
процессы
характеризуются
малыми
скоростями (k равна 10-3 – 10-5 л/моль.с), сравнительно
высокими значениями энергии активации (80 – 170
кДж/моль), они могут быть эндо- и экзотермическими.
130.
Факторы, влияющие на молекулярную массуполиконденсационных полимеров
1. Глубина проведения процесса q (необратимая поликонденсация)
2. Эквимольность реагирующих между собой исходных соединений
(молярное соотношение мономеров)
Нарушения:
Если в реакцию вводят неэквимольные количества исходных
веществ. Тогда
[ A]
r
1
[ B]
1 r
Pn
1 r 2rq
1 r
Pn
1 r
при q=1
Если в реакционной смеси присутствуют монофункциональные
соединения C, взаимодействующие с исходными веществами, то
2[A]
r
2[B] [C]
Если
функциональные
группы
мономеров
претерпевают
химические
изменения,
превращаясь
в
группы,
нереакционноспособные
в
условиях
поликонденсации
(циклизация, деструкционные процессы)
3. Наличие низкомолекулярных продуктов реакции ( олигомеров)
131.
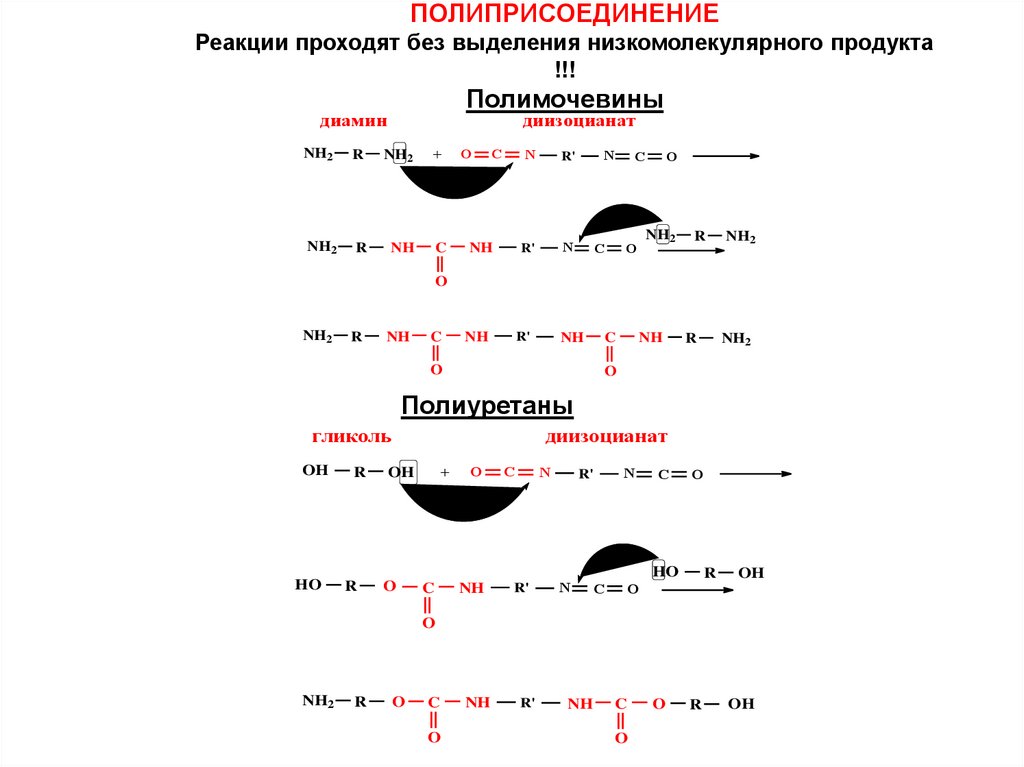
ПОЛИПРИСОЕДИНЕНИЕРеакции проходят без выделения низкомолекулярного продукта
!!!
Полимочевины
диамин
диизоцианат
NH2
R
NH2
+
O
C
N
R'
N
C
NH2
R
NH
C
NH
R'
N
C
O
NH
R'
NH
O
NH2
R
NH2
NH
R
NH2
O
NH2
R
NH
C
C
O
O
Полиуретаны
гликоль
диизоцианат
OH
R
OH
HO
R
O
+
O
C
N
R'
N
C
O
HO
C
NH
R'
N
NH
R'
NH
C
R
O
OH
O
NH2
R
O
C
O
C
O
O
R
OH
132.
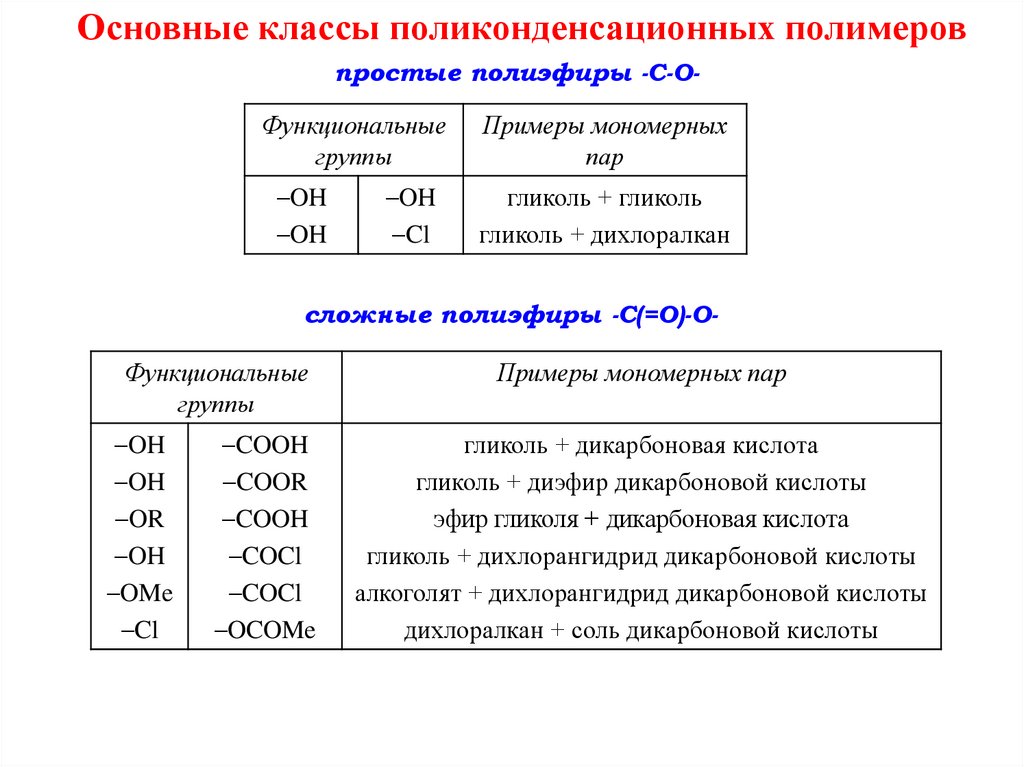
Основные классы поликонденсационных полимеровпростые полиэфиры -C-O-
Функциональные
группы
Примеры мономерных
пар
OH
OH
гликоль + гликоль
гликоль + дихлоралкан
OH
Cl
сложные полиэфиры -C(=O)-O-
Функциональные
группы
OH
OH
OR
OH
OMe
Cl
COOH
COOR
COOH
COCl
COCl
OCOMe
Примеры мономерных пар
гликоль + дикарбоновая кислота
гликоль + диэфир дикарбоновой кислоты
эфир гликоля + дикарбоновая кислота
гликоль + дихлорангидрид дикарбоновой кислоты
алкоголят + дихлорангидрид дикарбоновой кислоты
дихлоралкан + соль дикарбоновой кислоты
133.
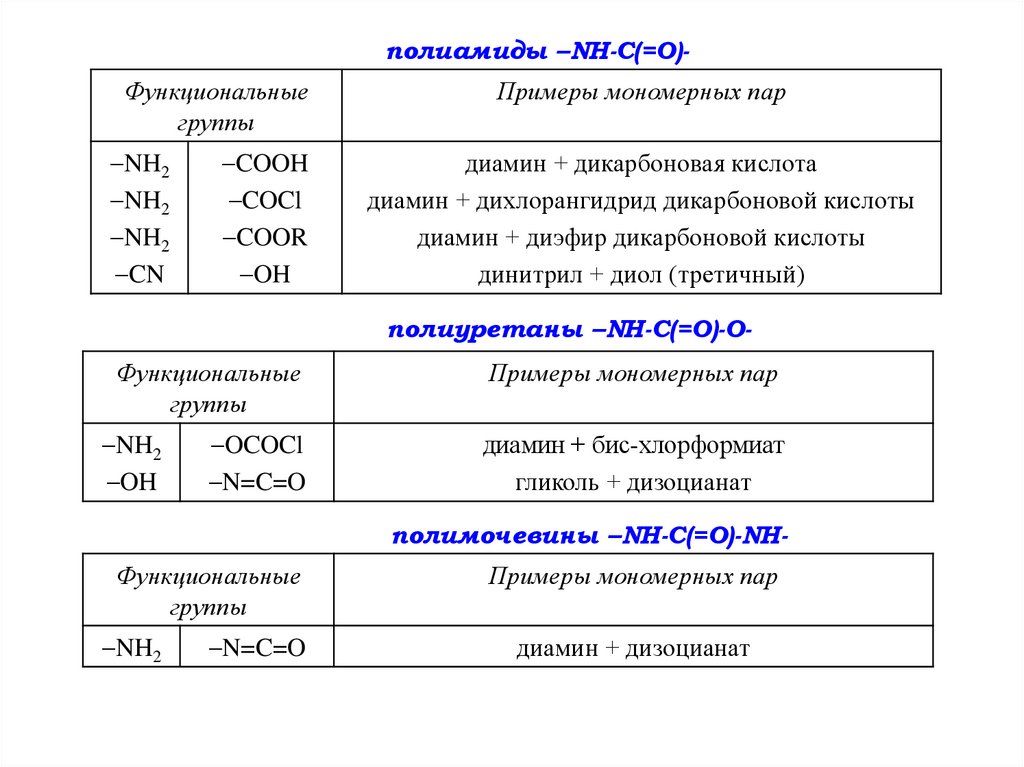
полиамиды –NH-C(=O)Функциональныегруппы
NH2
NH2
NH2
CN
COOH
COCl
COOR
OH
Примеры мономерных пар
диамин + дикарбоновая кислота
диамин + дихлорангидрид дикарбоновой кислоты
диамин + диэфир дикарбоновой кислоты
динитрил + диол (третичный)
полиуретаны –NH-C(=O)-O-
Функциональные
группы
Примеры мономерных пар
NH2
OH
диамин + бис-хлорформиат
гликоль + дизоцианат
OCOCl
N=C=O
полимочевины –NH-C(=O)-NHФункциональные
группы
NH2
N=C=O
Примеры мономерных пар
диамин + дизоцианат
134.
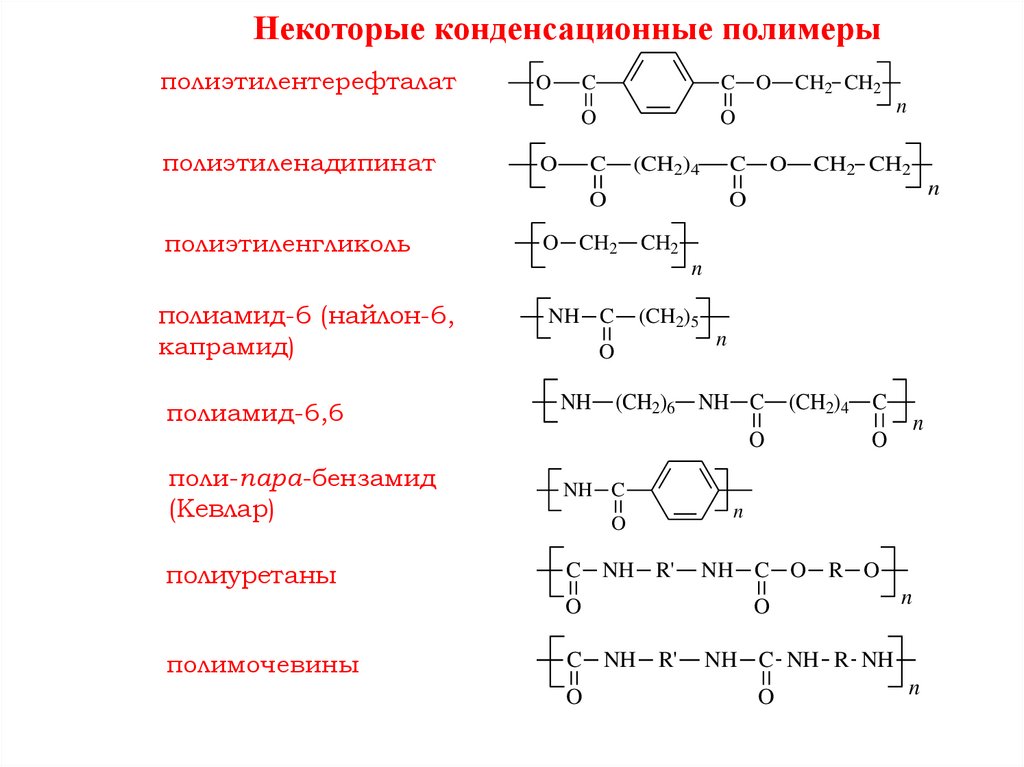
Некоторые конденсационные полимерыполиэтилентерефталат
полиэтиленадипинат
O
C
C O
O
O
O
C
(CH2)4
полиэтиленгликоль
n
C
O
CH2 CH2
O
CH2 CH2
n
O
O CH2
CH2
n
полиамид-6 (найлон-6,
капрамид)
NH C
полиамид-6,6
NH
(CH2)5
n
O
(CH2)6
NH C
(CH2)4
O
поли-пара-бензамид
(Кевлар)
NH C
полиуретаны
C NH R'
O
O
полимочевины
C NH R'
O
C
n
O
n
NH C O
R O
O
n
NH C NH R NH
O
n
135.
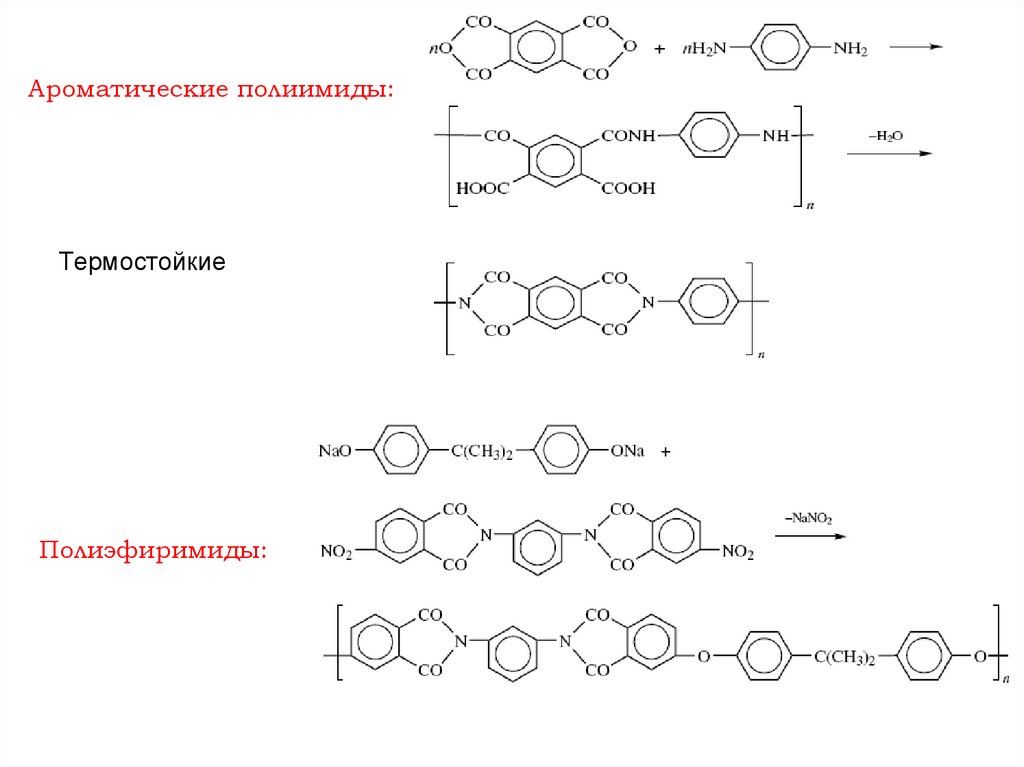
Ароматические полиимиды:Термостойкие
Полиэфиримиды:
136.
1. Полимеризации в блоке подвергаются жидкиемономеры в присутствии растворенных в них инициаторов.
Такую
полимеризацию
можно
осуществлять
по
периодическому и непрерывному способу. В первом случае
полимер
образуется
в
формах,
помещаемых
в
обогреваемые камеры. В зависимости от используемой
формы готовое изделие может иметь вид пластины, трубы
и т.д. Непрерывная полимеризация проводится в
полимеризационных башнях. Мономер, проходя через
башню, попадает в зоны с различной температурой,
повышающейся в направлении продвижения полимера. В
последнюю зону поступает готовый полимер, где он
расплавляется и выдавливается в виде жгутов, которые
нарезаются на гранулы (так получают, например,
прозрачное
органическое
стекло
из
стирола
и
метилметакрилата).
137.
2. Полимеризация в растворителях осуществляется всреде, растворяющей либо мономер и полимер, либо
только мономер. В первом случае продукт реакции –
раствор полимера в растворителе. Затем отделяют
полимер отгонкой растворителя либо осаждением
полимера, добавляя осадитель (например, воду). В
растворе
проводят
главным
образом
ионную
полимеризацию.
3. Полимеризация в эмульсиях протекает с большими
скоростями
и
позволяет
получать
полимеры
с
высокомолекулярной массой в виде порошка или водных
эмульсий. Продуктом такой полимеризации является
водная дисперсия полимера – латекс. Выделяют полимер
из латекса добавлением электролита для разрушения
поверхностной пленки эмульгатора.
138.
4. Суспензионную полимеризацию проводят в жидкости,не растворяющей мономер, обычно в воде. Размер капель
мономера в водной фазе в сотни раз больше (от 1 мкм до 1
мм), чем при эмульсионной полимеризации. Также
добавляются эмульгаторы, образующие с каплями
мономера дисперсию. Получаемые частицы имеют форму
бисера или гранул. Полимер легко отделяется от водной
фазы в центрифуге без специальной коагуляции.
Стабилизаторы суспензии легко отмываются с поверхности
гранул, полимер содержит мало примесей. Недостаток
метода – загрязнение сточных вод.




































































 Химия
Химия








