Похожие презентации:
Общая характеристика ферментов как биологических катализаторов
1.
Общая характеристикаферментов
как биологических
катализаторов
2. Ферменты (энзимы) – вещества белковой природы, способные каталитически ускорять протекание химических реакций
ФЕРМЕНТЫ(ЭНЗИМЫ)
ПРИРОДЫ,
БЕЛКОВОЙ
КАТАЛИТИЧЕСКИ
УСКОРЯТЬ
–
ВЕЩЕСТВА
СПОСОБНЫЕ
ПРОТЕКАНИЕ
ХИМИЧЕСКИХ РЕАКЦИЙ
1.
2.
3.
4.
5.
Значение для изучения:
Ферменты - биологические регуляторы
химических процессов в клетке (основа
жизнедеятельности);
Нарушения в их структуре и функции –
возникновение энзимопатий.
Энзимодиагностика.
Энзимотерапия.
Использование к качестве реактивов для
определения метаболитов.
3.
Сходство ферментов с небиологическимикатализаторами заключается в том, что:
1. Небиологические катализаторы и энзимы ускоряют
энергетически возможные реакции;
2. Ведут реакции в обход энергетического барьера;
4.
Сходство ферментов с небиологическимикатализаторами заключается в том, что:
Свободная энергия
Еа
Е’а
Начальные
субстраты
Конечные
продукты
Еа – энергия активации некатализируемой реакции
Е’а – энергия активации катализируемой ферментами реакции
Время
5.
Сходство ферментов с небиологическимикатализаторами заключается в том, что:
3. В ходе катализа направление реакции не
изменяется;
4. Не расходуются во время реакции;
5. Требуется небольшое их количество.
6.
Отличие ферментов от небиологическихкатализаторов заключается в том, что:
1. Скорость ферментативных реакций выше, чем
реакций,
катализируемых
небелковыми
катализаторами;
2. Ферменты обладают высокой специфичностью;
3. Энзимы
действуют
при
определенных
оптимальных
условиях
(температура,
рН,
микроэлементы, кооперативность);
4. Скорость
ферментативной
реакции
может
регулироваться.
7.
Основные свойства ферментовкак биологических
катализаторов
А. Субстратная специфичность
Б. Каталитическая специфичность
В. Лабильность ферментов
Г. Способность ферментов к регуляции
8.
Структура ферментовФермент (энзим)
Простой белок
Сложный белок
(РНК-аза,
пищевые ферменты)
(холофермент)
Белковая часть
(апофермент)
Небелковая часть
Простетическая
группа
Кофермент
9.
Небелковая часть1. Производные витаминов
2. Гемы, входящие в состав цитохромов, каталазы,
пероксидазы, гуанилатциклазы, NO-синтазы и
являющиеся простетической группой ферментов
3. Нуклеотиды – доноры и акцепторы остатка
фосфорной кислоты
4. Убихинон, или кофермент Q, участвующий в
переносе электронов и протонов
5. Фосфоаденозилметионин,
участвующий
в
переносе сульфата
6. S-аденозилметионин – донор метильной группы
7. Глутатион, участвующий в окислительновосстановительных реакциях
10.
Функции небелковой части фермента1. Перенос атомов водорода, электронов
(окислительно-восстановительные реакции – НАД,
ФАД и др.).
2. Перенос химических групп (фосфопиридоксаль,
биотин и др.)
3. Реакции синтеза, изомеризации, расщепление связей
(ТДФ и др.)
11.
Активные центры ферментовСубстратный
Каталитический
Аллостерический
Закономерности в построении активных центров
1. В построении активных центров принимают
участие
небольшое
количество
радикалов
аминокислот, обычно находящихся на значительном
расстоянии друг от друга в полипептидной цепи.
2. Чаще всего в состав центра входят радикалы гис,
сер, лиз, асп, цис.
3. В построении центров сложных ферментов
участвуют химические группировки небелковой
части.
12.
Активные центры ферментовСубстратный
Каталитический
Аллостерический
Закономерности в построении активных центров
4. Если фермент является олиго- или мультимером, то
обычно на каждом протомере есть субстратный и
каталитический участки.
5. Энергия взаимодействия субстрата с активным
центром слабая с образование нековалентных связей
6. Активные центры формируются при образовании
третичной и четвертичной структуры белковой части в
процессе взаимодействия с субстратом (индуцированное
соответствие).
13.
Схема строения активного центра фермента14.
Формирование активных центровхимотрипсина
А-цепь(13)
S–S
В-цепь(140)
S–S
С-цепь(96)
S–S
S–S
195-сер
16-илей
57-гис
102-асп
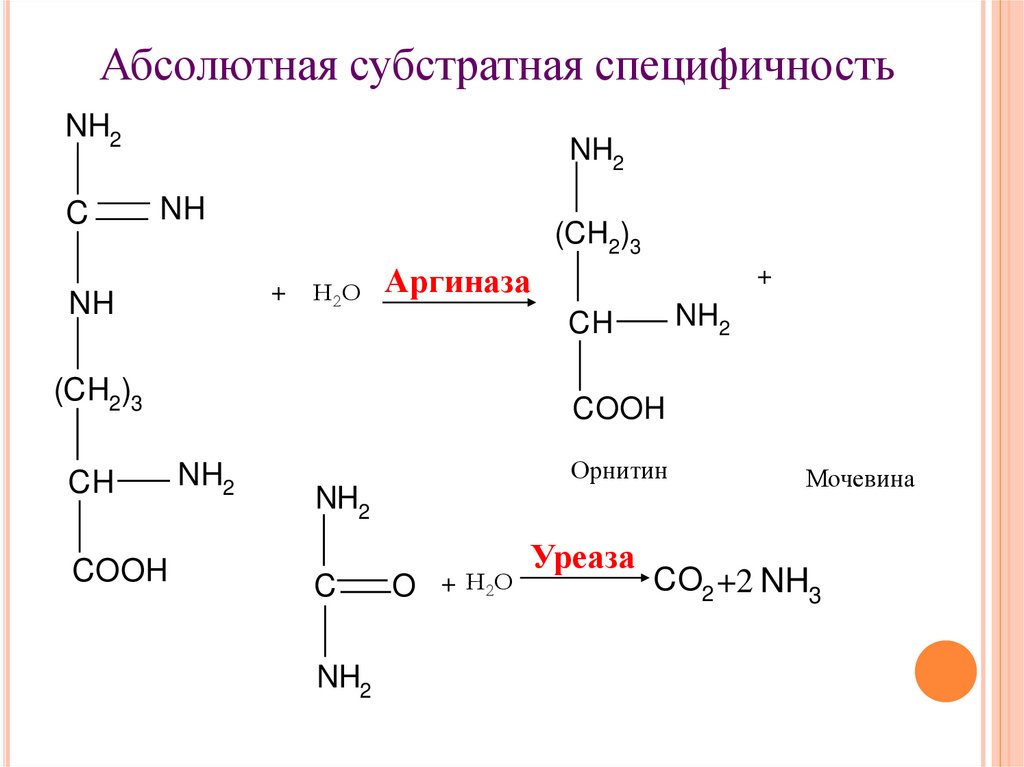
15.
Абсолютная субстратная специфичностьNH2
C
NH2
NH
(CH2)3
+
NH
Н2О
Аргиназа
COOH
NH2
CH
(CH2)3
CH
+
COOH
NH2
Орнитин
NH2
C
NH2
O + Н2О
Уреаза
Мочевина
CO2 +2 NH3
16.
Групповая субстратная специфичностьCH2
O
C
CH
O
C
CH2
O
C
O
CH2
R1
Панкреатическая
O
липаза
R2 +2 Н2О
CH
O
COOH
COOH R2
R3 R1
Триацилглицерол
OH
O
C
O
R2
CH2 OH
2-Моноацилглицерол
17. Групповая субстратная специфичность
ГРУППОВАЯ СУБСТРАТНАЯ СПЕЦИФИЧНОСТЬ(фен, тир, три, глу, асп)
Пепсин
- NH2
Трипсин
- СООH (лиз, арг)
Химотрипсин
- СООH (тир, фен, три)
18. Групповая субстратная специфичность
ГРУППОВАЯ СУБСТРАТНАЯ СПЕЦИФИЧНОСТЬОH
Тир
СH2
H
NH
С
СО
NH
С
H
СО
NH
Н
R1
Пепсин
С
R3
Химотрипсин
СО
19.
СтереоспецифичностьСтереоспецифичность к D-сахарам
CH2OH
H
OH
O H
+ АТФ
H
OH
H
OH
H
OH
D-глюкоза
Гексокиназа
H2C O PO3H
H
O H
H
+ АДФ
OH H
OH
OH
H
OH
D-глюкозо-6-фосфат
Стереоспецифичность к L-аминокислотам
20.
Активный центр ферментаУчасток связывания
Обеспечивает
субстратную специфичность
(выбор субстрата)
Каталитический участок
Обеспечивает
каталитическую
специфичность выбора
пути превращения
данного субстрата
-Абсолютная субстратная
специфичность
-Групповая субстратная
специфичность
-Стереоспецифичность
Специфичность пути
превращения субстрата
21. Каталитическая специфичность
КАТАЛИТИЧЕСКАЯ СПЕЦИФИЧНОСТЬКаталитические пути превращения глюкозо-6-фосфата
22.
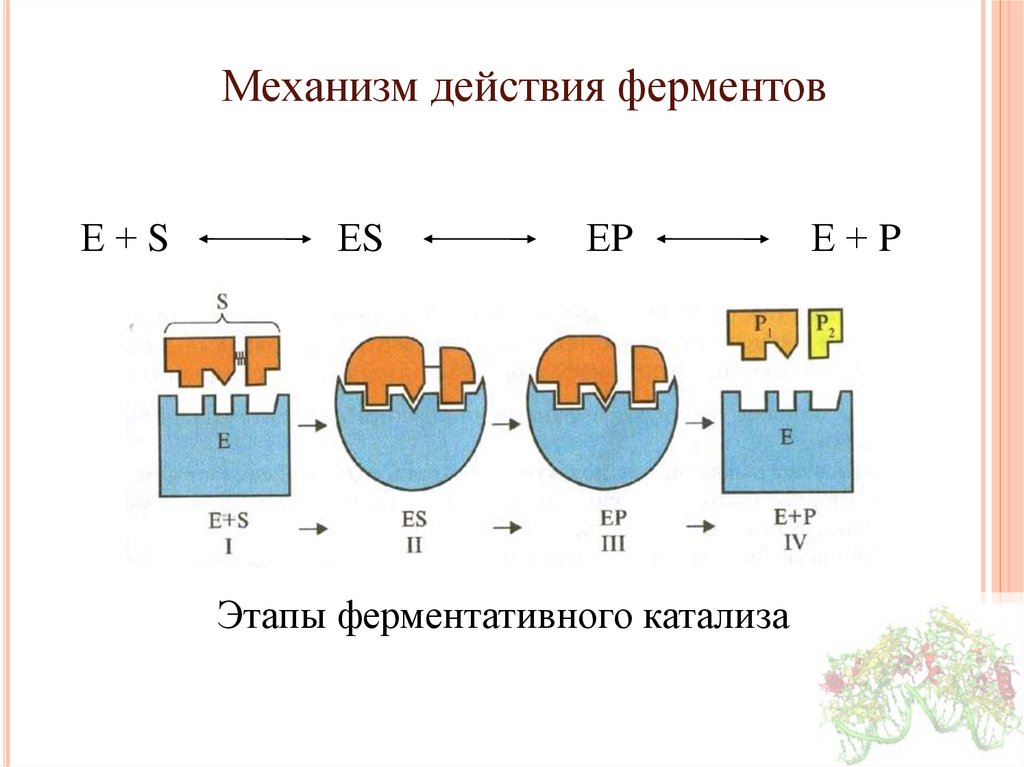
Механизм действия ферментовЕ+S
ЕS
ЕP
Этапы ферментативного катализа
Е+P
23.
Механизм действия ферментовИзменение свободной энергии в ходе химической реакции,
некатализируемой и катализируемой ферментами
24.
2 H2O2Еа
2 H2O
+
O2
18000 кал/моль
платина (11 700 кал/моль)
каталаза ( менее 2000 кал/моль)
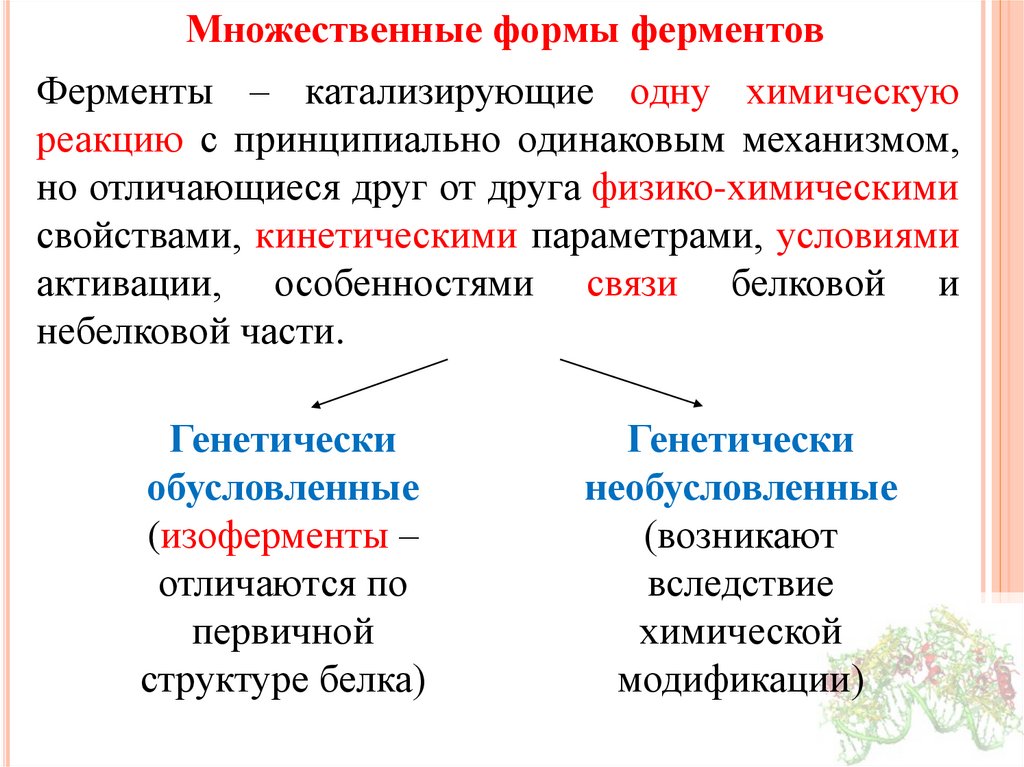
25.
Множественные формы ферментовФерменты – катализирующие одну химическую
реакцию с принципиально одинаковым механизмом,
но отличающиеся друг от друга физико-химическими
свойствами, кинетическими параметрами, условиями
активации, особенностями связи белковой и
небелковой части.
Генетически
обусловленные
(изоферменты –
отличаются по
первичной
структуре белка)
Генетически
необусловленные
(возникают
вследствие
химической
модификации)
26.
Реакция, катализируемаялактатдегидрогеназой (ЛДГ)
























 Биология
Биология








