Похожие презентации:
Ізогіпсичні перетворення функціональних груп. Реакції заміщення та елімінування
1. ІЗОГІПСИЧНІ ПЕРЕТВОРЕННЯ ФУНКЦІОНАЛЬНИХ ГРУП РЕАКЦІЇ ЗАМІЩЕННЯ ТА ЕЛІМІНУВАННЯ
Сучасні методиорганічного синтезу
2. Функціональні групи
Рівень 1Рівень 2 Рівень 3
X: Рівень 0
F, Cl, Br, I
Рівень R0 CH
Рівень
Рівень 2 Рівень 3
CH1
2
OH, OR
R CH CH
X
X
X
X
NR2, NO2, N3, NCO
R
CH
CH
R
CH
CH
X
CH2 X
R CH CH
2
SR, SOR, SO2R,RSOCH
3H
Y
R CH C X
Y
R CH CH
PR2, PO(OR)2
X Y
RR C CH
C 2 HC
R
CH
CH
R
C
C
H
3
CN, CYX2
2
2
2
2
2
3
R CH CH2
Y:
O
NR
S
2
R CH CH X
R CH CH2
R CH2 C H
Y
R C CH3
Y
R CH CH XY
R CH2 C
R C
Y
H
Y
CH3
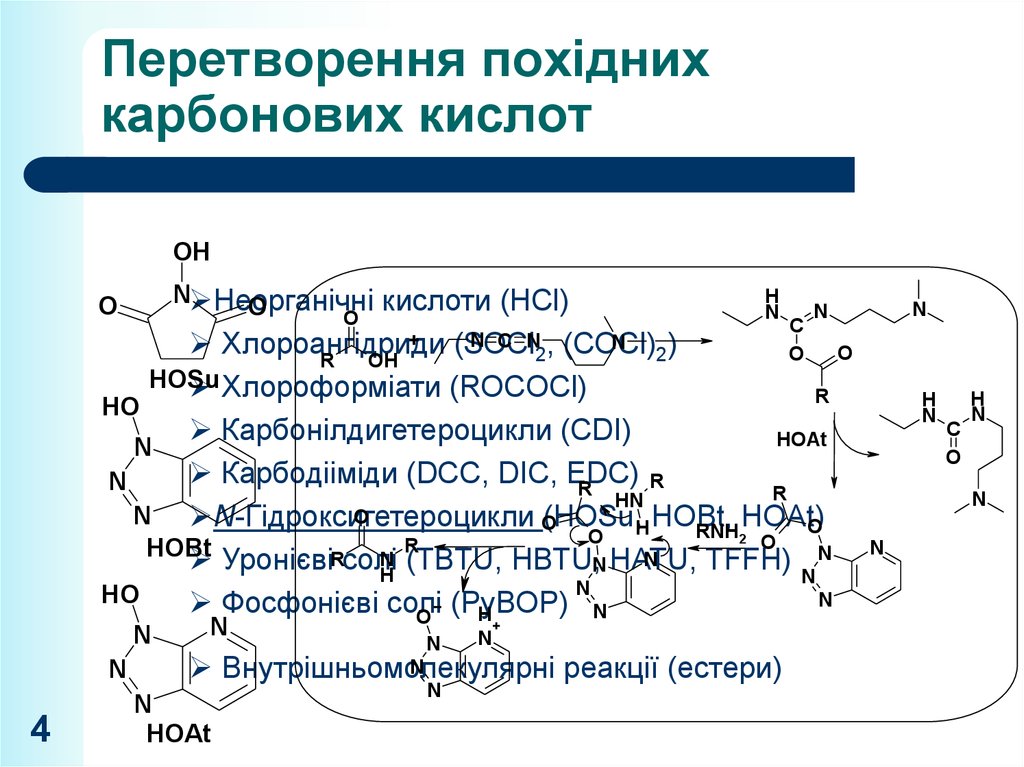
3. Перетворення похідних карбонових кислот
Активація карбонових кислотНеорганічні кислоти (HCl)
C N , (COCl) )
ХлороангідридиN(SOCl
2
2
Хлороформіати (ROCOCl)
DCC
Карбонілдигетероцикли (CDI)
N EDC)
N CDIC,
Карбодііміди (DCC,
DIC (HOSu, HOBt, HOAt)
N-Гідроксигетероцикли
Уронієві солі (TBTU, HBTU, HATU, TFFH)
Фосфонієві солі
N
N
N C(PyBOP)
Внутрішньомолекулярні
реакції (естери)
EDC (EDCI, EDAC)
3
4. Перетворення похідних карбонових кислот
OHN Неорганічні
кислоти (HCl)
O
O
O
H
N
C
O
+
N C N , (COCl)
N
Хлороангідриди
(SOCl
O
2
2)
R
OH
HOSu
Хлороформіати (ROCOCl)
R
HO
Карбонілдигетероцикли (CDI)
HOAt
N
Карбодііміди (DCC, DIC, EDC)
R
N
R
R
HN
O
N N-Гідроксигетероцикли
(HOSu,H HOBt,
HOAt)
O
O
RNH2
O
O
R
HOBt
N
N (TBTU, HBTU,N HATU,
N
УронієвіRсолі
TFFH)
H
N
N
HO
N
Фосфонієві солі
(PyBOP)
N
H
O
N
N
4
N
+
N
N
N
Внутрішньомолекулярні
реакції (естери)
N
HOAt
N
N
N
H
N
C
O
H
N
N
N
5. Перетворення похідних карбонових кислот
O+
N
BF4-
+
N
N
PF6PF6-(HCl)
кислоти
N
+
O
N
N
O
+
N
Хлороангідриди
(SOCl
,
(COCl)
)
PF
COOEt
2
2
6
N
N
N
N
O
N (ROCOCl)N
N Хлороформіати
N
N
CN
N
TBTU
Карбонілдигетероцикли (CDI) N
COMU
HBTU
N
Карбодііміди (DCC, DIC, EDC)
HATU
+
N-Гідроксигетероцикли (HOSu, HOBt, HOAt)
N
PF6 Уронієві солі (TBTU, HBTU, HATU, TFFH)
F
N
TBTU: Tetrafluoroborate BenzotriazolylTetramethylUronium
Фосфонієві солі (PyBOP)
O
Неорганічні
5
HBTU: Hexafluorophosphate BenzotriazolylTetramethylUronium
HATU: Hexafluorophosphate AzabenzotriazolylTetramethylUronium TFFH
Внутрішньомолекулярні реакції (естери)
HTTF: TetramethylFluoroFormamidinium Hexafluorophosphate
COMU: (1-Cyano-2-ethoxy-2-Oxoethylidenaminooxy)dimethylaminoMorpholinocarbeniUm hexafluorophosphate
6. Перетворення похідних карбонових кислот
Неорганічні кислоти (HCl)N
N
N
Хлороангідриди
(SOCl
,
(COCl)
)
+
N
2
2
+
P
PF6P
PF6 Хлороформіати
(ROCOCl)
O
N
O
N
Карбонілдигетероцикли
(CDI)
N
N
N
Карбодііміди
(DCC, DIC, EDC) N
N
N HOAt)
N-Гідроксигетероцикли (HOSu, HOBt,
BOP
PyBOP
Уронієві
солі (TBTU, HBTU, HATU,
TFFH)
Фосфонієві солі (PyBOP)
Внутрішньомолекулярні реакції (естери)
6
Han, S.-Y., Kim, Y.-A. “Recent development of peptide coupling reagents in organic synthesis”
Tetrahedron 2004, 60(11), 2447–2467
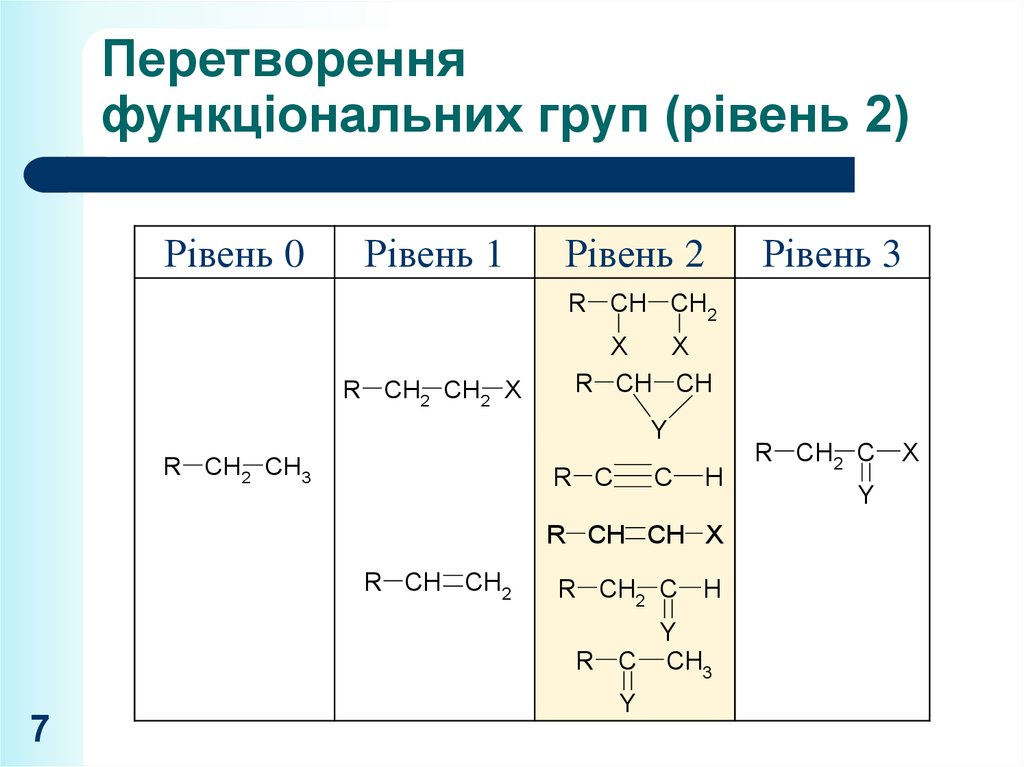
7. Перетворення функціональних груп (рівень 2)
Рівень 0Рівень 1
Рівень 2
Рівень 3
R CH CH2
R CH2 CH2 X
X
X
R CH CH
Y
R CH2 CH3
R C
C
H
R CH CH X
R CH CH2
R CH2 C H
Y
R C CH3
7
Y
R CH2 C
Y
X
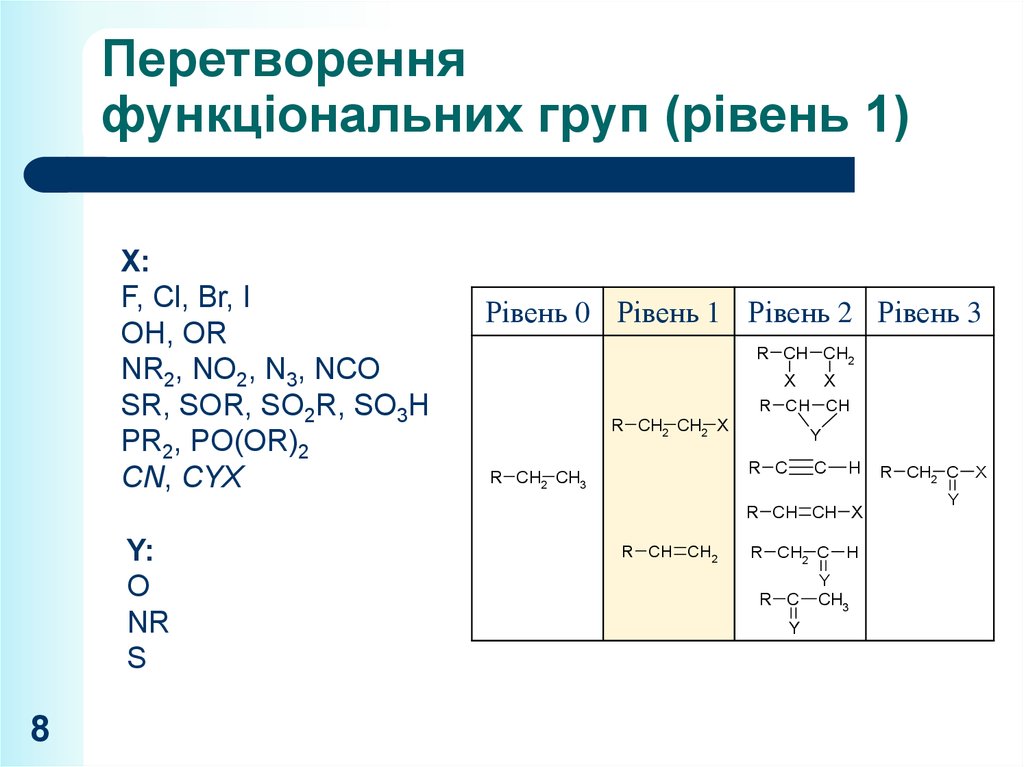
8. Перетворення функціональних груп (рівень 1)
X:F, Cl, Br, I
OH, OR
NR2, NO2, N3, NCO
SR, SOR, SO2R, SO3H
PR2, PO(OR)2
CN, CYX
Рівень 0 Рівень 1 Рівень 2 Рівень 3
R CH CH2
X
X
R CH CH
R CH2 CH2 X
Y
R C
R CH2 CH3
C
H
R CH CH X
Y:
O
NR
S
8
R CH CH2
R CH2 C
R C
Y
H
Y
CH3
R CH2 C
Y
X
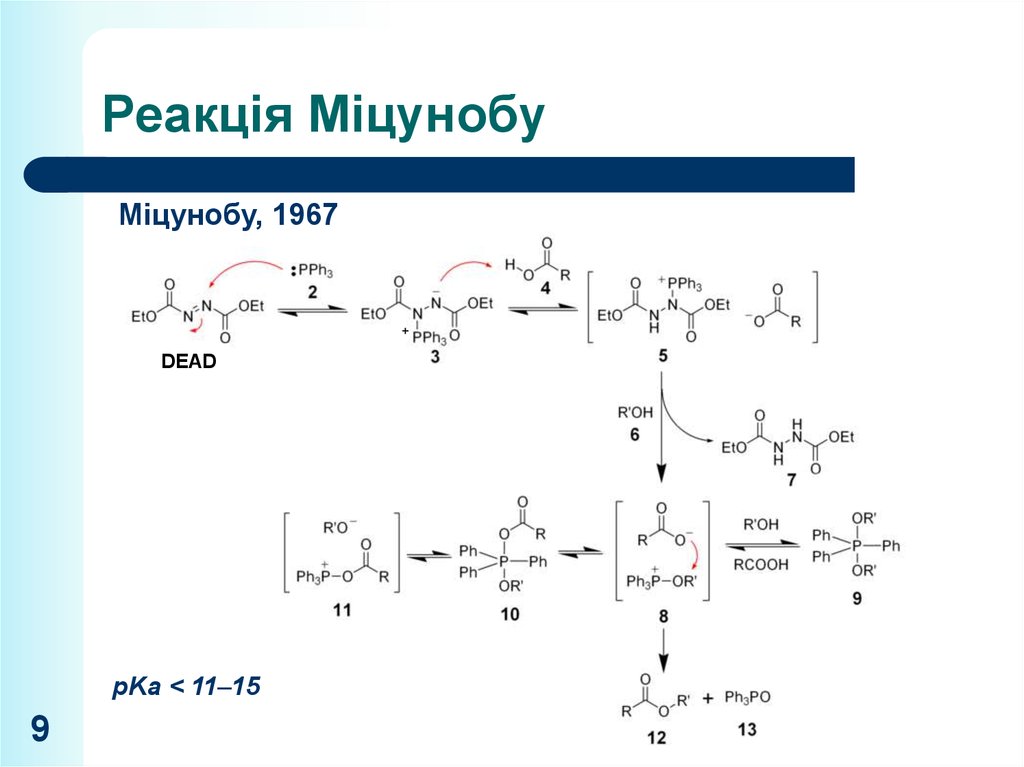
9. Реакція Міцунобу
Міцунобу, 1967+
DEAD
pKa < 11–15
9
10. Реакція Міцунобу
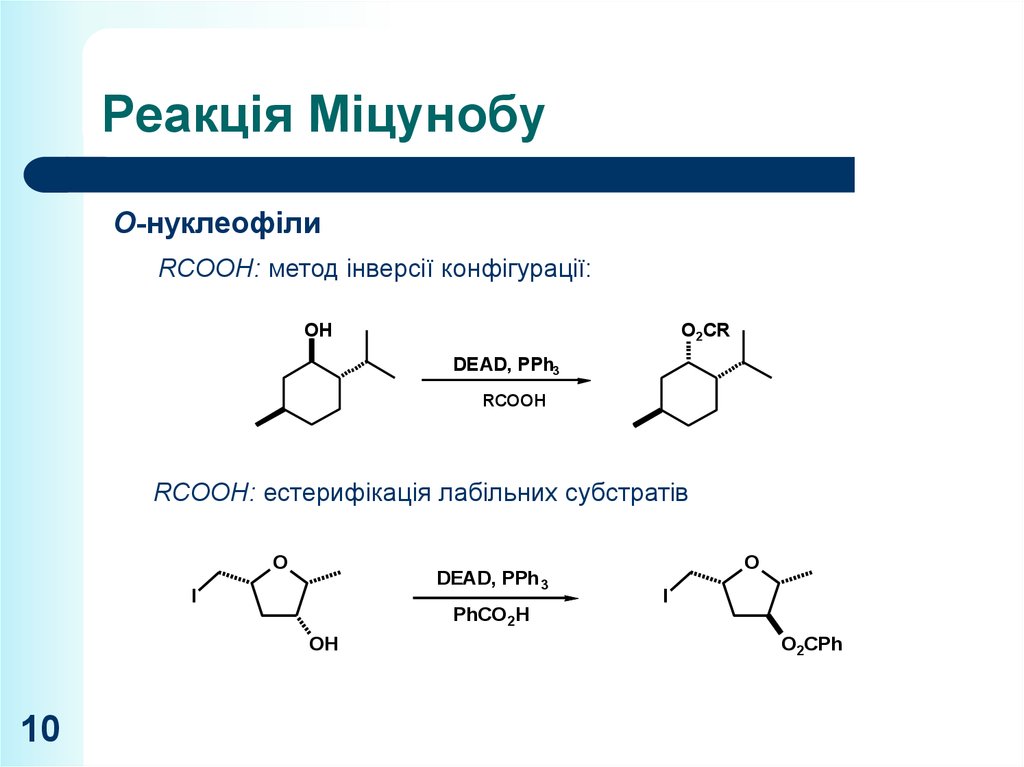
O-нуклеофілиRCOOH: метод інверсії конфігурації:
OH
O2CR
DEAD, PPh3
PhH
RCOOH
O
O
RCOOH: естерифікація лабільних
субстратів
OH
R'
O
OH
DEAD, PPhR'
3
I
O
R'H2C
OH
O
I
PhCO 2H
OH
10
O2CPh
11. Реакція Міцунобу
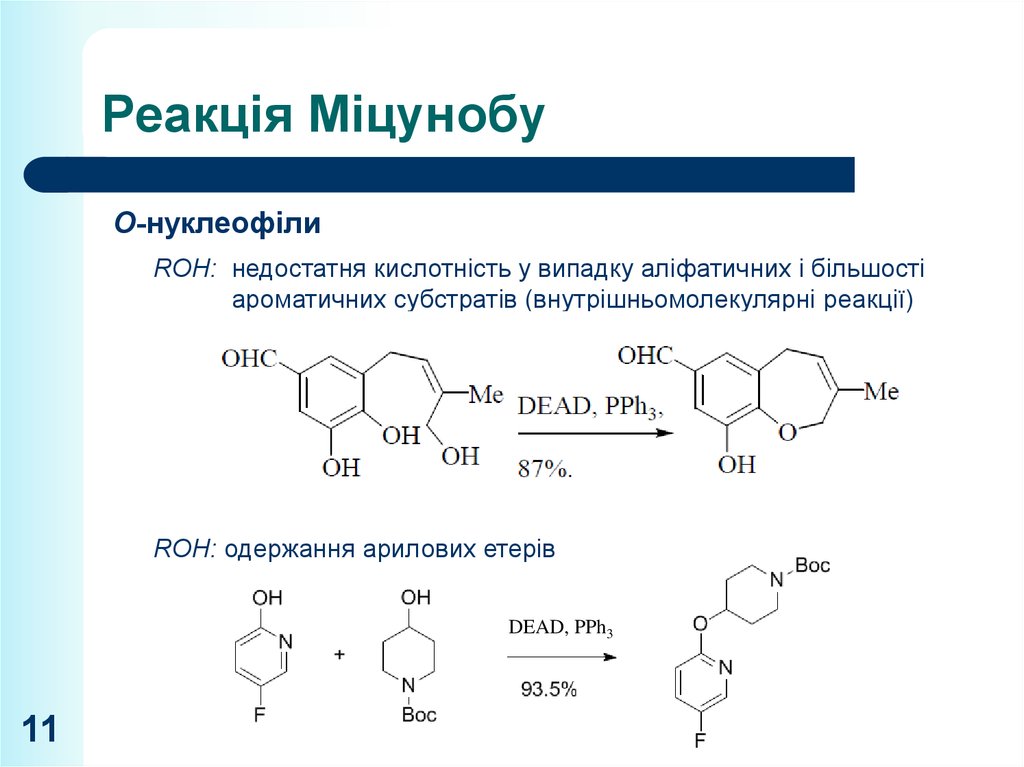
O-нуклеофілиROH: недостатня кислотність у випадку аліфатичних і більшості
ароматичних субстратів (внутрішньомолекулярні реакції)
ROH: одержання арилових етерів
DEAD, PPh3
11
12. Реакція Міцунобу
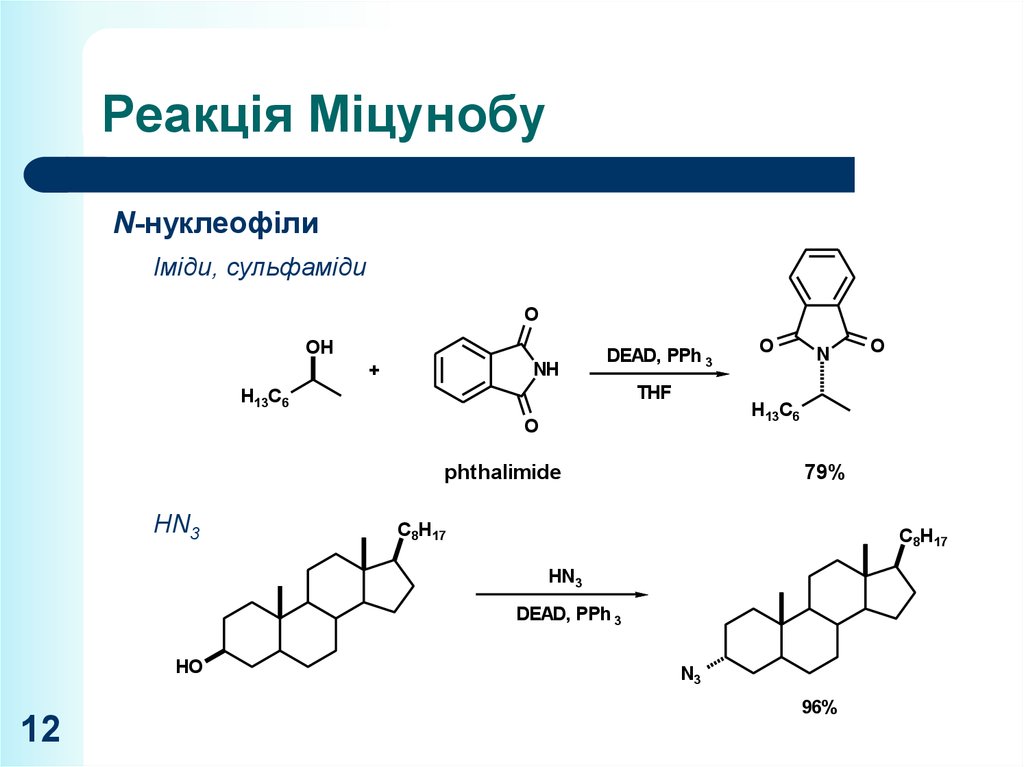
N-нуклеофілиO
Іміди, сульфаміди
O
OH
NH
+
H13C6
OH
+
H13C6
O
phthalimide
N
DEAD, PPh 3
O
THF
H13PPh
C6 3
DEAD,
NH
THF
EtOH
O
N
O
79%
C8H17
C8H
DEAD, PPh 3
12
H
49%
HN
C8H17 3
HN3
DEAD, PPh
N3 3
HO
H13C6
N2H4
EtOH
C8H17
HO
NH2
N2H4
79% H13C6
O
phthalimide
HN3
O
96%
N3
13. Реакція Міцунобу
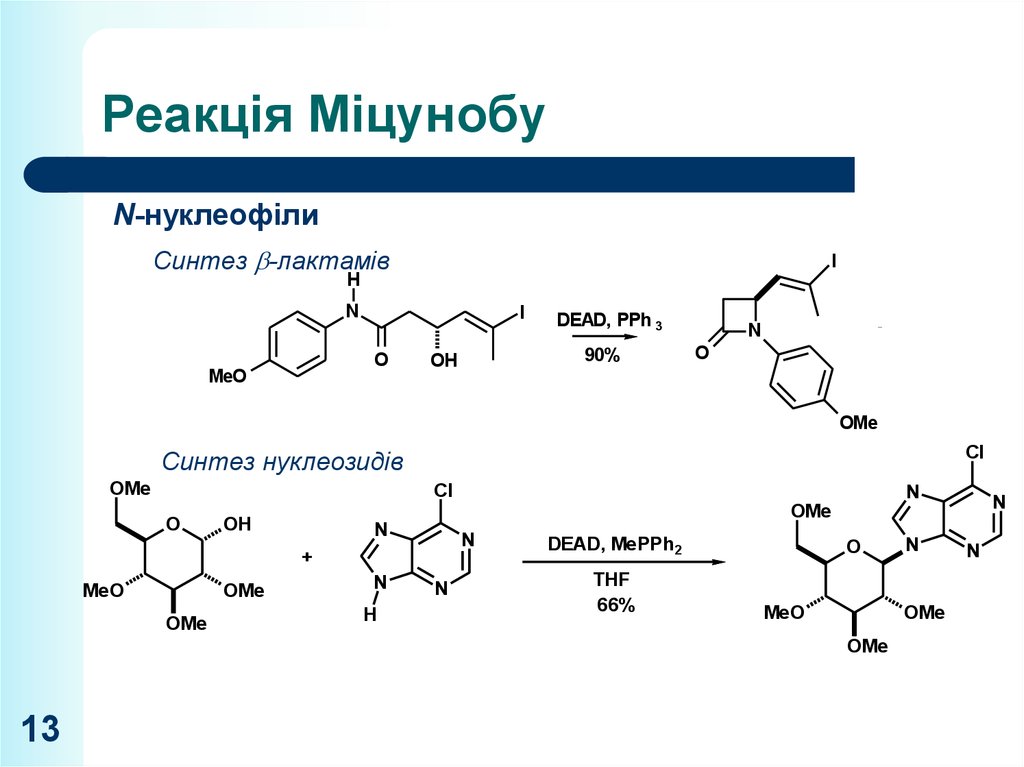
N-нуклеофілиСинтез -лактамів
I
H
N
MeO
I
O
CAN
DEAD, PPh 3
90%
OH
Cl
N
O
Cl
N
N
OMe
N
+
N
DEAD,
MePPh 2
Синтез
нуклеозидів
N OMeN
O
H
MeO
N
OH
N
2. LDA, MeI
+
70% 3Nsteps N
H
MeO
N
Cl
I N
OMe
O
O
MeO
O
OMe
HO
13
COMe
N
N
OMe
N
DEAD,
MePPh
O OMeSiMe 2Bu t 2
THF
66%
O
OMe
1.THF
t-BuMe 2SiCl, Et
Cl3N
OMe
OMe
O
MeCN, H 2O
N
HN
O
N
OMe
O
66%
Lankicidin C
OH
14. Реакція Міцунобу
Галогенідні нуклеофіли – реакція АпеляBr
OH
PPh3, CBr4
O
N
Cbz
14
O
90%
O
N
Cbz
O
15. Реакція Міцунобу
S-нуклеофіли; С-нуклеофіли15
Swamy, K. C. K., Kumar, N. N. B.; Balaraman, E. Kumar, K. V. P. P. “Mitsunobu and Related
Reactions: Advances and Applications” Chem. Rev. 2009, 109(6), 2551–2651
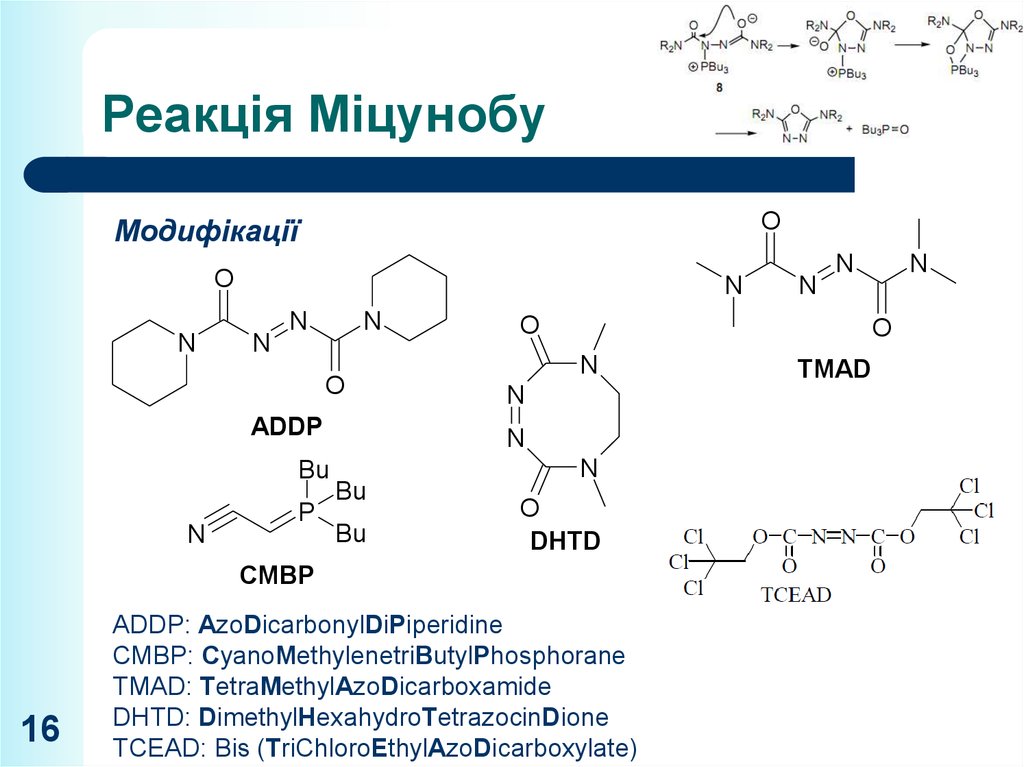
16. Реакція Міцунобу
OМодифікації
O
N
N
N
N
N
O
ADDP
Bu
N
P
O
O
N
N
N
Bu
Bu
N
O
DHTD
CMBP
16
N
N
N
ADDP: AzoDicarbonylDiPiperidine
CMBP: CyanoMethylenetriButylPhosphorane
TMAD: TetraMethylAzoDicarboxamide
DHTD: DimethylHexahydroTetrazocinDione
TCEAD: Bis (TriChloroEthylAzoDicarboxylate)
TMAD
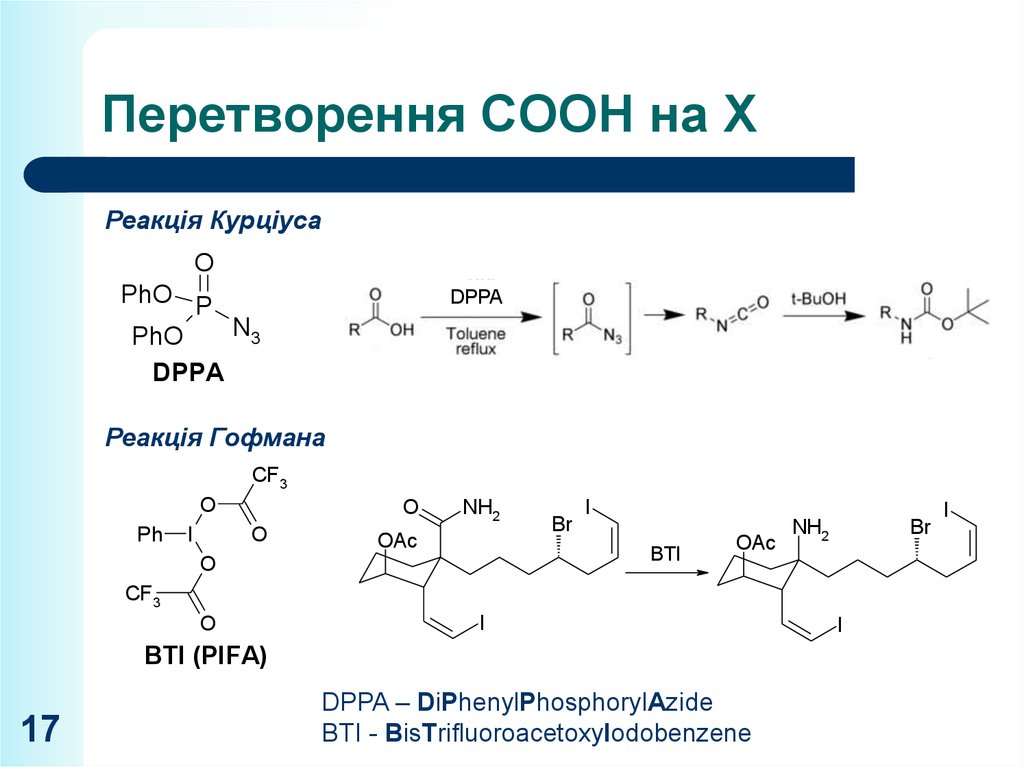
17. Перетворення СООН на Х
Реакція КурціусаO
PhO P
N3
PhO
DPPA
DPPA
Реакція Гофмана
CF3
O
Ph
O
O
I
NH2
OAc
Br
I
BTI
O
OAc
NH2
Br
CF3
O
I
BTI (PIFA)
17
DPPA – DiPhenylPhosphorylAzide
BTI - BisTrifluoroacetoxyIodobenzene
I
I
18. Реакції елімінування
“Класичні” E2-елімінуванняBzO
N
N
DBU
DBU
Елімінується:
HI
RSO2OH
Me3N HX
OMEM
OMEM
O
BzO
heat
O
I
OH
O
O
1. MsCl, TEA
2. DBU
Елімінування селеноксидів
PhSeCl
PhSeBr
N-PSP
PhSeSePh
18
OH
OH
O
O
H
1. LDA, PhSeCl
2. 30% H2O2
OTBS
Reich, H. J.; Wollowitz, S. "Preparation of α, β-Unsaturated Carbonyl Compounds and
Nitriles by Selenoxide Elimination" Org. React. 1993, 44, 1–296
OTBS
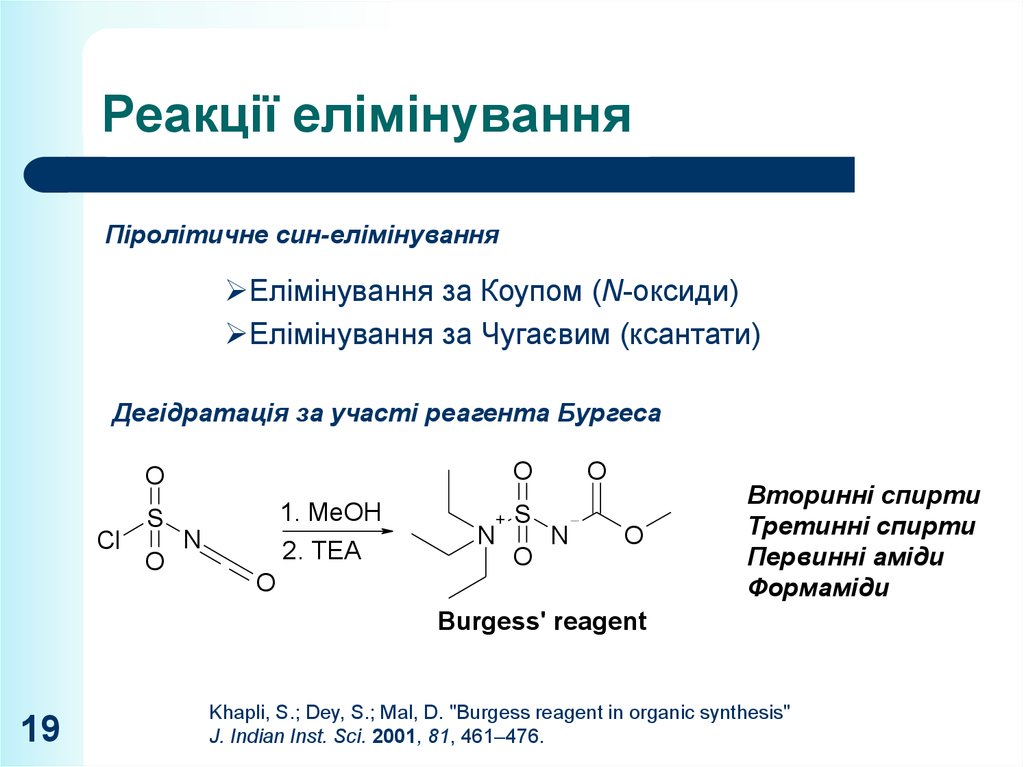
19. Реакції елімінування
Піролітичне син-елімінуванняЕлімінування за Коупом (N-оксиди)
Елімінування за Чугаєвим (ксантати)
Дегідратація за участі реагента Бургеса
Cl
S
O
O
O
O
1. MeOH
2. TEA
N
N
+
S
O
N
O
O
Вторинні спирти
Третинні спирти
Первинні аміди
Формаміди
Burgess' reagent
19
Khapli, S.; Dey, S.; Mal, D. "Burgess reagent in organic synthesis"
J. Indian Inst. Sci. 2001, 81, 461–476.








 Химия
Химия








