Похожие презентации:
Углерод и его соединения
1.
Углерод и его соединения2.
Элемент - неметалл№ 6 в периодической
системе
Возможные
степени
окисления:
-4, 0, +2, +4
C
Основа всех живых
организмов
IV группа
главная
подгруппа
3.
Аллотропные модификации углеродаимеют атомную кристаллическую
решетку.
Их строение
Графит
Алмаз
Фуллерен
4.
Алмаз…это самое твердое вещество
на Земле, тугоплавкое с высоким
показателем преломления
Применяется в:
• Обрабатывающей промышленности
• Электротехнике
• Горной промышленности
• Ювелирном производстве
5.
Графит…это мягкое серо-черное вещество,
тугоплавкое , являющееся
полупроводником со слоистой структурой.
Применяется в:
•Графитовых стержнях-электродах
• Производстве теплозащитного
материала для головных частей ракет
(термостойкость)
• Получении тиглей
• Изготовлении минеральных красок
• Карандашной промышленности
6.
Фуллерен… это новая аллотропная
форма углерода , молекула которого
состоит из 60-70 атомов , образующих
сферу.
Фуллерены планируют
использовать:
1. Для создания фотоприемников
2. Для создания сверхпроводящих материалов
3. В качестве красителей для копировальных машин
4. В качестве основы для аккумуляторных батарей
5. Для создания оптоэлектронных устройств
6. В медицине и фармакологии
7.
Нахождение вприроде
Содержание
углерода в земной
коре 0,1 % по
массе
В самородном
виде:
алмаз и графит
В виде солей:
Мел,
известняк,
мрамор
CaCO3
Магнезит
MgCO3
Сидерит
FeCO3
8.
9.
Углерод в живыхорганизмах
В составе
растений и
животных
(~18 %).
В организме человека достигает около
21 % (15 кг на 70 кг массы тела). Углерод
составляет 2/3 массы мышц и 1/3 массы
костной ткани
Выводится из организма
преимущественно с выдыхаемым
воздухом (углекислый газ) и мочой
(мочевина).
10.
Химические свойства углеродаС простыми
веществами:
1. С неметаллами:
Si + C =SiC
C+O2=CO2
2. С металлами:
4Al + 3C = Al4C3
Сa + C = CaC2
Со сложными веществами:
1. Восстанавливает металлы
из их оксидов
CaO+ 3C=CaC2+CO
2. Реагирует с
концентрированными
кислотами
С+2H2SO4=2SO2+CO2+2H2O
В реакциях углерод проявляет, и
окислительные, и
восстановительные свойства
11.
АдсорбцияАдсорбция – это способность твердых
веществ (адсорбентов) поглощать своей
пористой
поверхностью
газы
и
растворенные вещества.
12.
Химические свойства углеродаC + 2H2 = CH4
(600 ºС )
2C + H2 = C2 H2
(1500-2000 ºС )
C + O2 = CO2
(600-700 ºС )
2C + O2 = 2CO
(выше 1000 ºС )
C + H2 O(пар) = CO + H2
(800-1000 ºС )
C + 2H2 SO4 (конц., гор.) = CO2 + 2SO2 + 2H2 O
C + 4HNO3 (конц., гор.) = CO2 + 4NO2 + 2H2 O
C + 2PbO = 2Pb + CO2
(600 ºС )
13.
Производствочугуна и стали
Применение
углерода
Карандашная
промышленность
В медицине
(уголь
активированный)
Для
изготовления
электродов
В ювелирной
промышленности
14.
Для углерода в сложныхсоединениях характерны
следующие степени
окисления
-4
низшая
+2
промежуточная
+4
высшая
15.
CH4 – газметан
Сгорание:
CH4 + 2O2 = CO2 +2H2O
Степень окисления -4
Реакции с водой и с кислотой:
Al4C3 - карбид
алюминия
AL4C3 + 12H2O=3CH4 + 4AL(OH)3
Al4C3 + 12HCl = 3CH4 + 4AlCl3
16.
Степеньокисления
+2
CO - угарный газ
сильный яд, опасный для жизни
и здоровья человека
(несолеобразующий оксид)
17.
Степеньокисления +4
CO2углекислый
газ
H2CO3угольная
кислота
Соли угольной
кислоты
(например
K2CO3карбонат
калия)
18.
Химические свойстваCO
1.Реагирует с кислородом
2CO + O2 =CO2
2. Является восстановителем
металлов из их оксидов
ZnO + CO = Zn + CO2
19.
Химические свойства оксидауглерода(II)
CO2 + C = 2CO
CO + Cl2 (125-150° C, Pt) = COCl2.
2CO + 2S = CO2 + CS2
4CO (700° C) + Fe3O4 = 3Fe + 4CO2.
20.
Химические свойства CO2(кислотный оксид)
1.Реагирует с водой
CO2 + H2O = H2CO3
2.Реагирует с основными оксидами
CO2 + CaO = CaCO3
3.Реагирует с щелочами
CO2 + 2KOH = K2CO3 + H2O
4.Реагирует с углеродом
CO2 + C = 2CO
21.
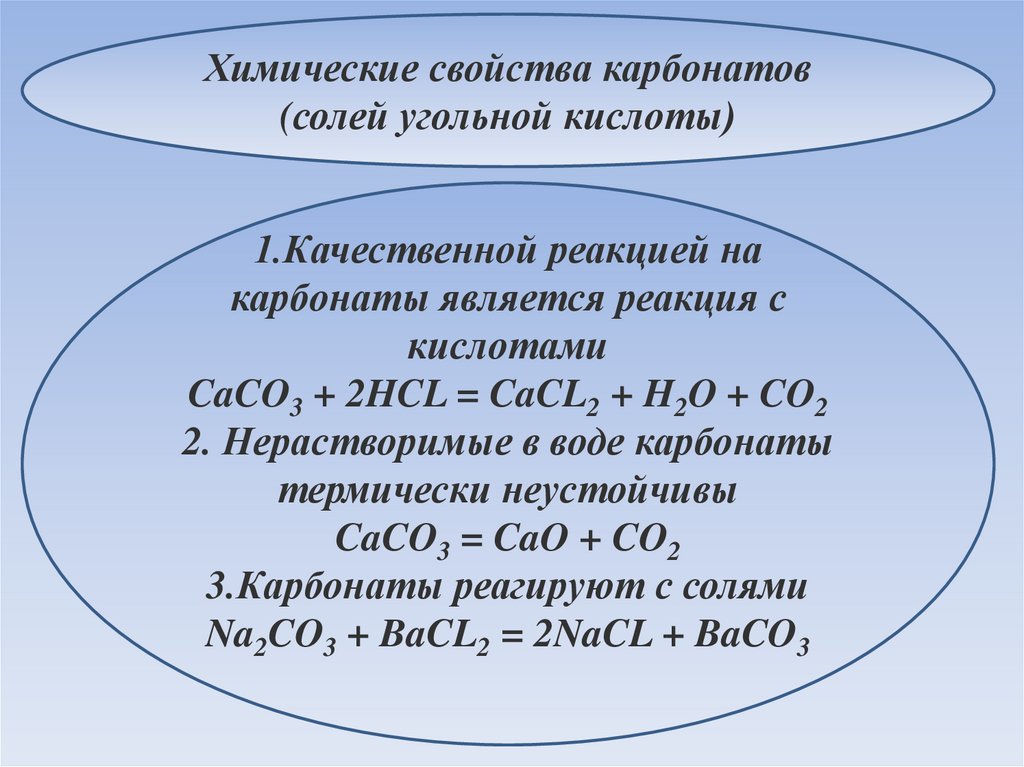
Химические свойства карбонатов(солей угольной кислоты)
1.Качественной реакцией на
карбонаты является реакция с
кислотами
CaCO3 + 2HCL = CaCL2 + H2O + CO2
2. Нерастворимые в воде карбонаты
термически неустойчивы
CaCO3 = CaO + CO2
3.Карбонаты реагируют с солями
Na2CO3 + BaCL2 = 2NaCL + BaCO3
22.
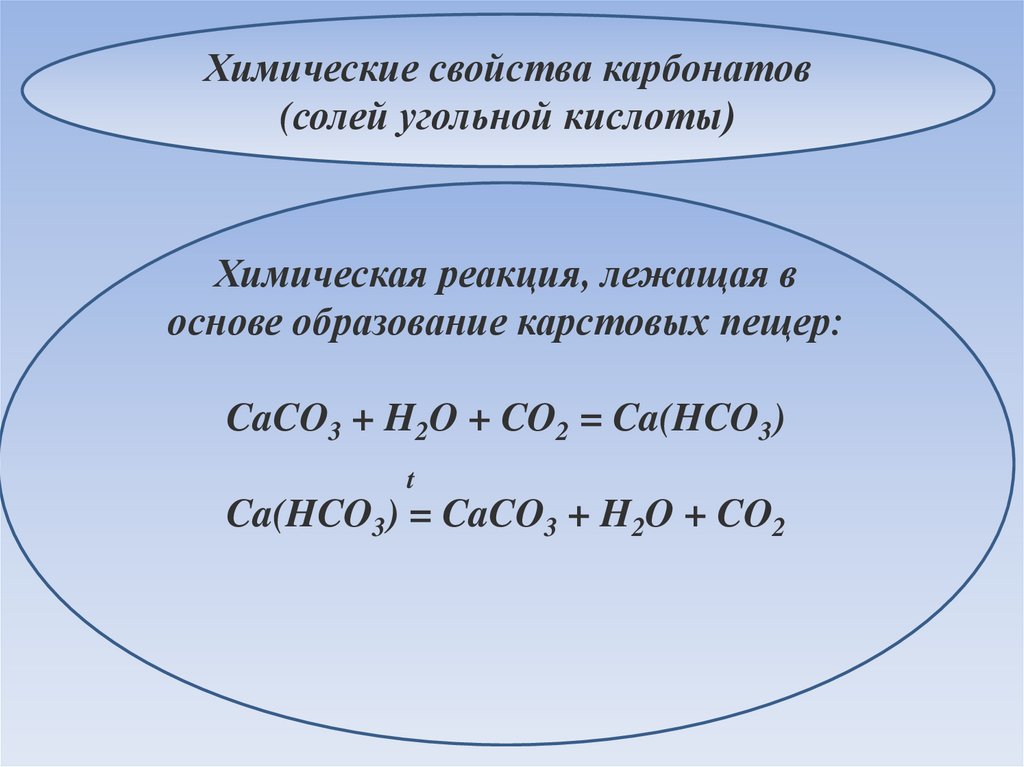
Химические свойства карбонатов(солей угольной кислоты)
Химическая реакция, лежащая в
основе образование карстовых пещер:
CaCO3 + H2O + CO2 = Ca(HCO3)
t
Ca(HCO3) = CaCO3 + H2O + CO2
23.
Углекислотныйогнетушитель
Соединения углерода вокруг нас
Сухой лед (хладагент)
Лимонады
Моющие средства
Сода
24.
Al + С →C + O2 →
CO2 + С →
C+ H2=
C+ H2SO4(конц)=
C+ HNO3 (конц)=
C+ PbO=
*C+ H2O=
25.
Al4С3 + H2O → + CH4↑CH4 + O2 →
СО2 + Са(ОН)2 →
СаСО3 + НCl →
СаСО3 + СО2 + Н2О →
Са(НСО3)2 →
26.
1.Качественная реакция на СО32- =получение СО2 в лаборатории.
Составьте уравнение реакции получения углекислого
газа в лаборатории, она же – качественная реакция на
карбонат-анион.
2.Качественная реакция на СО2
с известковой водой
Как доказать, что выделяющийся газ – СО2? Составьте
уравнение соответствующей реакции.
27.
1.Качественная реакция на СО32- =получение СО2 в лаборатории.
2.Качественная реакция на СО2.
1) СаСО3 + 2НCl → СаСL2 + СО2↑ + Н2О
2) СО2 + Са(ОН)2 → СаСО3 + Н2О
28.
Переход карбоната вгидрокарбонаты и обратно.
Составьте уравнения реакций перехода
карбонатов в гидрокарбонаты и обратно.
29.
Переход карбоната вгидрокарбонаты и обратно.
СаСО3 + СО2 + Н2О → Са(НСО3)2
исчезновение помутнения
t
Са(НСО3)2 → СаСО3↓ + СО2 + Н2О
30.
Генетическая взаимосвязь соединенийуглерода.
• составьте схему переходов
• составьте уравнения реакций переходов
СО, С, СО2, СаСО3, Са(НСО3)2, Аl4С3, СН4
31.
Генетическая взаимосвязь соединенийуглерода.
• С
СО
СО2
СаСО3
Са(НСО3)2
• Аl4С3
• СН4
• составьте схему переходов
• составьте уравнения реакций переходов.
32.
Ссылки на источники информации и изображения:http://www.rmnt.ru/pub/uploads/glass_cutter_0511_3.jpg
http://www.students.by/articles/19/1001931/PH04503.jpg
http://www.jabinesban.com/wpcontent/uploads/2010/09/fullereno_fullereno.jpg
http://artmarket.com.ua/media/catalog/product/cache/17/image/9df78eab33525d08d6
e5fb8d27136e95/1/1/111111111111111_2.jpg
http://im5-tub-ru.yandex.net/i?id=42457246-63-72&n=21
http://s58.radikal.ru/i160/1012/ff/2e7639eb01bc.jpg
http://urbanjewelers.biz/wp-content/uploads/2010/10/diamondse1288016603994.jpg
33.
http://im6-tub-ru.yandex.net/i?id=795134635-71-72&n=21http://im0-tub-ru.yandex.net/i?id=58758432-63-72&n=21
http://im7-tub-ru.yandex.net/i?id=28109246-51-72&n=21
http://im2-tub-ru.yandex.net/i?id=584425754-01-72&n=21
http://im6-tub-ru.yandex.net/i?id=59807605-60-72&n=21
http://im1-tub-ru.yandex.net/i?id=501551220-00-72&n=21
http://im5-tub-ru.yandex.net/i?id=51546160-51-72&n=21
http://im0-tub-ru.yandex.net/i?id=140463688-66-72&n=21
http://im0-tub-ru.yandex.net/i?id=945542505-10-72&n=21
http://im4-tub-ru.yandex.net/i?id=412111321-54-72&n=21
http://im2-tub-ru.yandex.net/i?id=440598815-39-72&n=21






























 Химия
Химия








