Похожие презентации:
Введение в биохимию. Строение и функции белков, пептидов и аминокислот
1.
Лекция №1Тема:
Введение в биохимию. Строение и
функции белков, пептидов и
аминокислот
(Количество часов – 2)
Лектор к.х.н., ст. преп-ль Матаипова Анара
Кушубаковна
2.
Цель лекции:Ознакомиться предметом биохимии, ее
задачами и ролью в клинической
медицине;
изучить
классификацию,
биологическую роль и структуру белков,
аминокислот и пептидов.
3.
Полугодовая учебная нагрузка по биохимиидля лечебного отделения
Количество кредитов-3
Лекция – 18 ч.
Практическое занятие – 27ч.
СРС – 45 ч.
2 РК, 4 ТК.
Отчетность: зачет в конце 3-го семестра
4.
Литература:Основная:
1. Березов Т.Т., Коровкин Б.Ф. Биохимия,
1982, 1990, 1998 г. изд.
2. Кушманова О. Д., Ивченко Г.М.
Практикум по биохимии, 1983 г.
3. Материалы лекции.
Дополнительная:
1. Николаев А.Я. Биохимия, 1989 г.
2. Строев Е.А. Биохимия, 1986 г.
5.
Основные вопросы:1-ая часть лекции:
1. Введение. Предмет и задачи биохимии. Роль биохимии в
практической медицине.
2-ая часть лекции:
1. Понятие о белках. Функции белков в организме.
2. Аминокислоты, классификация, строение и биологическая
роль.
3. Механизм образования пептидов и пептидная связь.
4. Структурная организация белка (первичная, вторичная,
третичная и четвертичная).
6.
1-часть.Введение. История развития биохимии
Что изучает биохимия?
Биологическая химия - это молекулярная
наука, изучающая химический состав и
структуру молекул, входящих в состав живой
материи, их превращении в физикохимических процессах, лежащих в основе
жизнедеятельности.
7.
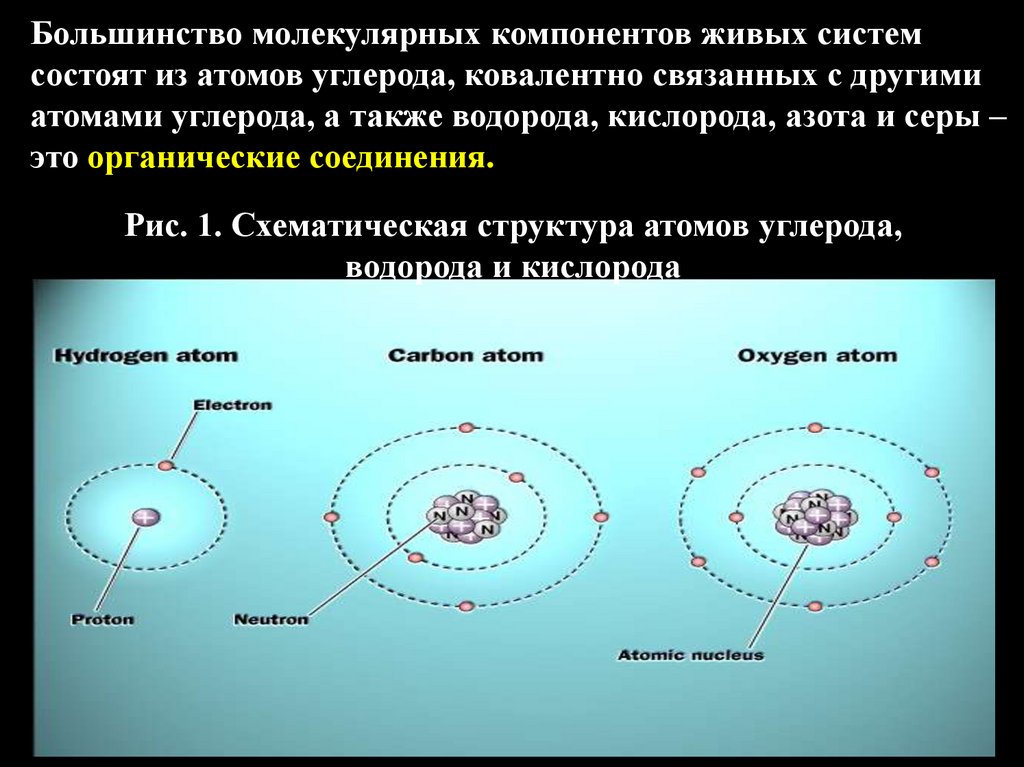
Большинство молекулярных компонентов живых системсостоят из атомов углерода, ковалентно связанных с другими
атомами углерода, а также водорода, кислорода, азота и серы –
это органические соединения.
Рис. 1. Схематическая структура атомов углерода,
водорода и кислорода
8.
Механизм образования биополимеров ихмономеров
мономеры
полимеры
Аминокислоты
Пептиды и белки
Жирные кислоты, глицерин
фосфорная кислота, азот. соед.
Липиды (триглицериды,
фосфолипиды, холестерин
Моносахариды (глюкоза, фруктоза,
галактоза, производные
Полисахариды
(крахмал, гликоген,
гетерополисахариды)
Биологически активные
Биологически активные
9.
Рис. 2. Строение клетки10.
Рис. 3. Митохондрия клетки – энергетическаястанция клетки форме АТФ
(аденозинтрифосфат)
Дыхательные
ферменты и
клеточное дыхание
Цикл Кребса, бетаокисление и др.
11.
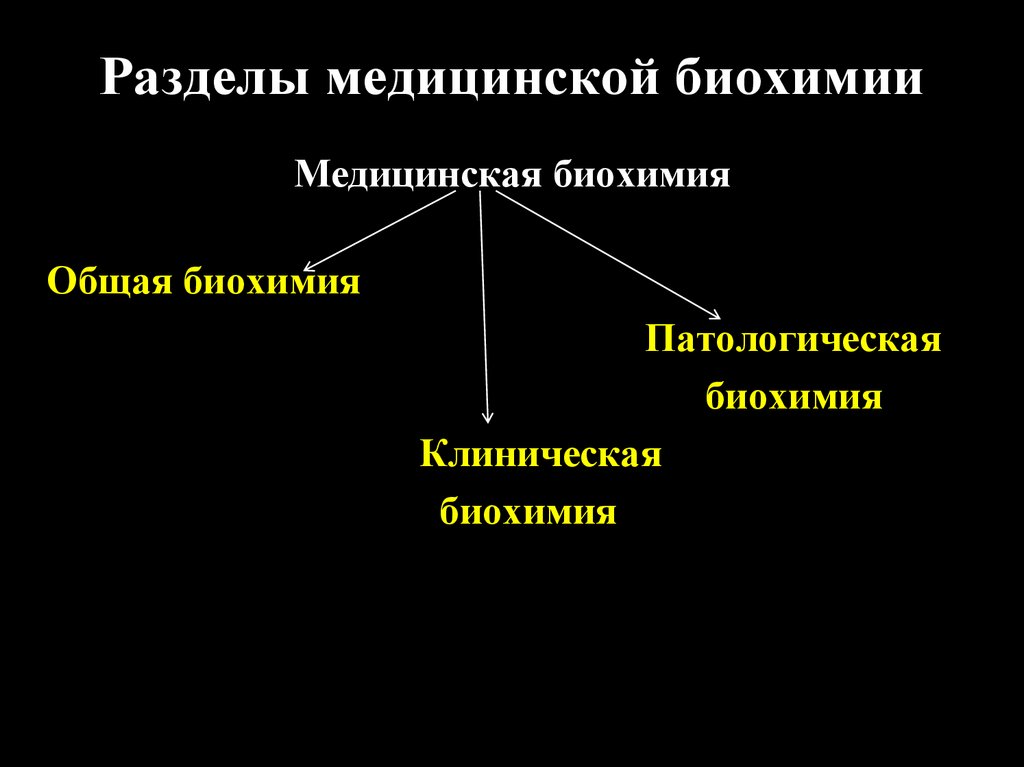
Разделы медицинской биохимииМедицинская биохимия
Общая биохимия
Патологическая
биохимия
Клиническая
биохимия
12.
Этапы развития биохимииБиохимия развивалась в 3-х направлениях:
1-этап. С конца XYIII до середины XIX века.
Развивалась статическая биохимия – изучение структуру
химических веществ живого организма.
2- этап до середины XX века развивалась динамическая
биохимия – изучение метаболизма химических превращений
веществ в организме.
3- этап. Середина XX до нашего времени развивалась
функциональная биохимия – развитие методов выделения и
исследование клеточных органелл и основных биополимеров,
доставка и биохимический механизм действия лекарственных
веществ, действия токсических и др. веществ.
Интенсивно развивается диагностические аспекты клинической
биохимии
13.
Ученые биохимики14.
Открытия ученых в области биохимииШееле (1742-1786гг.)-
Хим. состав животных и
растительных тканей.
Лавуазье (1780г)Открыл дыхание клетки.
Воклен (1806г.)Открытие аминокислот.
Функ и Лунин (1812г.)Открытие витаминов.
Велер (1828г)Синтез мочевины.
К. Бернар (1950г.)Выделение гликогена.
Мишер (1869 г.)Открытие нуклеиновых кислот.
Э. Фишер (1902г)Открытие структуры белков.
Г. Кребс (1932, 1937г.) – Цикл трикарбоновых кислот и
орнитиновый цикл мочевинообразования.
Д. Уотсон и Ф.Крик (1954г.)- Структуры ДНК. и др.
15.
Ученые биохимики50-60- годы XX века
Ф. Мишер
ДЖ. Уотсон
Ф. Крик
16.
Задачи биохимииИзучить
строение
и
функции
биомолекул
(неорганических и органических) входящих в состав
тканей, органов организма.
Изучение
механизм
поступления
веществ
во
внутреннюю среду организма.
Разобрать
механизм превращения мономеров в
биополимеры
Понять
механизм
образования,
накопления
и
использования энергии в клетке.
Изучение механизм образования и выведения конечных
продуктов обмена в организме.
Изучение механизм воспроизведения и передачи
наследственных признаков организма.
17.
Роль биохимии в клинической медицинеБиохимиятеоретическая
основа
клинической
медицины.
2.
Биохимия
в
медицинском
вузе
является
фундаментальным предметом для профессионального
медицинского образования.
3. Биохимия важную роль играет в овладении такими
дисциплинами, как, нормальная и патологическая
физиология фармакология, клиническая биохимия, все
клинические дисциплины.
4. Биохимия играет важную роль в врачебной деятельности
т.е. методы исследования, диагностики и проверки
эффективности лечения больного, прогноз и др.
1.
18.
Понятие о белках. Функции белков ворганизме.
Белки- это высокомолекулярные азотсодержащие
соединения, молекулы которых состоят из альфа
аминокислот
Аминокислоты –это алифатические карбоновые
кислоты, альфа углеродный атом который имеет
аминогруппу.
19.
Рис. 4. Природные источники белков20.
Содержание белков в продуктах (в 100гр.)Легкие - 84%
Печень – 80%
Селезенка – 82%
Мясо - 22%
Сыр - 36%
Соя - 35%
Горох – 26%
Рыба – 22%
Макарон – 13%
Яйцо – 13%
Орехи лесные – 12%
Пшено – 10%
21.
Суточная норма потребления белковСуточная потребность в белках:
У детей до 12 лет – 55 – 72 гр./ сутки.
У взрослых - занимающихся умственным
трудом - 100-120г.
У взрослых, занимающихся физическим трудом
– 130-150 гр.
22.
Рис. 5. Функции белков в организме23.
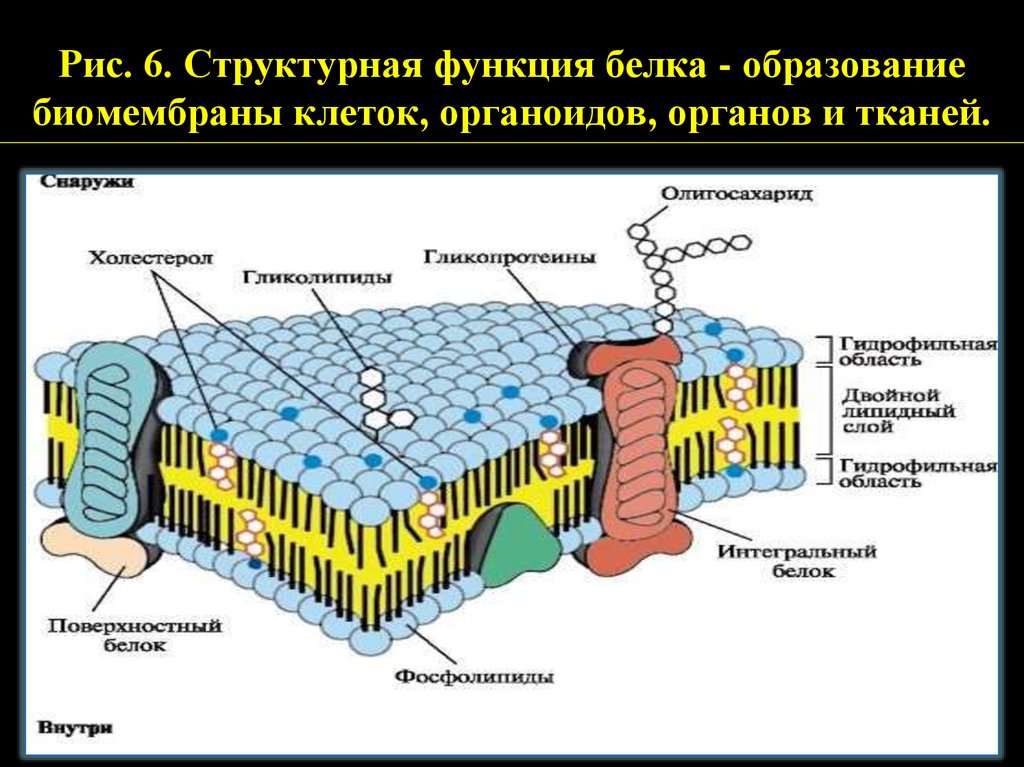
Рис. 6. Структурная функция белка - образованиебиомембраны клеток, органоидов, органов и тканей.
24.
Рис. 7. Транспортная функция белковГемоглобин в крови –
переносит О2 и СО2.
Альбумин в крови
переносит ЛП, витамины
лекарства, токсины и др
А
А
25.
Рис. 8. Защитная - иммуноглобулины кровиСтруктура Ig G (150кД).
Структура Ig М (935кД)
26.
Рис. 9. Классы иммуноглобулинов27.
Рис.10. Каталитическая: ферментыбиокатализаторыФерменты- ускоряют хим. реакции в организме в млн.
и миллиарды раз.
Модель фермента
нуклеозид-фосфорилазы
Модель фермента Helicobacter pylori
28.
Рис.11. Сократительная – мышечные белкиСхема строения актиновой нити и миозиновых комплексов
актин
тропониновый
комплекс
тропомиозин
29.
Рис. 12. Регуляторная: гормоныГормон –белково-пептидный
R
G
AА
Мембрана клеток
Аденилатциклаза
(белок-фермент)
ГТФ АТФ
ц-АМФ
Активирует ферменты
Изменение обмена веществ и функции клетки
30.
Рис. 13. Питательная (запасная)Яичный белок (резервный
белок для развития
зародыша)
Ферритин (запас железа
для синтеза гемоглобина)
31.
Рис. 14.Транспорт железа вкрови
Трансферрин – транспортирует железо в крови.
1 мол. трансферрин связывает 2мол Fe 3+
2Fe 3+
2Fe 3+
32.
Аминокислоты – структурные компонентыбелков
Общая формула:
R – CH - COOH
NH2
В ионизированной форме
(биполярные ионы)
R – CH – COOкислот. свойство
NH3+
основное свойство
амфотерность
33.
Таблица 1. Классификация аминокислот по строению(выучить)
34.
Рис. 15. Аминокислоты с алифатической боковойцепью (Рис. 15-20 для ознакомления)
35.
Рис. 16. Ароматические аминокислоты36.
Рис. 17. Аминокислоты с линейнойкислородсодержащей цепью
37.
Рис. 18. Кислые аминокиcлоты и ихпроизводные
38.
Рис. 19. Аминокислоты с основной боковойцепью
39.
Рис. 20. Иминокислота - пролин40.
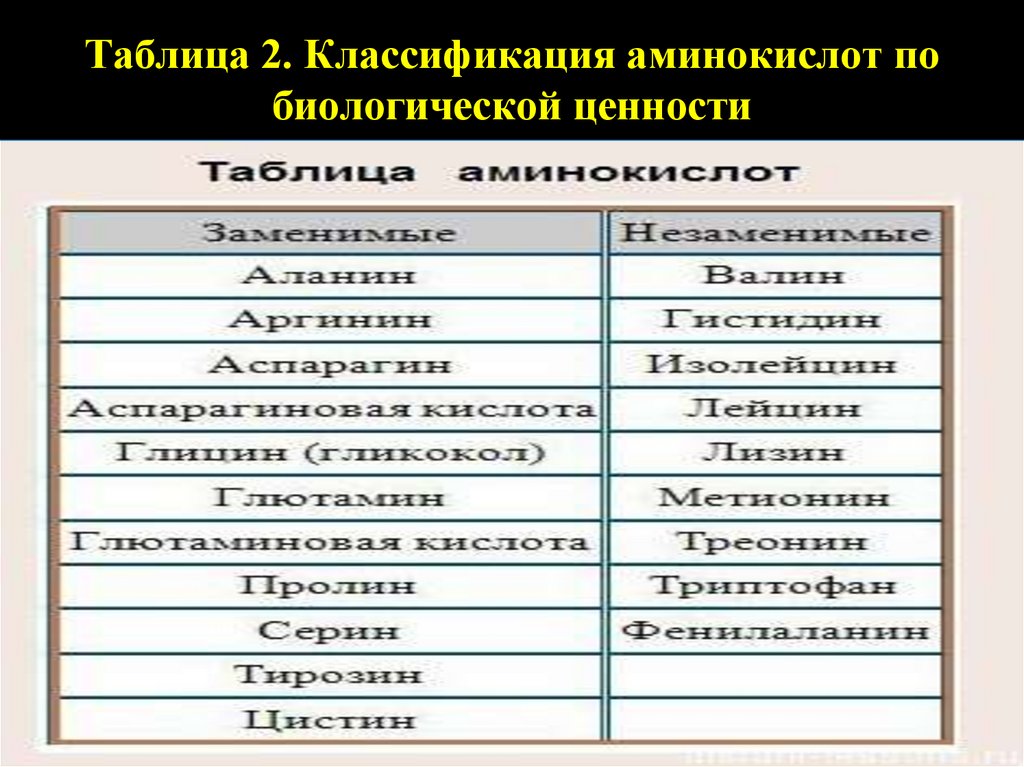
Таблица 2. Классификация аминокислот побиологической ценности
41.
Рис. 21. Биологическая рольаминокислот
42.
Рис. 22. Механизм образования пептиднойсвязи
43.
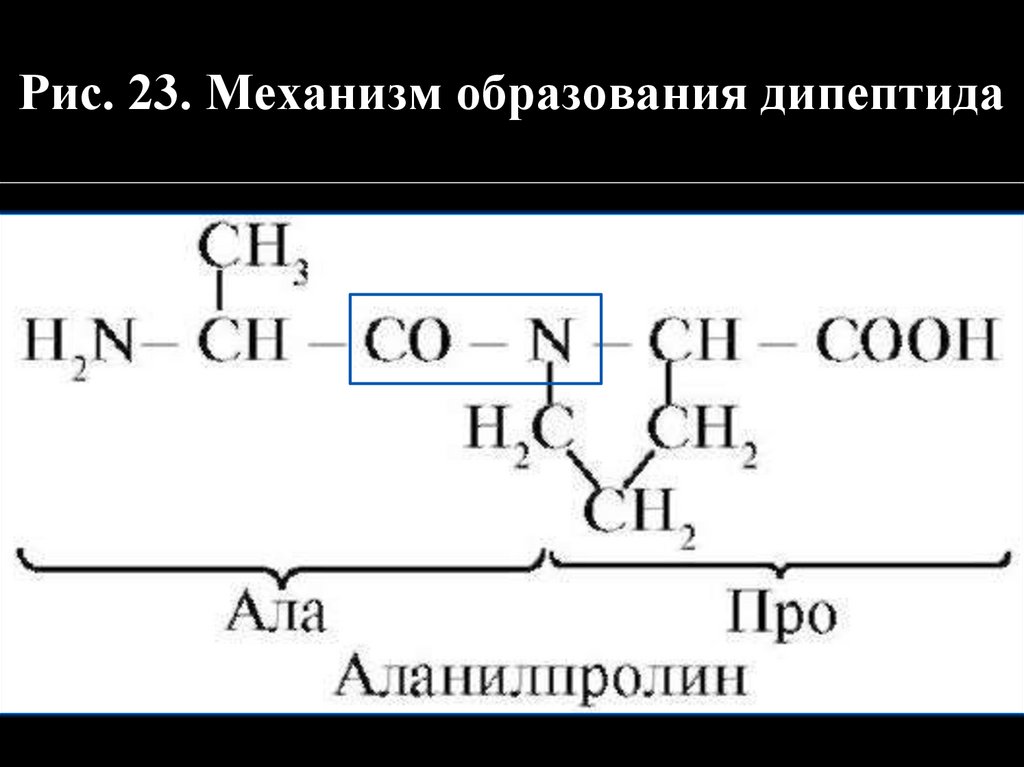
Рис. 23. Механизм образования дипептида44.
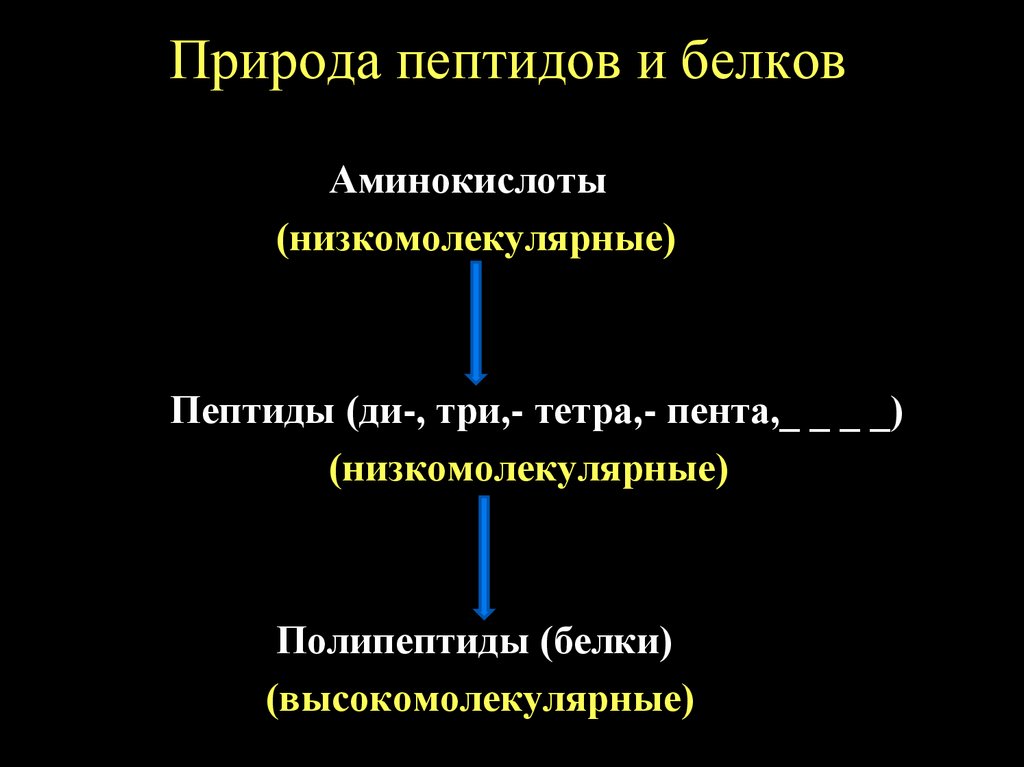
Природа пептидов и белковАминокислоты
(низкомолекулярные)
Пептиды (ди-, три,- тетра,- пента,_ _ _ _)
(низкомолекулярные)
Полипептиды (белки)
(высокомолекулярные)
45.
Классификация пептидов1. Гормональные пептиды (гормоны
гипоталамуса, гипофиза и др. – регуляторы
биохим. и физиол. процессов.
2. Сывороточные пептиды в крови – регуляторы
тонуса сосудов. Ангиотензин, брадикинин,
каллидин.
3. Пептиды, участвующие в пищеварении в
ЖКТ – гастрин, секретин и др..
4. Нейропептиды в ЦНС – эндорфины,
энкефалины и др..
46.
Рис. 24. Принципы структурной организациибелков в организме
Первичная Вторичная
Аминокисл.
Остатки
α-спираль
Третичная
Четвертичная
Полипептидная
цепь
Комплекс
субъединиц
47.
Рис. 25. Первичная структура белка48.
Рис. 26. Схема первичной структуры белкаСН-R1
NH2
CO
N – конец
NH
CO
CH-R2
CH-R3
NH
Пептидная связь
(прочная, ковалентная)
COOH
С – конец
49.
Рис. 27. Пример.Пептиды в организме имеют первичную
структуру
Гормон инсулин
50.
Рис. 28. Гормоны гипоталамусаГонадолиберин - декапептид (10амк)
Пиро - Глу–Гис–Три–Сер–Тир–Гли–Лей–Арг–Про–Гли-NН2
Соматостатин (14амк)
51.
Рис. 29. Вторичная структура белкаВодородные
связи
(слабая, не
ковалентная)
52.
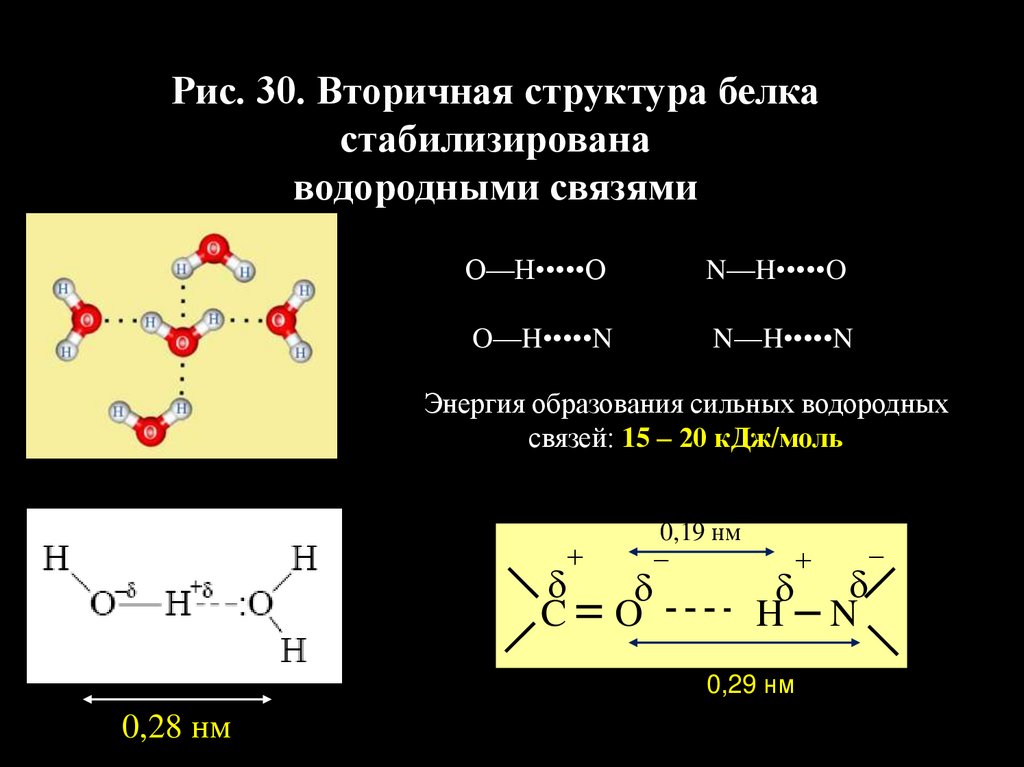
Рис. 30. Вторичная структура белкастабилизирована
водородными связями
О‒‒Н•••••О
N‒‒H•••••O
O‒‒H•••••N
N‒‒H•••••N
Энергия образования сильных водородных
связей: 15 – 20 кДж/моль
C
0,19 нм
O
H N
0,29 нм
0,28 нм
53.
Рис. 31. Пример.Белки мышечной и соединительной ткани имеют
вторичную структуру
Мышечные белки актомиозиновый комплекс
54.
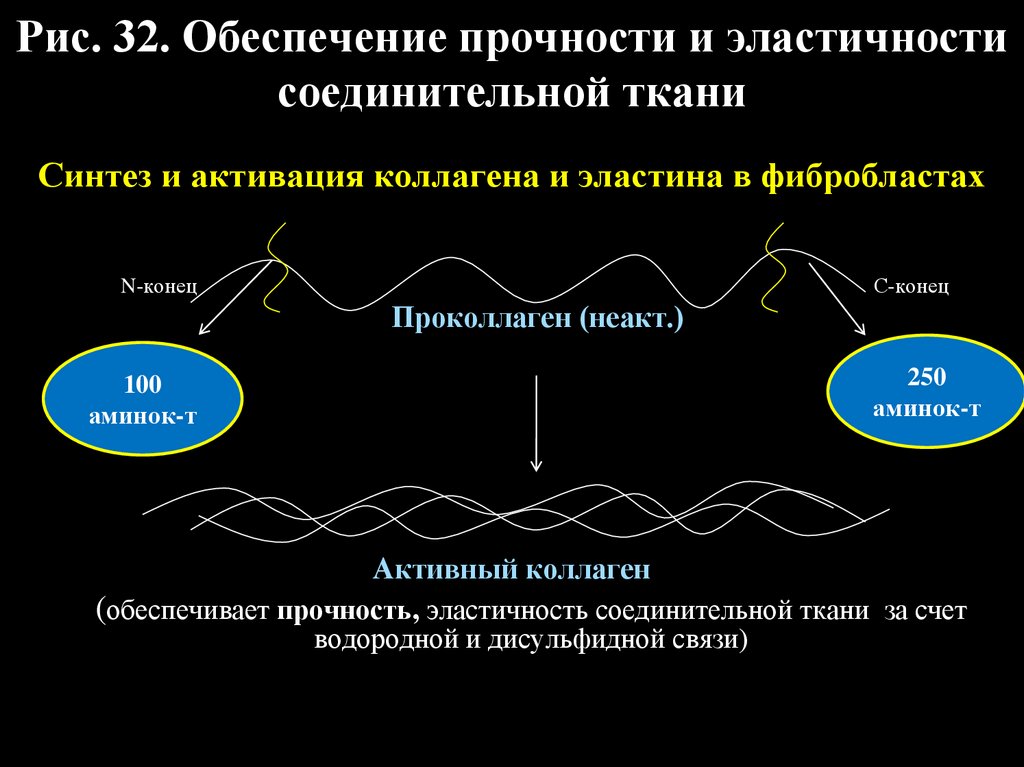
Рис. 32. Обеспечение прочности и эластичностисоединительной ткани
Синтез и активация коллагена и эластина в фибробластах
С-конец
N-конец
Проколлаген (неакт.)
100
аминок-т
250
аминок-т
Активный коллаген
(обеспечивает прочность, эластичность соединительной ткани за счет
водородной и дисульфидной связи)
55.
Рис. 33. Третичная структура белкаПример. Все внутриклеточные белки и транспортные,
защитные белки крови и др. имеют третичную структуру
Третичная структура белка-миоглобина мышц
56.
Max Perutz и John Kendrew –рентгеноструктурный анализ миоглобина (1958) и
гемоглобина
57.
Рис. 34. Третичная структура миоглобинаa – ленточная модель (видны
вторичные стр.)
b – сетчатая (поверхность)
c – поверхностный контур
d – ленточная с боковыми
радикалами
e – полная пространственная
модель
58.
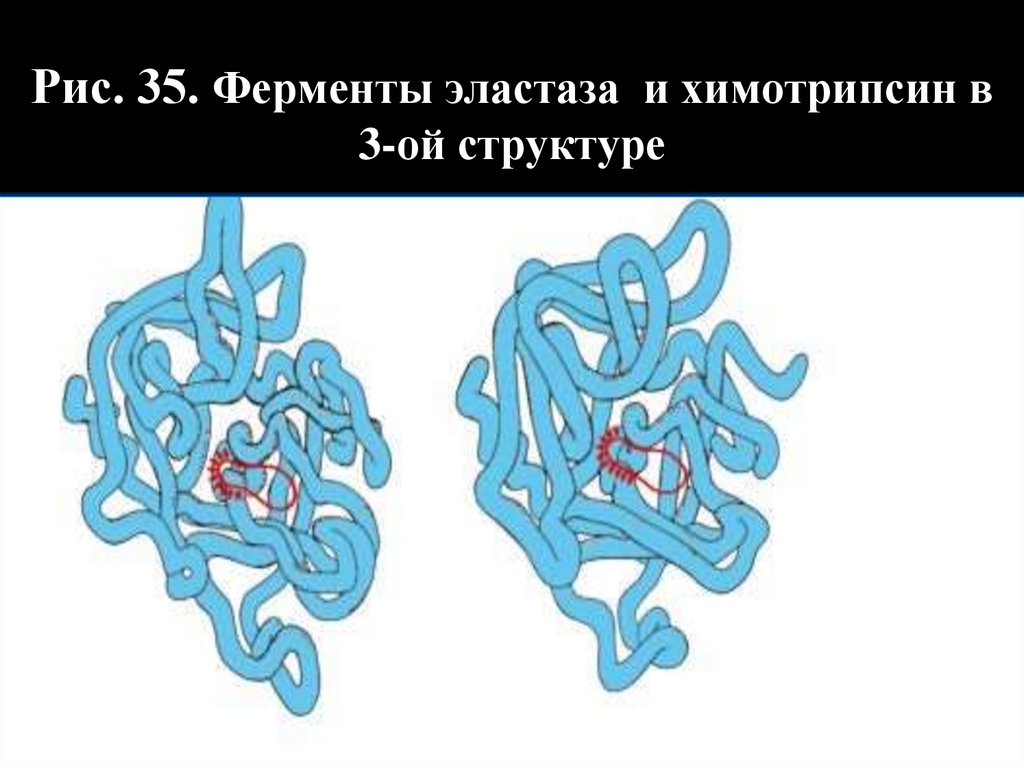
Рис. 35. Ферменты эластаза и химотрипсин в3-ой структуре
59.
Рис. 36. Межмолекулярные связи втретичной структуре белка
60.
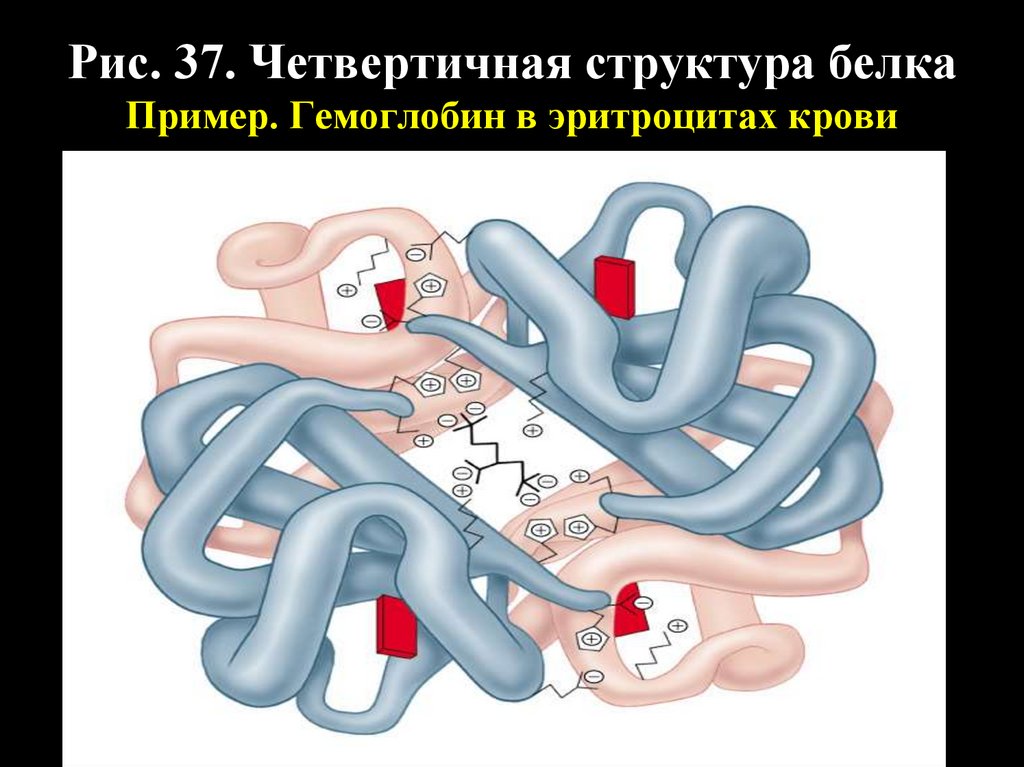
Рис. 37. Четвертичная структура белкаПример. Гемоглобин в эритроцитах крови
61.
ЗАДАНИЕ СРС:1. Выучить формулы 20 аминокислот.
2. Научиться составлять пептиды (ди,-три-,
тетра-, пента и т.д.)
3. Показать строение и классификацию
пептидов в организме.
4. Место нахождения пептидов в организме и
их биологическая роль.
5. Отличия белков от пептидов.
Задание нужно показать в иллюстративной
форме:




















































 Биология
Биология








