Похожие презентации:
"Когда даже холодильник не помог". Задача №15. X Всероссийский студенческий БиоТурнир
1.
X Всероссийский студенческий БиоТурнирЗадача № 15
“Когда даже холодильник не помог”
Команда «Кто-нибудь знает правила?»
ФГАОУ ВО РНИМУ им. Н.И. Пирогова
Подготовили: Лукина Татьяна, Крохалева Валентина, Кухарчук Артём, Далинина Василиса,
Суходолова Екатерина
2.
УсловиеНебольшой убиквитин-подобный модификатор (SUMO) часто используется в качестве
метки для экспрессии нерастворимых и/или склонных к неправильному фолдингу
белков. Для отщепления SUMO от целевого белка наиболее часто используют Ulp1
протеазу, которая распознает SUMO-лидер. Ulp1 экспрессируется в растворимой
форме, проста в использовании и широко применяется для очистки белков. Однако
активность Ulp1 постепенно снижается при хранении, даже при температурах ниже 80 °С. Такая потеря активности не позволяет хранить данную протеазу, а также
нарабатывать ее впрок. Объясните механизмы потери активности и
предложите способы длительного хранения активной формы Ulp1.
Автор задачи – Казакова Ангелина Владимировна, научный сотрудник, RnD центр
Герофарм.
2
3.
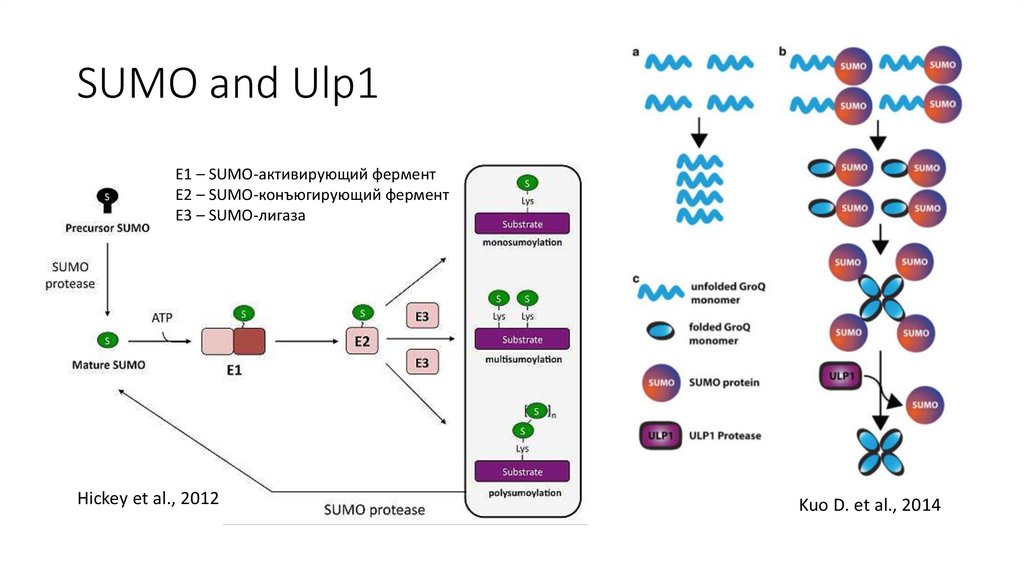
SUMO and Ulp1Е1 – SUMO-активирующий фермент
E2 – SUMO-конъюгирующий фермент
Е3 – SUMO-лигаза
SMT3 – SUMO S. cerevisiae
Hickey et al., 2012
Kuo D. et al., 2014
4.
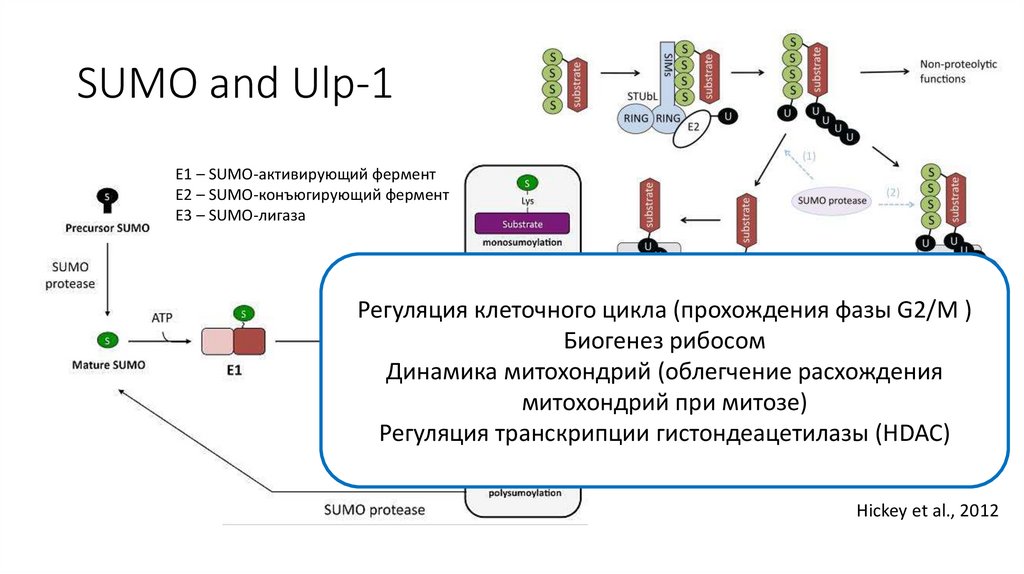
SUMO and Ulp-1Е1 – SUMO-активирующий фермент
E2 – SUMO-конъюгирующий фермент
Е3 – SUMO-лигаза
Регуляция клеточного цикла (прохождения фазы G2/M )
Биогенез рибосом
Динамика митохондрий (облегчение расхождения
митохондрий при митозе)
– SUMO S. cerevisiae
Регуляция транскрипцииSMT3
гистондеацетилазы
(HDAC)
Hickey et al., 2012
5.
Ulp1_WT –КОНСЕРВАТИВНЫЙ протеазный домен
• Ulp1 - 621 АК
• Ulp1_WT = Ulp1(403-621) консервативный протеазный домен
• Для наработки Ulp1 используют именно
Ulp1(403_621), т.к. в E. Coli полная
форма приводит к гибели клеток
(Mossessova E, et al. 2000; Elmore ZC et
al., 2011; Lau, Yue-Ting K et al., 2018 и
др.)
PDB 1EUV
• При этом, Ulp1 в растворимой форме
теряет активность со временем
5
6.
Проверка стабильности Ulp1Для проверки стабильности была проведена молекулярная
динамика 1EUV в пакете GROMACS
Стратегия симуляции:
1.
2.
3.
4.
5.
6.
7.
убрали субстрат SMT3 и кристаллическую воду
сольватировали белок в кубической ячейке и добавили
Na+и Cl- для уравновешивания заряда
минимизировали энергию системы
уравновесили систему по температуре и давлению в
течении 100 пс
провели симуляцию динамики в течении 3 нс при 300К
получили графики подвижности остатков, составляющих
каталитический центр
визуализировали данные в UCSF Chimera
7.
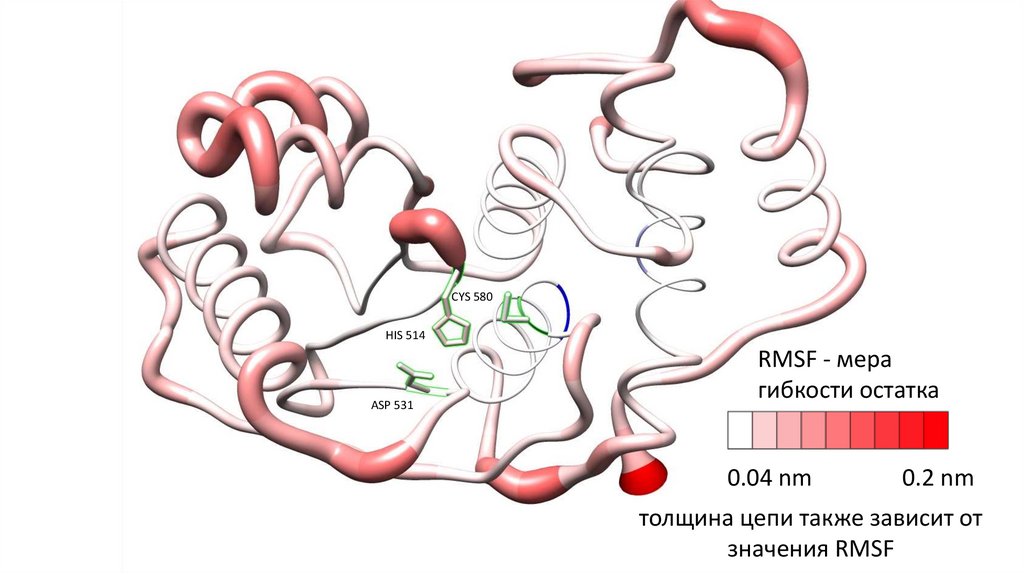
HIS 514 0.0570 нмASP 531 0.0466 нм
CYS 580 0.0394 нм
RMSF означает среднеквадратичное колебание. Это численное измерение, аналогичное RMSD, но вместо
указания позиционных различий между целыми структурами с течением времени, RMSF представляет собой
расчет гибкости отдельного остатка или того, насколько конкретный остаток перемещается (колеблется) во время
моделирования. RMSF на остаток обычно отображается в зависимости от количества остатков и может структурно
указывать, какие аминокислоты в белке вносят наибольший вклад в молекулярное движение.
8.
CYS 580HIS 514
ASP 531
RMSF - мера
гибкости остатка
0.04 nm
0.2 nm
толщина цепи также зависит от
значения RMSF
9.
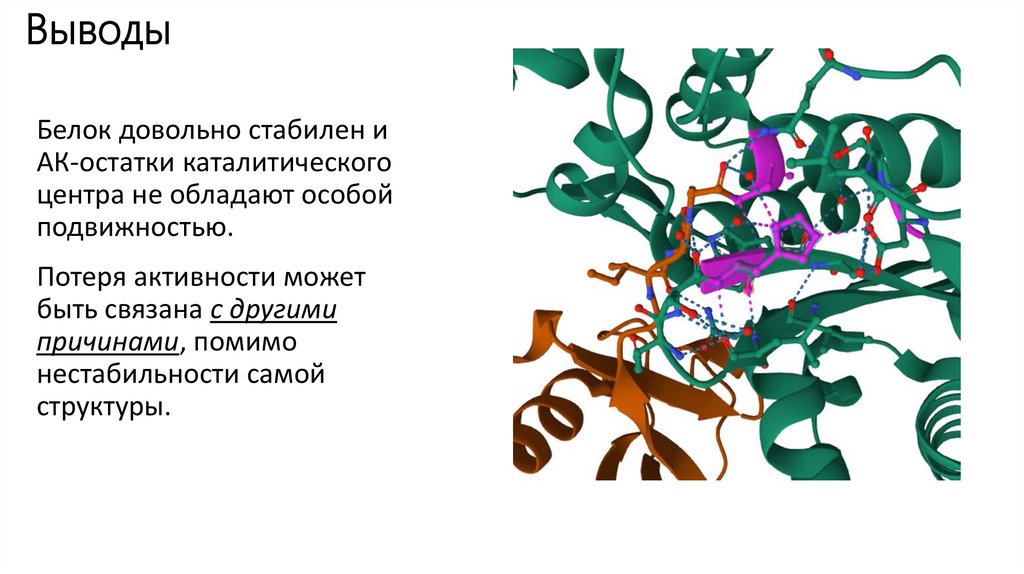
ВыводыБелок довольно стабилен и
АК-остатки каталитического
центра не обладают особой
подвижностью.
Потеря активности может
быть связана с другими
причинами, помимо
нестабильности самой
структуры.
10.
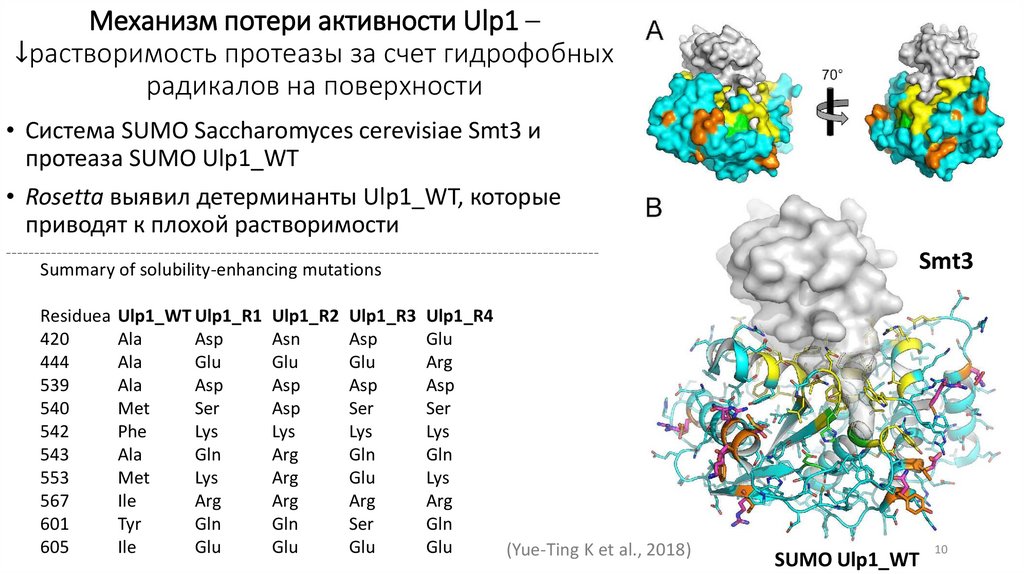
Механизм потери активности Ulp1 –↓растворимость протеазы за счет гидрофобных
радикалов на поверхности
• Система SUMO Saccharomyces cerevisiae Smt3 и
протеаза SUMO Ulp1_WT
• Rosetta выявил детерминанты Ulp1_WT, которые
приводят к плохой растворимости
Summary of solubility-enhancing mutations
Residuea Ulp1_WT Ulp1_R1 Ulp1_R2 Ulp1_R3 Ulp1_R4
420
Ala
Asp
Asn
Asp
Glu
444
Ala
Glu
Glu
Glu
Arg
539
Ala
Asp
Asp
Asp
Asp
540
Met
Ser
Asp
Ser
Ser
542
Phe
Lys
Lys
Lys
Lys
543
Ala
Gln
Arg
Gln
Gln
553
Met
Lys
Arg
Glu
Lys
567
Ile
Arg
Arg
Arg
Arg
601
Tyr
Gln
Gln
Ser
Gln
605
Ile
Glu
Glu
Glu
Glu
(Yue-Ting K et al., 2018)
Smt3
SUMO Ulp1_WT
10
11.
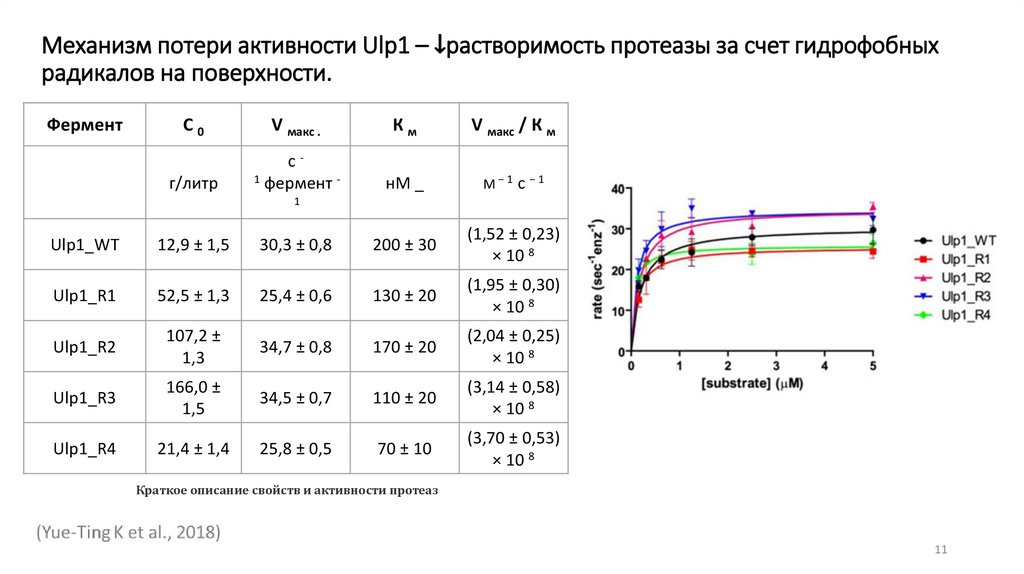
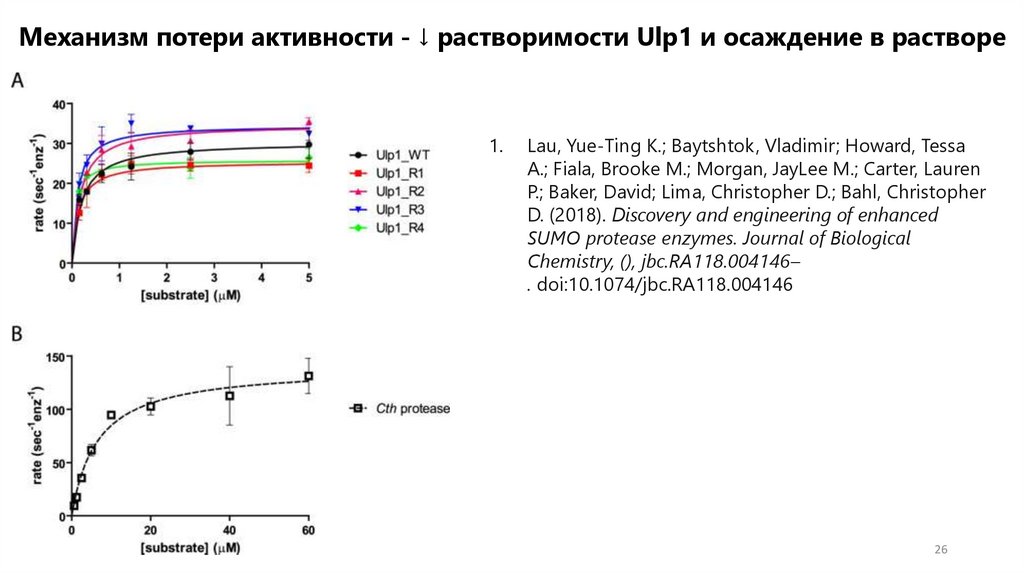
Механизм потери активности Ulp1 – ↓растворимость протеазы за счет гидрофобныхрадикалов на поверхности.
Фермент
С0
V макс .
Км
V макс / К м
г/литр
с1 фермент -
нМ _
М−1 с −1
1
Ulp1_WT
12,9 ± 1,5
30,3 ± 0,8
200 ± 30
(1,52 ± 0,23)
× 10 8
Ulp1_R1
52,5 ± 1,3
25,4 ± 0,6
130 ± 20
(1,95 ± 0,30)
× 10 8
Ulp1_R2
107,2 ±
1,3
34,7 ± 0,8
170 ± 20
(2,04 ± 0,25)
× 10 8
Ulp1_R3
166,0 ±
1,5
34,5 ± 0,7
110 ± 20
(3,14 ± 0,58)
× 10 8
Ulp1_R4
21,4 ± 1,4
25,8 ± 0,5
70 ± 10
(3,70 ± 0,53)
× 10 8
Краткое описание свойств и активности протеаз
11
12.
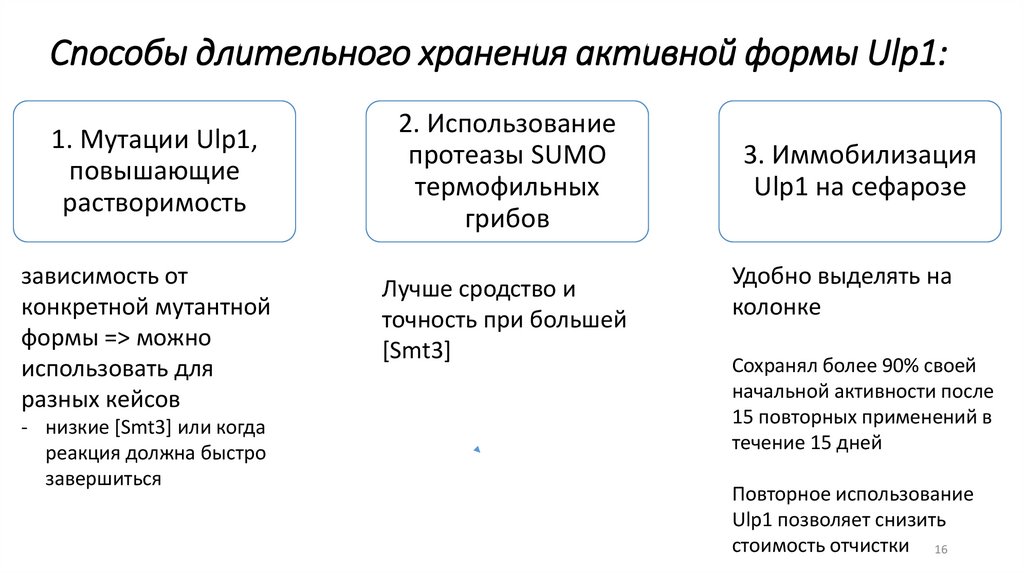
Способы длительного хранения активной формы Ulp1:1. Мутации Ulp1,
повышающие
растворимость
2. Использование
протеазы SUMO
термофильных
грибов
3. Иммобилизация
Ulp1 на сефарозе
12
13.
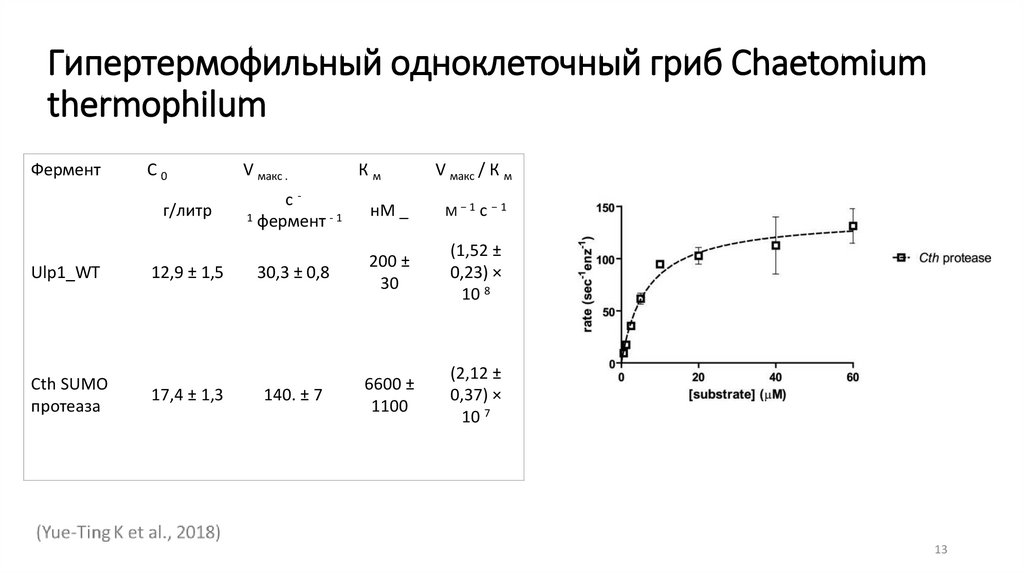
Гипертермофильный одноклеточный гриб Chaetomiumthermophilum
Фермент
С0
г/литр
Ulp1_WT
Cth SUMO
протеаза
12,9 ± 1,5
17,4 ± 1,3
V макс .
Км
V макс / К м
с1 фермент - 1
нМ _
М−1 с −1
30,3 ± 0,8
200 ±
30
(1,52 ±
0,23) ×
10 8
140. ± 7
6600 ±
1100
(2,12 ±
0,37) ×
10 7
13
14.
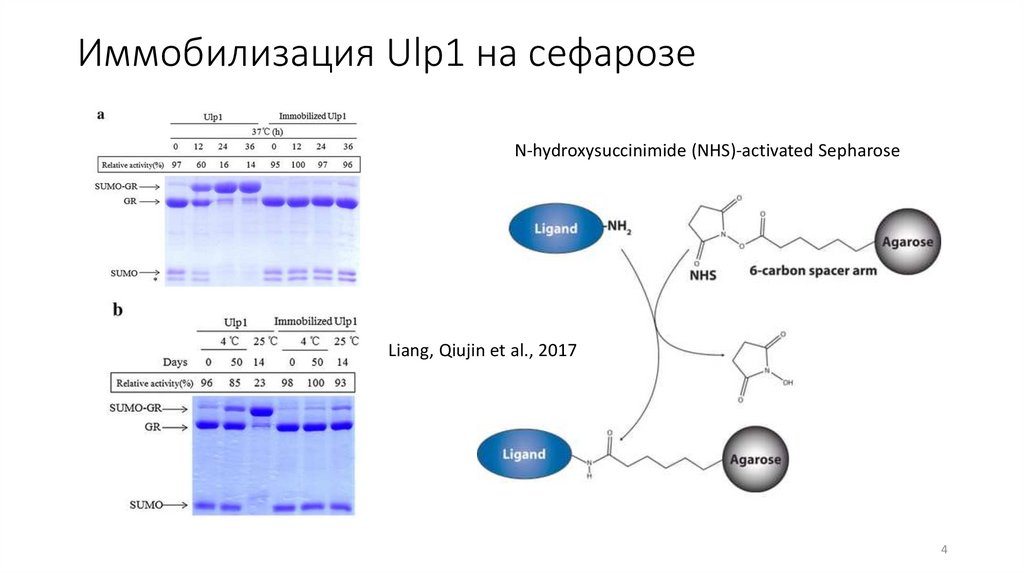
Иммобилизация Ulp1 на сефарозеN-hydroxysuccinimide (NHS)-activated Sepharose
Liang, Qiujin et al., 2017
14
15.
Иммобилизация Ulp1 на сефарозеИммобилизованный Ulp1 сохранил более 90% своей стартовой
активности после 15 повторных использований в течение 15
дней
Иммобилизованный Ulp1 сохранял >90% активности после 50
дней хранения при 4 °C и более 14 дней хранения при 25 °C.
Кроме того, иммобилизованный Ulp1 стабилен при
экстремальных значениях pH и толерантен к органическим
реагентам. Очистка белков, меченных SUMO, достигается в
течение 1 часа с использованием иммобилизованной Ulp1 и
Ni-NTA-сефарозы.
• SUMO-GR (1 мг/мл) расщепляли свободным (10 -4 -10 -5 мг/мл) и иммобилизованным Ulp1 в
буфере Ulp1 (50 мМ Трис/HCl, pH 8,0) при 4 °С в течение 24 ч или при 25 °C в течение 12 ч
при осторожном перемешивании.
Liang, Qiujin et al., 2017
15
16.
Способы длительного хранения активной формы Ulp1:1. Мутации Ulp1,
повышающие
растворимость
зависимость от
конкретной мутантной
формы => можно
использовать для
разных кейсов
- низкие [Smt3] или когда
реакция должна быстро
завершиться
2. Использование
протеазы SUMO
термофильных
грибов
Лучше сродство и
точность при большей
[Smt3]
3. Иммобилизация
Ulp1 на сефарозе
Удобно выделять на
колонке
Сохранял более 90% своей
начальной активности после
15 повторных применений в
течение 15 дней
Повторное использование
Ulp1 позволяет снизить
стоимость отчистки 16
17.
Протеаза Ulp-1 стабильна при -80*• Отсутствие неспецифического
протеолиза
• Активность от 2°С до 37°С.
• Последовательность из шести
гистидинов для облегчения ее удаления
из образца расщепленного белка.
Определение единицы: Одна единица
протеазы SUMO определяется как
количество фермента, необходимое для
расщепления 85% 2 мкг белка-субстрата
при 30°C в течение одного часа.
Хранить при -80°C. Гарантированная стабильность в
течение 6 месяцев при правильном хранении.
17
18.
Источники:1.
Mossessova E, Lima CD. Ulp1-SUMO crystal structure and genetic analysis reveal conserved interactions
and a regulatory element essential for cell growth in yeast. Mol Cell. 2000;5(5):865-876.
doi:10.1016/s1097-2765(00)80326-3
2.
Hickey CM, Wilson NR, Hochstrasser M. Function and regulation of SUMO proteases. Nat Rev Mol Cell
Biol. 2012;13(12):755-766. doi:10.1038/nrm3478
3.
Kuo, D., Nie, M., & Courey, A. J. (2014). SUMO as a Solubility Tag and In Vivo Cleavage of SUMO Fusion
Proteins with Ulp1. Methods in Molecular Biology, 71–80. doi:10.1007/978-1-4939-1034-2_6
4.
Elmore ZC, Donaher M, Matson BC, Murphy H, Westerbeck JW, Kerscher O. Sumo-dependent substrate
targeting of the SUMO protease Ulp1. BMC Biol. 2011;9:74. Published 2011 Oct 28. doi:10.1186/17417007-9-74
5.
Lau, Yue-Ting K et al. “Discovery and engineering of enhanced SUMO protease enzymes.” The Journal of
biological chemistry vol. 293,34 (2018): 13224-13233. doi:10.1074/jbc.RA118.004146
6.
Liang, Qiujin et al. “Immobilization of Ulp1 protease on NHS-activated Sepharose: a useful tool for
cleavage of the SUMO tag of recombinant proteins.” Biotechnology letters vol. 39,7 (2017): 1025-1031.
doi:10.1007/s10529-017-2330-5
7.
Malakhov MP, Mattern MR, Malakhova OA, Drinker M, Weeks SD, Butt TR. SUMO fusions and SUMOspecific protease for efficient expression and purification of proteins. J Struct Funct Genomics. 2004;5(12):75-86. doi: 10.1023/B:JSFG.0000029237.70316.52. PMID: 15263846.
18
19.
Спасибо за вниманиеЧто будет, если
пытаться
решить задачи
с помощью GPT
https://gpt-chatbot.ru/
19
20.
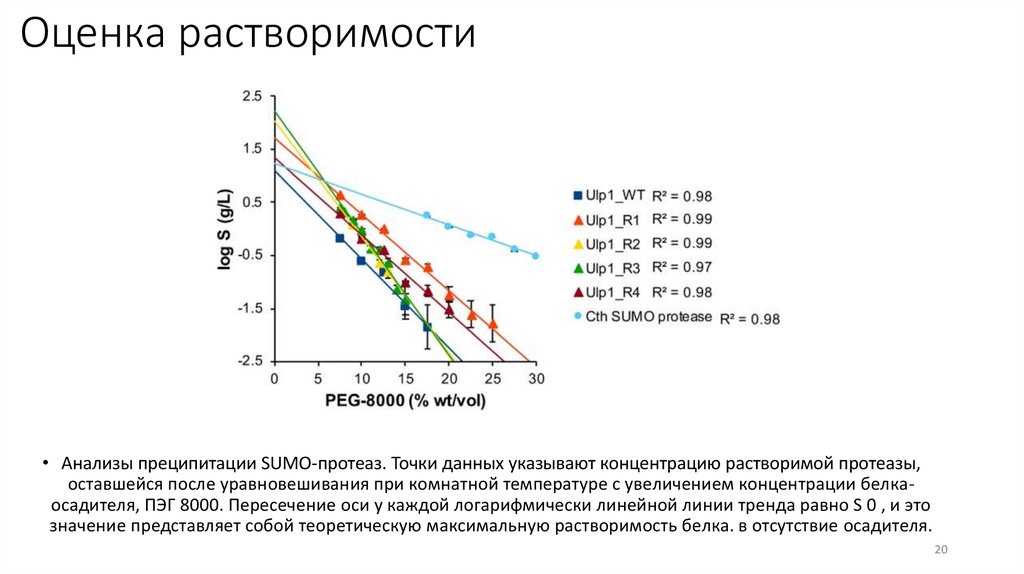
Оценка растворимости• Анализы преципитации SUMO-протеаз. Точки данных указывают концентрацию растворимой протеазы,
оставшейся после уравновешивания при комнатной температуре с увеличением концентрации белкаосадителя, ПЭГ 8000. Пересечение оси y каждой логарифмически линейной линии тренда равно S 0 , и это
значение представляет собой теоретическую максимальную растворимость белка. в отсутствие осадителя.
20
21.
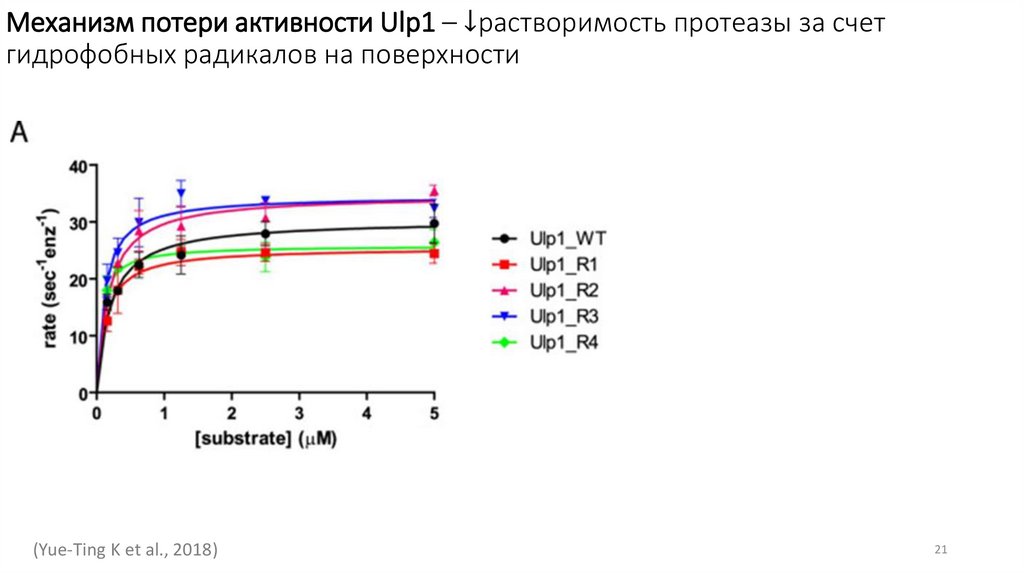
Механизм потери активности Ulp1 – ↓растворимость протеазы за счетгидрофобных радикалов на поверхности
(Yue-Ting K et al., 2018)
21
22.
Убиквитилирование белков• Для создания метки в белках, подлежащих деградации – идет ацилирование
белков активированной С-концевой карбоксильной группой остатка глицина
убиквитина (8 кДа), состоящего из 76 аминокислотных остатков.
1 стадия:
Активация карбоксильной группы убиквитина с помощью
убиквитин-активирующего фермента Е1 и АТР с
образованием убиквитил-АМР.
2 стадия:
Перенос остатка убиквитина Ub переносится на SHгруппу Ub-переносящего белка E2
3 стадия :
Перенос Ub-остатка убиквитин-протеин лигазой E3 на
остаток лизина белка-мишени, при этом образуется
амидная связь (Lys-белок с COO- глицина убиквитина)
Модифицированный остатком убиквитина белок
подвергается протеолизу в протеасомах или лизосомах
https://actanaturae.ru/2075-8251/article/view/10755/pdf
22
23.
Сумоилирование• не приводит к деградации белков
• SUMO экспрессируется во всех эукариотических организмах (дрожжи,
растения, животные), но отсутствует у бактерий (однако присутствует у архей).
• У дрожжей, червей и насекомых экспрессируется одна изоформа* SUMO.
• У позвоночных животных определено несколько изоформ — SUMO1, SUMO2,
SUMO3 (рис. 2), которые встречаются во всех тканях, и SUMO4, который
является псевдогеном*
• (ДНК → РНК → SUMO). Чтобы стать активным SUMO, ему сначала приходится
подвергнуться протеолизу*.
https://biomolecula.ru/articles/sumo-iaponskaia-borba-ili-unikalnaiaposttransliatsionnaiamodifikatsiia#:~:text=%D0%9F%D1%80%D0%BE%D1%82%D0%B5%D0%BE%D0%BB%D
23
24.
Функциональная значимость SUMO и сумоилирования• Конъюгация SUMO с RanGAP1 осуществляется через RanBP2 — ядерный белок: такая
модификация важна для ядерного транспорта и локализации RanGAP1.
• Интересен тот факт, что сумоилирование может быть вовлечено в патогенез многих
нейродегенеративных заболеваний. Показано, что сумоилирование необходимо для
ядерного транспорта фактора DJ-1, который подавляет транскрипционную активность
апоптотического белка р53, и мутации в котором зачастую связаны с развитием ранней
аутосомно-рецессивной формы болезни Паркинсона [12].
• Cумоилирование таких транскрипционных факторов, как Sp3, p300, c-jun, c-myb и Elk1
понижает их активационные свойства [13].
• Сумоилирование транскрипционного фактора HIC1 по аминокислотному остатку
лизина 314 не влияет на его ядерную локализацию, но усиливает репрессионные
свойства белка
• Существуют версии, что полисумоилирование может, как и убиквитинилирование,
приводить к деградации белков. Так, например, показано, что опухолевый супрессор
PML может подвергаться полисумоилированию и деградации 26S-протеасомой.
Полисумоилирование может влиять на другие ПТМ за счет экранирования сайтов
связывания белка-субстрата с ферментами, принимающими участие в ПТМ
24
25.
ПРОТЕОЛИЗ SUMO• Протеолиз белка SUMO осуществляется на С-конце полипептидной
цепи, освобождая два остатка аминокислоты глицина — GG. Данная
стадия процесса сумоилирования называется «созревание» и
осуществляется SUMO-специфическими протеолитическими
ферментами — SENP-протеазы у млекопитающих и Ulp-протеазы у
дрожжей. Далее наш маленький белок SUMO активируется Е1активирующим ферментом (гетеродимер Aos1/Uba2) и переносится на
фермент Е2 (Ubc9). После этапа активации SUMO конъюгируется с
субстратом в реакции, которая катализируется ферментами Е3 (рис. 3).
Как и в случае убиквитинилирования, на молекулу белка-субстрата
может переноситься как один остаток SUMO (моносумоилирование),
так и несколько (полисумоилирование).
25
26.
Механизм потери активности - ↓ растворимости Ulp1 и осаждение в растворе1.
Lau, Yue-Ting K.; Baytshtok, Vladimir; Howard, Tessa
A.; Fiala, Brooke M.; Morgan, JayLee M.; Carter, Lauren
P.; Baker, David; Lima, Christopher D.; Bahl, Christopher
D. (2018). Discovery and engineering of enhanced
SUMO protease enzymes. Journal of Biological
Chemistry, (), jbc.RA118.004146–
. doi:10.1074/jbc.RA118.004146
26
27.
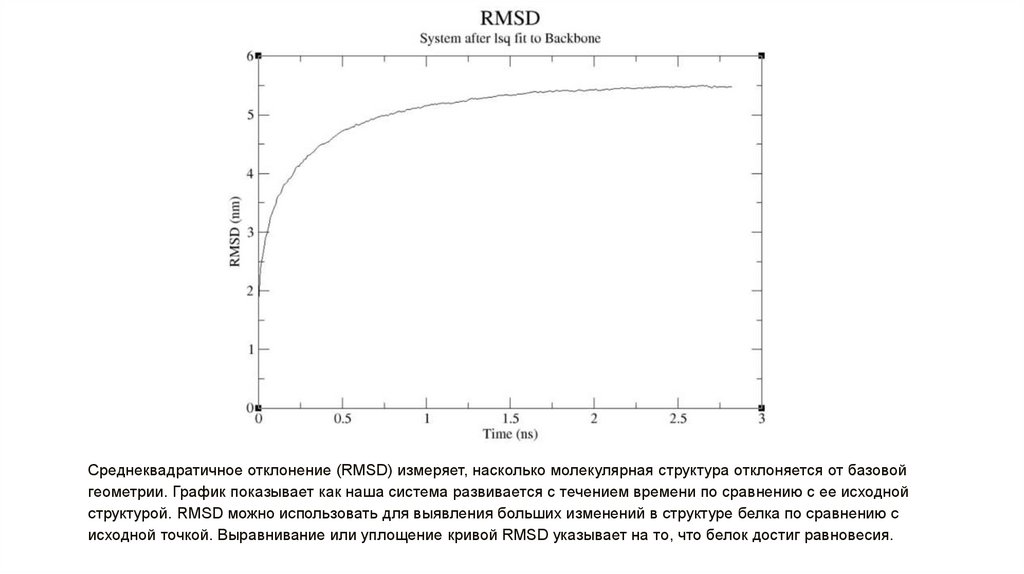
Среднеквадратичное отклонение (RMSD) измеряет, насколько молекулярная структура отклоняется от базовойгеометрии. График показывает как наша система развивается с течением времени по сравнению с ее исходной
структурой. RMSD можно использовать для выявления больших изменений в структуре белка по сравнению с
исходной точкой. Выравнивание или уплощение кривой RMSD указывает на то, что белок достиг равновесия.














 Биология
Биология