Похожие презентации:
Диссоциация оснований, кислот, солей
1.
ДИССОЦИАЦИЯОСНОВАНИЙ, КИСЛОТ,
СОЛЕЙ
2.
В левой части –формула
электролита
Поставить знак
равенства или
обратимости
Проверить
сумму ионов
В правой части –
формулы ионов
Перед формулами
ионов поставить
коэффициенты
3.
Кислоты – это электролиты, при диссоциации которыхобразуются катионы водорода и анионы кислотного остатка
HCl = H+ + ClHNO3 = H+ + NO3H2SO4 = 2H+ + SO42-
HNO2 ⇆ H+ + NO2-
4.
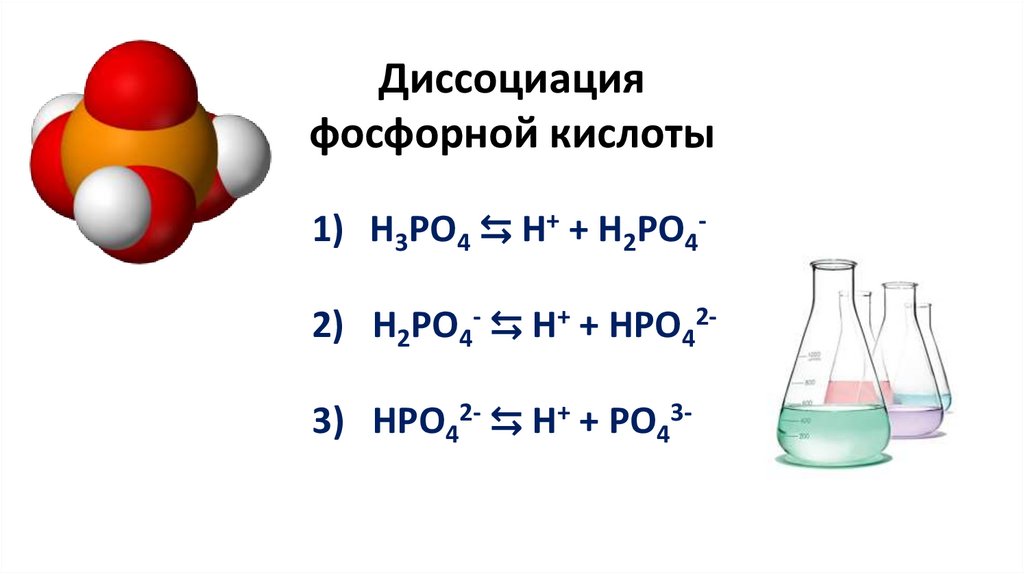
Диссоциацияфосфорной кислоты
1) H3PO4 ⇆ H+ + H2PO42) H2PO4- ⇆ H+ + HPO42-
3) HPO42- ⇆ H+ + PO43-
5.
При диссоциации кислотыобразуют катионы
водорода
Кислоты имеют кислый
вкус
Кислоты изменяют
окраску индикаторов
6.
Основания – это электролиты, при диссоциации которыхобразуются катионы металла и в качестве анионов
гидроксид-ионы
NaOH = Na+ + OH-
1) Cu(OH)2 ⇆ CuOH+ + OH-
Ca(OH)2 = Ca2+ + 2OH-
2) CuOH+ ⇆ Cu2+ + OH-
Свойства оснований: мыльность на ощупь, изменение окраски
индикаторов: лакмус становится синим, метилоранж – жёлтым,
фенолфталеин – малиновым
7.
Соли – это электролиты, при диссоциации которыхобразуются катионы металлов (или аммония) и анионы
кислотного остатка
NaCl = Na+ + ClNH4NO3 = NH4+ + NO3Al2(SO4)3 = 2Al3+ + 3SO42-
8.
(NH4)2SO4NH4+
SO42-
Ион аммония
Сульфат-ион
9.
Диссоциация кислых солейNaHCO3 = Na+ + HCO3HCO3- ⇆ H+ + CO32-








 Химия
Химия








