Похожие презентации:
Введение в направление подготовки. Типы связей в кристаллах
1.
Введение в направление подготовки2.
3.
4.
5.
6.
7.
Типы связей в кристаллахУстойчивость кристаллов и понятие энергии связи
За устойчивость кристаллов отвечает электростатическое взаимодействие между частицами
(атомами, ионами или молекулами), образующими кристалл.
Мерой устойчивости кристаллов является энергия связи – величина, показывающая насколько
уменьшится энергия при образовании из совокупности изолированных атомов кристалла.
Энергия связи
св
U U кр
N
(1.1)
- число частиц (атомов или ионов), образующих кристалл
U - суммарная энергия совокупности изолированных частиц
U кр U U вз -энергия кристалла
N
U вз -энергия взаимодействия частиц
(U <
; 0 соответствует силам притяжения)
вз
Чем больше энергия связи, тем выше устойчивость кристалла
8.
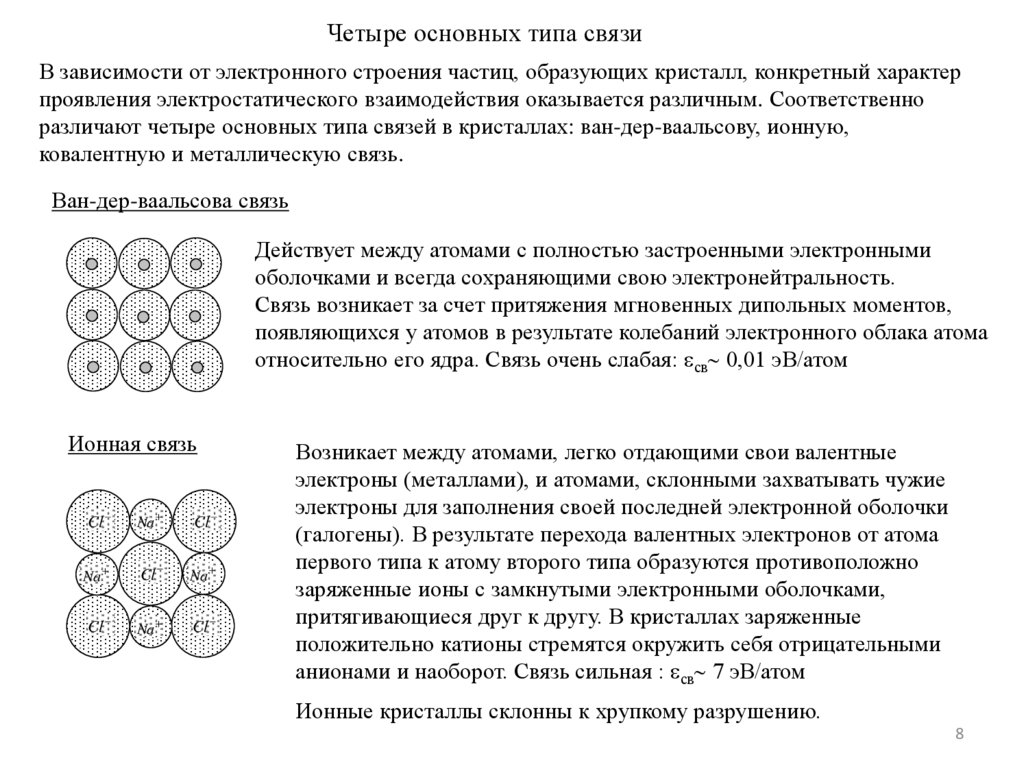
Четыре основных типа связиВ зависимости от электронного строения частиц, образующих кристалл, конкретный характер
проявления электростатического взаимодействия оказывается различным. Соответственно
различают четыре основных типа связей в кристаллах: ван-дер-ваальсову, ионную,
ковалентную и металлическую связь.
Ван-дер-ваальсова связь
Действует между атомами с полностью застроенными электронными
оболочками и всегда сохраняющими свою электронейтральность.
Связь возникает за счет притяжения мгновенных дипольных моментов,
появляющихся у атомов в результате колебаний электронного облака атома
относительно его ядра. Связь очень слабая: св 0,01 эВ/атом
Ионная связь
Cl
Na
Cl
Na
Cl
Na
Cl
Na
Cl
Возникает между атомами, легко отдающими свои валентные
электроны (металлами), и атомами, склонными захватывать чужие
электроны для заполнения своей последней электронной оболочки
(галогены). В результате перехода валентных электронов от атома
первого типа к атому второго типа образуются противоположно
заряженные ионы с замкнутыми электронными оболочками,
притягивающиеся друг к другу. В кристаллах заряженные
положительно катионы стремятся окружить себя отрицательными
анионами и наоборот. Связь сильная : св 7 эВ/атом
Ионные кристаллы склонны к хрупкому разрушению.
8
9.
Ковалентная связьВозникает в результате перекрытия не заполненных до конца
электронных оболочек соседних атомов и обобществления пар
электронов с противоположными спинами. Следствием
обобществления электронов является повышение электронной
плотности в пространстве между ионами и возникновение сил
притяжения соседних ионов к этим областям с повышенной
электронной плотностью. Связь сильная : св 10 эВ/атом
Ковалентная связь насыщена и направлена в пространстве.
Указанные свойства определяют высокую прочность, но
хрупкость ковалентных кристаллов
Металлическая связь
Na
Na
Na
Na
Na
Na
Na
Na
Na
Образуется за счет полного обобществления валентных
электронов всеми ионами кристалла. Обобществленные
электроны заполняют все межионное пространство и достаточно
свободно перемещаются по кристаллу. Таким образом, металл
можно представить в виде ионной решетки, погруженной в газ
обобществленных электронов. Устойчивость металлических
кристаллов обеспечивается притяжением положительно
заряженных ионов к электронному газу. Энергия связи 3-5
эВ/атом
Ненаправленный характер металлической связи обеспечивает
металлам наряду с достаточно высокой прочностью высокую
пластичность, несвойственную кристаллам с другими типами
связей
9
10.
Различают простые и переходные металлы.В простых металлах все внутренние электронные оболочки атомов (ионов) целиком
заполнены.
Примеры: Na (1s22s22p63s1), Al, Cu, Mg
Атомы (ионы) переходных металлов содержат внутренние незаполненные до конца
электронные d-оболочки (вместимость – 10 электронов).
Примеры: Fe (1s22s22p63s23p63d64s2), Cr, Mo, W
При образовании кристалла d-оболочки соседних ионов перекрываются. В результате, в
переходных металлах возникает ковалентная компонента связи, которая обеспечивает:
-более высокую энергию связи;
- более высокие температуры плавления.
Помимо высокой пластичности, металлы обладают следующими уникальными
физическими свойствами:
-обобществленные высокоподвижные электроны (электронный газ) обусловливают
высокую электропроводность и высокую теплопроводность металлов.
-переходные металлы Fe, Co, Ni с нескомпенсированным спиновым магнитным моментом
d-электронов являются ферромагнетиками.
11.
Атомно-кристаллическое строение металловПонятие кристаллической решетки
В кристаллическом состоянии атомы (ионы) металла располагаются в пространстве
периодически, образуя кристаллическую решетку.
Атомный мотив, повторением (трансляцией) которого можно построить весь кристалл,
называется элементарной ячейкой.
Выбор элементарной ячейки неоднозначен (рис.)
а3
a2
a2
а1
а1
Непримитивная
(сложная) ячейка
(два атома на ячейку)
Примитивная
ячейка
(один атом на ячейку)
а2
а1
Трехмерная элементарная
ячейка
Модули базисных векторов элементарной ячейки называются параметрами решетки.
12.
Моно- и поликристаллыМонокристаллы – индивидуальные кристаллические образцы,
во всем объеме которых наблюдается правильная периодичность в расположении атомов.
Поликристаллы – кристаллические образцы, объем которых разбит на микрообласти (зерна) ,
имеющие одинаковую кристаллическую решетку, но по-разному ориентированную в пространстве.
При случайной ориентировке зерен поликристаллы становятся изотропными.
Если зерна поликристалла имеют какую-либо предпочтительную (близкую) ориентировку
в пространстве, то говорят, что поликристалл обладает текстурой . Текстура приводит к анизотропии
свойств поликристалла.
13.
Оптическая микроскопия – метод изучения структуры на микроуровнеМикроструктурой называют строение металла, наблюдаемое при больших увеличениях (с
помощью оптического микроскопа).
Из исследуемого металла изготавливают микрошлиф:
-вырезают небольшой образец и подвергают его шлифовке и полировке;
- травят полированную поверхность.
Происходит избирательное вытравливание границ раздела –
на шлифе образуется микрорельеф.
При наблюдении под микроскопом сильно растворившиеся
участки будут выглядеть более тёмными, а слабее
растворившиеся — более светлыми.
14.
Электронная микроскопия –основной метод изучения дефектов кристаллического строенияЭлектронно-микроскопические изображения кристаллов
с низкой и высокой плотностью дислокаций .
15.
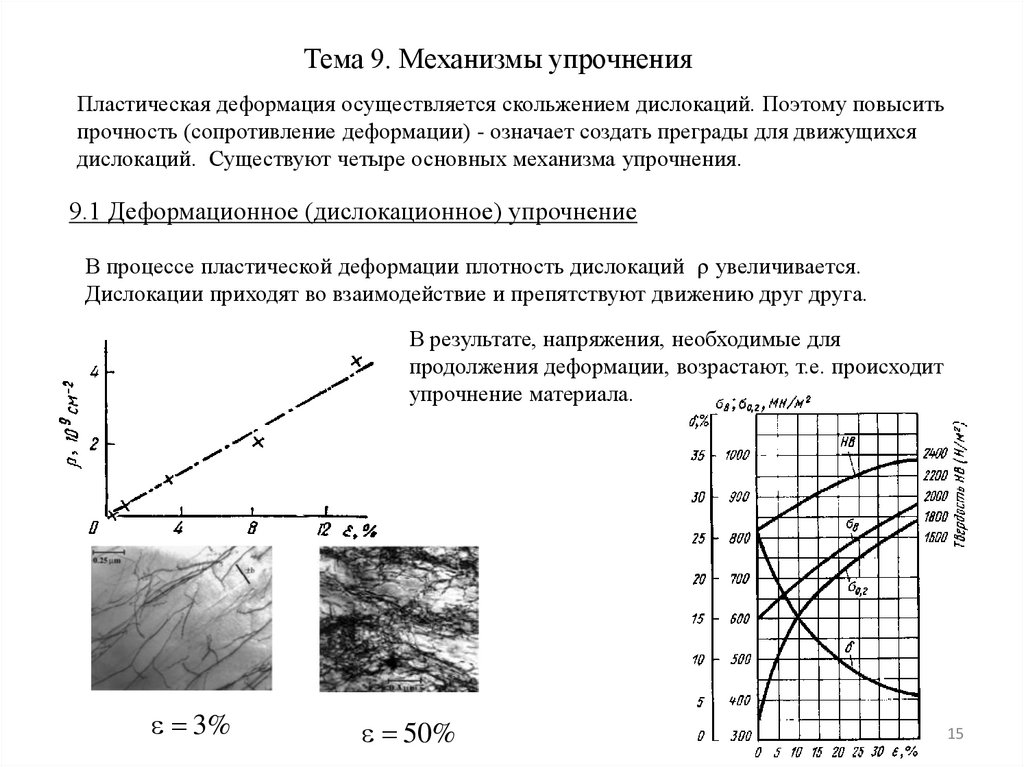
Тема 9. Механизмы упрочненияПластическая деформация осуществляется скольжением дислокаций. Поэтому повысить
прочность (сопротивление деформации) - означает создать преграды для движущихся
дислокаций. Существуют четыре основных механизма упрочнения.
9.1 Деформационное (дислокационное) упрочнение
В процессе пластической деформации плотность дислокаций увеличивается.
Дислокации приходят во взаимодействие и препятствуют движению друг друга.
В результате, напряжения, необходимые для
продолжения деформации, возрастают, т.е. происходит
упрочнение материала.
3%
50%
15
16.
9.2 Твердорастворное упрочнениеВ твёрдых растворах около атомов растворённого элемента создаются области упругих
напряжений. Эти напряжения препятствуют движению дислокаций , то есть вызывают
упрочнение. Упрочнение тем больше, чем большие искажения решётки возникают вокруг
атомов растворённого элемента и чем выше концентрация раствора. При сопоставимой
концентрации упрочнение в твёрдых растворах внедрения намного выше, чем в растворах
замещения.
Упругие искажения
вокруг растворенного атома
Вклад твердорастворного упрочнения
в предел текучести феррита
Атмосферы растворенных
атомов вокруг дислокации
16
17.
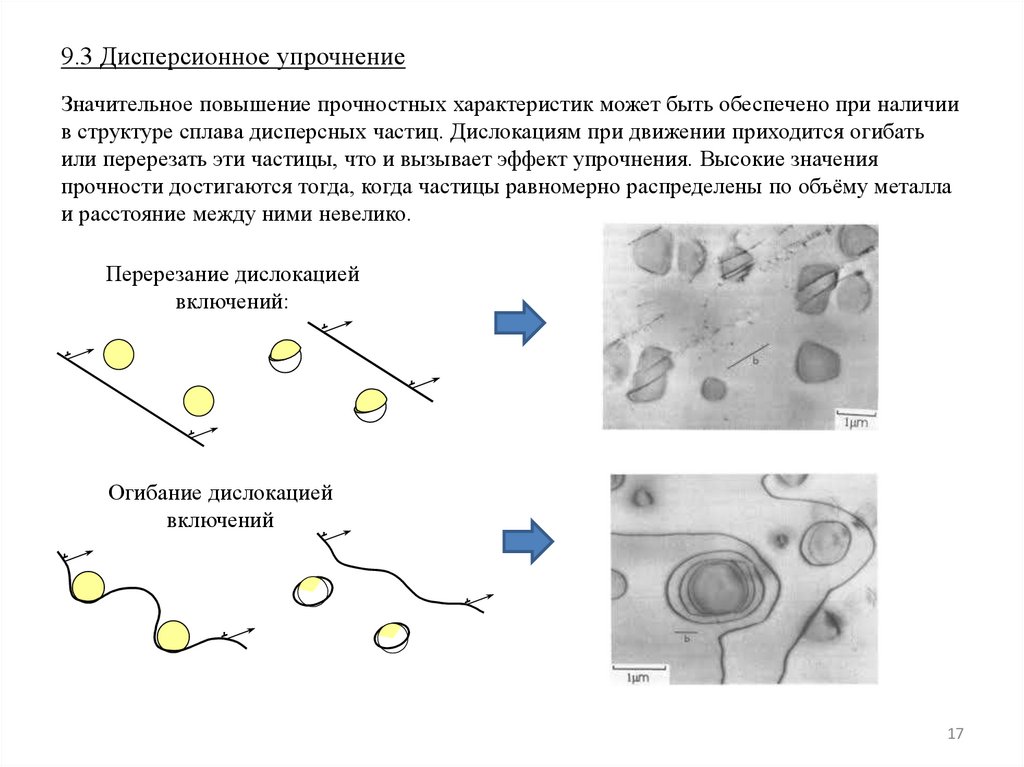
9.3 Дисперсионное упрочнениеЗначительное повышение прочностных характеристик может быть обеспечено при наличии
в структуре сплава дисперсных частиц. Дислокациям при движении приходится огибать
или перерезать эти частицы, что и вызывает эффект упрочнения. Высокие значения
прочности достигаются тогда, когда частицы равномерно распределены по объёму металла
и расстояние между ними невелико.
Перерезание дислокацией
включений:
Огибание дислокацией
включений
17
18.
9.4 Зернограничное упрочнениеГраницы зёрен непроницаемы для дислокаций, что затрудняет передачу сдвига из зерна в зерно.
Поэтому уменьшение размера зерна приводит к росту прочностных характеристик. Зависимость
предела текучести σ0,2 от размера зерна d описывается формулой Холла – Петча:
0,2 0
Зависимость механических свойств от
размера зерна феррита
K
d
Измельчение зерна единственный механизм
упрочнения, который наряду с повышением
прочности увеличивает вязкость и снижает
порог хладноломкости.
Все прочие механизмы упрочнения снижают
вязкость.
18
19.
Тема 10. Особенности деформации при повышенных температурах10.1 Динамический возврат и динамическая рекристаллизация в процессе
горячей деформации
В зависимости от температуры деформирования различают холодную и горячую деформацию.
Для технически чистых металлов пластическая деформация считается холодной, если она
осуществляется ниже 0,3Tпл.
Пластическая деформация при температурах выше (0,6…0,7)Tпл называется горячей
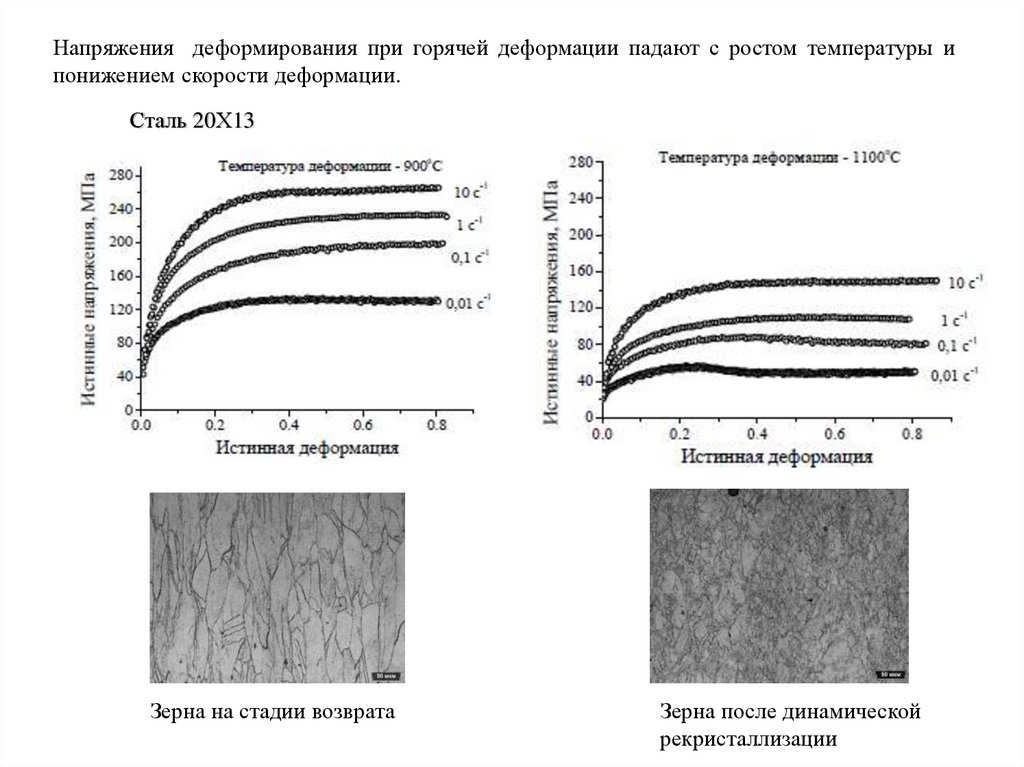
деформацией. Процессы упрочнения при горячей деформации сопровождаются процессами
разупрочнения- динамическим возвратом и динамической рекристаллизацией
На стадии динамического возврата
рост плотности дислокаций сопровождается
их аннигиляцией и перераспределением с
образованием субзеренной структуры.
В результате, начиная с некоторой величины
деформации, устанавливается баланс между
процессами деформационного упрочнения и
динамического разупрочнеия, так что
последующая деформация происходит под
действие постоянных (установившихся)
напряжений
20.
Динамическая рекристаллизация заключается в формировании в процессе деформацииновых зерен с их последующим ростом.
Динамическая рекристаллизация сопровождается падением напряжений до некоторого
установившегося значения.
Динамическая рекристаллизация происходит при относительно высоких температурах и
относительно малых скоростях деформации
21.
10.2 Новый механизм деформации – зернограничное проскальзываниеПри высоких температурах и очень малых скоростях деформации в материалах с мелким зерном
«включается» особый механизм деформации в виде зернограничного скольжения.
Исходное состояние
Как следствие, мелкозернистые материалы проявляют
высокотемпературную сверхпластичность
Зернограничное проскальзывание
22.
10.2 Ползучесть в процессе горячей деформацииПовышение температуры приводит не только к снижению прочностных характеристик —
пределов текучести и прочности. При повышенных температурах возникает также явление,
называемое ползучестью, под которой понимают медленное нарастание пластической
деформации при постоянно действующих напряжениях, меньших предела текучести.
1 –стадия неустановившейся ползучести;
2 – стадия установившейся ползучести;
3 – стадия разрушения
Различают дислокационную и диффузионную ползучесть. Дислокационная связана с
движением дислокаций. При диффузионной ползучести деформация происходит в
результате ориентированного диффузионного перемещения атомов под действием
приложенных напряжений.
23.
Под жаропрочностью понимают способность металлов сопротивляться деформации иразрушению при длительном воздействии нагрузок при повышенных температурах
Основной характеристикой жаропрочности материала является длительная прочность
Предел длительной прочности
t
750
100
50 МПа
означает, что материал выдерживает нагрузку 50 МПа при температуре 750°С без
разрушения в течении 100 ч.
Предел ползучести
750
0,1/1000 50 МПа
означает, напряжение 50 МПа при температуре 750°С за 1000 часов не должно вызвать
остаточной деформации более 0,1 %.
Пути повышения жаропрочности
1) Повышение сил межатомного взаимодействия. за счет легирования. Чем они выше, тем выше
температура плавления , порог рекристаллизации и сопротивление ползучести.
2) Создание структур с дисперсными частицами упрочняющих фаз, затрудняющим движение
дислокаций
3) Использование материалов с крупным зерном , препятствующим зернограничному скольжению,
зарождению пор и трещин и повышающим сопротивление ползучести
24.
Напряжения деформирования при горячей деформации падают с ростом температуры ипонижением скорости деформации.
Сталь 20Х13
Зерна на стадии возврата
Зерна после динамической
рекристаллизации



















 Физика
Физика








