Похожие презентации:
Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2-го і 3-го періодів
1. Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2-го і 3-го періодів.
2.
• Скільки електронів може максимально перебувати на: а)одній атомній орбіталі; б) s-підрівні; в) р-підрівні; г) dпідрівні?
• Дайте визначення принципу найменшої енергії, правила
Хунда, принципу Паулі. Схарактеризуйте їхнє значення для
визначення розподілу електронів в електронній оболонці.
• Що називають «неспареним електроном», «електронною
парою»?
• Чому перший енергетичний рівень заповнюється раніше за
другий?
• Наведіть порядок заповнення електронами підрівнів для
перших чотирьох енергетичних рівнів.
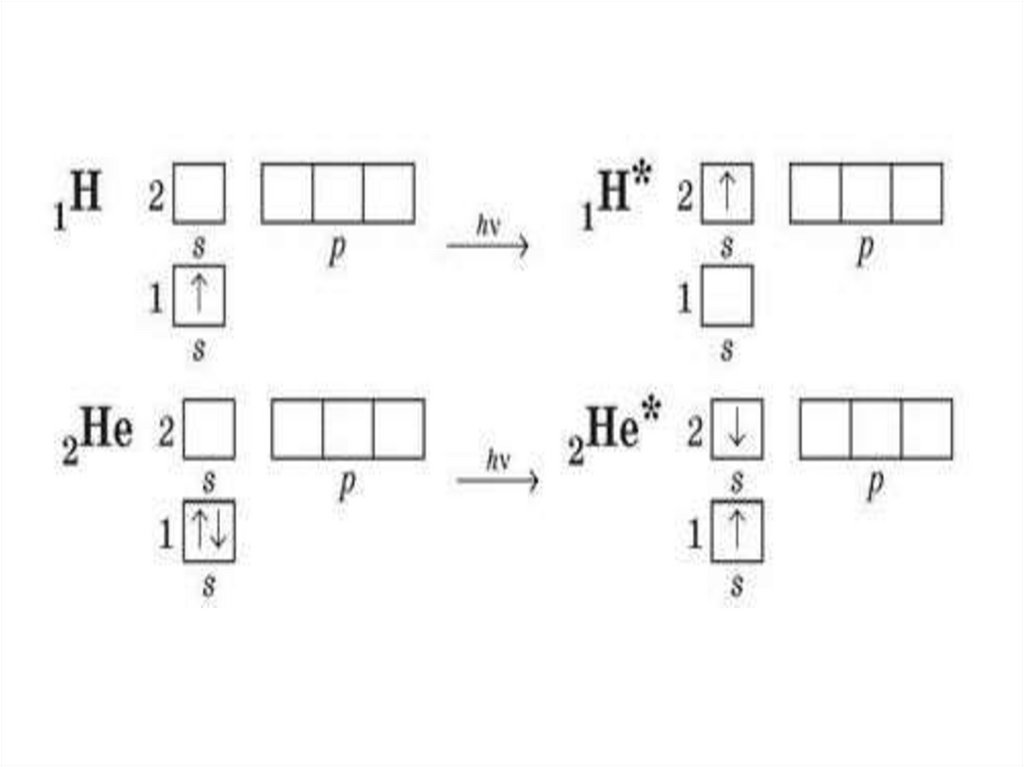
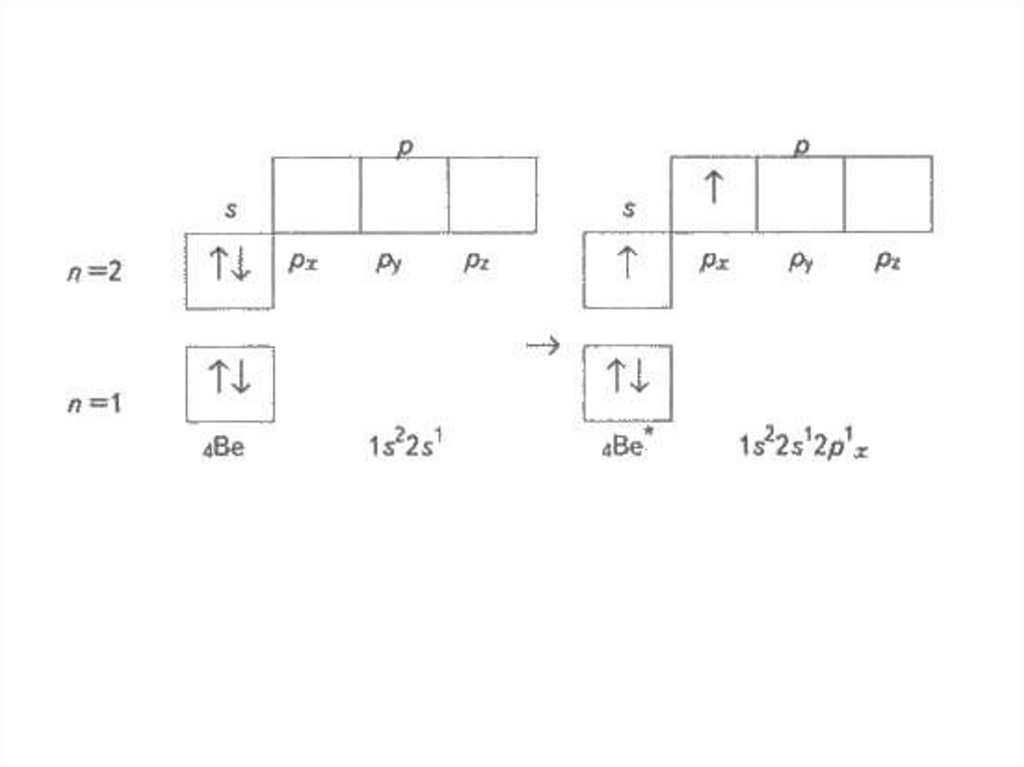
• Чому в атомах Берилію електрони другого енергетичного
рівня перебувають на s-орбіталі, а не на р-орбіталі?
• Скільки енергетичних рівнів зайнято електронами в атомах:
а) Натрію; б) Кальцію; в) Брому?
3. Пригадаємо, що таке:
• Валентність – це властивість атомів одного хімічногоелемента з'єднуватися з певним числом атомів інших
хімічних елементів. Термін походить від лат.
• Ступінь окиснення – це умовний цілочисельний заряд
атома в речовині.
• Електронегативність Здатність атомів елементів відтягувати до себе спільні
електронні пари в хімічних сполуках. ЕН зростає в групах
знизу вгору,а в періодах- зліва направо.
4.
5.
6.
7.
8.
9.
10.
11.
12. Тематичне оцінювання
Кожне завдання оцінюється 0,5 балів.На кожному завданні є пояснення,як його рішати.
Відповідь підтверджувати рішенням.
Слайд №14 – це 1 завдання
13. Приклад рішення 1 завдання Визначте елемент,який містить стільки електронів,скільки і йон магнію. К, Ne, Ca
Йон магнію Mg +2 має 10 електронів, тому щоатом має нульовий заряд,бо в ньому 12
протонів(р+) і 12 електронів (е-).Якщо йон має
заряд +,то в нього переважає кількість
протонів,а якщо заряд -,то переважає кількість
електронів
Розв’язок.
К має 19 електронів( пор. номер)
Ne має 10 електронів( пор. номер)
Са має 20 електронів( пор.номер)
14.
15.
Лжноземельні метали -це елементи ІІгрупи
16.
Відновні властивості зростають зізбільшенням кількості енергетичних
рівнів ( електронних оболонок)
17.
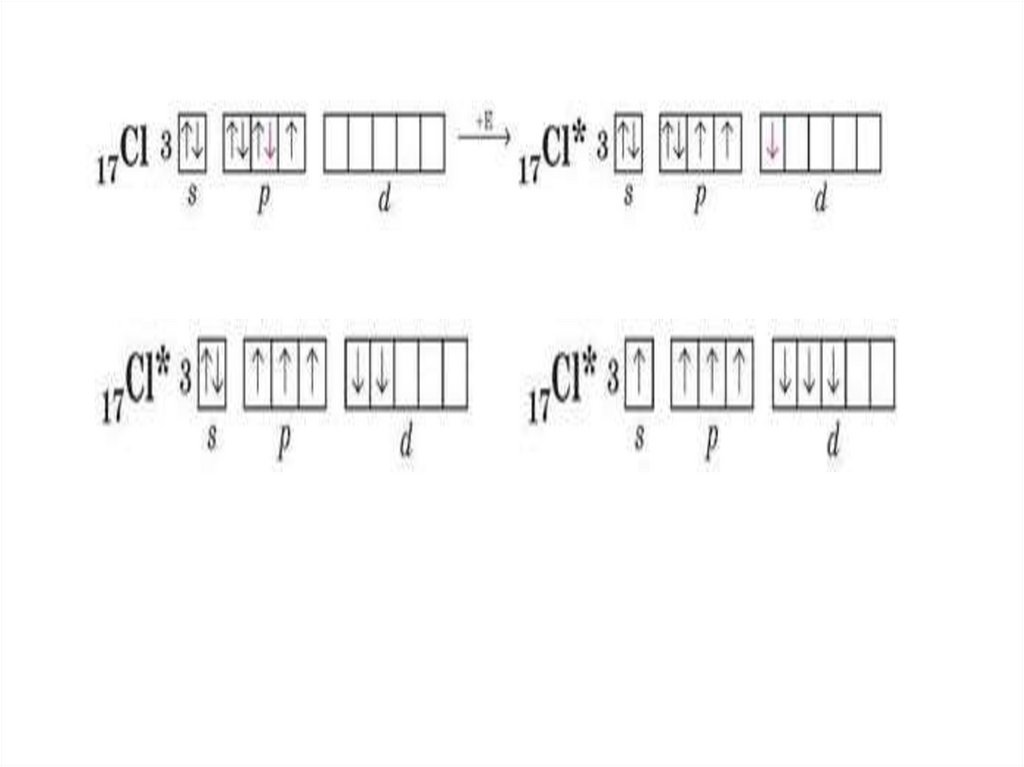
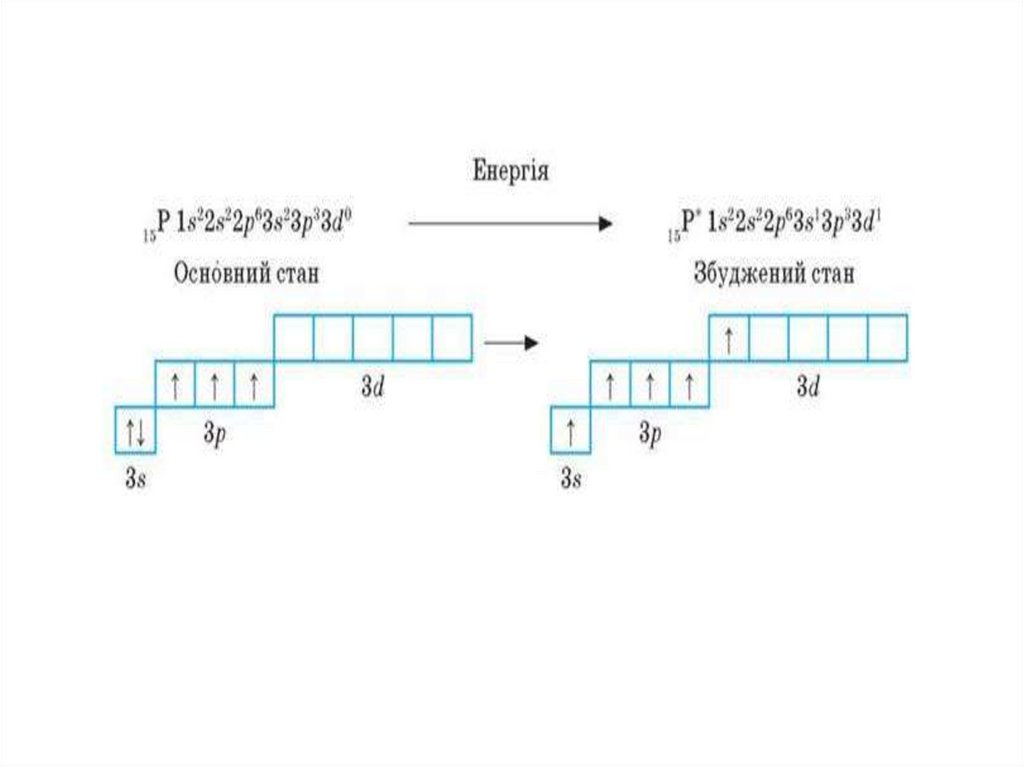
Приклад з карбоном на слайді вище18.
Якщо катіон має заряд +3,значить у йонаелектронів на 3 менше ніж заряд ядра
19.
20.
Кількість електронів на останнійоболонці дорівнює номеру групи,в якій
міститься елемент.
21.
Ізотопи- це нукліди22.
Протонне число- заряд ядра.23.
24.
25.
26.
27.
28.
Чим більше електронів на останнійоболонці,тим сильніше неметалічні
властивості.
29.
D –елементи- блакитні30.
НУКЛО́Н – спільне найменування складових Нейтрон – це елементарна частинка безчастин атомного ядра – протона і нейтрон
електричного заряду, що входить до складу
ядра атома
Прото́н — стабільна позитивно заряджена
елементарна частинка атомного ядра будь-якого
хімічного елемента
Електро́н — стабільна, негативно заряджена
елементарна частинка, що входить до складу
всіх атомів
31.
Якщо йон має заряд +,то в нього переважаєкількість протонів,а якщо заряд -,то
переважає кількість електронів
32.
Нуклонне число A можна знайти черезвизначення, A = Z + N, де Z є протонне
число, а N — нейтронне число ядра.






























 Химия
Химия








