Похожие презентации:
Н. Бордун атому
1. Н.Бордун атому Доц.Др. Тамара Карашева
2. Резерфорддун тажрыйбасы
Тажрыйбада альфа бөлүкчөлөрдүн басымдуу бөлүгүалтын фольгадан өткөндө
багытын байкаларлык өзгөртпөгөнүн, ал эми айрымдары(20000ден бири) 135-150
градуска бурулуп кеткени
байкалды.
Мындай өзгөрүүнүн себеби
электрондор боло алмак эмес.
Демек, атомдун борборунда
массивдүү оң заряддуу ядро
бар деген жыйынтык
чыгарылат.
3. Планеталык модель
Резерфорд 1911-жылы атомдун планеталык моделин сунуштаган. Алатомдун бардык массасы бир бөлүкчөгө топтолгон оң заряддуу
ядродон жана анын айланасында айланган терс заряддуу
электрондордон турат деп корутундулаган. Атом өзүнүн түзүлүшү
боюнча Күн системасын элестеткендиктен, мындай модель атомдун
планеталык модели же ядролук модели деп аталган.
Планеталык модель ачылгандан кийин атомдогу электрондордун
санынан алардын химиялык касиеттери көз каранды экендиги
аныкталып, Меделеевдин мезгилдүү таблицасынын тууралагы
тастыкталды.
Бирок бул модель атомдун туруктуулугун түшүндүрө алган эмес,
анткени тынымсыз нурданган электрон акырында ядрого кулап
түшмөк.
Атом нурданткан спектр туташ болмок.
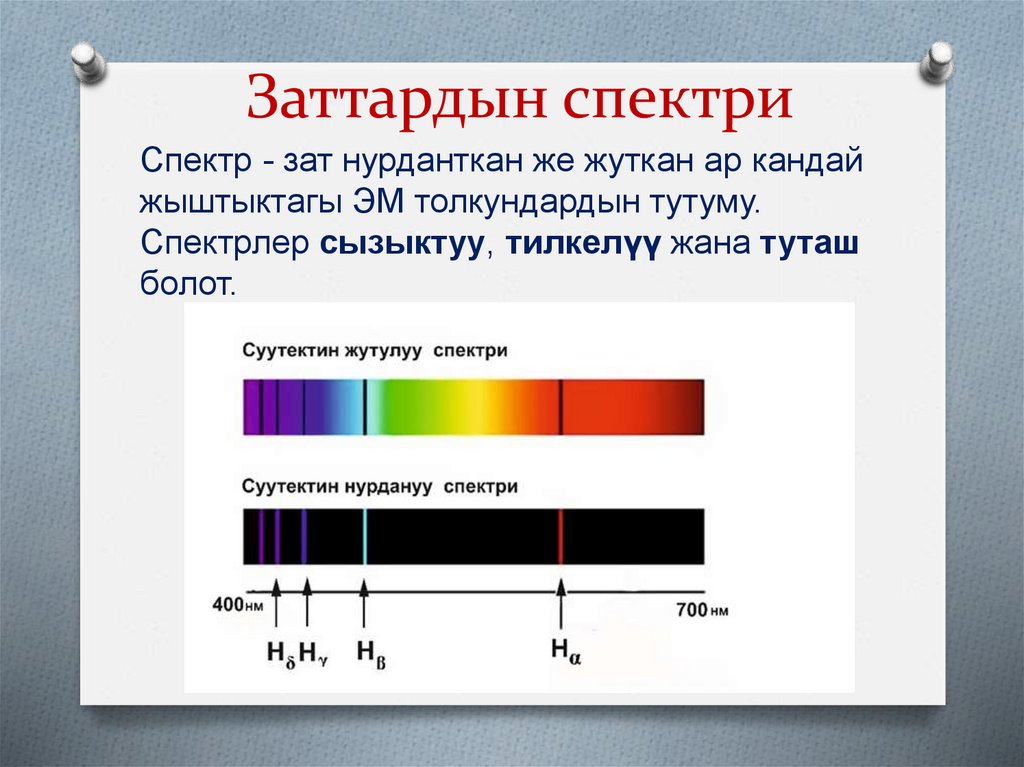
4. Заттардын спектри
Спектр - зат нурданткан же жуткан ар кандайжыштыктагы ЭМ толкундардын тутуму.
Спектрлер сызыктуу, тилкелүү жана туташ
болот.
5.
6. Бальмердин формуласы
Бальмер суутектин көзгө көрүнгөн диапозондогуспектрин мүнөздөгөн эмпирикалык формуланы
тапкан.
R = 3,29·1015c-1
R’ = 1,1·107 м-1
R =R’c
7. Бордун модели
1913 – жылы Нильс Бор атомдун алгачкыкванттык моделин сунуштайт. Н.Бор жарык
кванттары
тууралуу
М.Планктын
гипотезасына таянып, атомдун түзүлүшү
боюнча идеяларын эки постулат түрүндө
келтирет.
1-постулат. Электрон ядронун айланасында
кыймылдоого
мүмкүн
болгон
көптөгөн
орбиталардын
ичинен
белгилүү
(стационардык) орбиталар боюнча гана
кыймылдай алат. Атом стационардык абалда
болгондо
энергияны
нурдантпайт
жана
жутпайт.
2-постулат.
Атомдогу
электрондун
бир
стационардык абалдан экинчисине өтүшү
энергиянын hν квантын бөлүп чыгаруу же
жутуу менен коштолот. hν =Em-En
Бордун модели суутек атому үчүн гана так натыйжаларды берген.
Бор алгачкылардан болуп атомдогу энергиянын квантталуусун киргизген, бирок
электрондун кыймылына көз карашы классикалык бойдон кала берген.
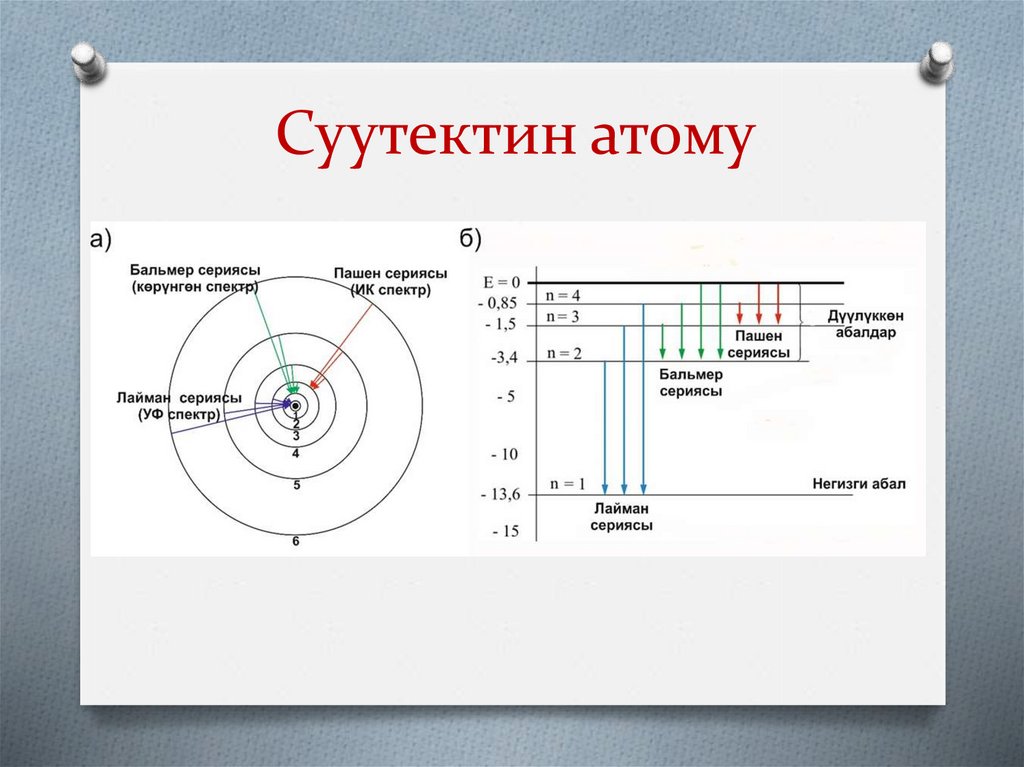
8. Суутектин атому
9.
10.
Бор стационардык орбиталардын болушунтүшүндүрө алган эмес.
Аны кийинчерээк Де-Бройль түшүндүргөн. ДеБройльдин идеясы боюнча стационардык
орбита болушу үчүн, анын узундугуна бүтүн
сан жарым толкун узундук туура келиши керек.
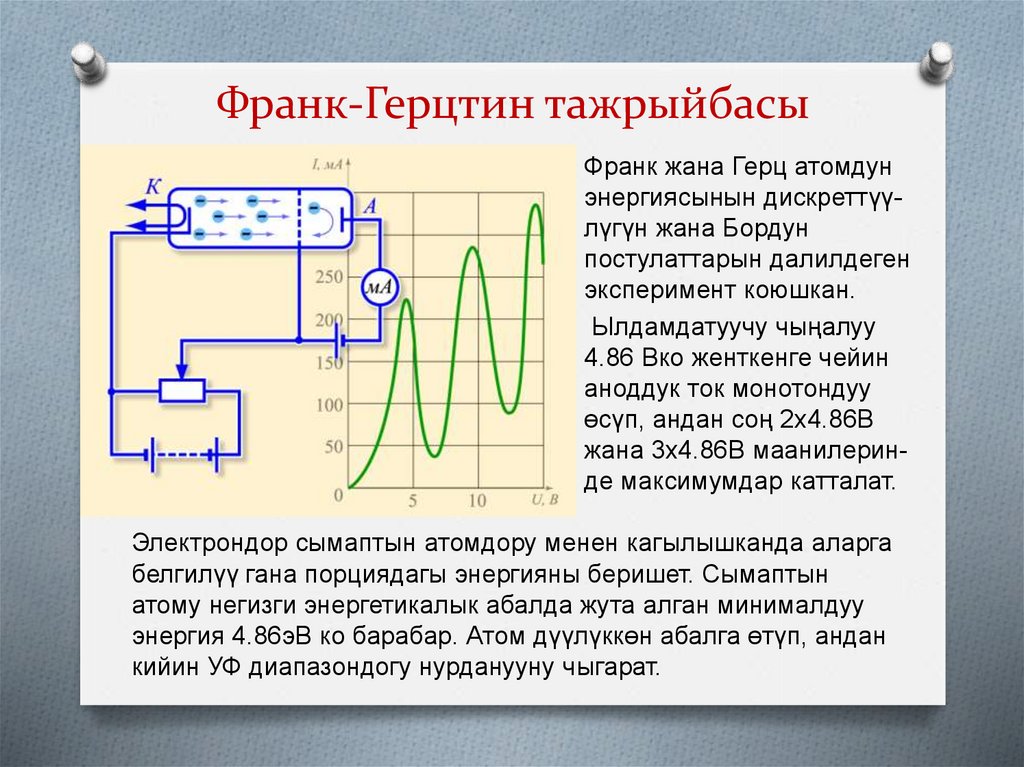
11. Франк-Герцтин тажрыйбасы
Франк жана Герц атомдунэнергиясынын дискреттүүлүгүн жана Бордун
постулаттарын далилдеген
эксперимент коюшкан.
Ылдамдатуучу чыңалуу
4.86 Вко женткенге чейин
аноддук ток монотондуу
өсүп, андан соң 2х4.86В
жана 3х4.86В маанилеринде максимумдар катталат.
Электрондор сымаптын атомдору менен кагылышканда аларга
белгилүү гана порциядагы энергияны беришет. Сымаптын
атому негизги энергетикалык абалда жута алган минималдуу
энергия 4.86эВ ко барабар. Атом дүүлүккөн абалга өтүп, андан
кийин УФ диапазондогу нурданууну чыгарат.
12. Корутунду
O Бордун теориясы атомдук физиканынөнүгүшүнө чоң салым кошту.
O Бирок, бул теория бир эле убакытта
классикалык физиканын закондоруна жана
кванттык постулаттарга таянган.
O Спектралдык сызыктардын интенсивдүүлүгүн
жана атомдордо тигил же бул өтүштөрдүн
себебин түшүндүрө алган эмес.
O Суутектен кийинки эле элемент гелий
атомунун спектрин мүнөздөй алган эмес.
13.
Көңүл бурганыңыздарүчүн чоң рахмат!










 Физика
Физика



