Похожие презентации:
Классификация веществ
1.
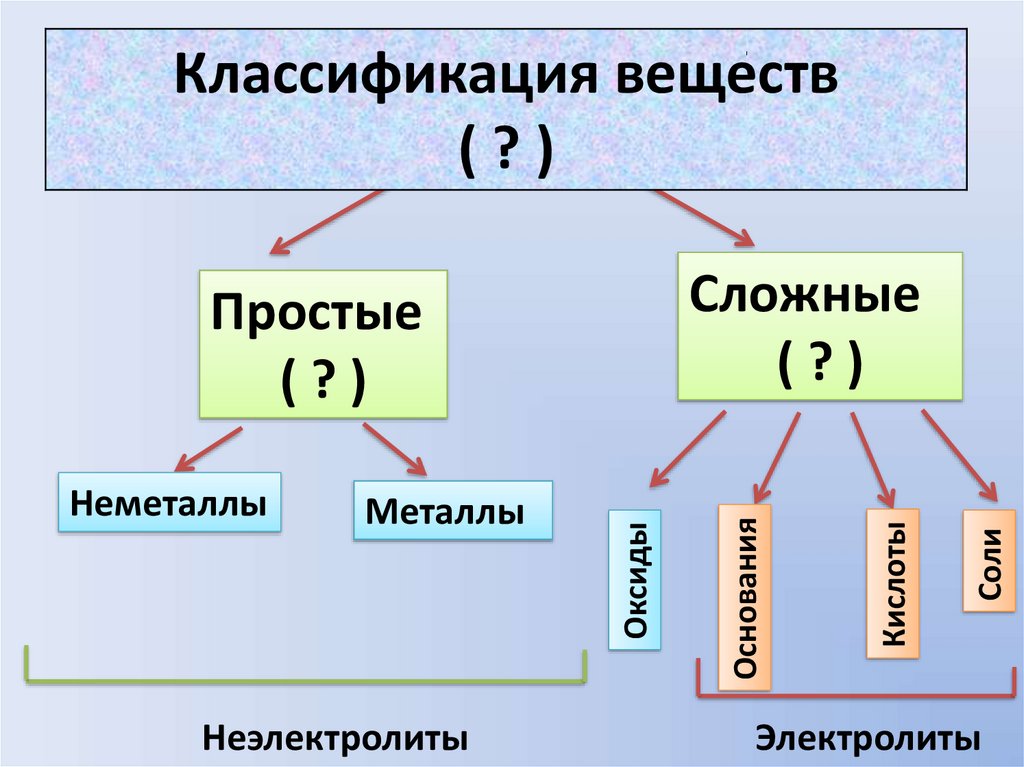
Классификация веществКлассификация
веществ
( по
( ?….?)
)
Неэлектролиты
Соли
Кислоты
Металлы
Оксиды
Неметаллы
Основания
Сложные
((??) )
Простые
Простые
(( ?? ))
Электролиты
2.
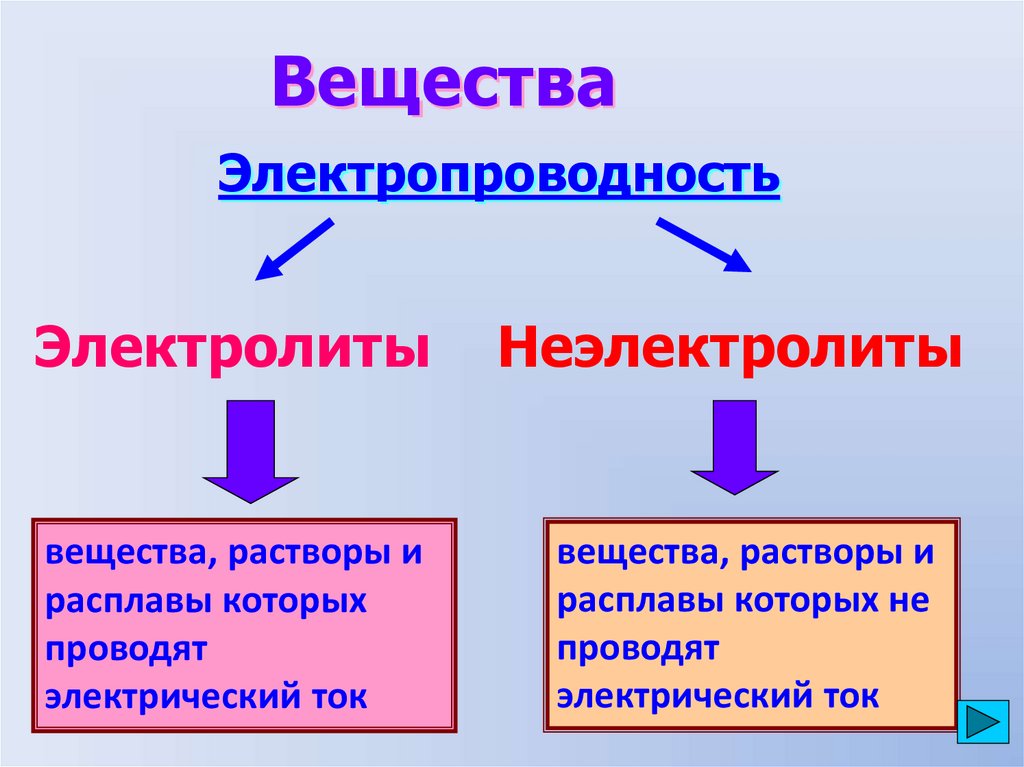
ВеществаЭлектропроводность
Электролиты
вещества, растворы и
расплавы которых
проводят
электрический ток
Неэлектролиты
вещества, растворы и
расплавы которых не
проводят
электрический ток
3.
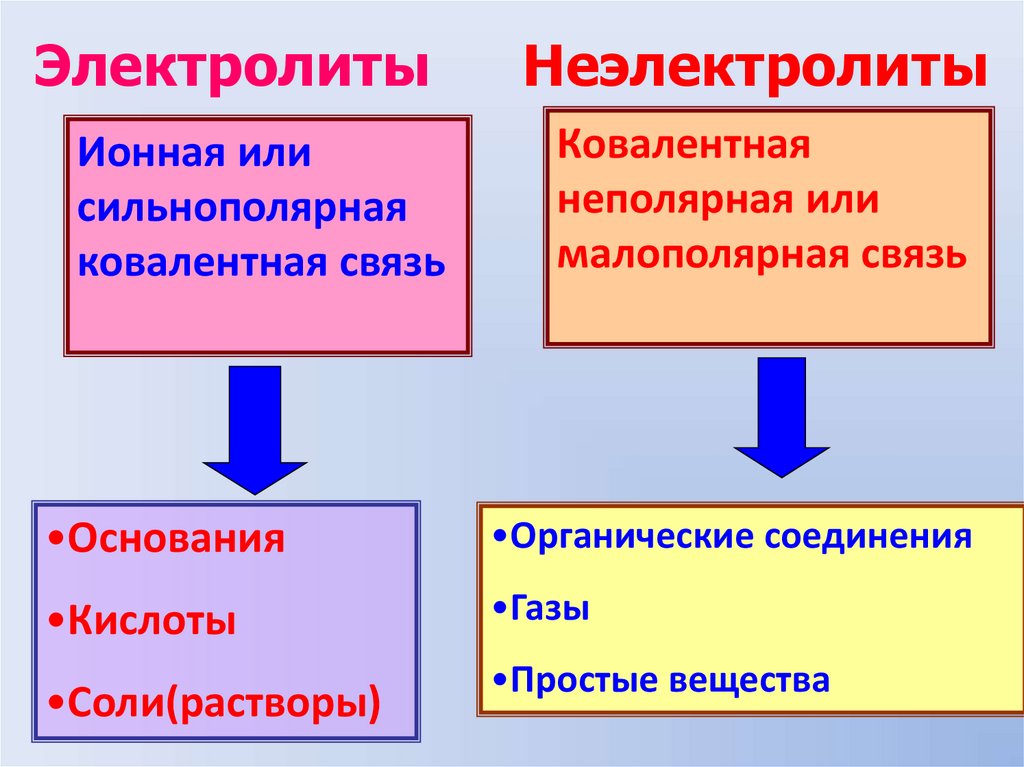
ЭлектролитыИонная или
сильнополярная
ковалентная связь
Неэлектролиты
Ковалентная
неполярная или
малополярная связь
•Основания
•Органические соединения
•Кислоты
•Газы
•Соли(растворы)
•Простые вещества
4.
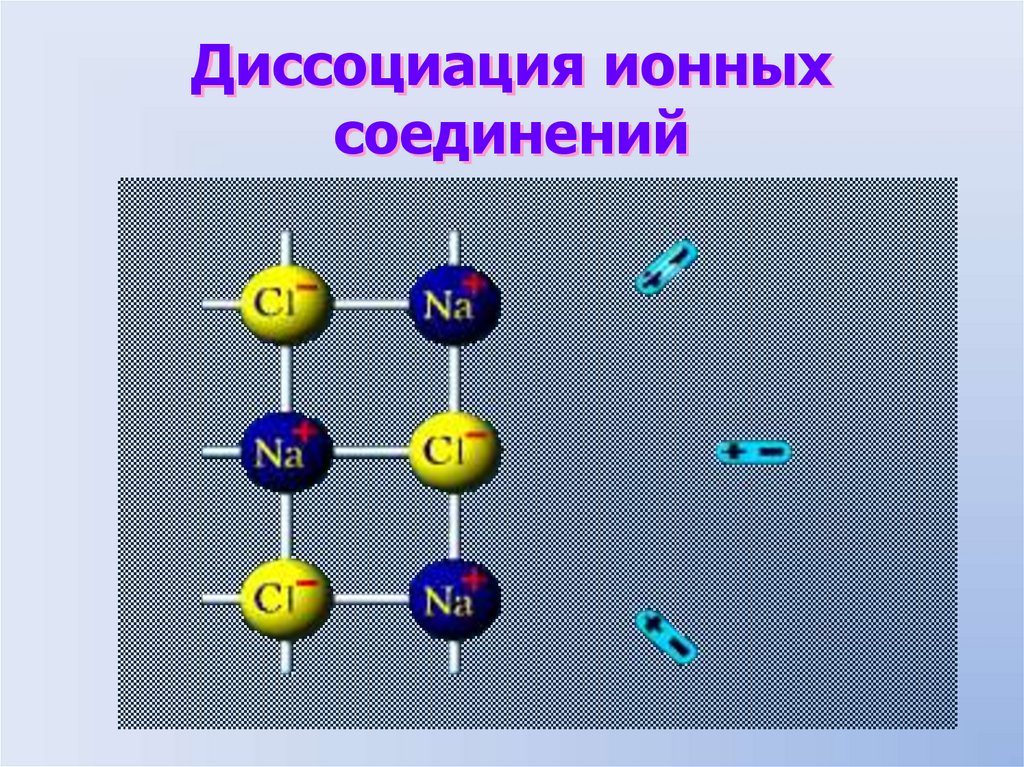
Диссоциация ионныхсоединений
5.
Диссоциация соединений сковалентной полярной
связью
6.
ЭЛЕКТРОЛИТЫЭлектролиты
α ›30%
К+ⁿА-ṁ →К+ⁿ
(p) – соли
(p) -основания
H2SO4, HNO3,
HCI и другие
+
α ‹3%
А-ṁ
+
-ṁ
→
+
К ⁿА
Кⁿ
(н) – соли
(н) –основания
Н2CO3, H2SO3, H2S,
H2SiO3
H2O
NH4OH
-ṁ
А
7.
Приложение 1Me(OH)m
Me
m+
-
+ nOH
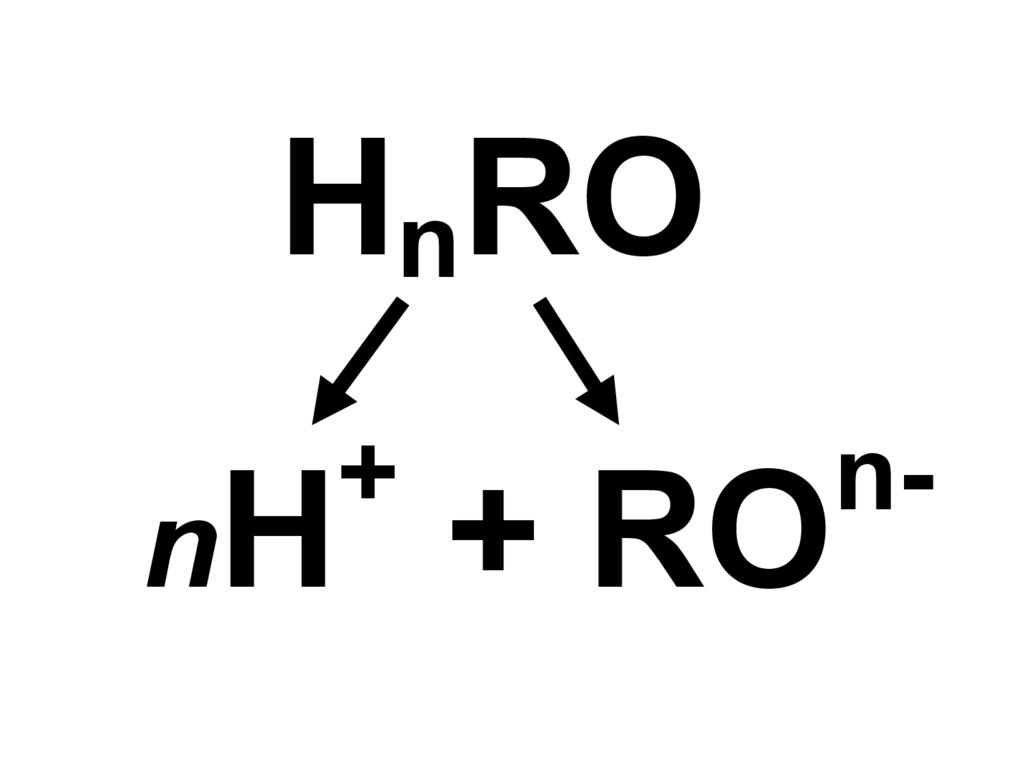
8.
HnRO+
nH
+ RO
n-
9.
лакмусметилоранж
фенолфталеин
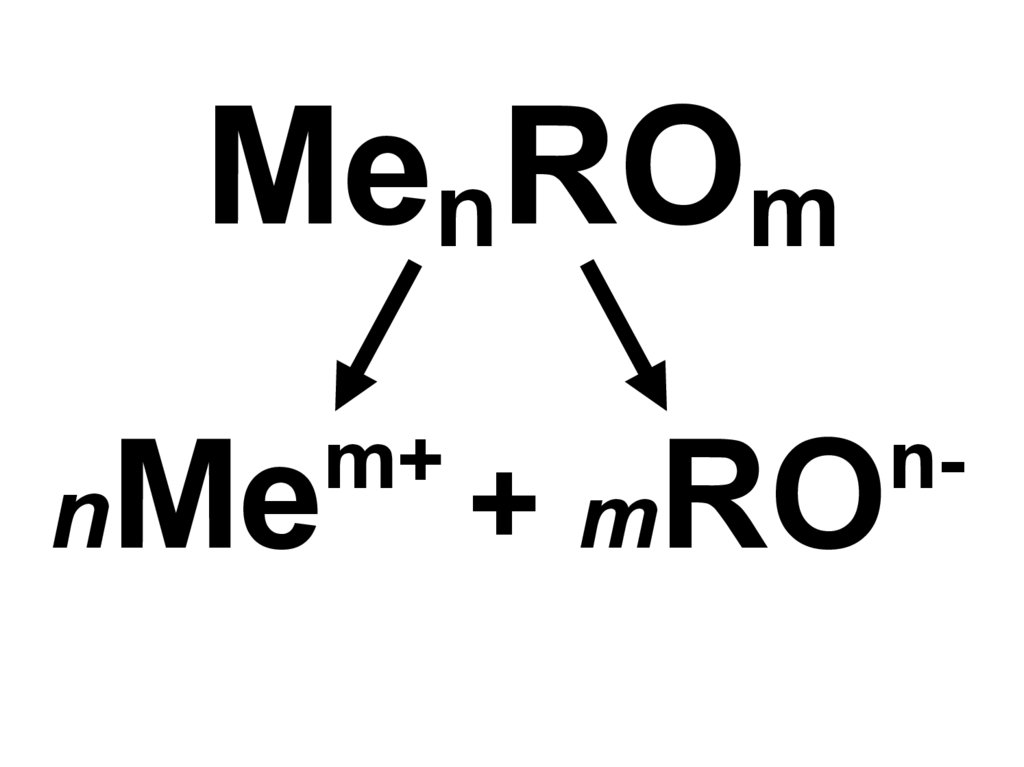
10.
MenROmnMe
m+
+ mRO
n-
11.
О2Ca(OH)2
H2 O
Mg(NO3)2
NaCl
Al(NO3)3
Na2CO3
CO2
K2SO4
CuCl2
AgCl
FeCl3
CaCO3
BaSO4
NaNO3
SО3
H2SO4
Cu(OH)2
K2S
NaOH
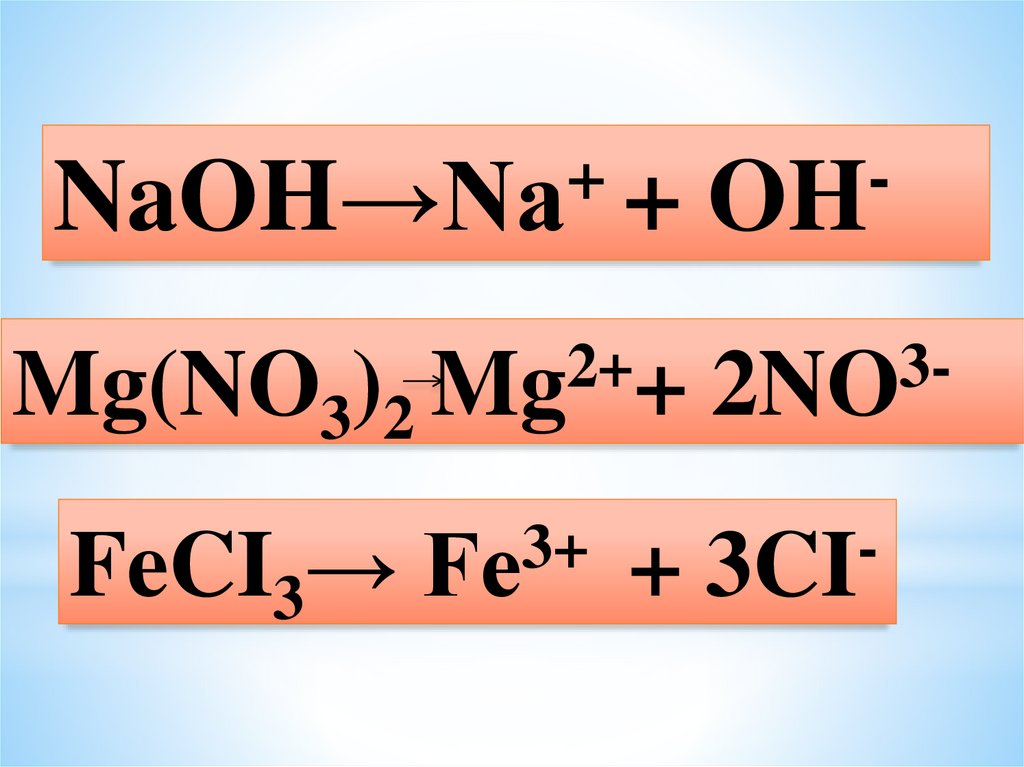
12.
+NaOH→Na +
Mg(NO3)2
FeCI3→
OH
2+
Mg +
32NO
3+
Fe
3CI
+
13.
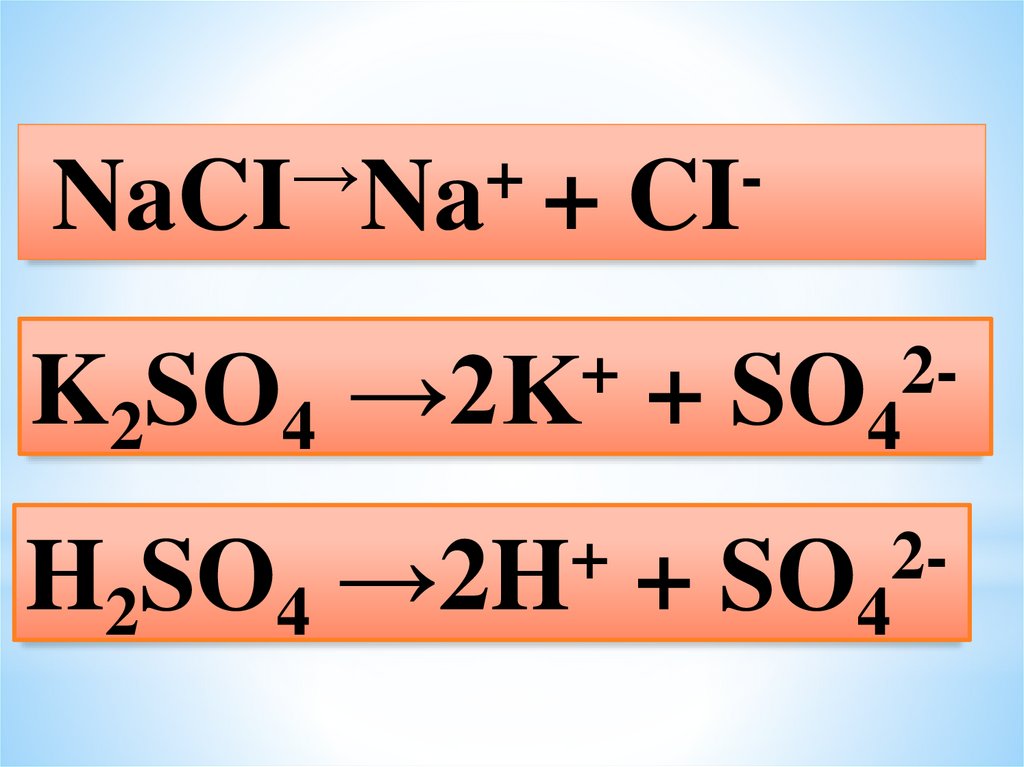
→+
NaCI Na +
K2SO4
+
→2K
H2SO4
+
→2H
CI
2-
+ SO4
+ SO4
2-
14.
Ca(OH)2→ Ca2+ +
AI(NO3)3
CuCI2 →
→AI3+ +
2+
Cu +
2(OH)
3(NO3
2CI
)
15.
Вещества слабые электролиты:CaCO3 BaSO4 Cu(OH)2 AgCI
H2O
Вещества неэлектролиты:
CO2 SO3 О2
16.
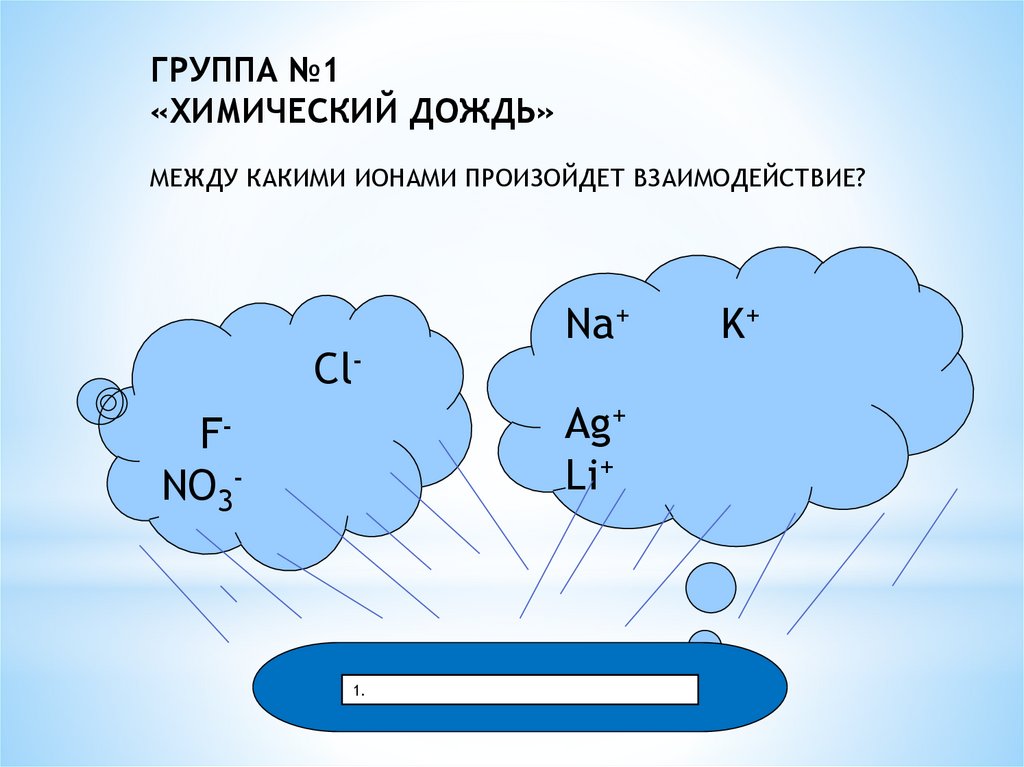
ГРУППА №1«ХИМИЧЕСКИЙ ДОЖДЬ»
МЕЖДУ КАКИМИ ИОНАМИ ПРОИЗОЙДЕТ ВЗАИМОДЕЙСТВИЕ?
Cl-
Na+
Ag+
Li+
FNO3-
1.
K+
17.
Ag++
CI
→ AgCI
18.
ГРУППА №3«ХИМИЧЕСКИЙ АКВАРИУМ»
ВОЗМОЖНО ЛИ ОДНОВРЕМЕННОЕ ПРИСУТСТВИЕ В РАСТВОРЕ
УКАЗАННЫХ ИОНОВ?
19.
3Ag++
3PO4
→ Ag3PO4
20.
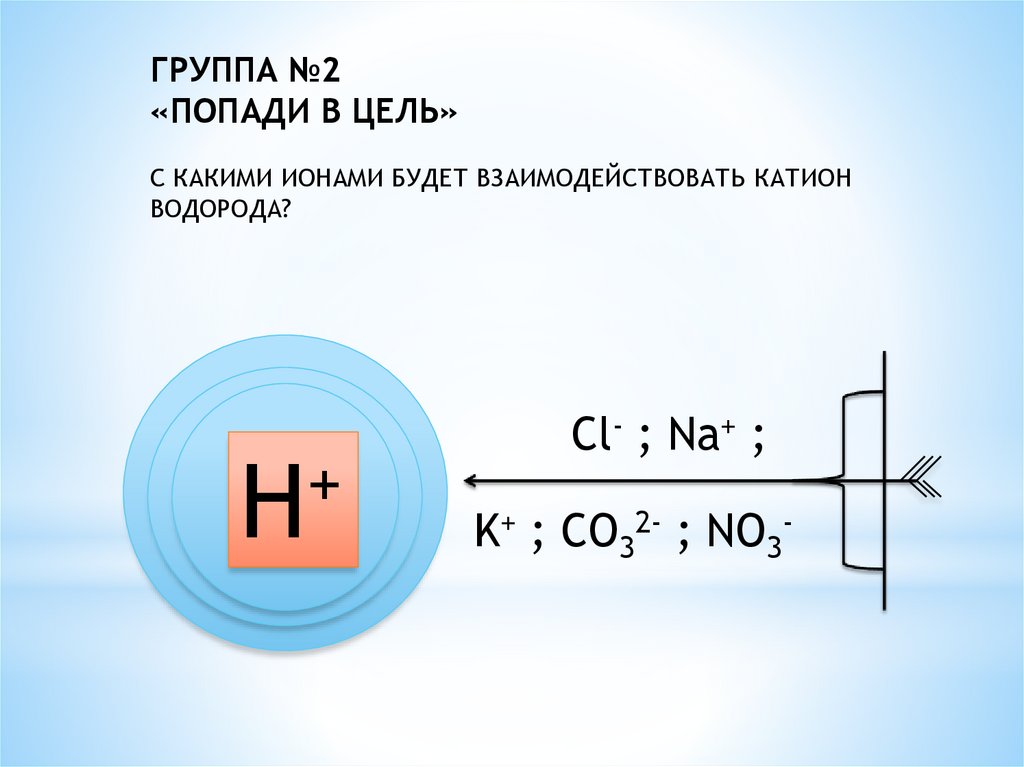
ГРУППА №2«ПОПАДИ В ЦЕЛЬ»
С КАКИМИ ИОНАМИ БУДЕТ ВЗАИМОДЕЙСТВОВАТЬ КАТИОН
ВОДОРОДА?
+
Н
Cl- ; Na+ ;
K+ ; CO32- ; NO3-
21.
H2O2
+
H
+ CO3
2-
H2CO3
CO2
22.
23.
Тема урока:Реакции ионного
обмена в растворах
электролитов
24.
Эпиграф к уроку –Электролитическая диссоциация
оказалась применимой и
полезной во всех областях
современной науки
Сванте Аррениус
25.
1. K2CO3 + H2SO4 ?2. Mg + HCI ?
3. Na2SO4 + Ba(NO3)2 ?
4. Zn(OH)2 ?
5. NaOH + HCI ?
26.
Появление осадка;Выделение газа;
Выделение (или поглощение) энергии;
Изменение цвета;
Появление запаха.
27.
Инструктаж по техникебезопасности:
Запрещается использовать посуду,
имеющую трещины и отбитые края.
28.
Осторожно: кислоты и щёлочи – едкиевещества.
Разрушают
ткани,
раздражают кожу, слизистые оболочки.
29.
После завершения работытщательно помыть руки с мылом
под проточной водой.
30.
Тема:Условия протекания реакций ионного
обмена.
I. Если образуется осадок.
2+ - + 2Na
+ BaCl
Na+2SO42- BaSO4 + 2Na
Ba
2Cl
2 NaCl
2Cl
2
Ba2+ +
+ SO42- BaSO4
+
+
+
+
2+
+
Mg(NO
Na+2CO3 2- MgCO3 + 22Na
NaNO
Mg2NO
2NO
3)2 + 2Na
3
Mg2++
+ CO32- MgCO3 +
+
+
+
31.
Тема:Условия протекания реакций ионного
обмена.
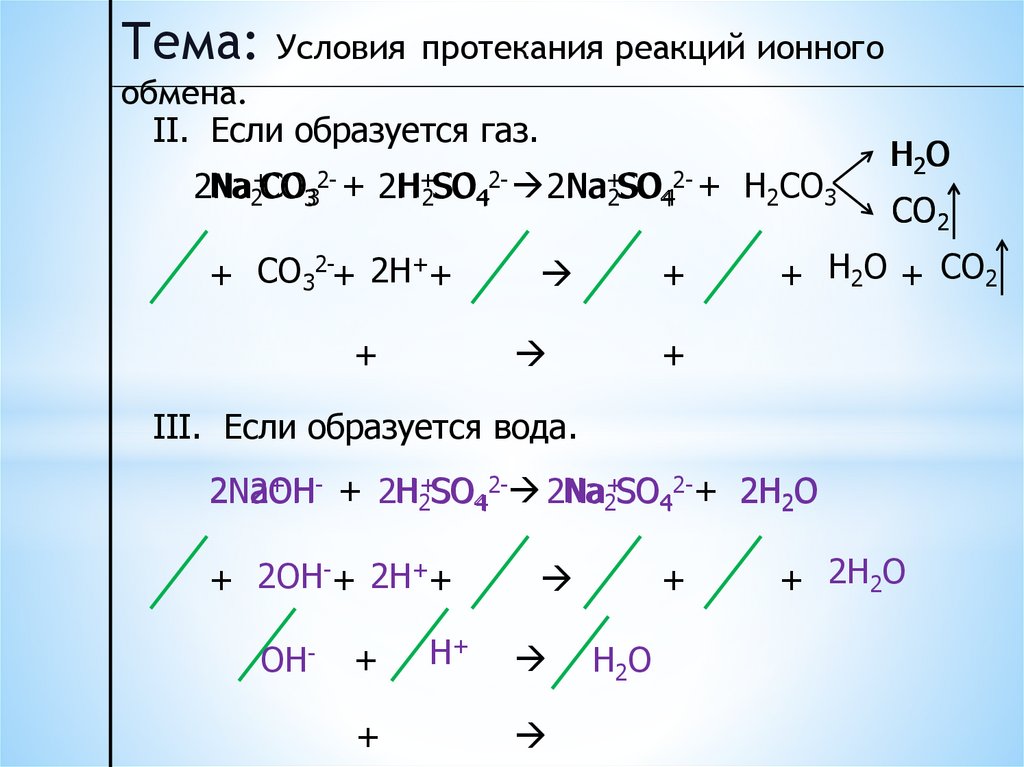
II. Если образуется газ.
Na2+CO332- + 2H
H+2SO42- 2Na
Na+2SO442- + H2CO3
2Na
+ CO32-+ 2H++
+
+
H2 O
CO2
+ H2O + CO2
+
III. Если образуется вода.
+ - + 2H
2NaOH
H2+SO4 2- 2Na
Na2+SO42-+ 2H2O
2Na
2OH
+ 2OH-+ 2H++
OH-
+
+
H+
+
H2O
+ 2H2O
32.
Выводы:1. РИО – это реакции между растворами электролитов,
при которых они обмениваются своими ионами.
2. Реакции в водных растворах электролитов являются
реакциями между ионами, и поэтому их изображают в
виде ионных уравнений.
3. РИО практически необратимо протекают только в
том случае, если в результате образуется осадок, газ
или малодиссоциирующее вещество (вода).
33.
Значение реакций ионногообмена
широко распространены в живой и неживой природе:
- образование осадочных пород (гипс, известняк, другие соли),
-появление камней в почках животных и человека;
- обменные процессы в живых организмах протекают в растворах;
широко используются в практических целях:
- для осаждения ионов, приносящих существенный вред людям и
животным. К таким относят, в первую очередь, катионы тяжёлых
металлов (кадмий, ртуть, свинец, сурьма), которые попадают в
сточные воды с промышленных производств;
-для очистки питьевой воды, для ее умягчения;
- для проведения качественных реакций (распознавания веществ);
- в медицине.
34.
ЗадачиЗадача 1.
В сточных водах гальванического цеха химического завода
обнаружены катионыFe3+, Ni2+ и анионы Cl-, SO42-. Как с
помощью реакций ионного обмена можно очистить эти
стоки?
Задача 2.
Предложите ионные реакции для очистки сточных вод
автотранспортного предприятия от катионов Pb2+ и
Cu2+, оказывающих токсическое действие на живые
организмы.
35.
заданиеС какими веществами может
реагировать фосфорная кислота,
образуя а) газ; б) воду; в) осадок?
Запишите уравнения реакций в
молекулярном, полном и
сокращённом ионном видах.
36.
37.
Домашнее задание: прочитать§ 9 стр. 36 (упр.3) стр. 37
(упр.4, задачи 5,6)


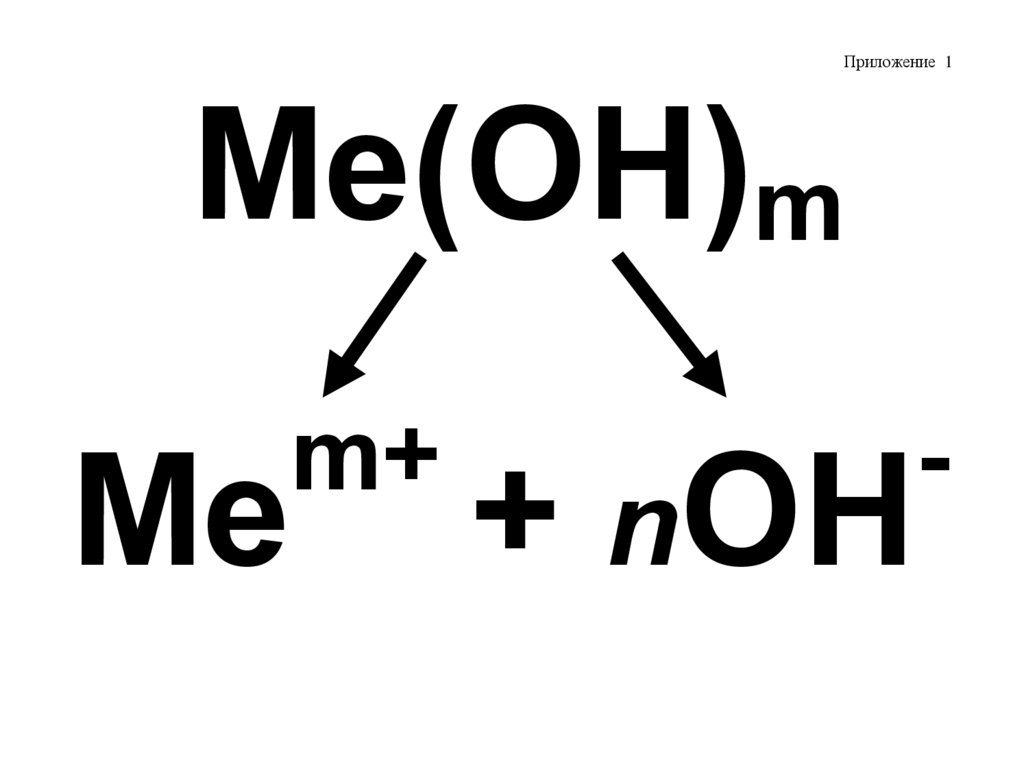



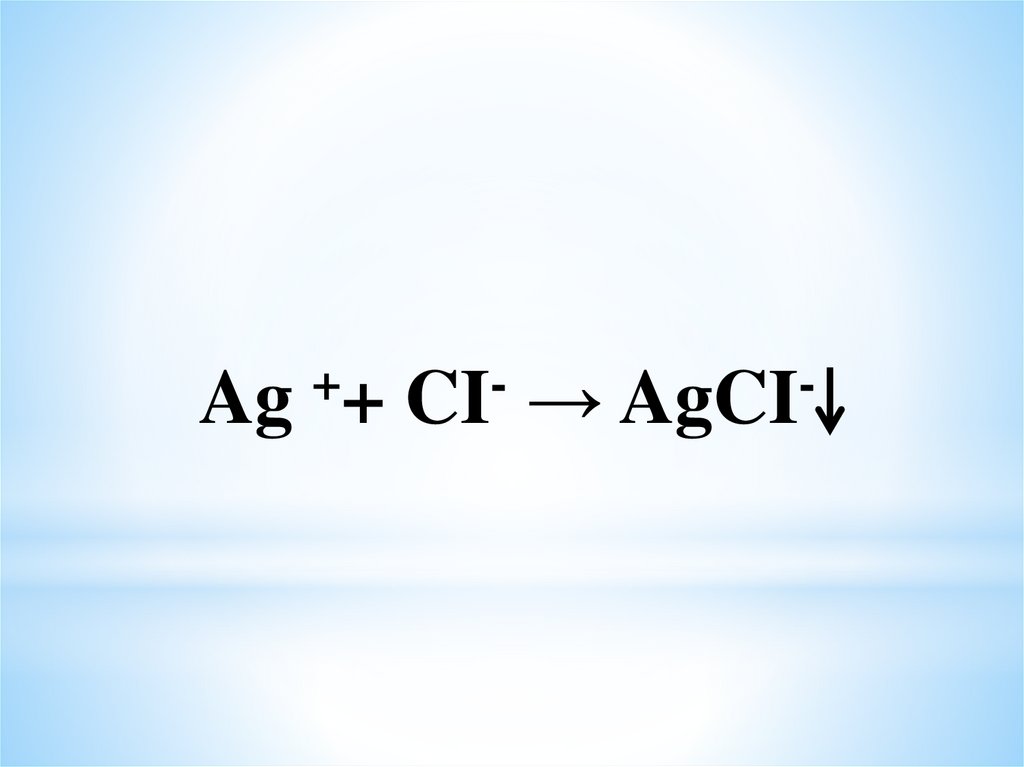

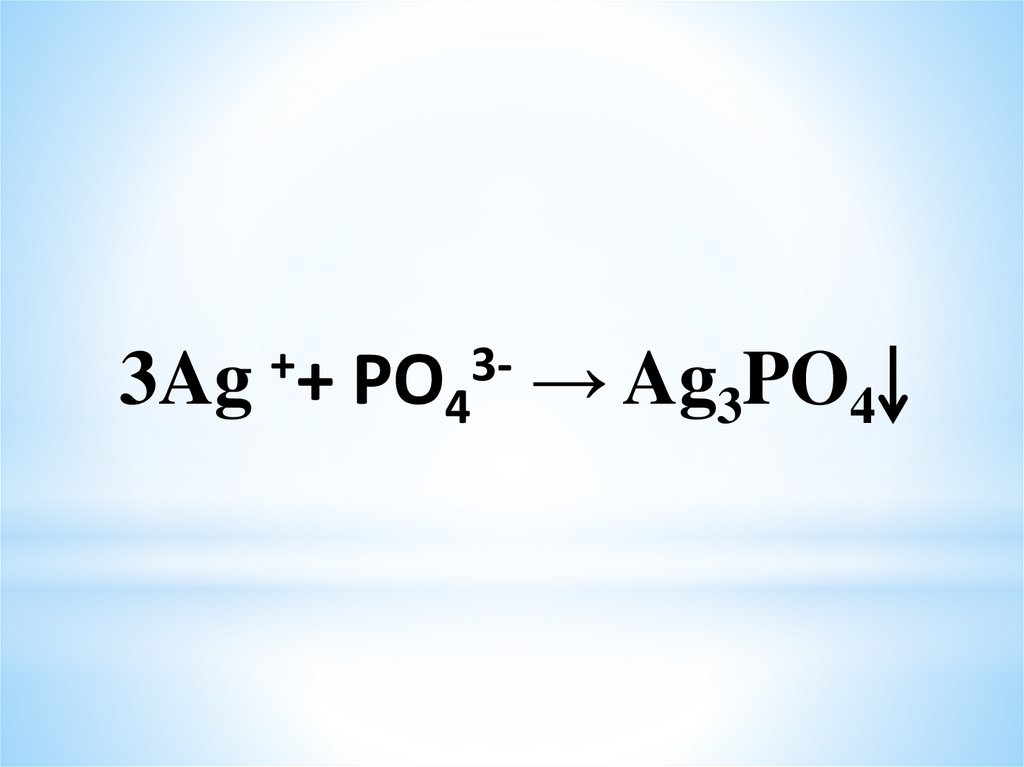



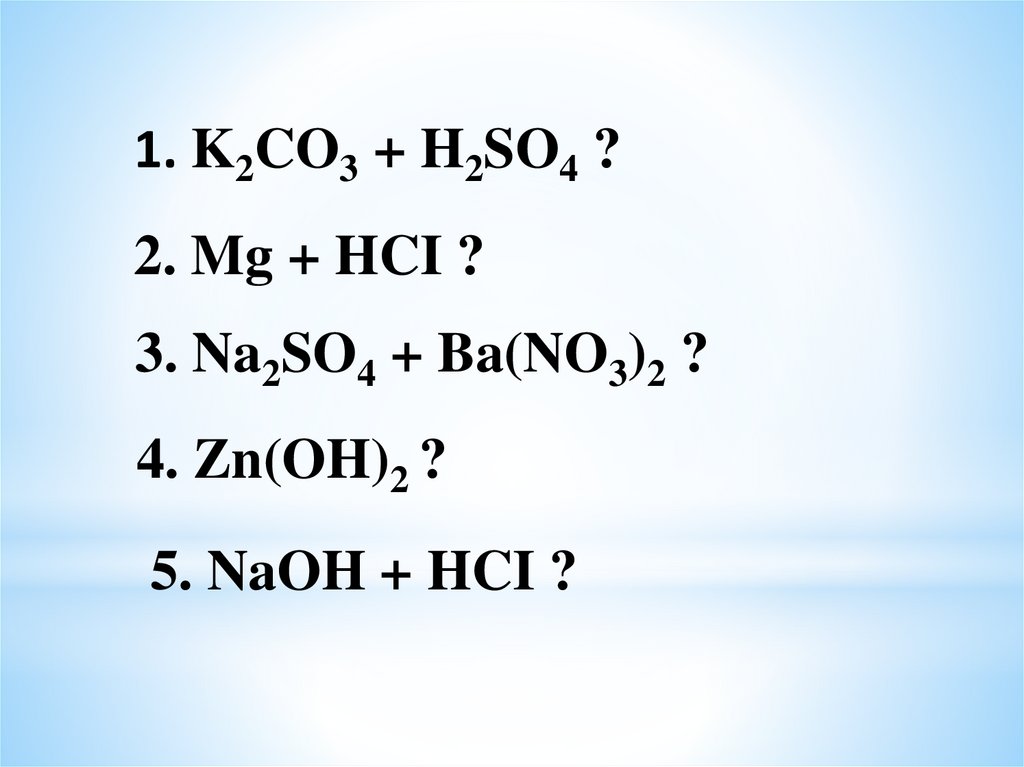











 Химия
Химия








