Похожие презентации:
Азотная кислота. История. Строение молекулы, получение, физические и химические свойства, реакции, цвет индикаторов, применение
1.
история. строение молекулы,получение, физические и химические
свойства, реакции, цвет индикаторов,
применение
Выполнила учитель химии МАОУ СОШ д.Орех
2.
История азотной кислотыАзотная кислота имеет длинную историю,
восходящую к 9 веку. Впервые получил её
алхимик Гебер.
В 1658 году Иоган Рудольф Глаубер получил
концентрированную кислоту.
В1776 году Антуан_Лоран-Лавуазье доказал
наличие кислорода в кислоте.
Жозеф Луи Гей-Люссак определил формулу
кислоты.
3.
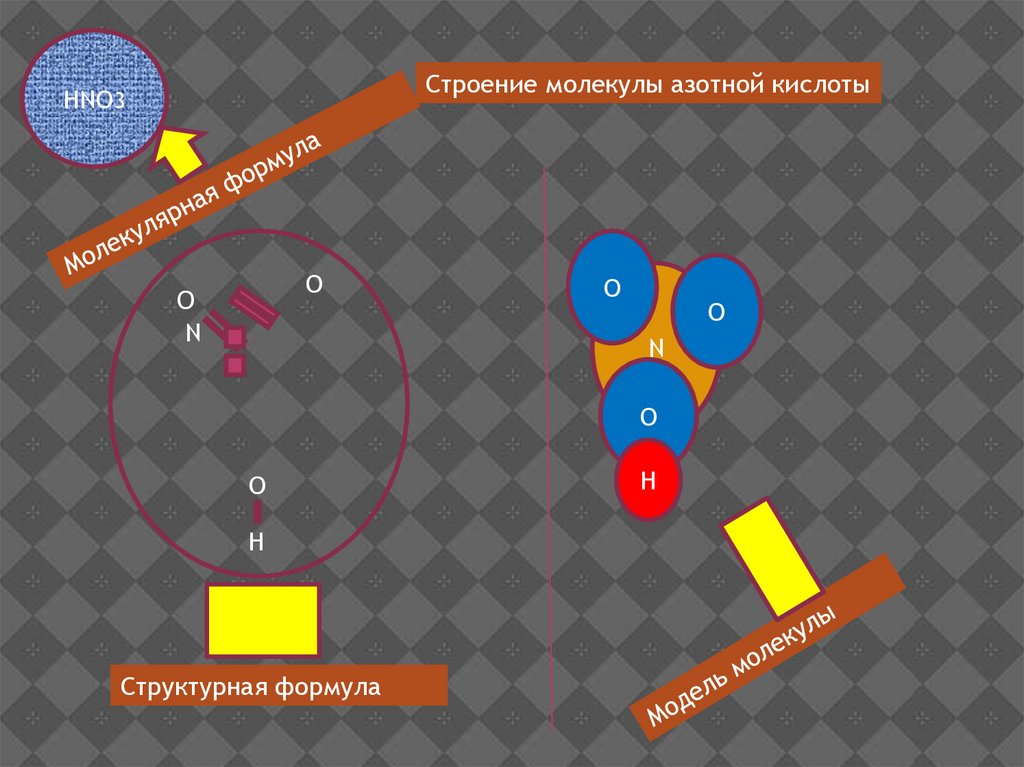
Строение молекулы азотной кислотыHNO3
O
O
N
O
O
N
O
O
H
Структурная формула
H
4.
Получение азотной кислоты1. из N2O5 и 2H2O :
N2O5+2H2O =2 HNO3
2. из NO2 ,O2 и H2O:
4 NO2 +O2 + H2O= 4 HNO3
3. в лаборатории HNO3 получают при
воздействии на её соли(нитраты)
концентрированной серной кислотой
4. HNO3 образуется в воздухе( из азота,
кислорода и воды) при электрических
разрядах .Она вместе с дождём попадает на
землю в виде разбавленного раствора.
5.
свойства HNO3Физические
бесцветная жидкость
смешивается в любых
соотношениях с водой
«дымит» на воздухе
Т пл. = -41,590С
Т кип = 830С
Р=1,52г/см3
Химические
Химические
сильный окислитель,
окислитель,
сильный
реагирует со
со всеми
всеми
реагирует
металлами, стоящими
стоящими вв
металлами,
вытеснительном ряду
ряду до
до ии
вытеснительном
после водорода.
водорода. При
При этом
этом
после
выделяются NH3,
NH3, N2O,
N2O, NO2
NO2
выделяются
,NO
,NO
Cu+8HNO3(разб. )=
)=
33 Cu+8HNO3(разб.
Cu(NO3)2 +2NO+4
+2NO+4 H2O
H2O
33 Cu(NO3)2
Cu+4HNO3(конц.)=Cu(NO3)2
Cu+4HNO3(конц.)=Cu(NO3)2
+ 2NO2
+2NO2
H2O
+2+2
H2O
6.
Реакции азотной кислотыС белками
(КСАНТОПРОТЕИНОВАЯ
РЕАКЦИЯ)
ИСПОЛЬЗУЕТСЯ ДЛЯ
ИДЕНТИФИКАЦИИ БЕЛКОВ
ПРИ ВОЗДЕЙСТВИИ HNO3
СУБСТАНЦИИ,
СОДЕРЖАЩИЕ БЕЛКИ
ПРИОБРЕТАЮТ
ХАРАКТЕРНЫЙ
ЖЁЛТЫЙ ИЛИ
ОРАНЖЕВЫЙ ЦВЕТ
С МЕДЬЮ
Cu+4HNO3(КОНЦ. )=
Cu(NO3)2+NO2+2H2O
ПРОДУКТ
ВОССТАНОВЛЕНИЯ
ЗАВИСИТ ОТ
КОНЦЕНТРАЦИИ КИСЛОТЫ
И УСЛОИЙ ПРОВЕДЕНИЯ
РЕАКЦИИ
7.
Цвет индикаторов в HNO3Под действием HNO3индикаторы
приобретают те же цвета, что и остальные
кислоты
Окраска индикатора
Название
В
В
индикатора нейтральной щелочной
среде
среде
В
кислотной
среде
лакмус
фиолетовая
Синяя
Красная
Метиловый
оранжевый
Оранжевая
Желтая
Краснорозовая
Фенолфталеин
Бесцветная
Малиновая
Бесцветная
8.
Применение HNO3применяется в
различных отраслях
промышленности
HNO3
Производство
Пластиков
Красителей
Удобрений
Лекарств
Взрывчатых веществ
9.
Соли азотной кислотыНитраты.
Их получают при действии кислоты на
металлы, их оксиды и гидроксиды
Нитраты натрия, кальция и аммония
3
называются селитрами.
Все их применяют
как азотные удобрения
Почти все нитраты хорошо растворимы а
воде.
При нагревании они разлагаются с
выделением кислорода.
10.
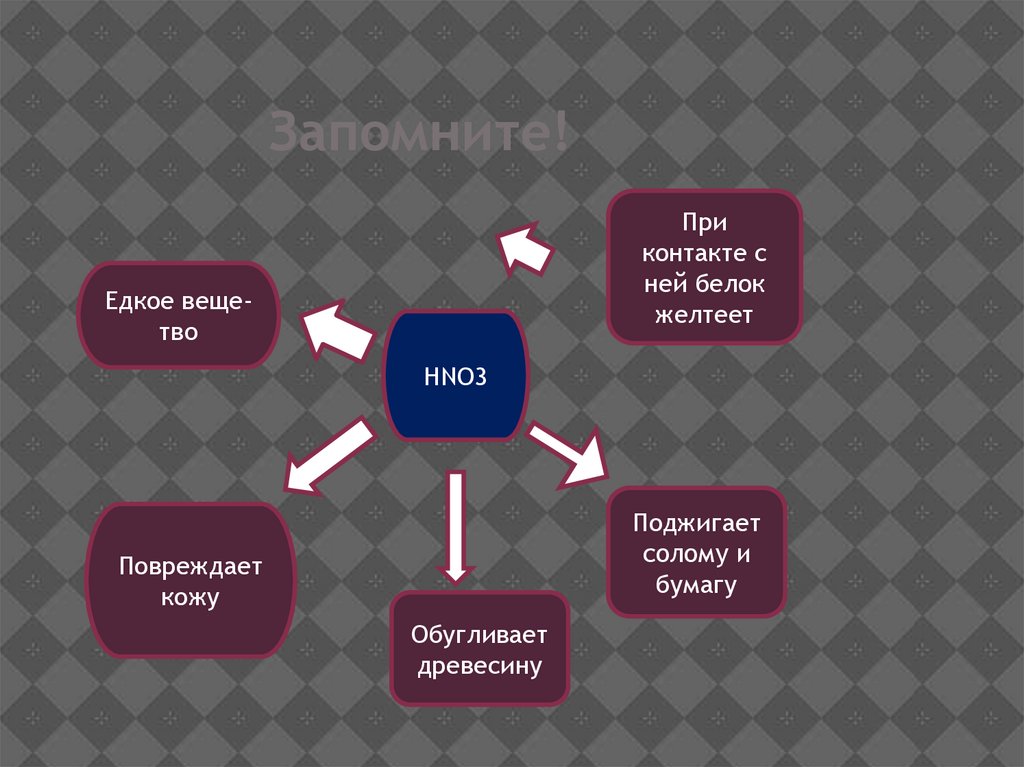
Запомните!При
контакте с
ней белок
желтеет
Едкое вещетво
HNO3
Поджигает
солому и
бумагу
Повреждает
кожу
Обугливает
древесину








 Химия
Химия








