Похожие презентации:
Ионная связь
1. ИОННАЯ СВЯЗЬ
2.
ИОННАЯ СВЯЗЬ – тип сильной химической связи, энергия которой определяетсяпочти исключительно кулоновскими (электростатическими) силами притяжения
между ионами противоположного знака. Возникает в молекуле между атомами с
большой разницей электроотрицательностей (более 1.7 по шкале Полинга), при
которой общая электронная пара почти полностью переходит к атому с большей
электрооотрицательностью: при этом образуются положительно и отрицательно
заряженные ионы – катионы и анионы, которые притягиваются друг к другу.
Классическим примером
образования ионной связи
является хлорид натрия
NaCl - известная всем
поваренная соль.
3.
Ионная связь рассматривается как частный случай поляризации сильнополярной ковалентной связи и образуется между типичными металлами
и неметаллами.
На самом деле полной передачи электрона от одного участника
химической связи другому не происходит, т.к. отрыв электрона от атома
характеризуется энергией ионизации, а присоединение электрона к атому
– сродством к электрону. При этом, энергия ионизации всегда больше
сродства к электрону. В этой связи вводится понятие «степени ионности»
связи. Так, для хлорида натрия NaCl степень ионности связи составляет
94%, а для фторида цезия CsF 97 %. Т.е., любая ионная связь носит
частично ионный и частично ковалентный характер.
Тем не менее, рассмотрение ионной связи как чисто электростатического
взаимодействия между разноименно заряженными ионами удобно и
широко используется на практике.
4. СВОЙСТВА ИОННОЙ СВЯЗИ
Ионная связь НЕ ОБЛАДАЕТНАПРАВЛЕННОСТЬЮ вследствие
сферической симметрии электрического поля каждого иона.
Ионная связь
НЕ ОБЛАДАЕТ
НАСЫЩАЕМОСТЬЮ, т.к.
разноименные ионы, притягиваясь друг к другу, сохраняют способность
электростатического взаимодействия с другими ионами.
Отсутствие у ионной связи направленности и насыщаемости
обуславливает
склонность ионных молекул к ассоциации, т.е.
соединению друг с другом.
Ассоциация зависит от температуры - чем ниже температура, тем выше
склонность к ассоциации, т.е. склонность к ассоциации проявляется в
жидкой, а особенно в твердой фазе.
5. ИОННЫЕ КРИСТАЛЛЫ
Отсутствие НАСЫЩАЕМОСТИ ионной связи наиболее ярко проявляется в склонностиэтих соединений к образованию кристаллических решеток, в узлах которых каждый ион
окружен максимально возможным числом ионов противоположного знака (6 ионов Clвокруг одного иона Na+ в кристалле NaCl).
Наиболее важное отличие ионных соединений от ковалентноувазянных - способность к диссоциации в полярных растворителях – обусловлена тем, что энергия сольватации ионов
кристалла молекулами растворителя превышает энергию
ионной связи в кристалле.
Ионные кристаллы обладают высокой температурой плавления,
ионной проводимостью при высоких температурах, значительной
шириной запрещенной зоны и рядом ценных оптических свойств,
связанных с наличием полос поглощения в ИК области спектра.
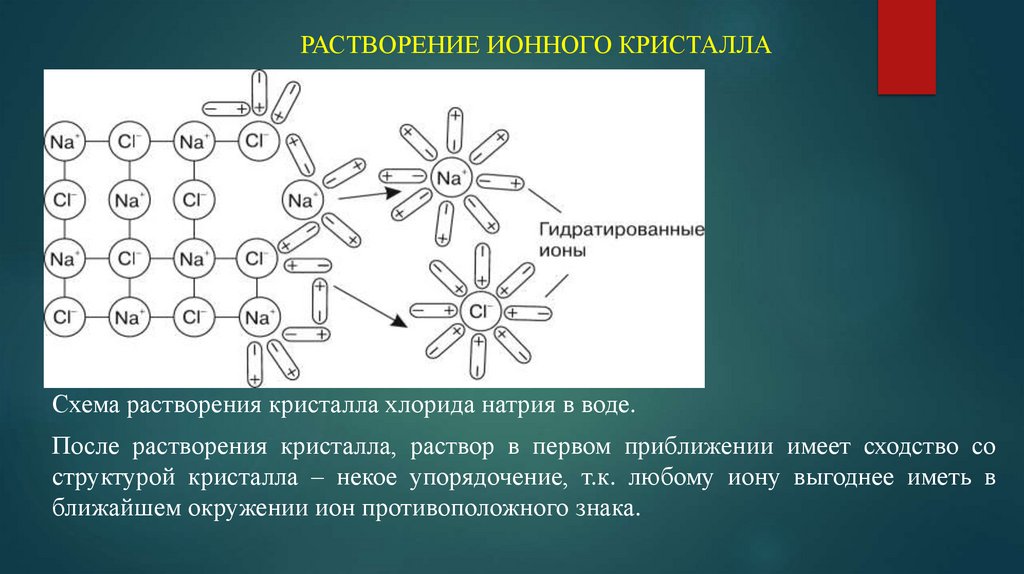
6. РАСТВОРЕНИЕ ИОННОГО КРИСТАЛЛА
Схема растворения кристалла хлорида натрия в воде.После растворения кристалла, раствор в первом приближении имеет сходство со
структурой кристалла – некое упорядочение, т.к. любому иону выгоднее иметь в
ближайшем окружении ион противоположного знака.
7. МЕЖМОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ. СИЛЫ ВАН-ДЕР-ВААЛЬСА.
МЕЖМОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ. СИЛЫ ВАНДЕР-ВААЛЬСА.Универсальные межмолекулярные взаимодействия – силы Ван-дерВаальса – возникают между молекулами и значительно слабее
внутримолекулярных химических связей (Есв.≥8 кДж/моль). Эти
связи отвечают за ассоциацию молекул в газовой фазе, за переход из
газовой в жидкую и твердую фазу, устойчивость молекулярных
кристаллов, процессы адсорбции и др.
Среди них выделяют ориентационные, индукционные и
дисперсионные взаимодействия, в основе которых лежит
электростатическая природа. Длина межмолекулярных связей
больше длины внутримолекулярных, энергия - много меньше. При
образовании межмолекулярных связей большую роль играют
дипольные моменты молекул и их поляризуемость.
8. ДИПОЛЬ, ДИПОЛЬНЫЙ МОМЕНТ, ПОЛЯРИЗУЕМОСТЬ.
Дипольный момент (вектор), [D]μ = q•l
Электронная поляризация –
мгновенный процесс (10-14–10-15с)
упругого смещения электронов
(электронных орбит)
относительно ядра атома.
Поляризуемость (α) – способность к поляризации зависит от структуры частицы:
чем больше радиус частицы, тем больше α. (для атомов, α в группах ПС возрастает
сверху вниз).Поляризующая способность – способность оказывать поляризацию
соседних частиц. Зависит от заряда частицы и ее геометрических размеров: чем
больше заряди чем меньше радиус частицы – тем выше ее поляризующая
способность
9.
10. СИЛЫ ВАН-ДЕР-ВААЛЬСА
1. ОРИЕНТАЦИОННОЕ ВЗАИМОДЕЙСТВИЕ связано с полярностью молекул:молекулы,
обладающие
постоянным
дипольным
моментом
за
счет
электростатических сил взаимодействуют друг с другом, образуя цепи или
ассоциаты. Энергию ориентационного взаимодействия можно оценить по формуле
Кеезома: Еор. = – (2/3)• μ12 •μ22/kTr6. Видно, что ориентационное взаимодействие
зависит от расстояния (r) между частицами и оно ослабевает с ростом температуры.
От этого вида взаимодействия зависят многие свойства веществ, например,
температура кипения.
2. ИНДУКЦИОННОЕ ВЗАИМОДЕЙСТВИЕ возникает между полярными и
неполярными молекулами, например, между HCl и Cl2. При этом, полярная молекула
индуцирует в неполярной молекуле наведенный дипольный момент, в результате
чего между ними возникает диполь-дипольное взаимодействие. Энергия такого
взаимодействия сильно зависит от дипольного момента полярной молекулы и
поляризуемости неполярной. Энергию индукционного взаимодействия можно
оценить по формуле Дебая: Еинд. = – (α1 • μ12 +α2 •μ22 )/r6 .
11. СИЛЫ ВАН-ДЕР-ВААЛЬСА
3. ДИСПЕРСИОННОЕ ВЗАИМОДЕЙСТВИЕ происходит за счет возникновениямгновенных диполей в различных молекулах, которые возникают самосогласовано. При
движении электронов в молекулах возможно мгновенное возникновение ассиметрии
распределения положительных и отрицательных зарядов. В результате в разных
молекулах
возникают
мгновенно
существующие
(приблизительно10-8с)
разнонаправленные диполи, из-за наличия которых молекулы могут как удерживаться
вблизи друг друга, так и отталкиваться. Тем не менее, из-за высокой подвижности
электронов и самосогласованности процесса образования мгновенных диполей,
вероятность притяжения молекул выше вероятности отталкивания. Энергию
дисперсионного взаимодействия можно оценить по формуле Ф.Лондона через энергии
ионизации (Ei): Едисп. = – (3/2)•[Ei(1) •Ei(2)/ (Ei(1) +Ei(2))]• α1•α2 /r6.
Все представленные выше виды межмолекулярных взаимодействий можно (с учетом
отталкивания молекулярных электронных оболочек) обобщить простым выражением:
Eммв = – A/r6 + B/rn , где А – обобщает все указанные выше взаимодействия для
конкретного случая, В – постоянная, п – 9, 12 или 15 эмпирический коэффициент.
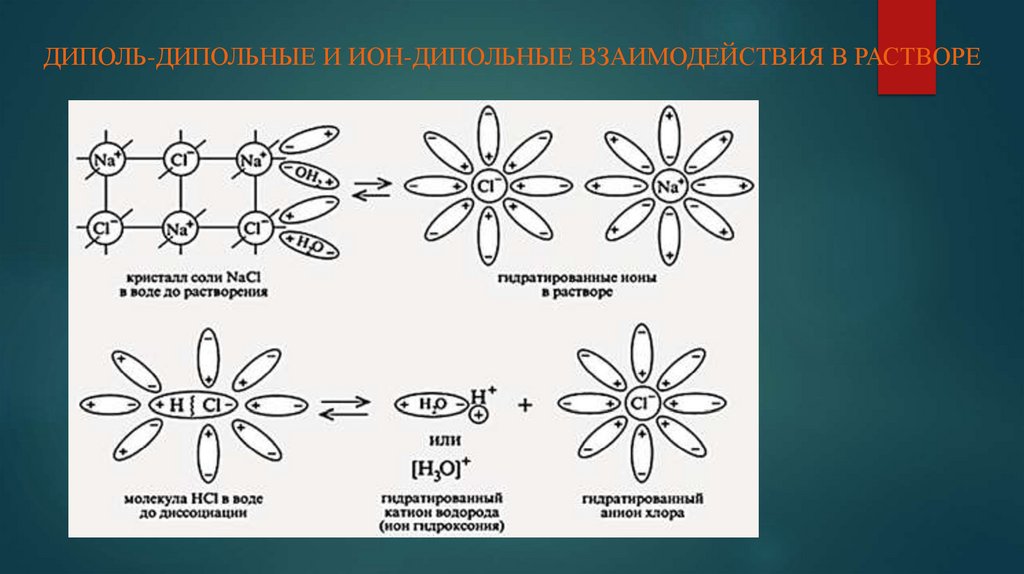
12. ДИПОЛЬ-ДИПОЛЬНЫЕ И ИОН-ДИПОЛЬНЫЕ ВЗАИМОДЕЙСТВИЯ В РАСТВОРЕ
13. ИОННЫЕ КРИСТАЛЛЫ
Характер химической связи находит отражение в агрегатном состоянии вещества и егофизических свойствах. В ионных кристаллах отрицательно заряженный ион хлора
притягивает не только «свой» ион Na+, но и другие ионы вокруг себя, т.е. отсутствие
насыщаемости ионной связи приводит в данном случае к притяжению нескольких
ионов противоположного знака. Фактически каждый Na+ вокруг себя координирует 6
ионов Cl-, а каждый ион Cl- в свою очередь – 6 ионов Na+. Это так называемая плотная
упаковка, кубическая гранецентрированная.
Ионные кристаллы тугоплавки (NaCl 800.8 0 С),
обладают высоким электрическим сопротивлением,
при повышении температуры они плавятся,
потом испаряются: при этом, пары состоят из
молекул (NaCl), что свидетельствует в пользу
того, что ковалентная составляющая связи
обязательно присутствует.
14. МОЛЕКУЛЯРНЫЕ КРИСТАЛЛЫ
МОЛЕКУЛЯРНЫЕ КРИСТАЛЛЫ (МК) образованы молекулами, которые связаны между собойслабыми ван-дер-ваальсовыми силами, существенно менее прочными, чем внутримолекулярные
связи. Из-за этого плавление, возгонка, полиморфные превращения у них происходят без нарушения
целостности молекул. МК в основном органические соединения – нафталин, сахар и др., бинарные
соединения – вода, СО2, N2O4, некоторые простые вещества – водород, халькогены, галогены.
Строение МК также определяется принципом плотнейшей упаковки и симметрией молекул, которые
располагаются так, чтобы выступы одних
входили в углубления других. Чаще всего
МК имеют моноклинную, ромбоэдрическую
или триклинную структуру. Для них
характерны низкая температура плавления,
низкая твердость, высокий КТР и высокая
сжимаемость, большинство из них диэлектрики.
При возможном растворении МК в воде
образуются растворы неэлектролитов.
Рисунок. Моноклинная кристаллическая сера.
Темно-желтая, температура плавления tпл = 119.3 0С,
плотность d =1.957 г/см3.
15. ВОДОРОДНАЯ СВЯЗЬ
ВОДОРОДНАЯ СВЯЗЬ – еще один из видов межмолекулярного (иногда внутримолекулярного)взаимодействия, образуется тогда, когда водород в молекуле связан с элементом, обладающим высокой
электроотрицательностью (фтором, кислородом, хлором). Энергия водородной связи меньше энергии
внутримолекулярной связи, но выше чем энергия ван-дер-ваальсовых сил. Возникновение этой связи
обусловлено тем, что сильное смещение общей электронной плотности в молекуле от водорода к
другому элементу с высокой электроотрицательностью превращает его в уникальную частицу: (а) его
размеры ничтожно малы и (б) он практически полностью лишен электрона. Все это позволяет сильно
поляризованному иону водорода очень близко приблизиться к электроотрицательному элементу из
соседней молекулы и образовать довольно сильную межмолекулярную связь. Так, между молекулами
HF длина водородной связи H – F ···· H – F соизмерима с длиной внутримолекулярной связи; для
молекул воды примерно вдвое больше (0.177 нм против 0.099 соответственно, Е =20 кДж/моль).
Наличие водородной связи
повышает температуру кипения и
плавления, отвечает за ассоциацию
молекул, играет важную роль в
строении органических веществ.













 Химия
Химия








