Похожие презентации:
Щелочные металлы
1.
2.
Щелочные металлы3. Периодическая система химических элементов Д.И.Менделеева
II
1
H
II
2
Li
III
3
Na
4
K
IV
5
6
V
7
8
VI
9
VII
10
II
Группы элементов
IV
V
VI
III
VII
VIII
He
Щелочные металлы
1
1.00797
Водород
6,939
3
Литий
19 Ca
39.102
Cu
63.546
37
85.47
Ag
107.868
Серебро
Cs
Цезий
79
Au
196.966
Золото
Fr
Франций
65.37
Цинк
38
87.62
Стронций
Sс
44.956
Скандий
Иттрий
112.41
Кадмий
Индий
56 57
137.34
Барий
Ртуть
200.59
Радий
Ac
227.028
Актиний
Ti
47.90
Zr
91.224
Цирконий
Hf
178.49
Гафний
Свинец
Rf
[261]
Резерфордий
O
8
15.996
Кислород
15 S
Фосфор
V
23
50.942
Ванадий
33
74.9216
Мышьяк
41
Nb
92.906
Ниобий
73
Ta
180.9479
Тантал
83
208.98
Висмут
105
Db
[262]
Дубний
F
фтор
16 Cl
32,064
Сера
Cr
24
51.996
Хром
Se
34
78.96
Селен
42
Mo
95.94
Молибден
51 Te
121.75
Сурьма
82 Bi
207.2
7
14.0067
30,9738
50 Sb
118.71
Олово
104
Азот
32 As
72.59
Германий
72
N
14 P
28,086
Титан
81 Pb
204.383
Таллий
88 89
[226]
La
138.81
Лантан
Hg Tl
80
22
49 Sn
114.82
12,011
Кремний
39 40
88.9059
6
Углерод
31 Ge
69.72
Галлий
Y
C
13 Si
26,9815
Алюминий
Cd In
48
87 Ra
[223]
5
10 .811
Zn Ga
30
55 Ba
132.905
Бор
20 21
40,08
Кальций
Sr
В
12 Al
24,312
Магний
Рубидий
47
4
9,012
11 Mg
Медь
Rb
Be
22,988
Калий
29
Гелий
Вериллий
Натрий
2
Теллур
74
52
127.60
W
183.85
Вольфрам
Po
25
Br
Бром
43
Sg
[263]
Сиборгий
10
20,18
Неон
18
Аргон
54.938
Железо
35 Kr
79.904
75
107
Co 28 Ni
58.933
Кобальт
99
126.904
Re
186.2
36
Криптон
101.07
Родий
[262]
Pd
106.4
Палладий
Ксенон
131,3
Os 77 Ir 78 Pt
190.2
192.2
Осмий
Иридий
86
Радон
[222]
Bh 108 Hs 109 Mt
Борий
46
54
85 Rn
210
102.905
Рутений
76
58.71
Никель
83,8
Tс 44 Ru 45 Rh
Рений
Астат
27
55.847
53 Xe
Иод
39,948
Mn 26 Fe
Технеций
I
Ne
17 Ar
35,453
Марганец
84 At
208.982
Полоний
106
Хлор
9
18.9984
4,003
[265 ]
Хассий
[266 ]
Мейтнерий
195.09
Платина
4.
Периодическая система химических элементов Д.И.МенделееваI
1
II
2
Li
III
3
Na
4
K
6,939
V
VI
11
22,9898
Натрий
10
В главной подгруппе:
19
39.102
Калий
Rb
37
Число электронов на внешнем слое
не изменяется
Радиус атома увеличивается
85.47
Рубидий
Электроотрицательность уменьшается
Cs
55
132.905
Цезий
9
VII
VIII
Литий
7
8
VII
3
5
6
III
Щелочные металлы
I
IV
II
Группы элементов
IV
V
VI
Восстановительные свойства усиливаются
Металлические свойства усиливаются
Fr
87
[223]
Франций
5.
Периодическая система химических элементов Д.И.МенделееваI
I
1
II
2
III
3
II
Группы элементов
IV
V
VI
III
Внешний вид
Мягкий металл
простого вещества серебристо-белого
цвета.
Электронная
[He] 2s1
коефигуранция
ЭО
0,98
(по Полингу)
Степень окисления 1
Плотность
0,534 г/см³
IV
5
6
V
7
8
VI
VII
10
VIII
Ли́тий / Lithium (Li)
4
9
VII
Li
Температура
плавления
Температура
кипения
453,69 K
1613 K
6.
Периодическая система химических элементов Д.И.МенделееваI
I
1
II
2
III
3
4
IV
5
6
V
7
8
VI
9
VII
10
II
III
Группы элементов
IV
V
VI
VII
VIII
Натрий/Natrium (Na)
серебристо-белый
Внешний вид
простого вещества мягкий металл
Электронная
коефигуранция
ЭО
(по Полингу)
Степень окисления
Плотность
[Ne] 3s1
Температура
плавления
Температура
кипения
370,96 К
0,93
1
0,971 г/см ³
1156,1 К
7.
Периодическая система химических элементов Д.И.МенделееваI
I
1
II
2
III
3
4
IV
5
6
V
7
8
VI
9
VII
10
II
III
Группы элементов
IV
V
VI
VII
VIII
Калий / Kalium (K)
Серебристо-белый
Внешний вид
простого вещества мягкий металл
Электронная
конфигуранция
ЭО
(по Полингу)
Степень окисления
Плотность
Температура
плавления
Температура
кипения
[Ar] 3d10 4s1
0,82
1
0,856 г/см³
336,8 К
1047 К
8.
Периодическая система химических элементов Д.И.МенделееваI
I
1
II
2
III
3
4
IV
5
6
V
7
8
VI
9
VII
10
II
III
Группы элементов
IV
V
VI
VII
VIII
Руби́дий / Rubidium (Rb)
Внешний вид
Серебристо-белый
простого вещества мягкий металл
Электронная
конфигуранция
ЭО
(по Полингу)
Степень окисления
Плотность
[Kr] 5s1
Температура
плавления
Температура
кипения
312,2 К
0,82
1
1,532 г/см³
961 К
9.
Периодическая система химических элементов Д.И.МенделееваI
II
III
Группы элементов
IV
V
VI
VII
VIII
I
1
Цезий / Caesium (Cs)
II
2
очень мягкий вязкий
Внешний вид
простого вещества серебристо-жёлтый
III
3
4
IV
5
6
V
7
8
VI
9
VII
10
похожий на золото
металл
Электронная
конфигуранция
ЭО
(по Полингу)
Степень окисления
Плотность
[Xe] 6s1
Температура
плавления
Температура
кипения
301,6 К
0,79
1
1,873 г/см
951,6 К
10.
Периодическая система химических элементов Д.И.МенделееваI
I
III
VII
VIII
1
II
2
III
3
4
IV
5
6
V
7
8
VI
9
VII
II
Группы элементов
IV
V
VI
10
Франций / Francium (Fr)
радиоактивный
Внешний вид
простого вещества щелочной металл
Электронная
конфигуранция
ЭО
(по Полингу)
Степень окисления
Плотность
[Rn] 7s1
Температура
плавления
Температура
кипения
300 К
2,2
1
1,87 г/см
950 К
11.
Щелочные металлыЛитий
Натрий
Фрайций
История
открытия
Калий
Цезий
Рубидий
12.
История открытия литияАрфведсон
Юхан Август
(12 .01.1792 г. –
28 .10.1841 г.)
Литий был открыт в 1817 г. А. Арфведсоном в
минерале петалите. Берцелиус предложил
назвать ее литионом (Lithion), поскольку эта
щелочь впервые была найдена в "царстве
минералов"
(камней);
название
это
произведено от греч.- камень. Металлический
Литий впервые получен в 1818 г. Г. Дэви путем
злектролиза щелочи.
В 1855 г. Бунзен и Маттессен разработали
промышленный
способ
получения
металлического лития злектролизом хлорида
лития.
13.
История открытия натрияГемфри Дэви
(17.12.1778 г –
29.05.1829 г)
Натрий (Natrium, от англ. и франц.
Sodium, нем. Natrium от древнеевр.
neter — бурлящее вещество. В 1807 г.
Г.Дэви путем электролиза слегка
увлажненных
твердых
щелочей
получил свободный металл - натрий,
назвав его содий (Sodium).
В следующем году Гильберт предложил
именовать новый металл натронием
(Natronium);
Берцелиус сократил
последнее
название
до
"натрий"
(Natrium).
14.
История открытия калияКалий (англ. Potassium, франц. Potassium,
нем. Kalium) открыл в 1807 г. Г.Дэви,
производивший электролиз твердого, слегка
увлажненного едкого кали. Дэви именовал
новый металл потассием (Potassium), но это
название не прижилось. Крестным отцом
металла оказался Гильберт, известный
издатель журнала "Annalen deг Physik",
предложивший название "калий"; оно было
принято в Германии и России.
Гемфри Дэви
(17.12.1778 г –
29.05.1829 г)
15.
История открытия рубидияРоберт Вильгельм
Бунзен
(31.03.1811 - 16.08.1899)
Густав Роберт Кирхгоф
(12.03.1824 – 17.10.1887)
При спектроскопическом анализе
минерала лепидолит (фторсиликат
лития и алюминия) и обнаружились
две новые красные линии в красной
части спектра. Эти линии Р. Бунзен и
Г.Кирхгофф правильно отнесли к
новому металлу, который назвали
рубидием (лат. rubidus - красный)
из-за цвета его спектральных линий.
Получить рубидий в виде металла
Бунзену удалось в 1863 году.
16.
История открытия цезияРоберт Вильгельм
Бунзен
(31.03.1811 - 16.08.1899)
Густав Роберт Кирхгоф
(12.03.1824 – 17.10.1887)
Цезий (англ. Cesium, франц. Cesium, нем.
Caesium) - первый элемент, открытый с
помощью спектрального анализа. Р.Бунзен и
Г.Кирхгофф
обнаружили
спектральные
линии нового элемента: одну слабо-голубую
и
другую
ярко-голубую
в
области
фиолетовой части спектра.
Р.Бунзен назвал вновь открытый металл
цезием (Casium) от лат. caesius -- голубой,
светло-серый; в древности этим словом
обозначали голубизну ясного неба. Чистый
металлический
цезий
получен
электролитическим путем в 1882 г.
17.
История открытия францияПЕРЕ (Perey)
Маргарита
(19.10.1909 13.05.1975)
Этот
элемент
был
предсказан
Д.И.Менделеевым (как Эка-цезий), и был
открыт (по его радиоактивности) в 1939 г.
Маргаритой Пере, сотрудницей Института
радия в Париже с порядковым номером Z = 87
и периодом полураспада 21 мин. Она же дала
ему в 1964 г. название в честь своей родины –
франций. . Микроскопические количества
франция-223 и франция-224 могут быть
химически выделены из минералов урана и
тория. Другие изотопы франция получают
искусственным путём с помощью ядерных
реакций.
18.
ФотографияОписание минерала
Химический
состав
LiAl[Si2O6]
Цвет
Бесцветный,
красный, желтый,
зеленый
Плотность
Сподуменн
Твердость
3,1—3,2 г/см3
6,5
19.
ФотографияГалит
Описание минерала
Химический
состав
NaСl
Цвет
Бесцветный,
красный,
желтый, синий
Плотность
2,2—2,3г/см3
Твердость
2,5
Вкус
Солёный
20.
ФотографияОписание минерала
Химический
состав
Цвет
Сильвин
КСl
Бесцветный,
молочно-белый,
темно-красный,
розовый
Плотность
1,97-1,99 г/см3
Твердость
1,5
Вкус
Едкий
21.
ФотографияОписание минерала
Химический
состав
Цвет
Карналит
MgCl2·KCl·6H2O
Красный,
желтый, белый,
бесцветный
Плотность
1,6г/см3
Твердость
1,5
Вкус
Жгучий соленый
22.
Химические свойстваПроверь себя
+Г2
MeГ
+O2
Li2O, Na2O2, KO2
+H2
МеH
+ N2
Me3N
+H2O
(бурно)
МеOH +H2
+ к-ты
(бурно)
соль+H2
R-OH
R-OMe +H2
с НеМе
Щелочные
металлы
со сложными
веществами
23.
Химические свойства1)
2Na + Cl2 = 2NaCl (в атмосфере F2 и Cl2 щелочные Me
самовоспламеняются)
2) 4Li + O2 = 2Li2O
2Na + O2 = Na2O2
3) 2Na + Н2 = 2NaН
(при нагревании 200-400oC)
оксид Li
2K + 2O2 = K2O4
пероксид Na
надпероксид K
4) 6Li + N2 = 2Li3N (Li - при комнатной T, остальные щелочные Me -при
нагревании)
5) 2Na + 2Н2О = 2NaОН + Н2
(Li - спокойно, Na - энергично,
остальные – со взрывом –
воспламеняется выделяющийся Н2
Rb и Cs реагируют не только
с жидкой Н2О, но и со льдом. .
6) 2Na+ Н2SО4 = Na2SО4 + Н2
(протекают очень бурно)
7) 2C2H5OH + 2Na = 2C2H5ONa + Н2
Щелочные металлы с
24.
Качественное определение щелочных металловДля распознавания соединений щелочных металлов по окраске пламени
исследуемое вещество вносится в пламя горелки на кончике железной
проволоки.
Li+ - карминово-красный K+ - фиолетовый
Na+ - желтый
Rb + - красный
Li+
Na+
Cs+ - фиолетово-синий
K+
25.
Получение щелочных металлов1) Электролиз расплавов соединений
щелочных металлов:
2МеCl = 2Ме + Cl2
4МеOH = 4Ме + 2Н2О + О2
2) Восстановление оксидов и
гидроксидов щелочных металлов:
2Li2O + Si = 4Li + SiO2
KOH + Na = NаOH + K
Схема электролизера для получения
натрия футеровкой, графитовым анодом
Ванна состоит из стального кожуха с шамотной
А и кольцевым железный катодом К, между которыми расположена сетчатая
диафрагма. Электролитом служит более легкоплавкая смесь его с 25% NaF и 12%
КСl (что позволяет проводить процесс при 610–650°С). Металлический натрий
собирается в верхней части кольцевого катодного пространства, откуда и
переходит в сборник. По мере хода электролиза в ванну добавляют NaCl.
26.
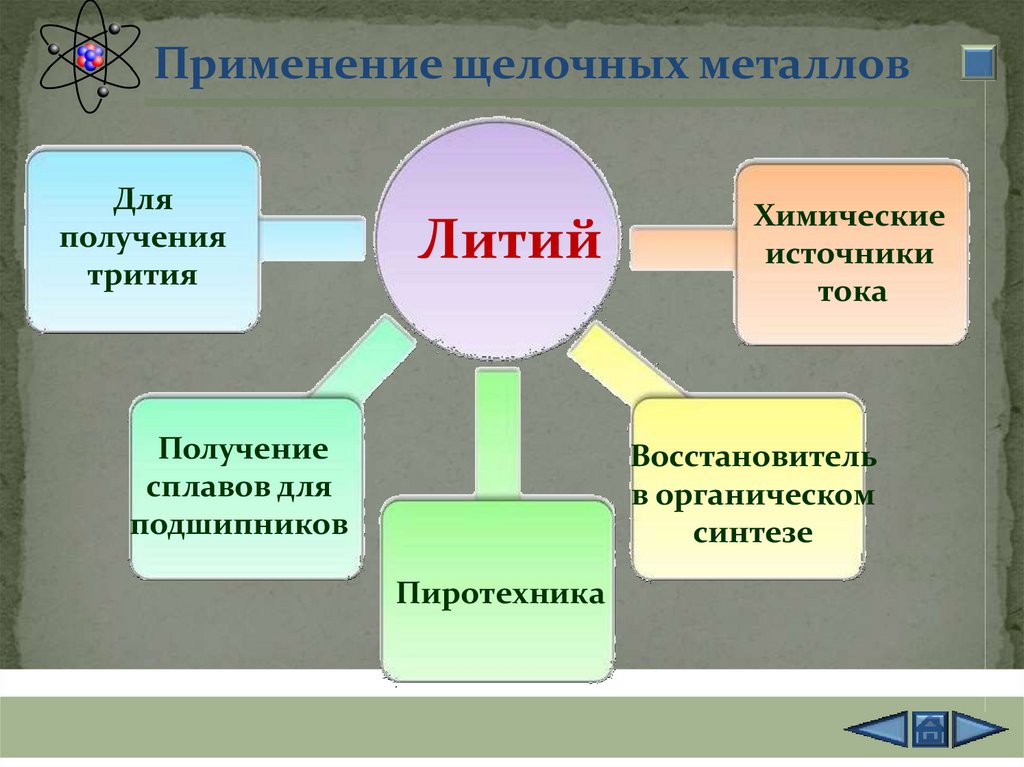
Применение щелочных металловДля
получения
трития
Литий
Получение
сплавов для
подшипников
Химические
источники
тока
Восстановитель
в органическом
синтезе
Пиротехника
27.
Применение щелочных металловТеплоносител
ь в ядерных
реакторах
Качественный
анализ
органических
веществ
Восстановите
ль в
органическом
синтезе
Натри
й
Газоразрядные
лампы
Термическое
получение
металлов
Производство
натриевосерных
аккумуляторо
в
28.
Применение щелочных металловТеплоноситель
в ядерных
реакторах
Калийные
удобрения
Для получения
перекиси калия
Калий
В гальванотехнике
Катализатор
Термическое
получение
металлов
29.
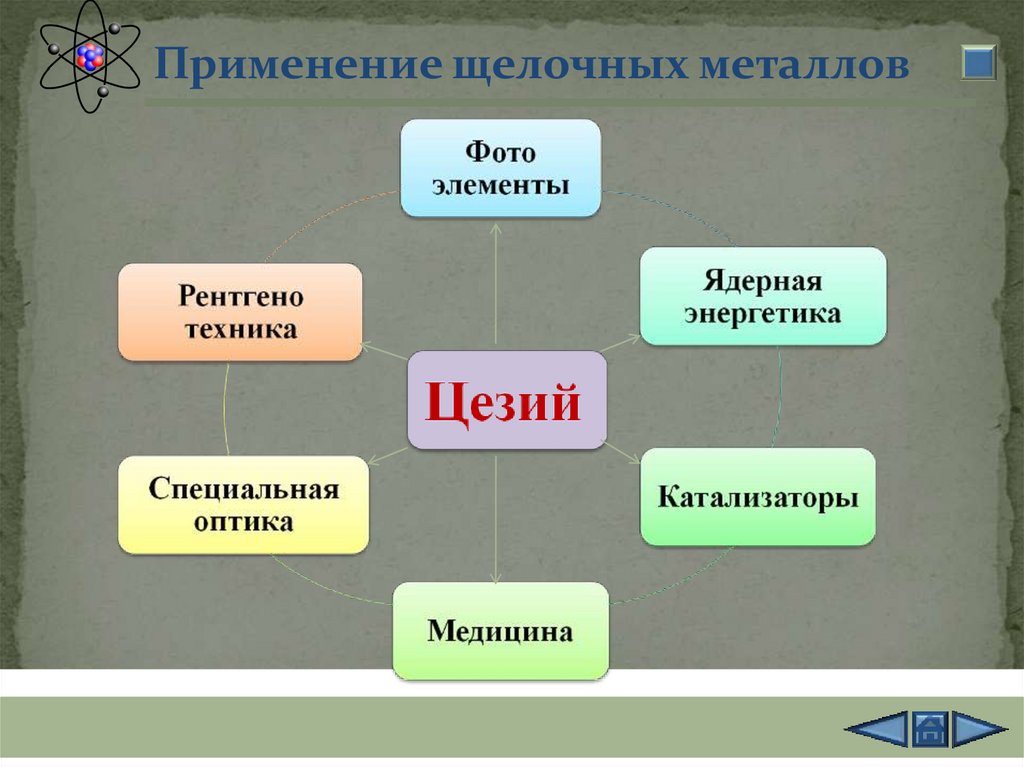
Применение щелочных металлов30.
Применение щелочных металлов31.
Физические свойства щелочныхметаллов
Заполни пропуски
Щелочные металлы цезия щелочные
серебристо–белые вещества, за исключением
серебристо-желтого цвета, с металлическим блеском. Все
металлы
характеризуются
малой
плотностью,
малой
твердостью, низкими температурами плавления и кипения и хорошей
электропроводностью.
Благодаря малой плотности Li, Na и К
всплывают на воде (Li–даже на керосине). Щелочные металлы легко
режутся
ножом. Несветящееся пламя газовой горелки щелочные
металлы и их летучие соединения окрашивают в характерные цвета: Li
– в карминово–красный, Na – в желтый,
фиолетовый , Rb - красный и
Cs – в фиолетово-синий.
К–
32.
Тест «Щелочные металлы»1. Предложил назвать калий от арабского «алкали» - щелочь
И. Арфведсон
Г.Деви
Й. Берцеллиус
2. В ряду от лития к францию атомный радиус:
уменьшается
не изменяется
увеличивается
3. Степень окисления щелочных металлов равна:
+1
-1
+2
4. Цвет пламени, в который его окрашивают ионы натрия
фиолетовый
красный
желтый
5. Соединение NaOH называется.
каустическая сода
проверить
поташ
кристаллическая сода
33.
NаО2Nа + O2
Nа + Н2О
+
NаО2
Na + HCl
+
Cl2
Na + N2
Nа + CH3OH
+
Na2O
NаОН
Nа2O2
H2
H2
NaCl
NaN
Na2N
Na3N
NaH
H2
CH3ONa
































 Химия
Химия








