Похожие презентации:
Взаимодействие металлов с кислотами
1.
Взаимодействие металловс кислотами
2.
Взаимодействие металлов с солянойкислотой
С соляной кислотой взаимодействуют металлы, стоящие в ряду
напряжений до водорода.
1
2
Mg 2HCl Mg Cl2 H 02 .
Восстановитель Mg 0 2e Mg 2 1 окисление
0
1 восстановление
Окислитель
2H 2e H 02
Вывод: окислителем являются катионы водорода,
принимают электроны от атома металла.
которые
3.
Взаимодействие металлов с серной кислотойа) Серная кислота разбавленная
В разбавленной серной кислоте окислителем являются ионы водорода
H , поэтому она взаимодействует с металлами, расположенными в ряду
напряжений до водорода.
Zn H 2 SO4 (разб.) ZnSO4 H 2
восстановитель Zn 0 2e Zn 2 1 окисление
0
окислитель
2H 2e H 02
1 восстановление
Вывод: окислителем являются катионы водорода, которые принимают
электроны от атома металла.
4.
Взаимодействие металлов с серной кислотойб) Серная кислота концентрированная
В концентрированной серной кислоте окислителем является ион SO42-,
но так как сульфат-ион не является сильным окислителем, то
большинство реакций идет при нагревании.
Степень окисления серы может меняться от +6 до - 2.
Чем активнее металл, тем больше степень восстановления серы.
Взаимодействие металлов с серной кислотой можно представить в виде
схемы.
5.
Характер взаимодействия зависит от активности металла, условийпроведения реакции.
Например: при нагревании серной концентрированной кислоты с цинком
сначала выделяется сернистый газ, а затем элементарная сера и
сероводород.
Увеличивается
время
нагревания
Zn H 2SO4 (конц.)
ZnSO4 SO2 H 2O
t0
t
Zn H 2SO4 (конц.)
ZnSO4 S H 2O
0
Zn H 2SO4 (конц.)
ZnSO4 H 2S H 2O
В одном из уравнений
электронного баланса.
t0
расставим
коэффициенты
методом
6.
Пример:Zn + H2SO4 (конц.) → ZnSO4 + H2S + H2O
7.
Пример:Zn0 + H2+S+6O4 -2 (конц.) → Zn+2S+6O4-2 + H2+S-2 + H2O
Zn0 -2e→ Zn+2
S+6 +8e→ S-2
2
8
8
4
Восстановитель, процесс
окисления
1
Окислитель, процесс
восстановления
4 Zn0 + S+6 → 4 Zn+2 + S-2
4 Zn0 + 5H2+S+6O4 -2 (конц.) → 4 Zn+2S+6O4-2 + H2+S-2 + 4H2O
8.
Вывод: Окислителем в концентрированной серной кислотеявляется ион SO 42 . Концентрированная серная кислота окисляет многие
металлы, в том числе и такие, которые в ряду напряжений расположены
правее водорода, при этом обычно выделяется сернистый газ.
Cu 0 H 2SO 4 (конц.) СuSO 4 H 2O SO 2
Ag 0 H 2SO 4 (конц.) Ag 2SO 4 H 2O SO 2
Hg 0 H 2SO 4 (конц.) HgSO 4 H 2O SO 2
Концентрированная
серная
кислота
не
действует
на
Au, Pt, Ru, Ph, Os, Ir и на холоде в концентрированной серной
кислоте Fe, Al, Cr, Co, Ni, Ba пассивируются и реакции не протекают.
9.
Взаимодействие металлов с азотнойкислотой
а) азотная кислота концентрированная
Концентрированная и разбавленная азотная кислота окисляет
металлы без выделения водорода, так как в ней окислителем является
нитрат-ион ( NO3 ).
10.
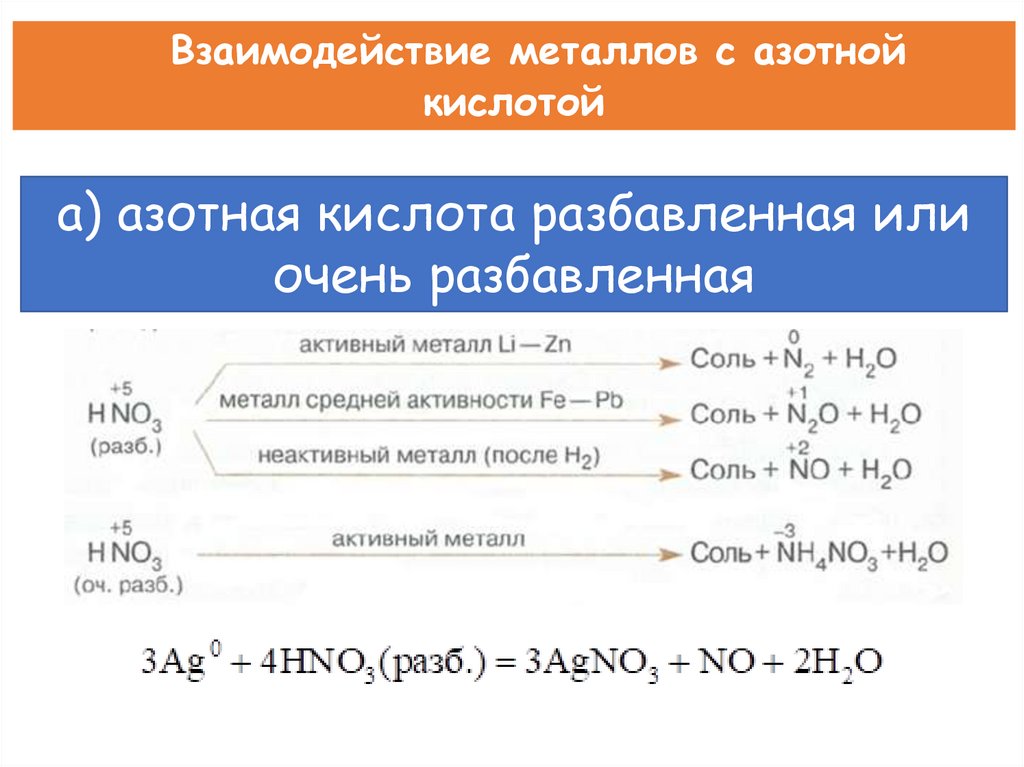
Взаимодействие металлов с азотнойкислотой
а) азотная кислота разбавленная или
очень разбавленная
11.
При взаимодействии активных металлов с очень разбавленнойазотной кислотой образуется соль, вода и аммиак или нитрат аммония.
8 Na + 10 HNO3 → 8 NaNO3 + NH4NO3 + 3 H2O
4 Ca + 10 HNO3 → 4 Ca(NO3)2 + NH4NO3 + 3 H2O
Вывод: окислителем в азотной кислоте является нитрат-анион.
Концентрированная азотная кислота пассивирует Fe, Cr, Al, Au, Ir Pt, …
Следует иметь в виду, что во многих случаях при действии азотной
кислоты на металлы образуется смесь различных азотсодержащих
соединений, в которых преобладает какое-либо из них.





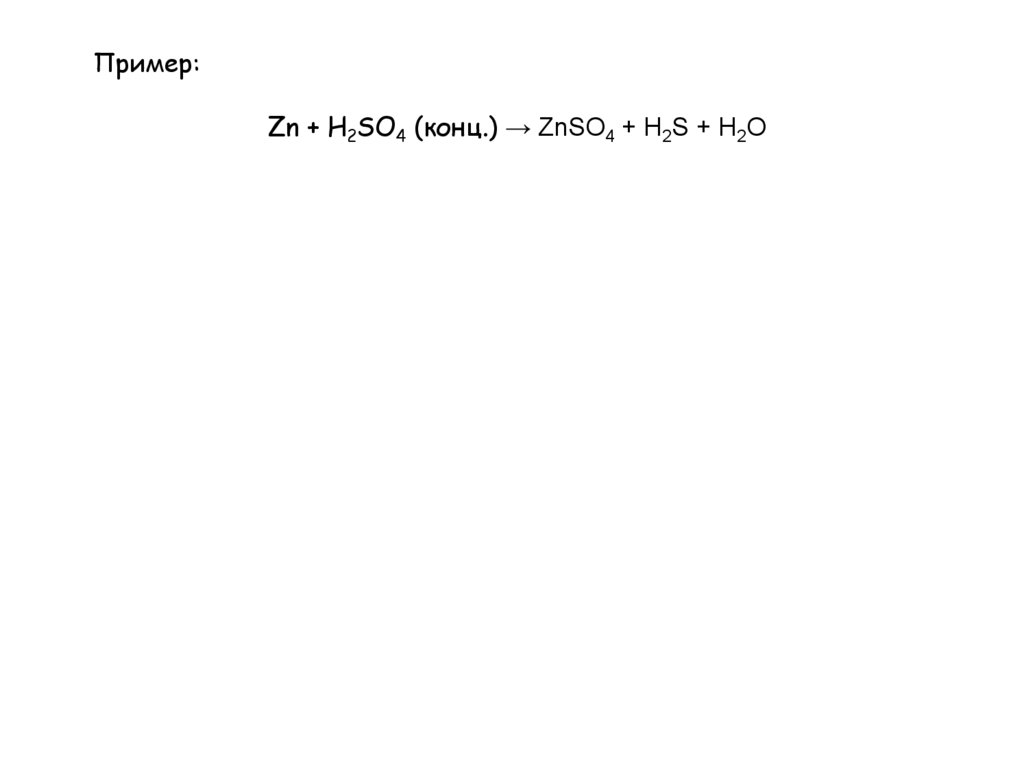





 Химия
Химия








