Похожие презентации:
Азотная кислота
1.
Азотная кислота2.
Физические и физико-химические свойстваАзот в азотной кислоте четырёхвалентен[3], степень окисления +5. Азотная
кислота — бесцветная, дымящая на воздухе жидкость, температура
плавления −41,59 °C, кипения +82,6 °C (при нормальном атмосферном
давлении) с частичным разложением. Азотная кислота смешивается с водой
во всех соотношениях. Водные растворы HNO3 с массовой долей 0,95—0,98
называют «дымящей азотной кислотой», с массовой долей 0,6—0,7 —
концентрированной азотной кислотой.
С водой образует азеотропную смесь (массовая доля 68,4 %, d20 = 1,41
г/см3, Tкип = 120,7 °C)
3.
Физические и физико-химические свойстваПри кристаллизации из водных растворов азотная кислота образует
кристаллогидраты:
моногидрат HNO3·H2O, Tпл = −37,62 °C;
тригидрат HNO3·3H2O, Tпл = −18,47 °C.
Твёрдая азотная кислота образует две кристаллические модификации:
моноклинная сингония, пространственная группа P 21/a, параметры ячейки a
= 1,623 нм, b = 0,857 нм, c = 0,631 нм, β = 90°, Z = 16;
ромбическая
4.
Физические и физико-химические свойстваМоногидрат образует кристаллы ромбической сингонии, пространственная
группа P na2, параметры ячейки a = 0,631 нм, b = 0,869 нм, c = 0,544 нм, Z =
4.
Плотность водных растворов азотной кислоты как функция её концентрации
описывается уравнением
где d — плотность в г/см³, c — массовая доля кислоты. Данная формула
плохо описывает поведение плотности при концентрации более 97 %.
5.
Химические свойстваВысококонцентрированная HNO3 имеет обычно бурую окраску вследствие
происходящего на свету процесса разложения.
При нагревании азотная кислота распадается по той же реакции. Азотную
кислоту можно перегонять без разложения только при пониженном давлении
(указанная температура кипения при атмосферном давлении найдена
экстраполяцией).
6.
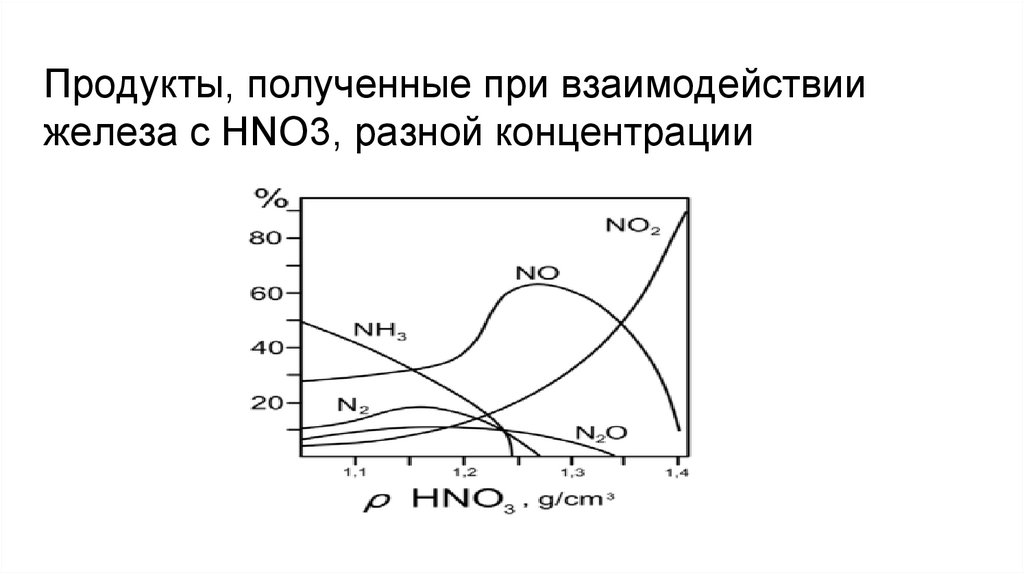
Продукты, полученные при взаимодействиижелеза с HNO3, разной концентрации
7.
Исторические сведенияМетодика получения разбавленной азотной кислоты путём сухой перегонки
селитры с квасцами и медным купоросом была, по-видимому, впервые
описана в трактатах Джабира (Гебера в латинизированных переводах) в VIII
веке. Этот метод с теми или иными модификациями, наиболее
существенной из которых была замена медного купороса железным,
применялся в европейской и арабской алхимии вплоть до XVII века.
В XVII веке Глаубер предложил метод получения летучих кислот реакцией их
солей с концентрированной серной кислотой, в том числе и азотной кислоты
из калийной селитры, что позволило ввести в химическую практику
концентрированную азотную кислоту и изучить её свойства. Метод Глаубера
применялся до начала XX века,
8.
Применениев производстве минеральных удобрений;
в военной промышленности (дымящая — в производстве взрывчатых
веществ, как окислитель ракетного топлива, разбавленная — в синтезе
различных веществ, в том числе отравляющих);
крайне редко в фотографии — разбавленная — подкисление некоторых
тонирующих растворов[7];
в станковой графике — для травления печатных форм (офортных досок,
цинкографических типографских форм и магниевых клише);
в производстве красителей и лекарств (нитроглицерин);
9.
Применениев ювелирном деле — основной способ определения
золота в золотом сплаве;
в основном органическом синтезе (нитроалканы, анилин,
нитроцеллюлоза, тротил)
10.
Действие на организмАзотная кислота ядовита. По степени воздействия на организм относится к
веществам 3-го класса опасности. Её пары очень вредны: пары вызывают
раздражение дыхательных путей, а сама кислота оставляет на коже
долгозаживающие язвы. При действии на кожу возникает характерное
жёлтое окрашивание кожи, обусловленное ксантопротеиновой реакцией. При
нагреве или под действием света кислота разлагается с образованием
высокотоксичного диоксида азота NO2 (газа бурого цвета). ПДК для азотной
кислоты в воздухе рабочей зоны по NO2 2 мг/м3[8]. Рейтинг NFPA 704 для
концентрированной азотной кислоты: опасность для здоровья: 4,
огнеопасность: 0, нестабильность: 0, специальное: Ox[9]









 Химия
Химия








