Похожие презентации:
Углекислотное равновесие и условия образования накипи. Уравнение Ланжелье. Индекс стабильности
1.
ЛЕКЦИЯ 4УГЛЕКИСЛОТНОЕ РАВНОВЕСИЕ И
УСЛОВИЯ ОБРАЗОВАНИЯ НАКИПИ.
УРАВНЕНИЕ ЛАНЖЕЛЬЕ. ИНДЕКС
СТАБИЛЬНОСТИ
2.
Содержащиеся в воде соединения угольной кислоты оказываютсущественное влияние на процессы накипеобразования.
Угольная кислота – двухосновная и имеет две ступени диссоциации:
H2CO3 H+ + НСО 3 ,
(1)
НСО 3 H+ + СО 32 .
(2)
В суммарном содержании в растворе (СО2 + Н2СО3) концентрация
недиссоциированных молекул Н2СО3 составляет всего около 0,1% от
концентрации молекулярного растворенного газа СО2. Поэтому в дальнейших
расчетах принимается, что угольная кислота представляет собой концентрацию
молекулярного растворенного газа СО2, которую можно считать равной
концентрации свободной углекислоты.
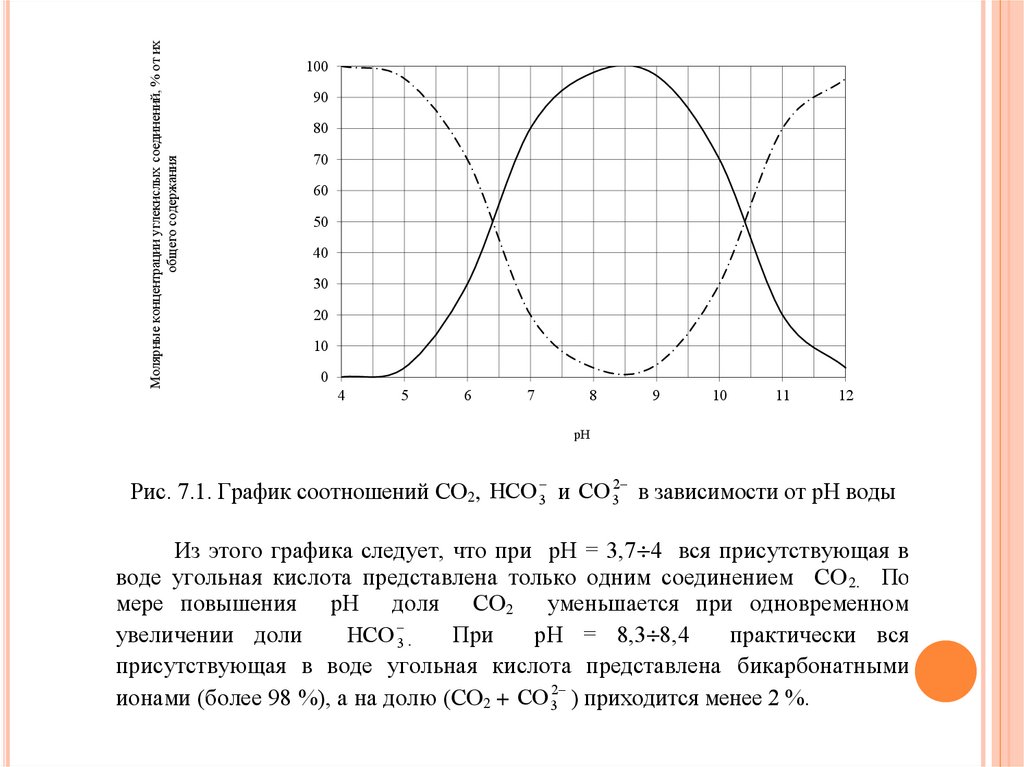
Изменение концентраций различных соединений угольной кислоты СО 2,
НСО 32 и СО 32 , в зависимости от рН при температуре 25 С, представлено на
рис. 1.
3.
Молярные концентрации углекислых соединений, % от ихобщего содержания
100
90
80
70
60
50
40
30
20
10
0
4
5
6
7
8
9
10
11
12
рН
Рис. 7.1. График соотношений СО2, НСО 3 и СО 32 в зависимости от рН воды
Из этого графика следует, что при рН = 3,7 4 вся присутствующая в
воде угольная кислота представлена только одним соединением СО 2. По
мере повышения рН доля СО 2 уменьшается при одновременном
НСО 3 .
увеличении доли
При
рН = 8,3 8,4
практически вся
присутствующая в воде угольная кислота представлена бикарбонатными
ионами (более 98 %), а на долю (СО2 + СО 32 ) приходится менее 2 %.
4.
При дальнейшем повышении рН (более 8,4) свободная углекислота в водеотсутствует и возрастает доля карбонатных ионов СО 32 при одновременном
уменьшении доли НСО 3 .
В водных растворах углекислых соединений существует динамическое
равновесие между различными формами угольной кислоты:
2НСО 3 СО 32 СО 2 Н 2 О .
(3)
Из этого уравнения следует, что для поддержания в растворе
определенной концентрации бикарбонатных ионов требуется, чтобы в воде
присутствовало определенное количество свободной углекислоты, называемой
равновесной углекислотой (СО2)равн.
При значениях (СО2)факт (СО2)равн будет существовать тенденция к
распаду части бикарбонатных ионов, т.е. к сдвигу вправо равновесия. Это
приведет к дополнительному образованию карбонатных ионов СО 32 , которые
будут реагировать с обычно присутствующими в природных водах катионами
кальция, выделяя из раствора осадок карбоната кальция в соответствии с
уравнением.
5.
Са2+ + СО 32 СаСО3.(4)
Образовавшийся осадок карбоната кальция СаСО3 называется накипью.
Если фактически присутствующее количество свободной углекислоты
(СО2)факт больше равновесной концентрации (СО2)равн., то избыток, равный
разности (СО2)агр= (СО2)факт – (СО2)равн, называется агрессивной углекислотой.
Агрессивная углекислота способна растворять отложения карбоната
кальция по уравнению
СаСО3 + (СО2)агр +Н2О Са(НСО3)
(5)
Такую воду называют «агрессивной».
Методы обработки воды для поддерживания стабильного состояния
называют стабилизационной обработкой.
Из уравнения (3) следует, что для оценки стабильности необходимо
знание (СО2)равн и (СО2)факт.
Имеются расчетные и лабораторные методы определения равновесной
концентрации (СО2)равн для данной воды, которые требуют значительного
времени и используются при экспериментальных исследованиях.
6.
Ланжелье предложил другой более удобный способ оценки стабильностиводы. По этому методу на основе данных химического анализа воды
производится вычисление величины рН, отвечающей равновесному состоянию
углекислых соединений. Это величина носит название «рН равновесного
насыщения воды карбонатом кальция» – рНs.
Уравнение рНs можно представить в упрощенном виде:
рНs = f1(t) – f2(Са2+) – f3(Щ) + f4(Р),
(6)
где f1(t) – функция температуры воды;
f1(t) = рК2 – рSСаСО3 ;
f2(Са2+) – функция содержания в воде катиона кальция в мг/л;
f2(Са2+) = lg [Са2+];
f3(Щ) – функция щелочности воды;
f3(Щ) = lg [Щ];
f4(Р) – функция общего солесодержания воды;
f4(Р) = 2,5 + 7,6.
На рис. 2
формуле (6).
представлен график для определения значений рН s по
7.
Слева от каждой прямой графика откладывают числовые значениясоответствующих показателей качества воды по данным ее анализа, а справа
находится значение функций этих величин.
Рис. 2. График для определения рНs
8.
Оценка отклонения от равновесного состояния производится путемсравнения измеренной величины рН воды с рНs. Если рН рНs, то это
указывает на превышение содержания в воде СО2 над равновесной
концентрацией. Такая вода способна разрушать бетон, растворяя входящий в его
состав карбонат кальция, и исключает возможность образования на стенках
стальных и чугунных труб защитной карбонатной пленки. Отсутствие защитной
пленки обуславливает контакт металла с водой, отчего при наличии в природных
водах растворенного кислорода происходит коррозия труб. Воду с рН рНs
можно условно назвать коррозионной.
Наоборот, при рН рНs вода отличается недостатком свободной
углекислоты по сравнению с равновесной концентрацией. Такую воду
называют некоррозионной.
Следует иметь в виду, что соотношением рН и рНs определяются не все
свойства воды в отношении коррозии бетона и металлов, а лишь те, которые
зависят от наличия в воде агрессивной углекислоты.
Ланжелье предложил характеризовать свойства воды с помощью индекса
стабильности или, как его иногда называют, индекса Ланжелье, численные
значения которого определяются по формуле
J = рН – рНs .
(9)
Соответственно вышеуказанному, знак индекса определяет следующие
свойства воды:
при рН рНs, J – величина положительная, вода не коррозионна;
при рН рНs, J – величина отрицательная, вода коррозионна;
при рН = рНs, J = 0 – вода стабильна.
Для определения рНs можно использовать не только изложенный выше
расчетный способ, но и прямой экспериментальный метод, описанный в
ГОСТ
3313-46.
«Вода
хозяйственно-питьевого
и
промышленного
водоснабжения. Методы технологического анализа. Определение стабильности
воды».
9.
1.1. У с л о в и я н а к и п е о б р а з о в а н и яв прямоточных и оборотных системах
В составе отложений трубчатых холодильников преобладает карбонат
кальция СаСО3, который служит вяжущим и для других примесей.
Карбонатные отложения могут быть плотными и рыхлыми, иногда
крупнозернистыми и в виде песка. Плотные отложения имеют ярко
выраженную кристаллическую структуру с зернами относительно правильной
формы и практически не содержат органических включений: при высыхании
они не распадаются. Такие структуры отложений характерны для
холодильников огневого нагрева металлургических печей, рубашек цилиндров
компрессоров и охлаждаемых водой темлообменных аппаратов с температурой
продукта свыше 100 С.
Отложения, имеющие рыхлую структуру, содержат большое количество
примесей минерального или органического происхождения (железо, кремнезем
и др.). При высыхании они склонны к распаду. Такие структуры отложений
характерны для холодильников с температурой продукта менее 100 С. Во всех
указанных случаях процессы отложения сочетаются с процессами
биологических обрастаний и коррозии металла.
Крупнозернистые отложения в виде чешуек или песка образуются в
теплообменных аппаратах, работающих с переменным теплонапряжением.
10.
Окраска отложений в большинстве случаев серая или серо-бурая. Вприсутствии железа – от светло- до темно-коричневой. При наличии
биологических обрастаний – серо-зеленая.
Отложения карбоната кальция на теплопередающей поверхности
образуются вследствие нарушения углекислотного равновесия в воде.
Имеются
принципиальные
отличия
в
характере
нарушения
углекислотного равновесия в системах прямоточного и оборотного
водоснабжения, которое обусловлено условиями использования воды.
Наибольший вклад в исследования процессов накипеобразования и
разработки методов предупреждения внесли российские ученые Г.Е. Крушель,
И.Э. Апельцин, Д.И. Кучеренко, А.Ф. Шабалин, Н.П. Лапотышкина.
1.1.1. Условия накипеобразования в прямоточных
системах и методы обработки
Определение вероятности накипеобразования в прямоточной системе при
нагревании воды не выше 70 С рекомендуется проводить по индексу
стабильности J. Из уравнения (9) следует, что при J 0 вероятно
накипеобразование. Экспериментальные и производственные испытания
прямоточных систем с различным качеством воды позволили получить
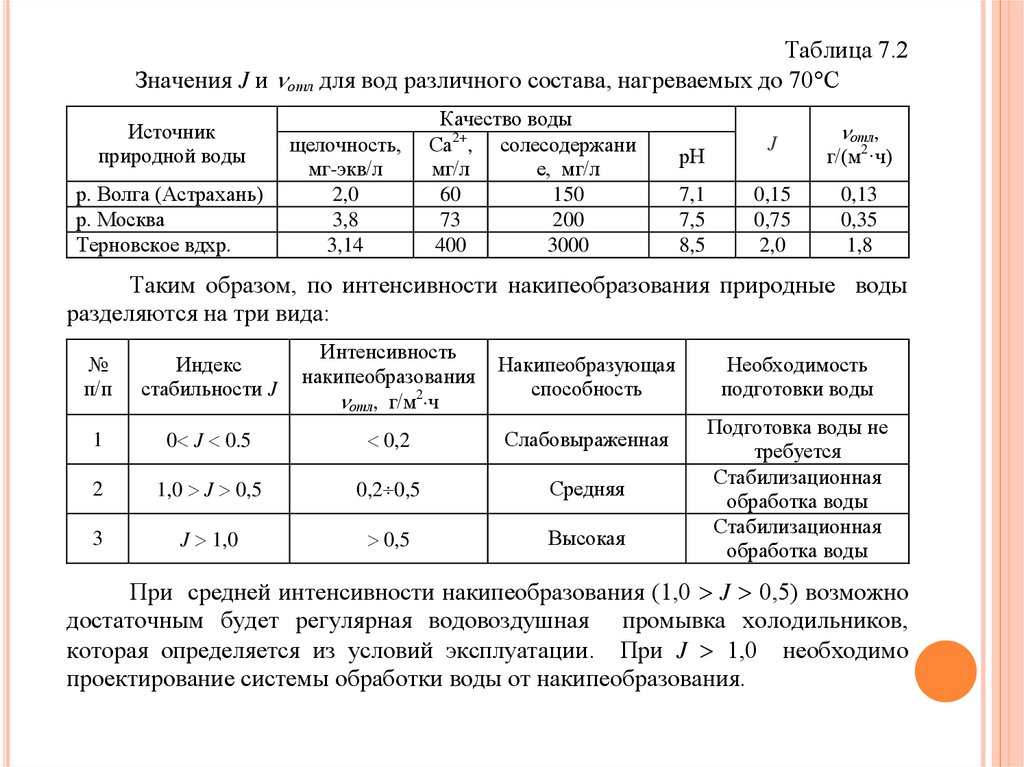
количественные значения интенсивности накипеобразования отл (табл. 2).
11.
Таблица 7.2Значения J и отл для вод различного состава, нагреваемых до 70 С
Источник
природной воды
р. Волга (Астрахань)
р. Москва
Терновское вдхр.
щелочность,
мг-экв/л
2,0
3,8
3,14
Качество воды
Са2+, солесодержани
мг/л
е, мг/л
60
150
73
200
400
3000
отл,
рН
J
г/(м2·ч)
7,1
7,5
8,5
0,15
0,75
2,0
0,13
0,35
1,8
Таким образом, по интенсивности накипеобразования природные воды
разделяются на три вида:
№
п/п
Индекс
стабильности J
Интенсивность
накипеобразования
отл, г/м2 ч
Накипеобразующая
способность
1
0 J 0.5
0,2
Cлабовыраженная
2
1,0 J 0,5
0,2 0,5
Средняя
3
J 1,0
0,5
Высокая
Необходимость
подготовки воды
Подготовка воды не
требуется
Стабилизационная
обработка воды
Стабилизационная
обработка воды
При средней интенсивности накипеобразования (1,0 J 0,5) возможно
достаточным будет регулярная водовоздушная промывка холодильников,
которая определяется из условий эксплуатации. При J 1,0 необходимо
проектирование системы обработки воды от накипеобразования.
12.
1.2. Условия накипеобразования в оборотных системахУсловия накипеобразования в оборотных системах имеют более сложный
характер, чем в прямоточных, так как на этот процесс одновременно влияют
интенсивность испарения воды, потеря водой углекислоты в охладителе,
многократные нагрев и охлаждение, содержание органических веществ и т.п.
В оборотных системах также должно устанавливаться определенное
соотношение между концентрацией в воде СО 2 и щелочностью воды. Однако
в оборотных системах, в связи с потерей растворенной углекислоты в
охладителях и многократным нагревом воды, равновесие достигается путем
распада бикарбонатов.
Исследования Г.Е. Крушеля и И.Э. Апельцина показали, что
углекислотное равновесие в воде промышленных оборотных систем и на
модельных оборотных системах не подчиняется закону распада бикарбоната по
уравнению (7.5). В циркуляционных системах наблюдаются значительно
большие щелочности воды, чем те, которые согласно уравнению (3) могли бы
удерживаться малыми концентрациями СО2. Исследователями было отмечено,
что в оборотных системах наблюдается предел распада бикарбонатов, ниже
которого значение щелочности не снижается даже практически при полном
удалении СО2.
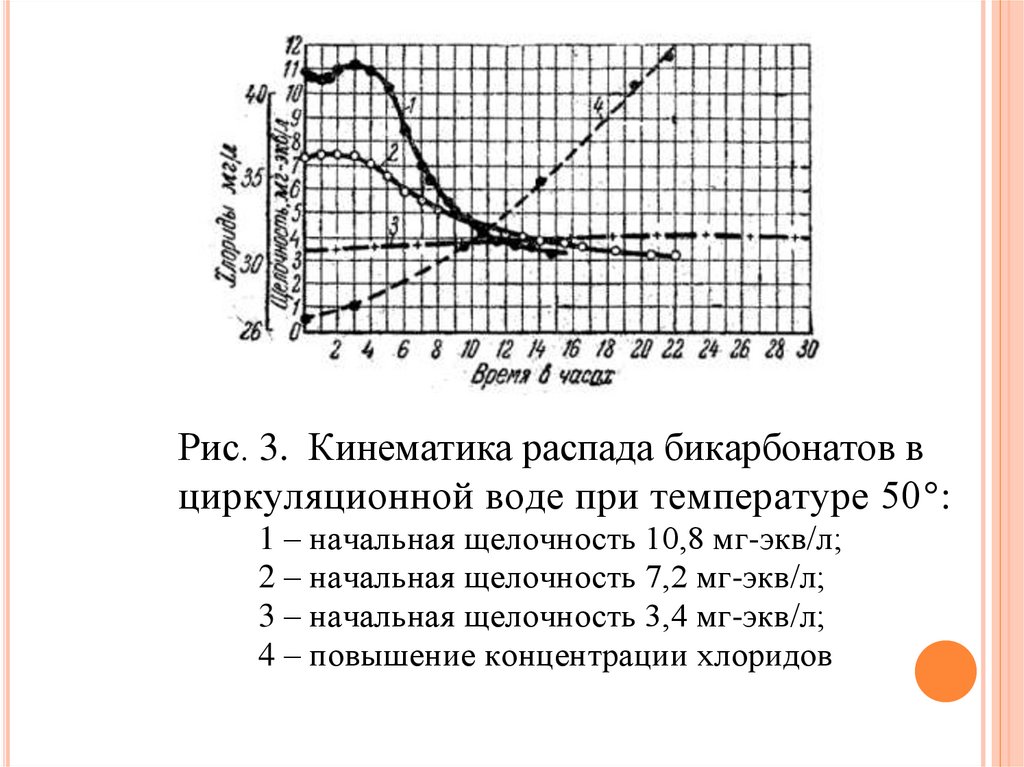
На рис. 3 представлены экспериментальные данные, полученные
И.Э. Апельциным во ВНИИ ВОДГЕО на лабораторной установке
оборотной системы.
13.
Рис. 3. Кинематика распада бикарбонатов вциркуляционной воде при температуре 50 :
1 – начальная щелочность 10,8 мг-экв/л;
2 – начальная щелочность 7,2 мг-экв/л;
3 – начальная щелочность 3,4 мг-экв/л;
4 – повышение концентрации хлоридов
14.
Были проведены три цикла исследования с водами, имеющими начальнующелочность 10,8, 7,2 и 3,4 мг-экв/л.
Опыты показали, что при начальной щелочности воды более 3,4 мг-экв/л
происходит достаточно быстрый распад бикарбонатов до предельной
щелочности 3,5 мг-экв/л при одновременном уменьшении содержания в воде
СО2 до 1 1,5 мг/л. Такому малому содержанию СО2 должна была бы, согласно
формуле (7.5), отвечать щелочность воды около 1,5 мг-экв/л.
При начальной щелочности 3,4 мг-экв/л происходит рост щелочности до
значения 4,0 мг-экв/л
за счет коэффициент концентрации. Начальная
концентрация хлоридов составляет Clн = 25 мг/л и в конце опыта (через 20
часов) составила Clк = 40 мг/л.
Коэффициент концентрирования
Cl
40
Кк к
1,6 .
Clн 25
Опыты на лабораторной установке оборотной системы с начальной
щелочностью воды 1,5 2,0 мг-экв/л показали, что в беспродувочном режиме
происходит нарастание щелочности до 2,5 3,0 мг-экв/л
по закону
концентрирования.
Однако
предельное
значение
коэффициента
концентрирования по щелочности всегда меньше, чем по хлоридам.
15.
Щ s предClпред
.
(10)
Щ s под
Clпод
При этом Щпред всегда больше, чем щелочность, согласно уравнению (3),
для фактической концентрации СО2.
Можно предполагать, что сохранение относительно высокой
щелочности циркуляционной воды объясняется тем, что в условиях
оборотных систем распад бикарбонатов частично задерживается на стадии
образования карбоната кальция в виде пересыщенного раствора по СаСО 3
или зародышевых кристаллов СаСО3.
При распаде бикарбонатов 2НСО 3 СО 32 СО 2 Н 2О
процесс
зарождения, образования и роста кристаллов СаСО3 проходит через ряд
последовательных стадий:
Са 2 СО32 СаСО3 СаСО3
раствор
пресыщенны й
раствор
СаСО3
зародыши
микрокристаллов
СаСО3 СаСО3 . (11)
аморфный
скелет
кристаллов
кристаллы
16.
На рис. 4 приведены фотографии процесса образования кристалловкарбоната кальция СаСО3, полученные на предметных стеклах при увеличении в
200 раз.
Рис. 7.6. Зародыши кристаллов карбоната кальция (увеличено в 200 раз):
а – образование зародышей кристаллов СаСО3 в нагретой воде;
б – рост зародышей
кристаллов в пересыщенной нагретой воде;
в – переход зародышей кристаллов в
пересыщенном нагретом растворе в аморфное состояние; г – объединение аморфных
зародышей кристаллов в пересыщенном нагретом растворе в укрупненные системы –
мицеллы легко выпадающие из раствора и примыкающие к поверхности, обмываемой водой
17.
Ионы Са2+ и СО 32 , соединяясь в молекулы, постепенно образуютпересыщенный раствор СаСО3. В этом растворе образуются центры
кристаллизации – зародыши (рис. 4,а) которые затем укрупняются (рис. 4,б) и
принимают вид слабой мути. Затем образуется скелет кристаллов (рис. 4,в) и,
наконец, сами кристаллы СаСО3 (рис. 4,г).
Процесс кристаллизации ускоряется при наличии в среде определенных
зародышей – начальных частиц, вокруг которых протекает дальнейшее
образование кристаллов. Такие зародыши могут образовываться за счет самой
кристаллизующейся среды или мелкодисперсных частиц. Особенностью
образования кристаллов является непрерывность процесса от зародыша
микрокристалла до кристалла, так как рост кристалла (увеличение размера)
происходит только на чистой поверхности кристалла.
При определенных условиях процесс кристаллизации СаСО3 может быть
остановлен на любой из стадий, предоставленных уравнениями (11).
Поэтому в этой системе отдельные стадии распада бикарбоната находятся
в динамическом равновесии.
В анализе щелочности воды, предварительно профильтрованной через
мембранные фильтры № 1, определяются не только ионы НСО 3 , но и
различные формы СаСО3, включая зародышевые микрокристаллы. В отличие
от обычных природных вод, для которых щелочность воды определяется
концентрацией ионов НСО 3 для циркуляционных вод, щелочность
определяется суммой ионов НСО 3 и мелкодисперстных частиц СаСО3.
18.
По-видимому, этим и определяется то, что для природных водсоотношение между щелочностью и равновесной СО2 совпадает с
теоретическим соотношением между НСО 3 и СО2, а для циркуляционных вод
щелочность оказывается обычно выше той, которая отвечает теоретическому
соотношению (3).
Процесс кристаллизации СаСО3 тормозится загрязнениями воды.
Влияние органических веществ природной воды на образование осадка
карбоната кальция было отмечено в процессах реагентного умягчения. В начале
прошлого столетия умягчение воды для паровых котлов осуществлялось
известково-содовым методом за счет введения в воду Na2CO3 и Са(ОН)2, при
этом в осадок выпадали СаСО3 и Mg(OH)2. Исследования показали, что при
перманганатной окисляемости воды 75 100 мг О2/л выпадение осадков СаСО3
и Mg(OH)2 практически прекращается.
Для природной воды основными загрязнениями являются гуминовые
вещества, для оборотной воды это органические вещества (нефтепродукты,
масла, жиры), а также поверхностно-активные вещества. В последние годы
ПАВ применяются как диспергаторы для карбоната кальция.
Так как соотношение концентрации бикарбоната в оборотной воде и
свободной углекислоты не подчиняется закону распада по уравнению (3), то
неприменимым является использование индекса стабильности J (уравнение (9))
для определения вероятности накипеобразования.
19.
На основании исследований установлено, что предельный уровеньраспада бикарбоната в оборотной системе Щ0 = 3 мг-экв/л. В нормах СНиПа
установлено, что обработку оборотной воды для предотвращения карбонатных
отложений (накипеобразования) следует предусматривать при условии
Щпод · Кк 3 мг-экв/л,
(12)
где Щпод – щелочность (карбонатная жесткость) подпиточной воды, мг-экв/л;
Кк – коэффициент концентрирования (упаривания).
В качестве методов предотвращения накипеобразования рекомендуется:
подкисление, рекорбонизация, фосфатирование, комбинированная фосфатнокислотную обработка и магнитная обработка.
При
Щоб 3,0 мг-экв/л
не рекомендуется разработка методов
предупреждения накипеобразования, однако это не означает, что в оборотной
системе при указанных условиях полностью исключается накипеобразование.
Процессы накипеобразования в оборотной системе протекают и при
меньших значениях щелочности и определяются температурой нагрева
оборотной воды, температурой охлаждаемого продукта, скоростью протока
воды по трубкам холодильника, концентрацией и качественной
характеристикой взвешенных веществ.
20.
Опыты, проведенные на полупроизводственной установке с нагревомоборотной воды до 50 93 С и последующим охлаждением на градирне до
30 35 С, показали, что с повышением температуры нагрева воды быстрее и
интенсивнее идет процесс распада гидрокарбонатного иона, особенно при нагреве
воды свыше 70 С.
На основании многочисленных экспериментов установлена максимальная
температура нагрева воды из условия накипеобразования 45 С.
Температура нагрева имеет существенное, но не главное значение в
процессе накипеобразования в трубках кожухотрубных холодильников.
На процесс накипеобразования влияет температура охлаждаемого
продукта, которая определяет температуру внутренней стенки трубки.
Наибольшая интенсивность накипеобразования имеет место в трубках
холодильников при температуре охлаждаемого продукта Тпр 100 С. Это
объясняется тем, что в тонком ламинарном слое происходит быстрый и полный
распад бикарбоната кальция вследствие перегрева воды до Т 100 С.
Парообразование не происходит из-за работы системы под давлением более 2
атм. При этом на поверхности трубок образуется плотный кристаллический
осадок карбоната кальция, который не удаляется водовоздушной промывкой.
Для холодильников с температурой охлаждаемого продукта Тпр 80 С
вместо кристаллического осадка карбоната кальция образуются рыхлые,
грязевидные отложения, которые могут удаляться водовоздушной промывкой.
На процесс накипеобразования в трубках кожухотрубных холодильников
оказывают существенное влияние концентрация взвешенных веществ и
скорость протока воды.
Взвешенные
вещества
в
системе
оборотного
водоснабжения
нефтеперерабатывающих заводов – биологического происхождения, т.е. это
продукт иммобилизованного биоценоза.
21.
При скорости протока воды по трубкам холодильников 0,7 м/собеспечивается их незаиливание. Большинство кожухотрубных холодильников
имеет скорость протока воды 0,3 м/с. При указанной скорости движения
воды происходит сорбция взвешенных веществ на биопленке в трубках
холодильников до полного заиления. В каждом ходе кожухотрубного
холодильника имеется от 20 до 100 трубок, которые работают в параллельном
режиме. Рассмотрим режим работы теплоотдающей трубки кожухотрубного
холодильника в данных условиях. После заиления трубки биомассой
происходит перегрев воды в пристеночном слое, который приводит к
образованию пленки карбоната кальция. Это снижает сцепление биомассы со
стенкой, и за счет давления воды биомасса выдавливается из трубки.
Пристеночный слой охлаждается водой до температуры, благоприятной для
образования биопленки и последующего заиления трубки. Многократность
повторения указанного процесса приводит к полной кальматации трубки
холодильника карбонатом кальция. При этом щелочность оборотной воды
может быть и ниже 2 мг-экв/л. Такой процесс накипеобразования следует
считать термическим, т.е. происходит нагревание воды более 100 С. Таким
образом, предотвращение
накипеобразование в оборотных системах
нефтеперерабатывающих заводов состоит из комплекса мероприятий по
снижению концентрации органических веществ (нефтепродуктов), повышению
скорости
протока
воды
в
холодильниках,
снижению
температуры
охлаждаемого продукта. Поэтому методы предупреждения накипеобразования,
обеспечивающие условие Щоб 3,0 мг-экв/л являются необходимыми, но не
достаточными
для
обеспечения
минимальной
интенсивности
накипеобразования в трубках холодильников.
Результаты
опытов
с
грунтовыми
водами
показали,
что
к
термостабильным можно отнести грунтовые воды с карбонатной жесткостью
только до 1,5 мг-экв/л, к ограниченно термостабильным от 1,5 до 3,0 мг-экв/л и
к нетермостабильным при карбонатной жесткости свыше 3 3,5 мг-экв/л.


















 Промышленность
Промышленность








