Похожие презентации:
Введение в технологию редких и радиоактивных элементов
1.
Введение в технологию редкихи радиоактивных элементов
Половов
Илья Борисович
Доцент, канд. хим. наук
2.
• Обогащение руд• Переработка концентратов минералов
редких металлов
• Получение чистых соединений
• Металлургия редких металлов
• Рафинирование редких металлов
3. Обогащение руд
Цель процесса – максимальноеобогащение бедной рудной массы по
ценному компоненту для удешевления
последующей переработки
Результат процесса – рудный
концентрат, состоящий, в основном,
из минерала ценного компонента
4. Обогащение руд. Титаномагнетиты
Добыча рудСкальные горные породы
разрабатываются с помощью
буровзрывных работ
Добыча руды ведется открытым
способом
5. Обогащение руд. Титаномагнетиты
ОбогащениеОсновной компонент руды - железо
(содержание 16.6 %)
Ванадий – побочный продукт,
изоморфно замещает железо
Обогащение ведут методами
магнитной сепарации
Транспортировка руды до дробильной
фабрики осуществляется ж/д
транспортом
6. Обогащение руд. Титаномагнетиты
ОбогащениеНа Качканарском ГОКе для
обогащения руды сооружен комплекс
цехов:
крупного дробления
среднего и мелкого дробления
обогащения
7. Обогащение руд. Титаномагнетиты
ОбогащениеКраткая характеристика:
дробление ведут в 4 стадии от 0-1200 мм
до -20 мм на конусных дробилках
классы +12 и +6 мм подвергаются сухой
магнитной сепарации (СМС)
мокрое магнитное обогащение включает в
себя три стадии измельчения и четыре
стадии мокрой магнитной сепарации
(ММС), в процессе которых,
последовательно вскрываются зерна
магнетита и удаляется пустая порода
8. Обогащение руд. Титаномагнетиты
ОбогащениеКраткая характеристика:
измельчение до -1 и -0.5 мм осуществляют
на стержневых мельницах
после 4-ой сепарации концентрат сгущают и
фильтруют на дисковых вакуум-фильтрах
пески сгустителей перед фильтрацией
размагничивают
пустая порода - сырье для производства
щебня, хвосты ММС отправляют на
осветление
9.
Исходная рудаI стадия дробления
(1400÷500 – 0 мм)
II стадия дробления
(150÷20 – 0 мм)
Грохочение
+ 60 мм
-60 мм
III стадия дробления (60÷10 – 0 мм)
Грохочение
-20 мм
+ 20 мм
IV стадия дробления (20÷4 – 0 мм)
Грохочение
10.
Грохочение-20 +12 мм
-6 мм
-12 + 6 мм
Сухая магнитная
сепарация (2 раза)
магнит.
фракция
Сухая магнитная
сепарация (2 раза)
магнит.
фракция
хвосты
Измельчение (1.5-0 мм)
Грохочение
-4 мм
H2O
магнит.
фракция
+4 мм
Мокрая магнитная
сепарация (2 раза)
Измельчение (0.5-0 мм)
хвосты
11.
Измельчение (0.5-0 мм)H2O
Мокрая магнитная
сепарация (2 раза)
хвосты
Размагничивание
ниж. слив
Фильтрация
кек
магнит.
фракция
Сгущение
верх. слив
Сгущение
фильтрат
Фильтрация
кек
слив
фильтрат
Железо-ванадиевый концентрат
12. Обогащение руд. Лопарит
ЛопаритЛопарит Ловозерского месторождения единственное промышленное сырье в России для
получения РЗМ (ООО «Ловозерский ГОК», п. Ревда
Мурманской обл.)
Лопарит
– комплексный
минерал–титана,
Запасы
лопарита в России
7 млн.ниобия,
т
тантала и РЗМ
Содержание
лопарита
в руде – 3-5
%
Необходима
комплексная
переработка
Извлечение
лопарита
в концентрат
– 75-80 %
Лопарит
добывают
подземным
способом
минерала
Горно-геологические условия редкометальных
руд Ловозерского месторождения относят к
неблагоприятным(наличие газопроявлений
CH4 и H2, значительная водообильность)
13. Обогащение руд. Лопарит
Обогащение лопаритаВ состав лопаритсодержащих руд входят
эгирин NaFe[Si2O6], нефелин NaAl[SiO4],
полевой шпат [К, Na][AlSi3O8], апатит
Исходную руду (3-5 % лопарита)
подвергают дроблению до -12 мм
(щековые дробилки) и мокрому
измельчению до –0.63мм (стержневые
мельницы)
Измельченный материал подвергается
гидравлической классификации
14. Обогащение руд. Лопарит
Обогащение лопаритаКрупные классы направляют на отсадку, а
мелкие – на концентрационные столы.
Применяют многодековые опорные
концентрационные столы
На стадиях доводки используют винтовые
сепараторы и конические классификаторы
Получаемый после гравитационного
обогащения концентрат обезвоживают,
сушат и подвергают электромагнитной
сепарации для удаления эгирина
1 Na,Fe[Si
— пульсатор;
2O6] 2 — авторегулятор;
3 — отсадочное решето; 4 — разгрузочное
устройство.
15.
Лопаритовая рудаДробление (до -12 мм)
H2O
Мокрое измельчение
-0.63 мм
крупная
фракция
Грохочение
+ 0.63 мм
Гидравлическая классификация
Гравитационное обогащение
тяжелая фракция
легкая фракция
мелкая
фракция
в отвал
Обезвоживание, сушка
немагнитная фракция
Магнитная сепарация
Лопаритовый концентрат
магнитная
фракция
Эгириновый к-т
16. Принципиальная схема обогащения лопарита
17. Обогащение руд. Циркон
ЦирконОсновные
запасы
циркона
связаны
с ПМР,ВГГМК
Добычу
ПМР обычно
ведут открытым
способом
Горно-геологическая
характеристика
карьеров
(карьеры)
содержащими помимо циркона, минералы титана
Содержание минералов,
Средняя
Средняя (олова,
тория, железа)
Для извлечения
относительно
бедных
кг/м3
Номер
мощность
мощность россыпей Тарского и Лукояновского
погребенных
карьера
вскрыши,
пласта, м
м
месторождений циркона
предложено
циркон
рутил
ильменит
Необходима комплексная переработка руд
использовать метод скважинной гидродобычи
4
13.3
38
12.3
20.7
55.7
(метод подземной добычи твёрдого полезного
5
14.5
38
15.5
17.3
47.1
ископаемого,
на разрушении
и
Циркониевые иоснованный
титановые концентраты
получают
6
11.6
38
10.9
15.4
39.3
доставке
его
к
скважинам
водой
и
выдачи
в виде
комбинацией гравитационных, магнитных,
7гидросмеси
11.0 на поверхность)
42
9.8
15.2
41.6
электрических
и флотационных методов
18. Обогащение руд. Циркон
1 – расходнаянасадка;
2,5,8,9,12 – трубы;
Обогащение руд. Циркон
3 – цилиндр;
4 – клин; 6,13,14 –
Гравитационное обогащение
узел регулировки;
1 – бункер, 2 –
винтовой
Первичное обогащение
(выделение
7 –желоб;
рама;
всех тяжелых3минералов
– крепление желоба
в концентрат)
10к–каркасу;
патрубок;
осуществляют
конусных
4 –вустройство
длясепараторах
смывной
воды;
11 – кольцевой
5 – каркас;
6 – отсекатель;
На стадии доводки
используют
желоб;
7 – хвостовой
желоб
винтовые сепараторы
и
15
– отсекатель;
Необходимо
максимальное
извлечение
концентрационные столы 16 – отклоняющее
ценных минералов
кольцо; 17 –
Электромагнитное обогащение
Производительность
их в 10-20
раз выше,и
регулировочный
Применяют
высокопроизводительные
болт; 18 – конус;
чем у концентрационных
столов
высокоградиентные
сепараторы
Сепарация – сухая 19 – конусное
кольцо;
20 – перегородка
19. Обогащение руд. Циркон
Электростатическая сепарацияОснована на различии в электропроводности
материалов
Все минералы
в ильменит,
электростатическом
поле
Проводники:
магнетит,
рутил, хромит
FeCrO4
поляризуются, а затем направляются к
вращающемуся
Непроводники:
циркон,электроду
алюмосиликаты (гранат
(Mg,Fe,Mn)3Al2(SiO4минералов
)3 , ставролитостаются
Частицы непроводящих
на электроде,
а4[SiO
частицы
проводящих
Fe(II)Al
O[SiO4],
4]4O2(OH)
2, дистен Al2—
передаюттурмалин
свой заряд электроду, заряжаются
одноименно
электродом
(Na,сCa)(Mg,
Fe, Li)3и
Al6отталкиваются
[Si6O18][BO3]3(OH)4),
от него монацит, кварц
20. Обогащение руд. Циркон
Обогащение ТЦРНа
Если
в коллективном
концентрате
преобладают
I этапе
осуществляют
дезинтеграцию
в
рутил, цирконобесшламливание
и алюмосиликаты,вто
процесс
скрубберах,
гидроциклонах
и
струйных
зумпфах иобычно
гравитационное
доводки начинается
с переделаобогащение
на
многоярусных конусных
сепараторах
электростатической
сепарации
Для получения
индивидуальных
концентратов
Если
же в коллективном
концентрате
преобладает
используют
сочетание
и
магнитный
ильменит,
то электростатической
технологический процесс
электромагнитной
сепарации
начинается
с передела
магнитной сепарации
Последовательность операций доводки зависит от
состава концентрата
21.
Принципиальная схема переработки ТЦР на ВГГМКПески ТЦР
Дезинтеграция
- 20 мм
H 2O
Грохочение
Обесшламливание
- 4 мм
cлив
Грохочение
Обогащение на конусных сепараторах
коллективный
концентрат
Сгущение
Сушка
+ 20 мм
В отвал
+ 4 мм
В отвал
хвосты
На получение
кварцевых
песков
22.
СушкаЭлектростатическая сепарация
Проводящая фракция
(рутил, ильменит)
Непроводящая фракция (циркон,
ставролит, дистен, монацит)
Электромагнитная
сепарация
Электромагнитная
сепарация
Магнитная
Немагнитная
Слабофракция Немагнитная
фракция
магнитная
фракция
фракция
(циркон,
Ильменитовый
Рутиловый
дистен)
концентрат
концентрат
Гравитационное обогащение
Легкая фракция
Дистеновый
концентрат
Сильномагнитная
фракция
Ставролитовый
концентрат
Тяжелая фракция
Монацитовый продукт
Цирконовый (на захоронение)
концентрат
23. Обогащение руд. Апатит
Апатит80-х гг
прошлого века
эта схема
прошла
В конце
Кольский
апатитовые
руды
–
промышленные
испытания
и была рекомендована
перспективное
и уникальное
сырье дляк
внедрению
на ОАО «Апатит»
комплексной
переработки,
содержит
соединения стронция, редкоземельных
В ОАО «Акрон» (г. Великий Новгород) с 2012 г. начат
элементов и фтора
выпуск концентрата РЗМ из апатитового сырья
При применяемом сернокислотном
методе РЗМ не извлекают
Перспективна азотнокислая схема
переработки апатита
24. Обогащение руд. Апатит
АпатитХибинские месторождения апатитнефелиновых руд - уникальные по
запасам и качеству месторождения
фосфатного сырья, расположенные в
Мурманской области на Кольском
полуострове
Добычу
апатита
ведут
на АО «Апатит» (ГК
Разведанные
запасы
апатит-нефелиновых
Фосагро)
и АО «Северо-западная
руд превышают
4 млрд. т с содержанием
фосфорная компания» (ГК Акрон)
P2O5 7.5-17.5%
Руду добывают открытыми (карьеры) и
подземными (шахты) способами
25. Обогащение руд. Апатит
Обогащение апатитаЦелесообразна
Основными породообразующими
комплексная переработка
минералами апатит-нефелиновых руд
руд с выделением нефелинового
являются апатит (43.2 %), нефелин
(производство алюминия и соды),
(Na,K)[AlSiO4] (37.9 %), титанит или
сфенового
(производство
лакокрасочной
сфен CaTi[SiO4](O,OH,F) (2.5 %),
продукции
основе
диоксида
титана),
пироксены на
(8.9
%) – эгирин
NaFe[Si
2O 6]
(производство
глазурей
и
иэгиринового
эгирин-авгит
Ca(Mg,Fe,Al)[Si
O
],
2 6
фарфора)
титаномагнетитового
полевой
шпати(K,Na,Ca)[AlSi
3O8] (2.8 %)
(выплавка стали)
и титаномагнетит
FeFeконцентратов
2O4·FeTiO3 (2.2 %)
26. Химическая технология РЗЭ. Обогащение руд
Обогащение апатитаИсходная руда подвергается крупному,
среднему и мелкому дроблению до
крупности -900, -45 и -28 мм на
конусных дробилках, работающих
последовательно с колосниковым и
инерционным грохотами
Дробленная руда измельчается в
шаровых мельницах, работающих в
цикле с односпиральным
классификатором и гидроциклонами
27. Химическая технология РЗЭ. Обогащение руд
Обогащение апатитаОсновной метод обогащения - флотация
Готовый флотационный концентрат
обезвоживают в гидроциклонах и
сгущают в сгустителях
Нижний слив сгустителя фильтруют на
дисковых вакуум-фильтрах и сушат при
500 0С в сушильных барабанах,
подключенных к системе
пылеулавливания
28.
Апатитовая руда+900 мм
I грохочение
Крупное дробление (-350 мм)
+130 мм
II грохочение
Среднее дробление (-45 мм)
+28 мм
- 900 мм
- 130 мм
III грохочение
Мелкое дробление (-6 мм)
- 28 мм
На измельчение (в мельничнофлотационное отделение)
29.
Дробленная апатитовая рудаH2O
Мокрое измельчение
слив
слив
слив
Пенная фракция
I классификация
пески
II классификация
пески
III классификация
пески
Флотация
Фильтрация
Фильтрат
Топочные газы
Сушка, 5000С
Апатитовый концентрат
Хвосты
На извлечение
вторичных
концентратов
Пыль
Пылеулавливание
30. Обогащение руд. Апатит
ФлотацияФлотация – способ разделения минералов,
основанный на различии в их смачиваемости
Основные термины:
1. Собиратель – вещество, способное
адсорбироваться на поверхности минерала и
придать ей гидрофобные свойства
2. Активатор – вещество, активирующее
переход ценного минерала во флотационную
пульпу
31. Обогащение руд. Апатит
ФлотацияФлотация – способ разделения минералов,
основанный на различии в их смачиваемости
Основные термины:
3. Депрессор – вещество, препятствующее
переходу ценного минерала во флотационную
пульпу
4. Пенообразователь – вещество, благодаря
которому на поверхности жидкости образуется
пена, удерживающая частицы минералов
32. Обогащение руд. Апатит
ФлотацияЭффективность
определяется:
Процесс флотациифлотации
ведут во флотационных
машинах
1. Смачиваемостью частиц минерала водой
2. Продолжительностью контакта с реагентами
3. Плотностью пульпы
4. Температурой
Группы собирателей:
анионные – органические кислоты, мыла и т.д.
катионные – амины, соли аминов и т.д.
аполярные – минеральные и древесные масла и
смолы, не диссоциирующие в воде
33. Обогащение руд. Апатит
Флотация апатитаВ качестве собирателя для флотации апатита
выбраны талловые масла, основой которых
являются входящие в их состав
высокомолекулярные карбоновые кислоты
Определяющим элементом с точки зрения сорбции
жирнокислотного собирателя является кальций, что
определяет предпочтительную флотацию апатита
Технологическая схема получения апатитового
концентрата включает в себя основную, контрольную
Талловые
масла
– смесь ненасыщенных
и три
перечистные
операции.
жирных кислот, получаемых в ходе
переработки целлюлозы
34. Переработка концентратов минералов редких металлов
Переработка концентратов подразумеваетотделение извлекаемого металла от основной
массы сопровождающих элементов и
концентрирование его в растворе или осадке.
Цель достигается пирометаллургическими
процессами (спекание, обжиг, возгонка) или
гидрометаллургическими методами
(обработка кислотами, растворами щелочей и
т.п.)
35.
Переработка концентратов минераловредких металлов. Сподумен
Физико-химические основы процесса вскрытия:
1). (Li,Na)Al[Si2O6]
Li(Na)[AlSi2O6]
α-сподумен 1100 0С β-сподумен
2). Li[AlSi2O6] + H2SO4 → Li2SO4 + H[AlSi2O6]
Выщелачивание:
1). СaCO3 + H2SO4 → CaSO4 + H2O + CO2
2). 5СaCO3 + 2 H[AlSi2O6] → 4CaSiO3 + Ca(AlO2)2
+H2O + 5CO2
3) Li2SO4 (тв) → Li2SO4 (р-р)
36.
Переработка концентратов минераловредких металлов. Сподумен
Очистка от примесей:
1). Сa(OH)2 + MgSO4 → CaSO4 + Mg(OH)2
pH = 12-14
2). Na2CO3 + CaSO4 → CaCO3 + Na2SO4
3). 4NaAlO2 + 2H2SO4 + 4H2O → 4 Al(OH)3 + 2Na2SO4
4NaFeO2 + 2H2SO4 + 4H2O → 4 Fe(OH)3 +2Na2SO4
pH = 7
4). Li2SO4 + Na2СO3 → Li2CO3 + Na2SO4
37.
Схема переработки сподуменового концентрата сернокислотым способомОбогащенная руда, 3-5%
Декрипитация, T=1100 0C
Охлаждение до T=120 0C
93% H2SO4
изб. 130-140%
Измельчение (-0,074мм)
Сульфатизация, Т=250 0С
CaCO3
Выщелачивание (pH= 6-6,5)
Фильтрование
Раствор Li2SO4
Осаждение Mg, Ca
(pH=12-14)
Шлам
Ca(OH)2
Na2CO3
H2O
Промывка
Шлам в отвал
Фильтрование
Фильтрование
10% раствор Li2SO4
Осадок Mg(OH)2 , CaCO3
На выщелачивание
Осадок гидроксидов Al, Fe
Упаривание (pH=7)
Фильтрование
Сажа
H2SO4
Промывная вода
38.
20% раствор Li2SO4Na2CO3
Осаждение, T=90 0C
Фильтрование
Маточный раствор
на выщелачивание
Кристаллы
H2O
Промывка
Фильтрование
Промывная вода
на выщелачивание
Кристаллы Li2CO3
Сушка
Li2CO3
39.
Переработка концентратов минераловредких металлов. Сподумен
Аппаратура
Обжиг и сульфатизацию проводят в
вращающихся трубчатых печах
Выщелачивание сульфатной массы ведут
в реакторе при непрерывном
перемешивании сжатым воздухом
Операции фильтрации и промывку
осуществляют на барабанном вакуумфильтре
Карбонат лития отделяют от маточного
раствора
центрфугированием
1 - разгрузочный
бункер;
2 - питающая труба; 3 - механизм среза осадка;
4 - кожух; 5 - ротор; 6 - опоры вала; 7 - вал; 8 - станина; 9 - привод.
40. Сернокислотный способ переработки сподумена
41.
Переработка концентратов минераловредких металлов. Сподумен
• Сухой карбонат лития в качестве основных
примесей содержит 0.18 % (Na2O+K2O), 0.04 %
CaO, 0.35 % SO42-.
• При переработке концентратов степень
извлечения лития составляет 85 –90 %, в целом,
за счет потерь при обогащении, выход лития в
карбонат из руды составляет 50 – 55 %.
• Современные направления совершенствования
этой технологии предполагают использование
автоклавного вскрытия серной кислотой при
температуре до 400 0С без предварительной
декрипитации
42. Переработка концентратов минералов редких металлов. Шеелит
Переработка шеелита. ХимизмАвтоклавно-содовый способ вскрытия шеелита
основан на обменной реакции
CaWO4(тв.) + Na2CO3(р-р) = Na2WO4(р-р) + CaCO3(тв.)
Для обеспечения полноты вскрытия 96-98 %
процесс ведут при давлении 25 атм,
температуре 200-225 0С и избытке соды (150 200 % для концентратов с 45-55 % по WO3 и
300-400 % для материалов, содержащих
15-20 % WO3) в присутствии NaOH (pH=13-14)
43. Переработка концентратов минералов редких металлов. Шеелит
Переработка шеелита. ХимизмПобочные реакции:
СаMoO4 (повеллит) + Na2CO3 = Na2MoO4 + CaCO3
FeAsO4 (скородит) + Na2CO3 + 2H2O =
= Na2HAsO4 + Fe(OH)3 + CO2
Ca5(PO4)3F + 5Na2CO3 + 3H2O = NaF + 3Na2HPO4 +
5CaCO3 + 3NaOH (выход – 75-80 %)
SiO2 + Na2CO3 = Na2SiO3 + CO2 (выход – 60-65 %)
Касситерит (SnO2), халькопирит (CuFeS2),
пирит (FeS2), CaCO3 и др. с содовым раствором
не реагируют и полностью переходят в кек
44. Переработка концентратов минералов редких металлов. Шеелит
Переработка шеелита. ХимизмРастворы вольфрамата натрия обычно
содержат примеси кремния, фосфора,
мышьяка, молибдена, серы, иногда фтора в
форме натриевых солей соответствующих
кислот
Очистка от кремния основана на осаждении
кремнекислоты при нейтрализации раствора
до pH = 8-9 соляной кислотой:
Na2SiO3 + Н2О = H2SiО3 + 2NaOH
45. Переработка концентратов минералов редких металлов. Шеелит
Переработка шеелита. ХимизмДля очистки растворов от фосфора и мышьяка
используют осаждение малорастворимых
аммонийно-магниевых фосфата и арсената
NH4MgPО4 и NH4MgAsО4:
Na2HPO4 + MgCl2 + NH4OH=Mg(NH4)PO4+ 2NaCl +H2O
Na2HAsO4 + MgCl2 + NH4OH=Mg(NH4)AsO4+ 2NaCl +H2O
Для исключения выпадения осадка Mg(OH)2 в
раствор добавляют избыток хлорида аммония
46. Переработка концентратов минералов редких металлов. Шеелит
Переработка шеелита. ХимизмОчистка от примесей фтора осуществляется
осаждением фтористого магния из нейтрального
раствора, в который добавляют MgCl2
Более глубокая очистка от фтора оказалась
нерациональной
При последующих операциях осаждения
искусственного шеелита и его разложения
соляной кислотой примесь ионов фтора
способствует снижению содержания SiО2
(вследствие связывания кремния в H2SiF6)
47. Переработка концентратов минералов редких металлов. Шеелит
Переработка шеелита. ХимизмОтделение молибдена от вольфрама основано
на осаждении трисульфида молибдена MoS3
При добавлении в растворы вольфрамата или
молибдата натрия гидросульфида натрия
образуются сульфосоли Na2МеS4:
Na2MeO4 + 4NaHS = Na2MeS4 + 4NaOH
Константа равновесия реакции для Nа2МоО4
значительно больше, чем для Na2WО4, поэтому
преимущественно образуется сульфосоль Mo
48. Переработка концентратов минералов редких металлов. Шеелит
Переработка шеелита. ХимизмПри последующем подкислении раствора до pH
2.5-3 сульфосоль разрушается с выделением
малорастворимого трисульфида молибдена:
Na2MoS4 + 2НСl = MoS3 + 2NaCl + H2S
Cульфидные осадки содержат 5-10% WО3
Путем растворения сульфидного осадка в растворе
соды и повторного осаждения трисульфида
молибдена можно получить молибденовый продукт
с содержанием WО3 не более 2%
49. Переработка концентратов минералов редких металлов. Шеелит
Переработка шеелита. ХимизмНепосредственное осаждение вольфрамовой
кислоты H2WO4 из растворов после извлечения
Na2WOприводит
молибдена
образованию
4 + CaCl2 =кCaWO
4↓ + 2NaCl
мелкодисперсных плохофильтрующихся
осадков, загрязненных примесями
Предложено использовать осаждение
искусственного шеелита (CaWO4) в виде легко
отстаивающиегося кристаллического осадка
осуществляют раствором СaCl2с его
последующем растворением кислотами
50. Переработка концентратов минералов редких металлов. Шеелит
Переработка шеелита. ХимизмРастворение искусственного шеелита
осуществляют действием соляной или азотной
кислот в горячих растворах (60-70 0С) при
высокой кислотности
CaWO4 (тв) + 2HCl(р-р) = H2WO4 (тв) + CaCl2 (р-р)
Высокая
Промытая,
отфильтрованная
и высушенная
кислотность
обеспечивает
дополнительное
вольфрамовая
кислота
содержит
0.2-0.3мышьяка
%
отделение
вольфрама
от примесей
фосфора,
ипримесей
молибдена (молибденовая кислота растворяется в
растворах
с концентрацией
по–HCl
100 %
г/л)
Общее
извлечение
вольфрама
96-98
51. Переработка концентратов минералов редких металлов. Шеелит
Переработка шеелита. АппаратураШеелитовые флотационные концентраты
тонкодисперсны (более 85 % частиц класса 0.074 мкм) не нуждаются в измельчении
Схема
автоклавной
Процесс
выщелачивания ведут в батарее
установки
непрерывного
колонных
автоклавов периодического
действия. 1-реактор
действия, выполненных из углеродистой стали
подогрева, 2-насос,
Для обогрева
и перемешивания пульпы
3-автоклавы,
4-дроссель,
используется острый пар
5-самоиспаритель,
6-сборник пульпы
52. Переработка концентратов минералов редких металлов. Шеелит
Переработка шеелита. АппаратураПульпа из автоклавов поступает в
самоиспаритель – аппарат, находящийся при
более низком давлении, в котором происходит
интенсивное испарение и вследствие этого
быстрое охлаждение пульпы.
Образующийся вторичный пар используют для
подогрева автоквлавной пульпы
Из самоиспарителя пульпа поступает в
сборники и далее на фильтрацию на дисковых
вакуумных фильтрах
53.
Na2CO3Шеелитовый концентрат
Пар
Выщелачивание (220 0С, 25 атм, 5 ч)
NaOH
H2О
Фильтрация
кек
Промывка
фильтрат
пром. воды
HCl,коагулянты
В отвал
MgCl2
Очистка от
NH4OH As, P и F
осадок
H2О
Промывка
На утилизацию
фильтрат
Фильтрация
пром. воды
Очистка от
кремния
Фильтрация
осадок
На утилизацию
фильтрат
Очистка от Мо
54.
NaHSHCl
Очистка от молибдена
газы
На улавливание
сероводорода
Фильтрация
осадок
раствор
На доизвлечение
Осаждение
молибдена и CaCl (10%) искусственного шеелита
2
вольфрама
HClконц
H2O
Получение
вольфрамовой
кислоты (рН=0)
Промывка
Сушка
Фильтрация
осадок
фильтрат
фильтрат
пром. воды
На утилизацию
Вольфрамовый концентрат (на аффинаж)
55. Переработка концентратов минералов редких металлов. Апатит
Переработка апатитаКольский апатитовый концентрат –
перспективное и уникальное сырье для
комплексной переработки, содержит
соединения стронция, редкоземельных
элементов и фтора
При применяемом сернокислотном
методе РЗМ не извлекают
Перспективна азотнокислая схема
переработки апатита
56. Переработка концентратов минералов редких металлов. Апатит
Переработка апатита. ХимизмВскрытие
Ca5(PO4)3F + 10 HNO3 = 5Ca(NO3)2 + 3H3PO4 + HF
Ln(Sr)PO4 + 3HNO3 = Ln(NO3)3+Sr(NO3)2 + H3PO4
Связывание НF (вводят кремнегель)
4 HF + SiO2 = SiF4 + 2 H2О
6 HF + SiO2 = H2SiF6 + 2 H20
SiF4 + 2 HF = H2SiF6
Выделение стронция
В HNO3(конц) Sr(NO3)2 высаливается из раствора
уже при 50-55 0C
57.
Переработка концентратовминералов редких металлов. Апатит
Переработка апатита. Химизм
Отделение кальция
В HNO3(конц) при -15 0C около 90 % Сa(NO3)2
«вымораживается» в твердую фазу из
растворов в виде Сa(NO3)2∙4H2O
Выделение фтора (вводят соду)
Na2CO3 + H2SiF6 = Na2SiF6 + H2O + CO2
Осаждение РЗЭ (нейтрализуют аммиаком)
При pH=1.5-2 РЗЭ и оставшийся кальций
выпадают в виде фосфатов
58. Переработка концентратов минералов редких металлов. Апатит
Переработка апатита. ОсобенностиРазложение ведут азотной кислотой
(избыток - 10-15 %) в течение 1.5 ч при
50-55 0С в каскаде реакторов из
нержавеющей стали
«Вымораживание»
Сa(NO
3)2 осуществляют
Степень вскрытия
апатита
– 99 %
0
в 3 ступени при 10, 0 и -15 C
Na2SiF6 осаждают при 20-40 0C в присутствии поверхностно-активных веществ
(ПАВ) за 60-90 минут
59.
HNO3(конц)H2O SiO2
Апатитовый концентрат
Разложение (50 0С, 1.5 часа) Промывные
Сгущение, фильтрация
осадок
стронциевый
концентрат
(Sr(NO3)2 и нераств.
остаток)
на получение SrCO3
Осаждение Na2SiF6
(30 0C, 60-90 мин)
фильтрат
воды
(HNO3(конц),
Сa(NO3)2,
H3PO4)
Кристаллизация (-150С)
Фильтрация
фильтрат
осадок
HNO3конц
Промывка (-10 0С)
осадок Ca(NO3)2 4H2O
на конверсию (в NH4NO3
и СaCO3)
60.
Na2CO3Осаждение Na2SiF6 (30 0C, 60-90 мин)
Отстаивание, декантация,
фильтрация
осадок
раствор
H2O
Промывка
NH4OH
на утилизацию
фтора
H2O
Промывка
Концентрат РЗЭ
(25%Ln2O3, 12.5%CaO,
33%P2O5)
Нейтрализация
(pH=1.4, 800C)
Отстаивание,
фильтрация
осадок
фильтрат
на получение
удобрений
61. Переработка концентратов минералов редких металлов. Апатит
Переработка апатита. Выделение РЗЭПри переработке РЗЭ-концентрата
необходимо обеспечить возврат фосфора в
основную технологическую схему
В концентрате
содержится
3% от
Так как апатит
является около
главным
содержащегося
в апатите
фосфора
образом источником
фосфора,
то
Концентрат растворяют в
Из концентрата щелочью
технология выделения РЗЭ должна
азотной кислоте, а затем
осаждают гидроксиды
рассматриваться как побочный процесс
осаждают оксалаты РЗЭ
РЗЭ, переводя фософор в
щавелевой кислотой
Na3PO4
62. Переработка концентратов минералов редких металлов. Апатит
Переработка апатита. ПерспективыАльтернативный вариант выделения РЗМ из
раствора – сорбционное извлечение на катионите
при специально подобранных условиях
63. Переработка концентратов минералов редких металлов. Циркон
Твердофазные реакции (ТФР)Твердофазные реакции – гетерогенные
химические реакции, в которых исходные
вещества и продукты – твердые вещества
Зона реакции:
Взаимодействие начинается на границе фаз
Передвижение более подвижного реагента в
объем (зерно) непрореагировавшего
материала
Разрушение зерна и распространение реакции
64. Переработка концентратов минералов редких металлов. Циркон
Элементарные стадии ТФРАктивация и отрыв от поверхности частиц менее
термостабильного компонента А
Перенос А через разделяющие среды к
поверхности компонента В (внешняя диффузия)
Адсорбция частиц А на поверхности B и
образование тонкого слоя хемосорбированного А
Химическое взаимодействие с образованием АВ
Образование зародышей АВ, а затем слоя АВ,
покрывающего границу раздела фаз
Диффузия частиц А через слой АВ (внутренняя)
65. Переработка концентратов минералов редких металлов. Циркон
G<0Термодинамика ТФР
GT= НT-Т· ST
С точки зрения термодинамики, ТФР
Реакция идут
Энтальпийный
Энтропийный
обычно
до конца, если:
возможна при
фактор
фактор
1. отсутствии
они являются экзотермическими ( Н<0)
2.кинетических
образуются менее упорядоченные
затруднений
структуры ( S>0)
Твердые растворы, смешанные кристаллы,
стекловидная или газовая фаза
66. Переработка концентратов минералов редких металлов. Циркон
Кинетика ТФРОсобенности
диффузионной
кинетики:
Твердофазные
реакции
ТФР
Скорость
реакции сильно
возрастает
при
часто осложнены
образованием
промежуточных
увеличении
температуры
Лимитируются
соединений
Лимитируются
Лимитируются
скоростью
Диффузионное
слоем продукта
диффузией торможение
образования
реакции зависит от скоростью
его свойств: если
удельный
химического
зародышей
объем образующейся
фазы меньше, чем
у
взаимодействия
исходной, то образуется
пористый слой
Очень плотный слой продукта может отслаиваться
Редко
Внешняя
от реагентаВнутренняя
67. Переработка концентратов минералов редких металлов. Циркон
Пути интенсификации ТФРМеханическое измельчение реагентов
(дробление, размол, истирание)
Активирование реагентов (конденсация при
быстром охлаждении, химическое осаждение с
последующей термообработкой, др.)
Увеличение площади контакта реагентов
(брикетирование или гранулирование шихты)
Добавка к шихте легкоплавких веществ
(плавней) или веществ, образующих
легкоплавкие эвтектики с реагентом
68. Переработка концентратов минералов редких металлов. Циркон
Спекание с мелом (известью, Ca(OH)2)В системе ZrO2-SiO2-CaO существует 12
соединений, между которыми
термодинамически возможно протекание 10
основных и 15 побочных реакций
Эвтектические точки – выше 1150 0С
Механизм взаимодействия - сложный
Моносиликат кальция CaSiO3 и ZrO2
Процесс идетвбез
участия
жидкой
фазы
сосуществуют
виде
твердого
раствора
В реальных условиях спекания на ход
процесса
влияют кинетические
факторы и
Увеличивается
энтропия системы
образующиеся промежуточные продукты
69. Переработка концентратов минералов редких металлов. Циркон
Механизм взаимодействия CaO и ZrSiO4I.
ZrSiO4+3CaCO3=
=CaZrO3+Ca2SiO4+3CO2 (1)
II. ZrSiO4+2Ca2SiO4=
=Ca3ZrSi2O9+CaSiO3 (2)
ZrSiO4+CaZrO3=
=CaSiO3+ZrO2 (3)
III. ZrSiO4+Ca3ZrSi2O9=
=3CaSiO3+2ZrO2 (4)
CaO
Ca2SiO
ZrSiO
4, CaZrO
4
3
CaSiO3
Ca3ZrSi2O9
CaSiO3
ZrO2
CaSiO3
ZrO2 3
CaSiO
ZrO2
Скорость реакций уменьшается от 1-ой к 3-ей ступени
70. Переработка концентратов минералов редких металлов. Циркон
Механизм взаимодействия CaO и ZrO2Состав продуктов ВСКРЫТИЯ зависит от
мольного отношения (МО) CaO:ZrSiO4
MO=1
ZrSiO4+CaO=CaSiO3+ZrO2
Для полноты вскрытия необходимо
завершение реакций 2-ой и 3-ей ступени
Достижение равновесия лимитируется самой
медленной реакцией (4)
71. Переработка концентратов минералов редких металлов. Циркон
Механизм взаимодействия CaO и ZrO2Состав продуктов зависит от мольного
отношения (МО) CaO:ZrSiO4
MO=3
CaO
Для полноты вскрытия и достижения равновеЭто наиболее
благоприятный
Ca2SiO4с
, CaZrO
сия необходимо
завершение
реакции
(1) 3
технологической
точки
CaSiOрежим
Большая
подвижность
СaOзрения
обеспечивает
3
Ca3ZrSi
преимущественное протекание
реакций
1-ой
CaSiO
2O9
3
ступени
CaSiO3
ZrO2
Из-за кинетических затруднений
ZrO2частично
протекают реакции 2-ой ступени ZrSiO
4
72. Переработка концентратов минералов редких металлов. Циркон
Солевые добавкиВведение солевых добавок позволяет
ускорить процесс разложения за счет:
Увеличения скорости диффузионных
процессов (внешних и внутренних)
Увеличения числа структурных дефектов в
зернах шихты
Улучшения контакта между компонентами
Солевые добавки позволяют снизить
температуру разложения
73. Переработка концентратов минералов редких металлов. Циркон
Солевые добавкиСолевые добавки могут оказывать
каталитическое действие
При меловом вскрытии наиболее целесообразно использовать CaCl2 (Tпл=774 0C)
ZrSiO4+CaCl2=ZrOCl2+CaSiO3
ZrOCl2+2CaO=CaZrO3+CaCl2
Добавка в шихту 5 % CaCl2 позволяет снизить
температуру спекания на 200-300 0С и уменьшить
время спекания на 1 час
74. Переработка концентратов минералов редких металлов. Циркон
Поведение примесейИмеющиеся примеси взаимодействуют с
СаО, образуя:
железо – феррит Сa2Fe2O5
титан – титанаты CaTiO3, Ca3Ti2O7
алюминий – алюминаты СaO·Al2O3,
3CaO·Al2O3, 12CaO·Al2O3
Отделения циркония от примесей на
стадии вскрытия не происходит
75. Переработка концентратов минералов редких металлов. Циркон
Спекание с мелом. ПараметрыРазложение предварительно измельченной до
-0.16 мм и тщательно перемешенной шихты
ведут во вращающихся печах
Весовое соотношение ZrSiO4:СaCO3:CaCl2
составляет 1:2:(0.06-0.4)
Температура – 1200 0С
Время
спекания20
– 4-5
часовизбытку СaCO3 по
Это
соответствует
%-ному
сравнению
стехиометрией
в расчете
на МО=3
Степень со
разложения
– 97-98
%
76. Переработка концентратов минералов редких металлов. Циркон
Выщелачивание спековДля выщелачивания известковоцирконового спека можно использовать
соляную, азотную и серную кислоты
Процесс ведут при HNO3:Zr>4, HCl:Zr>2,
H2-х
стадийная
одностадийная
2SO
4:Zr=1.2 схема
схема
1. 5-7 %-ные
НА ферритов
Основная
масса
и алюминатов
1.
H2SO
Происходит
избыточного
CaO,
CaCl2,
2. НАконцрастворение
4 конц
разлагается,
титанаты
кальция
Разлагаются
цирконаты
и цирконсиликаты,
кремнекислота
разлагаютсяплотные
силикаты
кальция
золя
Образуется
осадки
SiO2с·xH
O , однако
кальций
растворяются
только
в образованием
H22SO
4 конц
кремнекислоты
H2O·SiO2(р-р)
образует
частично
сорбирующий
переходитгель,
в плохофильтрующийся
гипсцирконий
CaSO4·2H
2O
77. Переработка концентратов минералов редких металлов. Циркон
1-корпус; 2 – приемнаятруба; 3 – пропеллерная
Выщелачивание спеков.
Аппаратура
мешалка; 4 – патрубок
Выщелачивание ведут вдля
каскаде
вывода пульпы;
контактных чанов или аппаратов
5 – патрубокс для ввода
пульпы; 6 – привод
пневматическим перемешиванием
(типа
мешалки;
Пачука)
7 – электродвигатель
Фильтрацию осуществляют
на фильтр-
прессах
1 – корпус; 2 – центральная циркуляционная труба;
3 – патрубок для подачи пульпы; 4 – отражатель; 5 – слив для
пульпы; 6 – транспортный аэролифт; 7 – свободный аэролифт
78.
Цирконовыйконцентрат
СaCO3
СaCl2
Cмешение
Cпекание, 1200 0C, 4-6 ч
H2 O
Грануляция
Измельчение
Сгущение
HCl (5-7 %)
осадок
H2 O
I стадия выщелачивания
Фильтрация
Промывка
осадок
раствор
пром. воды
фильтрат
На извлечение
CaCl2
79.
ПромывкаHCl конц
коагулянты
II стадия выщелачивания
Фильтрация
фильтрат
На получение
чистых
соединений
циркония
осадок
HCl конц
Репульпация
Фильтрация
кек
На сброс
фильтрат
80.
81. Переработка концентратов минералов редких металлов. Циркон
ПреимуществаУниверсальность
Дешевизна реагентов
Высокая степень разложения циркона
Простота организации крупномасштабного
процесса и используемого оборудования
Недостатки
Высокие потери циркония
Недостаточная очистка от примесей (Si, Fe)
Невозможность «прямого» разделения
циркония и гафния
82. Переработка концентратов минералов редких металлов. Циркон
Спекание с кальцинированной содой (Na2CO3)Tпл (Na2CO3)=876 0C
При нагревании сода не разлагается, а
плавится
Процесс ведут в режиме
В системе ZrO2-SiO2-Na2Оспекания-сплавления
невозможно
0С
свободное сосуществованиепри
ZrO
1100-1200
2 и силикатов
– образуются цирконсиликаты, хорошо
растворимые в кислотахДля образования жидкой
Температуры плавления цирконсиликатов
фазы не требуется
0C, а силикатов –
составляют от 1480 до 1540Облегчается
вводить плавни
0
от 750 до 1120 С
выщелачивание
83. Переработка концентратов минералов редких металлов. Циркон
Механизм взаимодействия Na2CO3 и ZrSiO4I.
II.
ZrSiO4+3Na2CO3=Na2ZrO3+Na4SiO4+3CO2
ZrSiO4+Na2ZrO3=Na2ZrSiO5+ZrO2
ZrSiO4+Na4SiO4=Na2ZrSiO5+Na2SiO3
Na2SiO3+ZrO2=Na2ZrSiO5
ZrSiO4если
+Naмольное
Zr23Si
III.
В случае,
отношение
Na42CO
:ZrSiO
2ZrSiO5+Na
2SiO3=Na
3O124
ZrSiO
+2Naвысокой
+ZrO2
больше
1 4из-за
подвижности
соды,
2ZrSiO5=Na
4Zr2Si3O12
образования
жидкой
и газообразной фаз реакции
IV.
ZrSiO4+Na
4Zr2Si3O12=2Na2ZrSi2O7+ZrO2
3-ей и 4-ой ступени не протекают
Скорость реакций уменьшается от 1-ой к 4-ой ступени
84. Переработка концентратов минералов редких металлов. Циркон
Механизм взаимодействия Na2CO3 и ZrSiO4Состав продуктов зависит от мольного
отношения Na2CO3 и ZrSiO4
При
МО 3 вскрытие не осложнено медленным
МО=1
взаимодействием
ZrSiO +Na CO тугоплавких
=Na ZrSiOцирконсиликатов
+CO
4
2
3
2
5
2
Состояние
термодинамического равновесия не
MO=2
достигается
– 2вCO
спеке
содержатся
цирконсиликаты
ZrSiO
4+2Na
3=Na
2ZrO3+Na
2SiO3+2CO2
MO=3
ZrSiO4+3Na2CO3=Na2ZrO3+Na4SiO4+3CO2
85. Переработка концентратов минералов редких металлов. Циркон
Спекание с содой. Аппаратура. ПараметрыСпекание ведут во вращающихся или
шахтных гарниссажных электропечах
Для
пылеулавливания
Весовое соотношение
концентрат:сода=
=1:(3.5÷5)
установливают циклоны
Оптимальная температура 1140-1180 0с
Время вскрытия: 1-1.5 часа
Степень вскрытия – 98-99 %
Пылеунос – до 4 % шихты
86. Переработка концентратов минералов редких металлов. Циркон
Спекание с содой. Поведение примесейПримеси, присутствующие в концентрате,
образуют титанат Na2TiO3, феррит
NaFeO2 и алюминат NaAlO2
Водой
разлагается с
образованием
NaOH и Fe2O3
Также как Na2ZrO3
частично
гидролизуется:
Растворим
в воде
Na2Zr(Ti)O3+H2O=Zr(Ti)O(OH)2 +2NaOH
87. Переработка концентратов минералов редких металлов. Циркон
Содовая схема. ВыщелачиваниеВыщелачивание ведут в 2 стадии: водное и
кислотное
Цель водного выщелачивания – отмывка от
избыточной соды и частичный вывод
кремнекислоты (силикатов)
Na4SiO4+(n+2)H2O 4NaOH+SiO2·nH2O
Цель кислотного выщелачивания –
максимальный перевод циркония в раствор
при удержании кремния в виде кремнегеля
88. Переработка концентратов минералов редких металлов. Циркон
Выщелачивание содовых спеков. ПараметрыВодное выщелачивание
Продукты: цирконийсодержащий раствор –
Реагент – оборотный содовый раствор
на экстракционную очистку (Zr – 25-40 г/л,
Т:Ж=1:(15-25)
– 0.5-2.5 г/л,
SiO2 –
0Cдо 50 мг/л,
Hf
Температура
– 40-60
Fe <–0.1
Ti,
Время
30 г/л,
мин НNO3 – 300-380 г/л)
Продукты:
циркониевый
кек (Na2ZrO3,
Кислотное
выщелачивание
Na
Реагент
–5,45
%-ная 2НNO
ZrO(OH)
, H2O·nSiO
3 (Сизб=250-300
2ZrSiO
2, Na2TiOг/л)
3,,
Fe
Т:Ж=1:(5-10)
2O3, влажность – 15-25 %), содовый
раствор
Температура
– 90-95 0C натриевой селитры)
(на получение
Время – 2-3 часа
89. Переработка концентратов минералов редких металлов. Циркон
Выщелачивание содовых спеков. АппаратураОперации водного и кислотного
выщелачивания ведут в аппаратах из
нержавеющей стали (грануляторы, контактные
чаны, гидроциклоны, центробежные
сепараторы-сгустители и т.д.)
Фильтрацию ведут на рамных фильтр-прессах
(циркониевый кек), дисковых вакуумных
(кремнекислота) и патронных (контрольный)
фильтрах
90.
Цирконовыйконцентрат
Na2CO3
Шихтование (1:(3.5÷5))
Вскрытие, 1150 0C, 1.5 ч
Гашение
оборотный
раствор
Na2CO3
I выщелачивание, 500С, 30 мин, Т:Ж=1:20
на получение
NaNO3 (150-170
г Na2CO3 / л)
оборотный
раствор
Na2CO3
Грохочение
I cгущение, 25 0С
I отмывка от соды
II cгущение , 25 0С
+1.5 мм
91.
растворNa2CO3
(30 г/л)
II cгущение , 25 0С
оборотный
раствор
Na2CO3
II отмывка от соды
III cгущение, 25 0С
осадок
Фильтрация
фильтрат
II выщелачивание, 900С, 2 ч
HNO3 (45 %)
Алюмометилсиликонат натрия
H2Oхол
Коагуляция кремния, 900С, 1 ч
Охлаждение, 40-600С
Корректировка кислотности (до 400 г/л HNO3)
HNO3 (45 %)
Фильтрация
92.
Фильтрациякек
фильтрат
I репульпация, Т:Ж=1:(6-10)
Фильтрация
кек
Контрольная
фильтрация
фильтрат
II репульпация, Т:Ж=1:(6-10)
кек
фильтрат
HNO3 (45 %)
На экстракцию
Фильтрация
фильтрат
кек
На
нейтрализацию
93. Переработка концентратов минералов редких металлов. Циркон
ПреимуществаУниверсальность
Низкие потери циркония
Высокая степень разложения циркона
Хорошая очистка от примесей
Простота организации крупномасштабного
процесса и используемого оборудования
Возможно последующее разделение Zr и Hf
Недостатки
Высокая стоимость реактивов
Агрессивность спека к огнеупорам
94. Переработка концентратов минералов редких металлов. Лопарит
Хлорирование в расплаве. ХимизмПродукты хлорирования
Солевая ванна
Высококипящие
[(Ca,Na,Ln)][Ti(Nb,Ta,Fe)]O
Газы
3 + nC+
твердые хлориды
CO,CO
2, HCl,
+
mCl
=
2
CaCl2, MgCl2,
Cl2, COCl
2
FeCl
=
TiCl
+
NbCl
+
TaCl
+
2, NaCl, KCl,
4
5
5
Низкокипящие
MnCl2, LnCl3, ThCl4
FeClжидкие
при3 + LnCl3 + CaCl2 +
3 +NbOCl
Низкокипящие твердые
нормальных
NaCl
+ nCO2/CO хлориды
AlCl (1800C), FeCl
условиях хлориды
TiCl4 (1360C), SiCl4
(570C), CСl4 (760C)
3
3
0
0
(315 C), NbCl5 (247 C), TaCl5
(2360C), NbOCl3 (4000C)
95. Переработка концентратов минералов редких металлов. Лопарит
Переработка концентратов минераловХлоратор
редких металлов. Лопарит
1 - бункер для
Хлорирование в расплаве. Аппаратура
концентрата
и
Хлоратор представляет собой
шахту
кокса;
прямоугольного сечения с высотой
2 - шнековый
уровня расплава около 3 метров
питатель;
Нагрев хлоратора ведут специальными
3 - хлоратор;
графитовыми нагревателями 4 - фурмы;
смонтированными в стенах аппарата
5 - расплав;
6 -0С
миксер;
Температура процесса 850 –900
7 - летка;
Содержание концентрата в расплаве
8 - охлаждаемый
около 1.5 % , углерода около 5 %
газоход;
9 - патрубок
вывода ПГС.
96. Переработка концентратов минералов редких металлов. Лопарит
Переработка концентратовминералов
Солевой фильтр
редких металлов. Лопарит
1 - корпус
Хлорирование в расплаве. Очистка
от Fe ифильтра,
Al
футерованный
Парогазовую смесь (ПГС) подвергают
очистке
от хлоридов Fe и Al на солевых фильтрах
шамотом; 2 каплеуловительная
камера; 3 - инертная
Принцип солевой очисткинасадка;
состоит в 4 - газоход;
образовании устойчивых соединений
при
5 - колосниковая
взаимодействии пара хлоридов железа
и
решетка;
алюминия с NaCl
6 - аэролифтная
труба; 7 - патрубок
Прочность комплексных соединений на
вывода
основе Fe и Al значительно выше,
чем у ПГС;
8 - загрузочный
Nb, Ta и Ti
бункер хлоридов
калия и натрия
97. Переработка концентратов минералов редких металлов. Лопарит
Хлорирование в расплаве. Системаконденсации
• На 1-ой ступени в специальных камерных
конденсаторах осаждают основную часть
твердых хлоридов тантала и ниобия
• Окончательное улавливание твердых
хлоридов
происходит
в оросительных
Температура
осаждения
твердых частиц ПГС
конденсорах (орошение
околоведут
200 0TiCl
С. 4), здесь
же конденсируются и пары TiCl4
На выходе из оросительных конденсоров
(3-4 шт) температура ПГС 70 до – 6 0С
98. Переработка концентратов минералов редких металлов. Лопарит
Хлорирование в расплаве. КонденсацияПоведение примесей
Вместе с Nb и Ta в камерных
конденсаторах осаждается вольфрам в
виде оксихлорида WOCl4 («камерные»
хлориды).
Пульпа после оросительных
конденсаторов, содержащая примеси
TaCl5, NbOCl3 и в меньшей степени,
WOCl4, SiCl4 и VOCl3 поступает на участок
вакуумной выпарки
99.
Переработка концентратов минераловредких металлов. Лопарит
Хлорирование в расплаве. Вакуум-выпарка
Цель операции – получение технического
0С)
TiCl
(t
=136
4
кип
на дохлорирование
TiCl4 (136 0C)
Смесь хлоридов
VOCl3(127 0C)
Вакуум-выпарка
SiCl4 (58 0C)
SnCl4 (112 0C)
NbCl5 (248 0C)
NbOCl3(400 0C)
«венулетные»
0
TaCl51(231
C)
хлориды
- вакуум-выпарной
аппарат
с перегребающим
0
WOCl4 (204
C)
устройством;
2 - мотор-редуктор;
3 - эжектор;
на ректификацию
4 - холодильник "труба в трубе"; 5 - насос;
6 - циркуляционный бак; 7 - расходный бак
100. Переработка концентратов минералов редких металлов. Лопарит
Хлорирование в расплавеПродукты хлорирования
Плав,
содержащий Концентрат «камерных» и
«венулетных» хлоридов
~ 50-60 %
LnCl3 и ~1 % ~ 60-75 % NbCl5 (NbOCl3) и
~10-15 % TaCl5, примеси:
ThCl4
2 % W, 4 % Si, 0.5 % Ti,
<1 % Fe, Al
Техн.
TiCl4
101. Переработка концентратов минералов редких металлов. Лопарит
NbTa
Ti
РЗМ
Хлорная технология
Извлечение продуктов
93 – 94 %
86 – 88 %
96.5 – 97 %
95.5 – 96 %
102. Переработка концентратов минералов редких металлов. Лопарит
Дохлорирование. Химизм2 MOCl3 + CCl4 Ta(Nb)Cl
= 2 MCl55, +
CO
WCl
AlCl3
6, 2
0C), SiCl , TiCl
(180
(M=Nb,Ta)
0
4
4
200-220 С
2 WOCl4 + CCl4на
= ректификацию
2 WCl6 + CO2
0С
T
(WCl
)
=348
кип
6
0С
330-360
360-400 0С
WCl6, LnCl3, FeCl3
(304 0C)
1 - питатель хлоридов; 2 - емкость с ССl4; 3 - испаритель ССl4;
4 - копильник остатков хлорирования; 5 - сборник остатков;
6 - привод скребков; 7 - многоподовый хлоратор;
8 - камерный конденсатор; 9 - плавильник; 10 - емкость
пентахлоридов; 11 - кожехотрубный конденсатор
103. Переработка концентратов минералов редких металлов. Лопарит
1 - основнойэлектронагреватель
куба;
Переработка концентратов
минералов
2 - пусковой
редких металлов. электронагреватель;
Лопарит
3 - куб
колонны; 4 -датчик
монометра;
Ректификация. Особенности
5 - включает
ректификационная
Технологическая схема
3
колонна; 6 - переливной
основных операции:
патрубок; 7 -для
дырчатая
• предварительная ректификация
8 -TaCl
конденсатор;
отделения примесейтарелка;
от суммы
5 и
9 - смотровое окно;
NbCl5 ;
10 - труба конденсатора;
• ректификационное 11
получение
чистого
- штуцер подачи воды;
NbCl5 с отделением концентрата
TaCl ;
12 - холодильник 5паров
• ректификацию концентрата
TaCl5 13
с -система
теплоносителя;
получением чистого регулироания
танталового давления;
продукта.
14 - датчик манометра;
15 - линия сброса давления
в колонне; 16 - кран отбора
дистиллята
104. Переработка концентратов минералов редких металлов. Лопарит
Ректификация. Особенностисорбция
Ti и Si
переходе высших летучих
Высокая
агрессивность
активированным
хлоридов
Fe и W в менее
газожидкостных
потоков
углем
летучие низшие
Часть W в виде WCl5 (tкип=2860С)
сопровождает тантал
Суть ее: пропускание
хлоридов через
Аппаратура
из спецсталей
на слой
основе
активной насадки, состоящей из смеси
Cr и Ni,
эмалирование
конструкций
латунной
стружки и угля
БАУ
Для очистки от W, а также от примесей
Fe, Si, Ti и Al полученные вещества
направляют на химико-сорбционную очистку
105. Переработка концентратов минералов редких металлов. Лопарит
Метод хлорирования в расплавеДостоинства
Высокая степень вскрытия концентрата (>99 %)
Высокое извлечение ценных компонентов
(94-96 %)
Четкое разделение хлоридов металлов с получением качественных продуктов (чистых хлоридов)
Малый объем вредных стоков
Недостатки
Экологически вреден
Высокая энергоемкость и сложность аппаратуры
106. Получение чистых соединений
Осуществляется химическими процессами вводных растворах (экстракция, ионный
обмен, осаждение, кристаллизация и др.).
Для дополнительной очистки могут
применяться и высокотемпературные
процессы – возгонка хлоридов,
ректификация галогенидов и т.п.
107.
108.
Технический Be(OH)21-й способ
Водный раствор
(NH4)2CO3
4-й способ
2-й способ
NaOH
(NH4)2S
Раствор
комплексного
карбоната +
осадок примесей
H2SO4
Оксиацетат Be
Be4O(CH3COO)6
BeSO44H2O
Гидролиз
Дистилляция
(360-400 0С)
Перекристаллизация
Основной карбонат Be
4Be(OH)2 BeCO3 5H2O
β – Be(OH)2
Be4O(CH3COO)6
BeSO44H2O
Прокаливание
Прокаливание
при 5000С
Прокаливание
при 600-7000С
Прокаливание
при 11000С
Гидролиз
(кипячение)
Раствор Na2BeO2
+ осадок твердых
примесей
3-й способ
CH3COOH
Чистый BeO
109. Получение чистых соединений. Разделение РЗЭ
Разделение РЗЭ методами селективногоокисления и восстановления
Основаны на способности Ce окисляться, а
Sm, Eu и Yb – восстанавливаться
По свойствам церий (IV) близок к Th и Ti, а
Sm, Eu и Yb с валентностью (II) – к
щелочноземельным элементам
Метод отличается большой эффективностью
из-за
Степень
окисления
+4 проявляют
также
возрастания
различий
в свойствах
празеодим
тербий,
в промышленАналоги
- Sr илантаноидов
Аналог -однако
Ca с обычной
соединений
степенью
ности это не используют из-за низкой
окисления – три
эффективности
110. Химическая технология РЗЭ. Разделение РЗЭ
Отделение церияОтделение церия от остальных РЗЭ проводят
на начальных стадиях разделения
ОВ-потенциал системы Ce4+/Ce3+ зависит от
природы
минеральной
кислоты и ее
Широкий
выбор окислителей
концентрации
Церий (IV) отделяют от других РЗЭ
гидроксидаВ(pH
Восаждением
кислых растворах
слабокислых
и или
осаждения=1.0)
экстракцией
в азотнокислых
растворах
он
равен 1.3 –ТБФ
1.8 В
щелочных
( Сe(IV)/Ln>30)
растворах – около 0 В
111. Получение чистых соединений. Разделение РЗЭ
Отделение церия1. Окисление воздухом
Недостатки:
Низкая степень окисления
церия (90-95
%)
Пропускание
воздуха
Сушка
гидроксидов на
Длительность
через пульпу
0C)
воздухе
(6
ч,
120
Загрязнение Сe(OH)4 другими
РЗЭ за счет
его
гидроксидов
(рН=10,
высокой сорбционной способности
130 0С, 5 атм, 1 ч)
2. Окисление
с добавками озона (0.01 г/л)
Фракционное
растворение
Степень перевода
церия в концентрат – 98-99
в HNO
3
% (за 30 минут при обычном давлении)
112. Получение чистых соединений. Разделение РЗЭ
Отделение церия3. Окисление перманганатом калия
3 Ce(NO3)3 + KMnO4 + 8 Na2CO3 + 10 H2O =
= 3 Ce(OH)4+8 NaHCO3+ 8 NaNO3+KNO3+ MnO2
2Сe(OH)4 + раствор
8 HCl = 2
CeCl3 + при
8 H2быстром
O + Cl2
В слабокислый
нитратов
MnO2 + 4HCl
= MnCl220
+ %-ный
2H2O +раствор
Cl2
перемешивании
добавляют
KMnO4 и соды (1:4)
полученного
раствора
осаждают
оксалат
Из
Осадок
фильтруют
и промывают
подкисленной
церия
горячей водой при pH=1.2-2.0
После 3-х стадийной репульпации осадок
растворяют в соляной кислоте
113. Получение чистых соединений. Разделение РЗЭ
Отделение церияВ другой модификации метод применяют для
очистки РЗЭ от небольших количеств церия
Из свободного от церия раствора удаляют
избыток перманганата
Для коагуляции
4 KMnO
H OH = 4 MnO2 + 2 K2CO3 + 3 H2O
Сe(OH)
4 + C2
4 5
добавляют ПАВ
После фильтрации из раствора осаждают
оксалат РЗЭ
Так снижают содержание Ce в La до 10-4 мас. %
114. Получение чистых соединений. Разделение РЗЭ
Отделение церия4. Окисление пероксидом водорода
К слабокислому раствору (pH=5÷6) добавляют
Используется для получения чистого оксида
30 %-ный H2O2 (в 50 %-ном избытке) и 25 %церия
ный аммиак (в стехиометрии)
2Ce(NO3)3+H2O2+ 6NH3 H2O=2Ce(OH)4+ 6NH4NO3
Для удаления гидроксидов других РЗЭ
обрабатывают ТБФ, равновесным с 12M HNO3
Реэкстракцию ведут пероксидом водорода
При этом церий (IV) переходит в экстракт, а
остальные РЗЭ (III) остаются в рафинате
115. Получение чистых соединений. Разделение РЗЭ
Отделение церия5. Электрохимическое окисление
Электролиз ведут из нитратных растворов
Анод:
Ce3+ - e Ce4+
2 H2O – 4 e O2 + 4 H+
Катод:
2 H+ +диффузией
2 e H2 ионов Ce3+, при
Процесс лимитируется
NO3- +усиливается
3 HNO
H+ +3<1.5
2e
При
концентрации
MHNO
выделяется
затруднении
выделение
2 + Hкислорода
2O водород,
при большей
– усиливается
образование HNO
Оптимальные
условия:
Развитие
реакции
зависит от концентрации
HNO23:
3 HNO2HNO
= HNO
+ H2O
Концентрация
моль/л
3 + 2 NO
3 =1÷1.5
0С
уменьшения
выделения
кислорода проводят
Для
Температура
45-50
интенсивное
ia =
0.05 А/см2 перемешивание и увеличивают
температуру
116. Получение чистых соединений. Разделение РЗЭ
1 - корпус;2 - кольцевой
Получение чистых соединений.
трубопровод с
отверстиями для
Разделение РЗЭ
подачи раствора к
Отделение церияаноду;
3 Аппаратура
- катод;
5. Электрохимическое окисление.
4 - кольцевой
Наиболее эффективны электролизеры с
приемник для слива
разделением катодного и анодного
раствора в коллектор
пространства
5; 6 - патрубок для
Конструкция диафрагменного электролизера:
отвода
газов,
корпус – Ti; катод – графит; анод
– Pt(Ti)
выделяющихся на
Отделение
электроды охлаждаются
Сe(IV) от РЗЭ
ведут экстракцией
катоде;
- штуцеридля
Степень
в составокисления
установки входят баки для7исходного
Выход
току >80в%
залива
раствора
окисленного растворов, анолита
и по
католита,
церия >99 %
катодное
циркуляционные насосы, устройства
для отвода
пространство;
газов
8 - крышка
электролизера; 9 анод; 10 - диафрагма
117. Получение чистых соединений. Разделение РЗЭ
Отделение самария, европия и иттербияОВ-потенциалы E0Ln3+/ Ln2+
Металл
Sm
Eu
Yb
E0Ln3+/ Ln2+
-1.72 В
-0.43 В
-1.15 В
Способы:
Восстановление амальгамой натрия (Sm,
Eu, Yb)
Восстановление цинковой пылью (Eu)
Электрохимическое восстановление (Eu)
118. Получение чистых соединений. Разделение РЗЭ
Электрохимическое восстановлениеЭлектролиз ведут из хлоридных растворов
Катод:
Eu3+ + e Eu2+
2 H+ + 2e H2
Анод:
2Cl- - 2e Cl2
2 H2O - 4e O2 + 4 H+
В начале электролиза
Оптимальные
условия: идет восстановление
pH=1-2европия, в конце - водорода
iк= 0.01-0.05 А/см2
При низкой
Концентрация
– 5-10
г/л Eu2O3 подконцентрации
НСl
Для
избежания Eu(III)
выпадения
гидроксидов,
0С
держивают
Температура
30-50
постоянную кислотность (pH=1-2)
119. Получение чистых соединений. Разделение РЗЭ
Электрохимическое восстановлениеОтделение европия
Европий (II) окисляется кислородом воздуха,
ионами-окислителями, экстрагентами
Суть метода:
Для выделения
европия используют
метод
После
окончания восстановления
европия
в
гидролиза
католитэлектрохимического
прекращают подавать
соляную кислоту
При увеличении pH гидроксиды РЗЭ (III)
выпадают в осадок, а Eu(II) остается растворе
120. Получение чистых соединений. Переработка концентратов Zr и Hf.
Перекристаллизация ФЦКФторцирконаты щелочных металлов менее
растворимы в воде, чем фторгафнаты
Растворимость натриевых солей намного
ниже, чем у калиевых, поэтому их
не
Температура, 0C
используют
Соединение
20
40
60
80 20 до100
При повышении
температуры
от
800С
растворимость
K
Zr(Hf)F
увеличивается
2
6
1.22
4.22
9.34
17.40
36.2
K2ZrF6
более, чем в 10 раз
K2HfF6
4.41
9.58
20.76
37.23
74.1
121. Получение чистых соединений. Переработка концентратов Zr и Hf.
Получение чистых соединений.Переработка концентратовI –Zr
и Hf.
подача
охлаждающей воды;
Перекристаллизация ФЦК
II – выход
0
Горячий (90-95 С), насыщенный по
охлаждающей воды;
цирконию (до 60 г/л), предварительно
1 – корпус;
доведенный аммиаком до pH=5-5.5
раствор
2 – мешалка;
поступает в реактор-кристаллизатор
3 – рубашка;
4 – змеевик;
Каждая из стадий перекристаллизации
включает в себя последовательно
5 – штуцервыполняедля отвода
мые операции : нагревание суспензии,
суспензии
охлаждение, отстаивание кристаллов и
декантацию маточника, обогащенного
гафнием
122. Получение чистых соединений. Переработка концентратов Zr и Hf.
ФЦКВ ходераствор
перекристаллизационной
очистки
Маточный
с
последующей
Растворение,
90 5 0C, 40 мин
кристаллы ФЦК остаются
в одном
перекристаллизации
реакторе-кристаллизаторе
Охлаждение, 25-35 0C
Последовательно-параллельно двигаются
30 гафнию
мин
маточные растворы,Отстаивание,
обогащаясь по
маточный раствор
Декантация
кристаллы
На перекристаллизацию более грязного по Hf ФЦК
123. Получение чистых соединений. Переработка концентратов Zr и Hf.
Перекристаллизация ФЦКДля практических целей при расчете
противоточной кристаллизации можно
пользоваться эмпирическим уравнением:
n lg K = lg CHfнач/ CHfкон , где K=1.36
Очистка ФЦК методом дробной
кристаллизации – длительный
энергоемкий процесс с использованием
большого числа аппаратов и большого
объема растворов
124.
Технический ФЦКРастворение, 90 5 0C, 2 ч
I перекристаллизация
II перекристаллизация
3 МР
4 МР
5 МР
2 МР
Гафниевые
маточные
растворы
(ГМР)
III перекристаллизация
IV перекристаллизация
V перекристаллизация
VI перекристаллизация
Конденсированная вода
1 МР
VII перекристаллизация
VIII перекристаллизация
IX перекристаллизация
6 МР
7 МР
8 МР
9 МР
125.
IX перекристаллизацияСгущение
Центрифугирование
Сушка
ФЦК на электролиз
Для получения циркония, удовлетворяющего
требованиям атомной помышленности, достаточно
12-15 ступеней перекристаллизации
126.
127. Получение чистых соединений. Переработка концентратов Zr и Hf.
Экстракция циркония и гафнияЭкстракцию применяют для:
очистки циркония и гафния
Вразделения
циркония
и гафния
России (СССР)
не применяют
Используемые экстрагенты:
Трибутилфосфат ТБФ из нитратных растворов
Метилизобутилкетон МИБК из роданидных
растворов
128. Получение чистых соединений. Переработка концентратов Zr и Hf.
Экстракция Zr и Hf из нитратных растворовДля снижения вязкости органической фазы
используют 70 %-ные растворы ТБФ в
керосине или трибутилбензоле
Механизм экстракции – сольватный
[Zr(OH)x(NO3)y]4-x-y+(4-y)NO3-+xH++2ТБФ
Zr(NO3)4·2ТБФ+xH2O
Часть циркония (гафния) находится в виде
анионных нитратных комплексов
Предложено вводить до 5 % триалкиламинов
129. Получение чистых соединений. Переработка концентратов Zr и Hf.
Экстракция Zr и Hf из нитратных растворовАзотная кислота хорошо экстрагируется ТБФ
в виде моно- и дисольватов
Предварительно насыщают экстрагент по НNO3
Коэффициенты распределения циркония и
гафния увеличиваются с ростом
концентрации HNO3
Коэффициенты распределения циркония
выше, чем у гафния, что объясняют меньшей
диссоциацией нитрата
130. Получение чистых соединений. Переработка концентратов Zr и Hf.
1 – корпус;2 – кольцевые
Получение чистых соединений.
сборники;
Переработка концентратов 3Zr
и Hf.
– переливное
кольцо;
4 – растворов
консольная
Экстракция Zr и Hf из нитратных
подшипниковая
Параметры. Аппаратура
опора;
5 – привод
На I этапе в сильнокислых растворах
(6М
ротора;
HNO3) экстрагируют сумму циркония
и гафния
6 – ротор;
Из суммарного экстракта реэкстрагируют
7 – лопастное
гафний 3М HNO3
транспортное
Цирконий реэкстрагируют 0.15 Мустройство;
HNO3
8 – лопастная
Экстракцию ведут в центробежных
мешалка; 9 –
экстракторах
камера смешения;
10 – подводящие
патрубки
131. Получение чистых соединений. Переработка концентратов Zr и Hf.
Поведение примесейНаличие кремния (золя кремнекислоты)
затрудняет процесс экстракции за счет
Титан образует
прочные
пероксидные
образования
межфазных
пленок
и эмульсий с
2+
комплексы
органической
фазой TiO(H2O2)n
Коэффициенты разделения суммы Zr и Hf и
алюминия, железа составляют около 30 и 10
Содержание
кремния
распределяется
Для
улучшения
очистки Кремний
от примесей
титана к
должно быть
меньше
между H
фазами
в соответствии
раствору
можно
добавлять
2O2 (β=15÷20)
0.5-0.7 г/л
с соотношением VОФ:VВФ
132.
Исходный растворЭкстракция Zr и Hf
8 ступеней, О:В=1.2:1
Экстракт
Zr -30 г/л
Hf – 0.5 г/л
3М HNO3
Реэкстракция Hf
10 ступеней, О:В=7:1
Орг. фаза
0.1М HNO3
Орг. фаза
Реэкстракция Zr
10 ступеней, О:В=2:1
Рафинат
На утилизацию
(Σ Zr+Hf 0.5 г/л,
250 г/л HNO3,
0.35 г/л ТБФ)
Рафинат
Экстракт
Zr 14.1 г/л
Zr 5.4 г/л
Hf 3.5 г/л
Рафинат
Доизвлечение Zr
10 ступеней,
Zr-ый концентрат (50-60 г/л
О:В=1.2:1
Zr, 0.05 г/л Нf, 5M HNO3)
Очистка
Рафинат
Hf-ый концентрат ( 3.5 г/л Hf, 3.3 г/л Zr)
133. Получение чистых соединений. Переработка концентратов Zr и Hf.
Очистка и доукрепление экстрагентаС течением времени происходит загрязнение
экстранета в результате протекания
процессов гидролиза ТБФ
Необходима очистка экстрагента от примесей
(C4H
+ H2O и его
(C4доукрепление
H9O)2HPO2 + C
9O)3PO
4HТБФ
9OH
ДБФ,
МБФ,
бутанола
по
(C4H9O)2HPO2 + H2O (C4H9O)H2PO3 + C4H9OH
(C4H9O)H2PO3 + H2O H3PO4 + C4H9OH
Являются
катионными
экстрагентами,
Часть
экстрагента
теряетсяв за счет
Возможно
образование
Происходит образование
результате
чего
меняются
коэффициенты
растворения
в
водной
фазе
нерастворимых фосфатов циркония
распределения циркония и примесей
эмульсий
134. Получение чистых соединений. Переработка концентратов Zr и Hf.
Очистка и доукрепление экстрагентаДля очистки экстрагента используют соду:
Na2CO3+ 2(C4H9O)2HPO2
2(C4H9O)2NaPO2+H2O+CO2
Так как экстрагент содержит много азотной
кислоты, происходит ее взаимодействие с
содой
Водорастворимая соль
Процессы очистки и приготовления
экстрагента
ведут
в экстракционных
Необходимо
доукрепление
по HNO3 колоннах
135.
Орг. фаза послереэкстракции Zr
Экстрагент
(ТБФ)
50 %
50 %
Na2CO3
(15 %)
H2 O
Разбавитель
(керосин)
Cодовая обработка,
О:В=4:1
Промывка
Оборотный
содовый
раствор
Смешение
ТБФ-70%
керосин-30%,
1 час
На сброс
HNO3 (45 %)
Насыщение экстрагента HNO3,
до 125 г/л, 3 ступени, О:В=3:1
Вод. фаза
На реэкстракцию (после
корректировки кислотности)
Орг. фаза
На экстракцию
136. Получение чистых соединений. Разделение РЗЭ
Методы ионного обменаВ начале 60-х годов являлся основным
технологическим методом получения
значительных количеств почти всех РЗЭ
В связи с развитием более производительного метода разделения РЗЭ – жидкостной
экстракции – ионообменную хроматографию
в настоящее время используют меньше
Метод ионного обмена является наиболее
универсальным методом разделения РЗЭ
137. Получение чистых соединений. Разделение РЗЭ
Методы ионного обменаРазличие в сорбируемости лантаноидов
очень невелики (уменьшаются с ростом
Разделение
ведут: на стадии сорбции
массы), поэтому
не происходит
разделения
в кислыхпрактически
средах для предотвращения
( Pr/Nd
=1.01, Yb/Lu
гидролиза
РЗЭ =1.03)
на сильнокислотных
Разделение
достигаетсякатионитах
в процессе
селективной
десорбции, основанной на
(КУ-2, CCCР)
разной устойчивости комплексных
соединений РЗЭ
138. Получение чистых соединений. Разделение РЗЭ
Элюентная хроматографияПосле сорбции и промывки проводят
селективную десорбцию раствором,
содержащим комплексообразователь и
катион, сорбирующийся слабее любого из
разделяемых ионов (ЭЛЮИРУЮЩИМ)
3+ образуют более устойчивые
Ионы
РЗЭ
При достаточной
длине
смолы
(высоте
+
+, Na+
Элюирующий
раствор
–
ЭДТА
соединения
со
смолой,
чем
H
,
NH
4
сорбционной
колонны) возможно
полное
(этилендиаминтетрауксусная
кислота)
В результатеразделение
адсорбционные
полосполосы РЗМ
перемещаются с разной скоростью
139.
Логарифмы констант образованиякомплексов с ЭДТА при 20 0С и ионной
силе 0.1 (KCl)
140. Получение чистых соединений. Разделение РЗЭ
Элюентная хроматография. ПараметрыСорбцию
ведут на
катионите
КУ-2-8 из
нитратных
Для больших
количеств
веществ
метод
или хлоридных
растворов В
с концентрацией
по
признан
неэффективным.
промышленности
Ln2O3 3-5 мас.
при pH=2.5-3
используется
на %
заключительной
стадии для
доочистки
по
определенному
+
+
После
промывки
водой
в
колонну
вводят
RnHбогатых
+ NH
RnNH
4
4 + H
лантаноиду
фракций
3+ –
4+ЭДТА,
элюирующий
раствор
%-ный
раствор
3 Rn(NH
0.5
(Rn)
4) + Ln
3Ln + 3 NH
буферированный
Для
сохранения до
pHpH=2.5-3.5
необходимо смолу
в аммонийную
форму
перевести
ПриПри
малой
скорости
подачи
растворов,
большой
pH=2.2
ЭДТА
выпадает
в осадок
Ввысоте
верхней
части
колонныконцентрациях
происходит неколонн,
небольших
РЗЭ
В
раствор
будут
извлекаться
прежде
всего
большое
обогащение
смолыионов
по легким РЗЭ
возможно
тяжелые
РЗЭ,полное
хуже разделение
сорбирующие
и образующие
с ЭДТА более прочные комплексы
141. Получение чистых соединений. Разделение РЗЭ
1 - корпус; 2 - сорбент;3 - распределительное
устройство
для подачи
Получение чистых
соединений.
элюирующего раствора;
4 - воздушник;
Разделение РЗЭ 5 - распределительное
устройство; 6, 7 и 8 - линии
Элюентная хроматография.
Аппаратура
подачи промывного,
исходного
и обедненного
(из
Процесс разделения ведут
полунепрерывно
предыдущего
аппарата)
в однотипных аппаратах
периодического
растворов; 9 - линия вывода
действия – сорбционных
растворафильтрах
после взрыхления
Сорбционные фильтры
аппараты
смолы; -10
и 11 - линии подачи
свежего
оборотного
колонного типа диаметром
оти 0.3
до 5 м,
растворов;
отношение высоты элюирующих
к диаметру до
20:1
12 - последовательно
гравий; 13 - дренажное
Аппараты соединены
и
устройство; 14 - линия подачи
последовательно-параллельно
в каскады,
воды; 15 и 16 линии
вывода
состоящие из 10 – 50сбросного
колон
и богатого
растворов;
17,
18 и 19 - линии
Соотношение между
числом
сорбционных
и
разделительных вывода
колоннисходного,
– от 1:3 дооборотного
1:10
элюирующего и товарного
растворов; 20 - линии
передачи бедного раствора в
последующий аппарат
142.
Работа сорбционно-десорбционного цикла1 цикл:
сорбция 1-2-3,
десорбция 6-5-4;
2 цикл:
сорбция 2-3-6,
десорбция 5-4-1;
3 цикл:
сорбция 3-6-5,
десорбция 4-1-2;
4 цикл:
сорбция 6-5-4,
десорбция 1-2-3
143. Химическая технология РЗЭ. Разделение РЗЭ
Вытеснительная хроматографияПосле сорбции разделяемых ионов в колонку
подают элюирующий раствор, содержащий
катион, сорбируемость и концентрация
которого должны быть настолько велики, что
позади иона-вытеснителя все другие катионы
отсутствуют
Достоинства
Большая
Более высокие концентрации
производи При
Менее
продолжителен
этом на смоле образуются полосы тельность
отдельных
Недостатки
катионов, имеющие резкие передние и задние
Невозможность полного разделения в 1 стадию
границы, перекрывающие частично друг друга
144. Получение чистых соединений. Разделение РЗЭ
Вытеснительная хроматография. ПараметрыВ технологии РЗЭ применяют один из вариантов
метода вытеснительной хромотографии –
использование ионов-заместителей
В качестве таковых используют ионы Cu2+, Zn2+,
Ni2+ и др., т.е. тех константы устойчивости
которых с ЭДТА сравнимы с лантаноидами
Через насыщенную по иону-замедлителю (Fe3+)
смолу пропускают раствор РЗЭ c ЭДТА
- они
Пока
в смоле
есть ионы-замедлители,
только
(Rn)
3Fe + Ln(Y)L (Rn)3Ln(Y) + FeL
переходят
в раствор,
четкие
(Rn)3Fe +
Ln(Cе)L-а
(Rn)3адсорбционные
Ln(Се) + FeLполосы
ионов РЗМ передвигаются вдоль смолы
(Rn)
3Ln(Y) + Ln(Ce)L- (Rn)3Ln(Ce) + Ln(Y)L-
145. Получение чистых соединений. Разделение РЗЭ
Вытеснительная хроматография.Аппаратура
Аппаратурное оформление процесса
вытеснительной хромотографии не
отличается от элюентной, меняется только
число сорбционных фильтров и их
функциональная нагрузка
146. Получение чистых соединений. Разделение РЗЭ
Фронтальная хроматографияМетод основан на получении определенного
количества чистого компонента, обладающего
наименьшей сорбируемостью при
пропускании смеси ионов через колонну
Достоинства
Высокопроизводительный непрерывный
процесс
Более полное использование смолы
Устойчивая работа сорбционных колонн
Недостатки
Невозможность полного разделения в I стадию
147. Получение чистых соединений. Разделение РЗЭ
Фронтальная хроматография. ПараметрыВ технологии РЗЭ предварительная сорбция
ионов РЗМ не проводится
В колонку непрерывно подается раствор,
содержащий смесь РЗЭ, и комплексон,
который добавляется в таком количестве,
чтобы связать только часть РЗЭ (например,
от Dy до Lu)
При пропускании через смолу сорбируются
только незакомплексованные ионы
(от La до Dy)
Со смолы РЗЭ десорбируются кислотой
(HNO3, HCl)
148. Получение чистых соединений. Разделение РЗЭ
Колонна ПСКТарелка КРИМЗ
Получение чистых соединений.
Разделение РЗЭ
Фронтальная хроматография. Аппаратура
1 - тарелка;
В промышленности методом фронтальной
2 - отверстие;
хроматографии реализован как непрерывный
3–
противоточный процесс в аппаратах
сонаправляющие лопатки
взвешенным слоем сорбента – пульсационных
сорбционных колоннах типа ПСК
В них распределителями потока является насадка
КРИМЗ со свободным сечением 40-60 %
Диаметр – до 3.4 м, высота – до 18 м
Скорость движения раствора 10 – 20 м/ч
- корпус;
2 - взвешенный
слой
Загрузка смолы в1 15
раз меньше,
чем у
сорбента;
3 - аэролифт; 4 - зона
сорбционных фильтрах,
а производительность
-в
Режим
стесненного
осаждения
– движущийся
3 раза
выше
распределения
сорбента;
псевдослой, секционированный
тарелками
5 - тарелка КРИМЗ;
6 - подача
пульсации; 7 - пульсационная
камера
149.
Работа каскада колонн ПСК для разделения РЗЭ1 - колонна отмывки сорбента от исходного раствора;
4-колонна
5 - 6десорбционно-регенерационная
- питатели;
отмывки
2,
8 -3аэролифты
-сорбента
сорбционные
7 - промежуточные
для
от регенерационного
смолы
колонны;
колонна;
емкости; р-ра
150. Получение чистых соединений. Разделение РЗЭ
Экстракционное разделение РЗЭЭкстракция - наиболее эффективный
промышленный способ разделения и
получения индивидуальных РЗЭ, в том числе
высокой степени чистоты
Используемые экстрагенты:
Трибутилфосфат (ТБФ)
Смеси ТБФ с четвертичными аммонийными
основаниями или солями (ЧАО, ЧАС)
Ди-2-этилгексилфосфорная кислота (Д2ЭГФК)
Нефтяные сульфоксиды (НСО)
151. Получение чистых соединений. Разделение РЗЭ
Трибутилфосфат (ТБФ)Экстракцию ТБФ ведут из нитратных растворов
Механизм экстракции – сольватный
РЗЭ экстрагируются в виде:
1. Простой недиссоциированной соли Ln(NO3)3:
Ln3+(в) + 3 NO3-(в) + 3 ТБФ(о) Ln(NO3)3 3ТБФ(о)
2. Комплексных кислот РЗЭ Hn[Ln(NO3)3+n], где n=1-3
3. Солей комплексных кислот Mn[Ln(NO3)3+n∙m], где
M – металл с валентностью m (Li, Zn, Al, Ln и др.)
152. Получение чистых соединений. Разделение РЗЭ
Изотерма распределения суммы РЗЭ при экстракции ТБФ1 - 100 %-ный ТБФ; 2 -70 %-ный ТБФ. Разбавитель – толуол.
Состав концентрата (%): La-20,Ce-40,Pr-8.7,Nd-30,Sm-0.8,Gd-0.3
Получение чистых соединений.
Разделение РЗЭ
Концентрации ТБФ и РЗЭ
Максимальная концентрация РЗЭ в
органической фазе - около 1.2 моль/л
(170-220 г/л)
Максимальное значение D=0.7 достигается
при концентрации РЗЭ в водной фазе 150 г/л
Разбавление ТБФ инертным растворителем
Может быть достигнута
приводит к снижению коэффициента
при очень больших
распределения и содержания РЗЭ в ОФ
концентрациях РЗЭ в
Использованию 100%
ТБФфазе
препятствует
водной
(до 500 г/л)
большая вязкость раствора
153. Получение чистых соединений. Разделение РЗЭ
Зависимость коэффициентов распределения La, Ce, Pr, Nd,Sm и Gd от их концентрации в водной фазе при экстракции
100 %-ным ТБФ (Состав концентрата (%): La-20, Ce-40, Pr-8.8,
Nd-30, Sm-0.85, Gd-0.3)
Получение чистых соединений.
Разделение РЗЭ
Концентрация РЗЭ и ТБФ
При увеличении концентрации РЗЭ в
водной фазе для элементов цериевой
подгруппы степень разделения
увеличивается
Оптимальная концентрация РЗЭ в водной
фазе – 150-200 г/л
154. Получение чистых соединений. Разделение РЗЭ
Зависимость коэффициентовразделения РЗЭ цериевой
Высаливатели
подгруппы от концентрации
Для увеличения коэффициентов
разделения
в
нитрата лития
при
систему вводят
высаливатели
экстракции
100 %-ным ТБФ
Ряд эффективности высаливателей:
Равновесная концентрация
LiNO3(6M) HNO3(15.6
М)
> вAl(NO
(2.5 M) >
3)3фазе
суммы
РЗЭ
водной
Подавляют
> Ca(NO3)2Увеличивают
(2.5
M)
>
NH
NO
(9 M)
4
3
200
г/л.
Состав
концентрата
концентрацию
диссоциацию
Введение высаливателя
приводит
к
уменьшению
(%): La-26, Ce-52.7,Ln(NO
Pr-3, Ndнитрат-ионов
3 )3
концентрации РЗЭ в15,
водной
фазе.
Sm-1.7,
Gd-1, Er-0.2, Dy-0.4
При осуществлении процесса в каскаде нужно
вводить операцию регенерации высаливателя
155. Получение чистых соединений. Разделение РЗЭ
СамовысаливаниеПри экстракции смесей легких РЗЭ
широко распространенные и хуже всех
экстрагируемые La и Ce могут выступать
в роли высаливателей
(самовысаливание)
Это позволяет, не вводя в систему новых
реагентов, выделять из смеси легких
РЗЭ самарий и гадолиний, а также
концентрат Pr и Nd
156. Получение чистых соединений. Разделение РЗЭ
Зависимость коэффициентов распределения РЗЭ от их порядкового номера при экстракции 80%-ным ТБФ (разбавитель - керосин) (1) и смесью ТБФ - ТАБАН (25 об. %) (2,3)Равновесная концентрация суммы РЗЭ (г/л): 1–150, 2,3–130. Концентрация высаливателя: 1 – Al(NO3)3, 6М; 2, 3 – NH4NO3, 1М.
Состав концентрата (%): 1,2–La(11), Ce(12.5), Pr(1.6), Nd(5),
Sm(1.4), Gd(7.5), Tb(1.4), Dy(8.7), Ho(1.3), Er(2.4), Tm(0.15),
Yb(1.1), Lu(0.15), Y(45.8); 3 – тоже без цериевой группы
Получение чистых соединений.
Разделение РЗЭ
Трибутилфосфат (ТБФ)
При экстракции смесей тяжелых РЗЭ из
нейтральных растворов в присутствии
высаливателей и без них наблюдаются
другие закономерности, связанные с
инверсией коэффициентов распределения
Наблюдаемые при этом коэффициенты
разделения малы, что препятствует
использованию нейтральных экстрагентов
для разделения иттриевых земель, а также
групповому разделению цериевой и
иттриевой подгуппы
157. Получение чистых соединений. Разделение РЗЭ
Смеси ТБФ-ЧАО (ЧАС)Применяют с целью разделения неодима и
празеодима, а также средних РЗЭ
(концентрат, содержащий самарий,
европий, гадолиний, примеси неодима,
тербия и диспрозия)
Используемые ЧАС:
ТАМАН (триалкилметиламмоний нитрат)
[R3N–CH3]+NO3-, где R=C7-C9
ТАБАН (триалкилбензиламмоний нитрат)
[R3N–CH2 –C6H5]+NO3-, где R=C7-C9
158. Получение чистых соединений. Разделение РЗЭ
Зависимость коэффициентов распределения РЗЭ от их порядкового номера при экстракции 80%-ным ТБФ (разбавитель - керосин) (1) и смесью ТБФ - ТАБАН (25 об. %) (2,3)Равновесная концентрация суммы РЗЭ (г/л): 1–150, 2,3–130. Концентрация высаливателя: 1 – Al(NO3)3, 6М; 2, 3 – NH4NO3, 1М.
Состав концентрата (%): 1,2–La(11), Ce(12.5), Pr(1.6), Nd(5),
Sm(1.4), Gd(7.5), Tb(1.4), Dy(8.7), Ho(1.3), Er(2.4), Tm(0.15),
Yb(1.1), Lu(0.15), Y(45.8); 3 – тоже без цериевой группы
Получение чистых соединений.
Разделение РЗЭ
Смеси ТБФ-ЧАО (ЧАС)
Механизм экстракции – синергетный
Часть РЗЭ, связанную в анионные комплексы
типа [Ln(NO3)3+n]n- , экстрагируются ЧАО по
анионообменному механизму
Остальные РЗЭ, а также комплексы РЗЭ с
ЧАО экстрагируются ТБФ как сольваты
Параметры
Содержание ЧАО в ТБФ – до 30 об. %
Концентрация РЗЭ в водной фазе –
120-170 г/л
159. Получение чистых соединений. Разделение РЗЭ
Зависимость коэффициентов распределения РЗЭ от их порядкового номера при экстракции 80%-ным ТБФ (разбавитель - керосин) (1) и смесью ТБФ - ТАБАН (25 об. %) (2,3)Равновесная концентрация суммы РЗЭ (г/л): 1–150, 2,3–130. Концентрация высаливателя: 1 – Al(NO3)3, 6М; 2, 3 – NH4NO3, 1М.
Состав концентрата (%): 1,2–La(11), Ce(12.5), Pr(1.6), Nd(5),
Sm(1.4), Gd(7.5), Tb(1.4), Dy(8.7), Ho(1.3), Er(2.4), Tm(0.15),
Yb(1.1), Lu(0.15), Y(45.8); 3 – тоже без цериевой группы
Получение чистых соединений.
Разделение РЗЭ
Смеси ТБФ-ЧАО (ЧАС)
Особенности
Использование комплексонов (ЭДТА)
Промывку экстракта перед промывным
раствором ведут чистым компонентом
Разделение
средних РЗЭ необходимо
Сложение коэффициентов
разделения,
проводить
в отсутствии
легких лантаноидов
обусловленных
ЧАО и комплексонами,
Позволяет
повысить
чистоту
продукта и
Недостатки
которые совпадают
по
направлению
снизить число ступеней
в экстракционном
Невозможность
разделения
тяжелых РЗЭ
каскаде
Более высокая стоимость
160. Получение чистых соединений. Разделение РЗЭ
ЗависимостьlgD
Ди-2-этилгексилфосфорная кислота
(Д2ЭГФК)
от порядкового
Д2ЭГФК обладает ОЧЕНЬ высокой
номера
селективностью по отношению к РЗЭ
( Lu/La>104)лантаноидов при
экстрации 0.1 М
Д2ЭГФК применяют в виде растворов в
раствора
Д2ЭГФК
неполярных растворителях (керосине,
бензоле
и
в толуоле
т.д.)
(СHClдимеризованы
= 1 моль/л,
В этих условиях молекулы Д2ЭГФК
концентрация РЗЭ
в водной фазе –
80 г/л)
161. Получение чистых соединений. Разделение РЗЭ
Получениечистых соединений.
Tb/Gd=4.93
Разделение РЗЭ
Д2ЭГФК Зависимость lgD
Sm/Nd=9.11
от порядкового
Механизм экстракции – катионообменный
номера
Ln3+водн + 3 H2A2 орг Ln(HA2)3 орг + 3 H+
лантаноидов при
Так как с повышением кислотности
экстрации 0.1 М
коэффициенты разделения уменьшаются, в
раствора Д2ЭГФК
ходе процесса экстракции предусмотрено
в %-ного
толуоле
регулирование pH добавками 0.1
(СHCl = 1 моль/л,
раствора Na2CO3
концентрация
Экстракцию ведут из хлоридных
растворовРЗЭ
в водной фазе –
На кривых проявляются 4 подгруппы
80 г/л)
(тетрады)
162. Получение чистых соединений. Разделение РЗЭ
Зависимость lgDот порядкового
На практике Д2ЭГФК применяют
для
разделения РЗЭ на легкие (по линии
Sm –
номера
Nd), средние (по линии Tb –лантаноидов
Gd) и тяжелые
при
Разделение легких и средних
лантаноидов
экстрации
0.1 М
из-за значительно более высоких
раствора Д2ЭГФК
концентраций металлов в экстрактах
в толуолес
экономически более выгодно проводить
использованием НФОС и смесей
с ЧАО
(СHCl НФОС
= 1 моль/л,
Тяжелые лантаноиды извлекаются
Д2ЭГФК
с
концентрация
РЗЭ
очень высокими коэффициентами
в водной фазе –
распределения, что вызывает серьезные
80 г/л)
трудности при реэкстракции металлов
Д2ЭГФК
163. Получение чистых соединений. Разделение РЗЭ
Нефтяные сульфоксиды (НСО)Применяют для выделения иттрия
Иттрий очищают одновременно от всех
лантаноидов в одном экстракционном
каскаде с использованием в качестве
экстрагента НСО с молекулярной массой от
122 до 244, разбавленных керосином
Коэффициенты
Экстракцию проводят
в присутствии
разделения
иттрия от гольмия
высаливателя (хлорида лития, магния,
и эрбия (наиболее близких к иттрию по своим
кальция или алюминия) при концентрациях в
свойствам) в хлоридных системах составляют
рафинате РЗМ 0.7 – 2.2 моль/л
1.7 и 1.6 соответственно
164. Получение чистых соединений. Разделение РЗЭ
Экстракция. ОборудованиеДля разделения и получения
индивидуальных РЗМ вследствие малых
значений коэффициентов разделения пар
соседних элементов необходимы каскады в
50 – 90 ступеней, состоящие из
последовательно работающих аппаратов
При таком большом их числе важнейшим
требованием
к ним является
в
Поэтому в производстве
РЗЭ надежность
получили
эксплуатации
распостранение
горизонтальные
Смесительно-отстойный
экстрактор
ящичного типа
(1 – смесительная
камера; 2 – турбинная
мешалка;
смесители-отстойники
ящичного
типа 3 –
горизонтальная перегородка; 4 - окно для перетока водной
фазы; ,5 – окно для перетока органической фазы;
6 – гофрированная перегородка; 7 – отстойная камера)
165. Получение чистых соединений. Разделение РЗЭ
Принципиальные схемы разделения РЗЭНа первом экстракционном каскаде из
хлоридных растворов с помощью Д2ЭГФК РЗЭ
делят на группы легких, средних и тяжелых
лантаноидов
Рафинат, содержащий лантан, церий,
празеодим и неодим, направляют на
конверсию хлоридов в нитраты, после или в
ходе чего проводят окисление церия
Церий (IV) выделяют экстракцией ТБФ
166. Получение чистых соединений. Разделение РЗЭ
Принципиальные схемы разделения РЗЭИз оставшихся в рафинате La, Pr, Nd экстракцией ТБФ выделяют лантан (самовысаливание)
Празеодим и неодим делят экстракцией ТБФЧАС
После промывки экстракта Д2ЭГФК 1 М НСl в
водную фазу переходят Sm, Eu, Gd (европий
извлекают восстановлением цинковой пылью
или электрохимически, а самарий и
гадолиний делят экстракцией ТБФ-ЧАС в
нитратных растворах)
167. Получение чистых соединений. Разделение РЗЭ
Принципиальные схемы разделения РЗЭПосле промывки концентрата тяжелых РЗЭ
6 M HNO3 в водную фазу реэкстрагируются Tb,
Dy, Ho, Er, Y и Тm
Иттрий (>75 % в рафинате) отделяют
экстракцией НСО
Смесь остальных РЗЭ делят с использованием
различных методов ионного обмена
Иттербий и лютеций извлекают из экстракта
20 %-ной НF и делят хромотографией
168.
LaРЗЭ
Рафинат I
La Ce Pr Nd
Lu
Экстракция
Д2ЭГФК
Экстракт
Sm Eu Gd Tb Dy Ho Y Er Tm Yb Lu
Конверсия в нитраты, окисление Ce
La Ce Pr Nd
Экстракция ТБФ
La Pr Nd
Экстракция ТБФ
Pr Nd
Ce
La
Экстракция ТБФ-ЧАС,
Промывка Pr(NO3)3
Pr
Nd
169.
Sm Eu Gd Tb Dy Ho Y Er Tm Yb LuПромывка HCl (1М)
Рафинат II
Экстракт
Sm Eu Gd
Tb Dy Ho Y Er Tm Yb Lu
Восстановление
Eu пылью Zn
Рафинат III
Промывка
HNO3 (6М)
Экстракт
Sm Gd
Eu
Конверсия в нитраты
Экстракция ТБФ-ЧАС
Промывка Sm(NO3)3
Sm
Yb
Lu
Реэкстракция
HF (20 %)
Yb
Lu
Ионный обмен
Gd
Tb Dy Ho Y Er Tm
Yb
Lu
170.
Tb Dy Ho Y Er TmЭкстракция
НСО
Tb Dy Ho Er Tm
Y
Ионный
обмен
Tb
Dy
Ho
Er
Tm
171. Производство редких металлов
Используют пирометаллургические иэлектрохимические методы.
Часть редких металлов может быть получена из водных
растворов цементацией (обменной реакцией) или
электролизом (Ga, In, Tl, Ge, Re)
Некоторые металлы восстановлением оксидов или
солей H2, CO, C при повышенных температурах
(W,Mo,Re,Ge,Nb,Ta)
Восстановлением из оксидов или солей металлами
(металлотермия) или электролизом в расплавах солей
получают Li, Rb, Cs, Be, РЗМ, Th, U, Zr, Hf, V, Ta, Nb.
172. Производство редких металлов. Цементация
Цементация – это извлечение металла путем вытесненияиз раствора его соли другим металлом (цементатором),
имеющим более отрицательный стандартный потенциал.
С понижением концентрации катионов извлекаемого
металла в растворе его потенциал становится более
отрицательным, поэтому вытеснение из раствора
происходит только вплоть до какой-то минимальной
концентрации, когда потенциалы вытесняемого и
вытесняющего металлов сравняются.
Для осуществления цементации необходимо, чтобы
разность потенциалов превышала ~ 0,2 В.
173. Производство редких металлов. Цементация
ЭлектродE0Men+/Me Электрод
E0Men+/Me Электрод E0Men+/M
е
Al(OH)4-/Al
-2.35 В
Ga(OH)4-/Ga -1.22 В
In3+/In
-0.34 В
Al3+/Al
-1.70 В
Zn2+/Zn
-0.76 В
Tl+/Tl
-0.33 В
Cr(OH)3/Cr -1.30 В
Cr3+/Cr
-0.74 В
Ni2+/Ni
-0.25 В
ZnO22-/Zn
Ga3+/Ga
-0.56 В
Ge4+/Ge
-0.15 В
-1.22 В
Если цементацию ведут на порошкообразных металлах,
полученный продукт содержит большой избыток металлацементатора.
Этого недостатка лишена цементация на листах. Полученная
металлическая губка далее обычно переплавляется.
174. Производство редких металлов. Цементация. Индий
Металлический индий получают цементацией наалюминиевых пластинах при 50-70 0С.
При цементации из сернокислых растворов в электролит
вводят соляную кислоту и нагревают электролит с целью
растворения пассивирующей пленки оксида.
В процессе цементации нагрев прекращают, так как
процесс сопровождается выделением тепла.
Цементация на алюминии идет не до конца – в растворе
остается до 0.5 г/л In, его остаток доосаждают цинковой
пылью.
Для получения компактного индия губку переплавляют.
175. Производство редких металлов. Металлотермия
МеталлотермияМеталлотермические процессы – это процессы
восстановления металлов из их соединений
более активными металлами, протекающие с
выделением тепла
Химизм:
p/n MnXm + mM’ = pM + m/nM’nXp + Q
где MnXm – восстанавливаемое соединение;
M’ – металл-восстановитель
M’nXp – образующееся соединение (шлак)
176. Производство редких металлов. Металлотермия
Металлотермия. Основные терминыМеталлотермическая шихта –
смесь MnXm и M’, загружаемая в аппарат для
проведения процесса
Термиты (тепловыделяющие добавки) –
соединения, способные взаимодействовать с
большим экзотермическим эффектом, чем при
протекании основной реакции
Балластные (теплопоглощающие) добавки –
вещества, реагирующие с металломвосстановителем с меньшим тепловым
эффектом, чем основной сырьевой компонент
177. Производство редких металлов. Металлотермия
Металлотермия. Основные терминыСплавообразующие добавки –
металлические частицы или соединения
металлов (восстанавливаемые в
металлотермическом процессе до металла),
служащие для образования сплава с
основным продуктом металлотермической
реакции
Флюсы – соединения, предназначенные
для изменения температуры плавления,
вязкости и других свойств шлака
178. Производство редких металлов. Металлотермия
Металлотермия. Требования к флюсамНе должны взаимодействовать с
восстановителем и получаемым по реакции
металлом
Должен снижать температуру
кристаллизации и вязкость шлака
Быть негигроскопичным, устойчивым
соединением, обладающим низким
давлением паров при температуре процесса
Химическая чистота
Низкая стоимость
179. Производство редких металлов. Металлотермия
Металлотермия. Термодинамика процессаПротекание металлотермического процесса
Проведение
Химическое связывание
возможно при:
процесса
продукта с помощью
T
G р-ции<0
в вакууме
специальных
добавок к шихте
где GTр-ции= m/n· GTM’X + p · GTM –
- p/n· GTMX - m · GTM’
Восстановление металлов при GTр-ции>0
невозможно без создания специальных
условий, сдвигающих равновесие
металлотермических реакций
180. Производство редких металлов. Металлотермия
Металлотермия. Закономерности кинетикиМеталлотермические процессы относятся к
твердофазным реакциям
Скорость металлотермии при одном и том же
эффекте
зависит от температуры
тепловом
Для реакций
металлотермического
характерны
закономерности,
восстановления
В отличии от других
ТФР при
металлотермии
описанные для твердофазных реакций
изменение агрегатного
состояния
происходит
Повышение температуры
вызывает увеличение
компонентов
шихты
скорости
реакции,
что ведет к росту скорости
(самоускорение
выделения
Определитьтепла
скорости
реакции – реакции)
сложно
Лимитирующая стадия может меняться
181. Производство редких металлов. Металлотермия
Металлотермия. Выбор восстановителя1. Определение Gр-ции=f(T)
2. Сравнение температуры проведения
процесса и температур плавления и
кипения получаемых продуктов
3. Технико-экономические показатели
(простота организации процесса,
стоимость, доступность, чистота,
устойчивость в атмосфере)
182. Производство редких металлов. Металлотермия
Металлотермия. Классификация1. По форме
организации
Четкой
границы
нет, так какпроцесса
тепловой баланс
Металлотермические
процессы
даже одного
и того же процесса
зависит от
масштаба, состава шихты и т.п.
Печные
Тепла, выделяющегося во
время реакции, недостаточно
для получения продуктов в
жидком состоянии и полноты
расслаивания фаз
Внепечные
Выделяющегося тепла
достаточно для
расплавления и
перегрева продуктов
плавки
183. Производство редких металлов. Металлотермия
Металлотермия. Классификация2. По типу получаемого продукта
Металлотермические процессы
Получение
металла или
сплава в виде
слитка
Получение
металла
в виде
губки
Получение
металла
в дисперсном
виде
184. Производство редких металлов. Металлотермия
Получение металла в виде слиткаПолучение металла в виде слитков
Условие формирования слитка:
наиболее желательно с точки
зрения технологии
выделяющегося
в ходе реакции и
извне тепла
для
подводимого
Позволяет сократить
циклдостаточно
металлотермии
расплавления
и расслаивания
металлической
Позволяет упростить
отделение
металла
(или
сплава) отфаз
шлака
и шлаковой
при интенсивном
теплоотводе
Позволяет уменьшить
загрязнение
(через стенки,
дно тигля и с
продукта
примесями расплава)
поверхности
185. Производство редких металлов. Металлотермия
Получение металла в виде слиткаОсновные стадии
Предварительный нагрев шихты или
инициирование металлотермической
операции
Горение шихты
Расслаивание металлической и
шлаковой фаз
Охлаждение и кристаллизация
продуктов восстановительной плавки
186. Производство редких металлов. Металлотермия
Получение металла в виде губкиМеталлическая «губка» это конгломерат скоалесцировавшихся и
закристаллизовавшихся струй металла
Губка образуется в результате горения
металлотермической смеси, когда скорость
кристаллизации продуктов взаимодействия
превышает скорости расслаивания
металлической и шлаковой фаз
187. Производство редких металлов. Металлотермия
Возможные причины образования «губки»Метод
Недостаточный
тепловых
Кролля – для компенсации
Метод
Хантера
–
потерь
экзотермический
эффект
реакции
магниетермия
натриетермия
(например,
при
малом
масштабе
плавки)
хлоридов титана,
хлорида титана
циркония
При высокой
летучести шлака, интенсивное
и гафния
испарение которого препятствует
расслаиванию
При раздельном вводе компонентов в
реакционную зону из-за длительности
процесса и рассеяния тепла
188. Производство редких металлов. Металлотермия
Получение металла в виде губкиОсновные стадии
Плавление и сублимация исходных
реагентов
Формирование частиц губки
Спекание частиц губки
Слив шлака из реактора
189. Производство редких металлов. Металлотермия
Получение металла в дисперсном видеМеталлы получают в дисперсном виде
при условиях, когда исключается
возможность не только коалесценции
капель, но и агрегирования
кристаллических частиц между собой с
образованием губки и дендритов
Металлы в дисперсном виде – это
порошки, гранулы, корольки
Наихудший вариант
190. Производство редких металлов. Металлотермия
Случаи образования дисперсного металлаЕсли тепловой эффект металлотермической
реакции недостаточен для полного
расплавления металла, шлака или обоих
продуктов
При больших тепловых потерях, которые
имеют место в маломасштабных процессах
или при получении тугоплавких продуктов
Если образуются легколетучие продукты,
отводящие тепло при испарении и
ухудшающие условия расслаивания
191. Производство редких металлов. Металлотермия
Случаи образования дисперсного металлаПри обратимых металлотермических
реакциях, протекающих в сторону
образования исходных компонентов при
температурах, близких к температуре
кристаллизации продуктов
Если процесс сильно растянут во времени изза диффузионных затруднений при
использовании крупных частиц шихты
В случае замедленного расслоения шлака и
металла из-за близости их плотностей
192. Производство редких металлов. Алюмотермия. Ванадий и ниобий
1 -съемнаякрышка;
Производство редких металлов. 2 - корпус
печи;
Алюмотермия. Ванадий и ниобий
3 - обечайка;
4 – реакциАпробированы способы получения
онный тигель
ванадия, ниобия и тантала
для засыпки
Распространение получило производство
шихты;
ванадия (Уралредмет) и ниобия (ЧМЗ)
5 - сливное
отверстие;
Исходное вещество – М2О5 (M=V, Nb)
6 – изложВосстановитель – Al (порошок) +мало
Са
ница;
Химизм: 3M2O5+10Al = 6M + 5Al2O37 – водоохОборудование: медная изложницалаждаемая
в
подина;
камере с инертной атмосферой
8 – электроТемпература: 1600 0C (V), 2050 0C (Nb)
запал;
9 - шлак;
10 – слиток
193. Производство редких металлов. Алюмотермия. Ванадий и ниобий
ОсобенностиAl в шихте
равный
30-40 % от
Избыток
Для реакции
характерен
высокий
стехиометрии
обеспечивает
нагрев
тепловой
эффект
(2640 кДж/моль
шихты)
0С, что
реакционной
смеси
до
2150
–
2200
Для разделения шлаковой и
достаточно для эффективного разделения фаз
металлической фаз необходимо
расплавление
реакционной
Экзотермический
эффект массы
определяет
Поджиг
шихты проведения
осуществляют
возможность
процесса без
термозапалом
из нихромовой
проволоки,
подведения
внешнего тепла
при пропускании
электрического
тока
Температура
плавления Al2O
3
0
0С
Продукты
сплавы
M-(8-15%
2030 С, аплавки
сплава– Nb
с 10 %
Al 2050 Al)
(Nb – 2470 0C)
194. Производство редких металлов. Алюмотермия. Ванадий и ниобий
ДостоинстваВысокий прямой выход (97-99%)
Высокая производительность
Низкие энергозатраты
Простота процесса и его аппаратурного
оформления
Полученный компактный сплав хорошо
отделяется от шлака
Сплавы могут быть использованы для
прямого легирования титана
Недостатки
Необходимость очистки от Al
195. Производство редких металлов. Магниетермия. Цирконий и гафний
Магниетермия хлоридов цирконияАпробированы способы получения циркония,
гафния и тория
Применяют в промышленности (Zr–ОАО “ЧМЗ“)
Исходное вещество – MeСl4
Восстановитель – Mg
Химизм: MeCl4 + 2Mg = Me + 2 MgCl2«Хлорная»
технология
0
Температура: Zr – 800-850 C, Hf – 950-1000 0C
Аппаратура: существуют разные конструкции,
отличающиеся по способу ввода MeCl4
196. Производство редких металлов. Магниетермия. Цирконий и гафний
1 – Zr; 2 – MgCl2; 3 – Mg;4 – нулевой уровень;
5 – неочищенный хлорид;
Производство редких
металлов.
рафинировочный
резервуар;
16––печь
реакционной
зоны;
7 –2и
плотный
хлорид;
Магниетермия. Цирконий
–гафний
реторта;
1 – короба
с исходным
8 – плавающая крыщка;
3–
реакционный
тигель;
2 – печь
9хлоридом;
– змеевики охлаждения;
Магниетермия хлоридов.
Особенности
10 – клапан
газовый;
4испарителя
– переходная
вставка;
хлорида;
11 – патрубок
5–
– стакан
парубок
вводадля
паров
3
с
конденсатом
Организация
процесса
вакуумирования; 12 – клапан
ZrCl
в реакционный
стакан;
– печь
выхлопной;
13 –4нагревательный
4 хлорида;
6 –элемент
стаканверхней
с очищенным
конденсатора;
5 – плиты;
штуцер
14 впуска
– ;свинцовый
затвор;
ZrCl
7
–
крышка
со
для
водорода;
Совмещенный способ 15
Раздельный
способ
4
– нагревательный
элемент
штуцерами
для
6
– штуцер
для
свинцового
затвора;
Очистку MeCl4 и
Очистку
MeCl4 проводят
16
–
нагревательный
элемент
вакуумирования реторты;
и впуска
вакуумирования
восстановление ведут в
в одном
аппарате,
а его
средней
зоны;
аргона;
8
–
печь
испарителя
7
–
штуцер
для
подачи
17 – место
очищенного хлорида;
одном аппарате
восстановление
- в
ZrCl
;
9
–
штуцеры
для
слива
аргона;
8
–
термопары
18 – реторта;
4
другом
19
– экраны;
20
– стержень для
МgCl
;
10
–
реакционная
2
подъема тигля; 21 – тигель для
масса; 11 – термопара
восстановления;
22 – пробки
системы охлаждения;
23 – нагревательный элемент
нижней зоны
197. Производство редких металлов. Магниетермия. Цирконий и гафний
1 – патрубокПроизводство редких
металлов.
1 – печь
реакционной
ввода аргона;
зоны;
Магниетермия. Цирконий2и–гафний
реторта;
2 – патрубок
3 – реакционный
подачи
тигель;
Магниетермия хлоридов.
Особенности
4 – переходная
газообразного
вставка;
5 – парубок
ввода
MeCl4;паров
3–
Организация
процесса
ZrCl4 в реакционный
патрубок
стакан;
6 – стакан с вакуумной
очищенным
ZrCl4; 7 – крышка
системы;
со
С единовременной
С непрерывной
штуцерами
4 – реакционный
для
загрузкой вакуумирования
подачей
сосуд;и5впуска
– Mg;
исходных веществ
тетрахлорида
аргона; 8 –
печь
6–
испарителя
MgCl2;
ZrCl4; 9 – штуцеры
7 – Zr; 8для
– линия
слива
МgCl2; 10 –выравнивания
реакционная
MeCl4 - газ
11 – давления;
термопара
MeCl4 -масса;
твердый
9 – слив MgCl2,
10 – тигель
198.
37
6
4
5
1 – транспортный
спецконтейнер;
2 – буферная емкость;
3 – загрузочный бункер;
4 – шнековый питатель;
5 – испаритель;
6 – аппарат
восстановления;
7 – паропровод;
8 – реакционный стакан.
2
1
8
199. Производство редких металлов. Магниетермия. Цирконий и гафний
Магниетермия хлоридов. ОсобенностиЧушковый магний обезжиривают горячей
Фронт
реакции
находится
на всейстакана
площади
водой,
подтравливают
раствором
соляной
На поверхности
реакционного
кислоты,
сушат,
амагния
затем
расплавляют
при
зеркала
жидкого
и на смоченной
образуется
слой
«гарниссажа»,
на
0С в течение 1-3 часов
800-820
магнием
поверхности
реакционного
стакана
поверхности которого
в дальнейшем
В начальный
момент
подачи ZrCl
4 скорость
формируется
циркониевая
губка
его реакции с Mg невелика
В присутствии MgCl2 магний приобретает
возможность смачивать тигель и цирконий
Частицы Реакция
образующегося
циркония,
идет в газовой
фазе
служащие центрами кристаллизации, под
действием силы тяжести опускаются на дно
200. Производство редких металлов. Магниетермия. Цирконий и гафний
Магниетермия хлоридов. ОсобенностиТемпература процесса – 750-850 0С (Zr)
В аппарате поддерживают инертную
атмосферу аргона (pраб=0.1 ати)
При
Скорость
подачи
ZrCl4 – 50-60 кг/час
больших
температурах
цирконий
Время восстановления
– 70-90
часов
взаимодействует
с
После окончания
железом подачи ZrCl4 аппараты
выдерживают в течение 3-х часов при 800820 0С для усвоения всего ТХЦ и расслоения
Mg и MgCl2
201. Производство редких металлов. Магниетермия. Цирконий и гафний
Магниетермия хлоридов. ОсобенностиПеред разборкой аппарата восстановления
осуществляют пассивацию пирофорных
возгонов дисперсных магния и циркония
путем постепенного заполнения аппарата
воздухом
Для извлечения продукта восстановлнения
тигель-стакан из стали 12Х13 разрезают
Продукт восстановления – реакционная
РМ содержащую
MgCl(мас.
Mg
2
масса,
%) - Zr (58),
Mg(32), MgCl2(10), отделяют механически
202. Производство редких металлов. Магниетермия. Цирконий и гафний
Магниетермия хлоридов. ОсобенностиГидрометаллургическую обработку для
извлечения Mg и MgCl2 из реакционной
массы не применяют
Для разделения продуктов применяют
вакуумную сепарацию при 950-1000 0С и
остаточном давлении 15-30 мкм рт. ст.
Выделяющийся
при взаимодействии
магния
Продолжительность
процесса - 56 часов
водойсепарации
водород энергично
с
сПосле
проводят взаимодействует
пассивацию
Zr
(Hf)
пирофорных
возгонов, последовательно
демонтируют
вакуум-провод,
конденсатор
При
растворении
магния выделяется
теплоии
извлекают циркониевую губку
происходит частичное окисление Zr (Hf)
203. Производство редких металлов. Магниетермия. Цирконий и гафний
1 – реторта5
сепарации;
Производство редких металлов.2 – блоки
Магниетермия. Цирконий и гафний
циркониевой
губки;
Магниетермия хлоридов. Особенности
3 – печь
6
1 – фундамент;
сепарации;
Существует 22 –типа
аппаратов
конденсатор;
4 –3для
тепловой
– стакан;
4
вакуумной
сепарации
4 – воронка
дляэкран;
слива МgCl2
(Мg); 5 – водяная
5 – ретортарубашка
1
охлаждения конденсатора;
конденсатор;
С нижним
С верхним
7–
6 вставка
– кессондля
С нижним 6 – реторта;
конденсатором
конденсатором
крепления
реторты;
ороситель;
8 – печь
конденсатором
2
8
7 – вакуумпровод;
3
8 – вакуумная
система
7
204. Производство редких металлов. Магниетермия. Цирконий и гафний
ДостоинстваВысокий прямой выход
Очень высокая производительность
Высокая чистота получаемого металла
Возможность использования в качестве
сырья ZrCl4
Недостатки
Относительно высокий расход
электроэнергии
Сложность аппаратурного оформления
Сложность подбора конструкционных
материалов
205. Производство редких металлов. Натрийтермия
Апробированы способы полученияниобия и тантала
Распространение получило производство
тантала (УМЗ)
Исходное вещество – K2TaF7
Восстановитель – Na (куски)
Химизм: K2TaF7+5Na = Ta+5NaF+2 KF
Оборудование: стальной тигель с
негерметичной крышкой, шахтная печь
Температура: 1000 0C (Ta)
206. Производство редких металлов. Натрийтермия
ОсобенностиВыделяющегося в результате реакции тепла
достаточно для разогрева реакционной
смеси.
Соли перед загрузкой должны быть хорошо
высушены
тигель
послойно
загружают K2TaF7 и
не Внужен
внешний
нагрев
нарезанные кусочки натрия (около 120% от
стехеометрии). Сверху шихту засыпают NaCl
с водой взаимодействуют
с части
пары
Длянатрия
инициализации
реакции в нижней
выделением
образующего
производятводорода,
местный разогрев
до с
Образующаяся
солевая
смесь
(KF+NaF+NaCl)
образования
«красного
пятна»
воздухом взрывоопасную смесь (550-600 0С),
образует
расплав,
который
защищает
тантал
после чего
реакция
быстро
распостраняется
от окисления кислородом воздуха.
207. Производство редких металлов. Натрийтермия
ОсобенностиСоли легко отмываются водой.
Порошок тантала обрабатывают слабым
раствором соляной кислоты, промывают
водой, спиртом и сушат при 110-120 0С
208. Производство редких металлов. Кальциетермия. Торий и РЗМ
Кальциетермия фторидовАпробированы способы получения циркония,
гафния,определяется
тория и РЗЭ
Выбор температуры
Используются
в промышленности
особенностями
процесса и необходимостью
Исходное
вещество
–в
MeF
получения
металла
виде
слитка
4, LnF
3
Восстановитель – Ca
Химизм: MeF4 + 2Ca = Me + 2 CaF2
2LnF3 + 3Ca = 2Ln + 3 CaF2
Температура: РЗЭ – 1700-1800 0C
Th – 1300-1400 0C
Zr – 2000-2200 0C, Hf – 2500-2600 0C
209. Производство редких металлов. Кальциетермия. Торий и РЗМ
1 –механизм,поднимающий крышку;
Кальциетермия фторидов
Особенности
2 –Th.
подвеска
муфеля;
3 – стержень
для
В шихту вводят подогревающую
добавку
ZnCl2 (термит) в расчете поднятия
на получение
крышки;
сплава Th – 7 мас. % Zn
4, 6 и 8 –
Упругость
паров цинка иведут
его хлорида
при
Процесс
восстановления
в аппаратах
нагревательные
температурах
–элементы
очень высокая
израбочих
стальных
труб с приваренным
дном
и
печи;
фланцем для присоеднения
5 –крышки
тигель печи;
Цинк
образует
с
Образующийся
Аппарат футеруют CaO или
7 –MgO
муфель печи;
торием сплав, понижая
CaCl2 снижает
Реакцию инициируют внешним
нагревом до
9 – огнеупорный
точку
температуру
650 0Сего плавления
кирпич
0
(ТплTh-7%Zn=1200 С)
плавления и
Необходима
герметизация аппарата
вязкость шлака
210. Производство редких металлов. Кальциетермия. Торий и РЗМ
Кальциетермия фторидов Th. ОсобенностиПосле охлаждения реактора и отделения
шлака, из слитка отгоняют цинк (p<1 мм рт.
ст., 1100 0С)
Полученную губку тория после
брикетирования переплавляют в
индукционных печах (тигли – из BeO, ZrO2)
или в аппаратах с электродуговой плавкой
Извлечение тория - 94-96 %
Чистота - >98 %
211. Производство редких металлов. Кальциетермия. Торий и РЗМ
Кальциетермия фторидов РЗЭ. ОсобенностиМетод используется для получения всех
лантаноидов
за исключением
Потери иттрия
со шлаком –самария,
до 10 %
европия, тулия и иттербия
Отличительная
черта получения
РЗМCaF
– 2и
Хуже всего происходит
разделение
небольшие
масштабы
(слитки –
наиболее
легкогопроизводства
из РЗЭ - иттрия
до 3-5 кг)
Восстановление
фторидов перечисленных
элементов
Вследствие
близости
плавления,
идет
толькотемператур
до двухвалентного
плотности и вязкости
РЗМ и СaF2 необходим
состояния:
значительный перегрев реакционной зоны
0С)
2SmF3 +
Ca = 2SmF2 + CaF
(температура
восстановления
– 800-1000
2
212. Производство редких металлов. Кальциетермия. Торий и РЗМ
1 – загрузочнаяворонка; 2 – бункеры; 3
Кальциетермия фторидов РЗЭ.– Особенности
шибер;
4 – плавильная камера;
В промышленности восстановительную
5 – индуктор;
плавку ведут в индукционных
печах
6 – тигель;
7 – камера с
полунепрерывного действия
в вакууме
изложницами;
Выплавку РЗМ ведут только в танталовых
8 – изложницы;
или вольфрамовых (реже) тиглях. Другие
9 – карусель;
металлы и огнеупорные материалы
10 – гидроподъемник;
непригодны для выплавки
РЗМ
11 – вспомогательные
Расплав после плавки сливают
в медные
устройства
для
изложницы
разгрузки
213. Производство редких металлов. Кальциетермия. Торий и РЗМ
Кальциетермия фторидов РЗЭ. ОсобенностиПосле отделения металла от шлака его
направляют на переплавку
Шлак, содержащий до 10 % металла
(обычно в виде мелких корольков),
измельчают
и обрабатывают
Прямое
извлечение
составляетсоляной
около 90 %
кислотой
Из полученного раствора осаждают
оксалаты РЗЭ, сушат и прокаливают с
получением оксидов
Оксиды направляют на получение фторидов
214. Производство редких металлов. Кальциетермия. Рубидий и цезий
Апробированы способы получениярубидия и цезия
Распространение получило производство
цезия (ОАО КХМЗ)
Исходное вещество – СsCl
Восстановитель – Ca
Химизм: 2MeCl + Ca 2Me + CaCl2
Оборудование: трубчатая печь с кварцевой
ячейкой
Температура: 700-800 0C, разряжение: 0.1 Па
215. Производство редких металлов. Кальциетермия. Рубидий и цезий
1- трубка из тугоплавкогостекла; 2 – отросток; 3 –
железный контейнер с
реакционной смесью;
5 – электропечь.
Температура 700-800 0С
Разряжение 10 – 0.1 Па
216. Производство редких металлов. Восстановление водородом
Реакция восстановления Н2 до металловможет быть записана как:
MenOm + m H2 = n Me + m H2O↑
Особенностью ее протекания является то, что
для развития процесса и определения
направления наряду с температурой влияют
парциальные давления газообразных
компонентов (H2 и H2O):
m
~
p H 2O
i
0
K x xi K ~ m
p
k
H2
217. Производство редких металлов. Восстановление водородом
Восстановление водородом - это сложныйгетерогенный процесс (схема: твердое
вещество – газ), включающий стадии
диффузионного подвода к твердой
поверхности, хемосорбции, химической
реакции на поверхности, десорбции и
диффузионного отвода продуктов реакции
(паров воды и др.)
Восстановлению Н2 до металлов
подвергают оксиды Mo и W,
кислородсодержащие соединения Re
218. Производство редких металлов. Восстановление водородом
Продуктом восстановления являютсяпорошки металлов, которые при
необходимости затем компактируют
методами порошковой металлургии, дуговой
и электронно-лучевой плавкой
К порошкам, предназначенным для
производства компактных металлов,
предъявляются высокие требования по
чистоте, а также регламентируют их
гранулометрический состав
219. Производство редких металлов. Молибден и вольфрам
Восстановление водородомАпробированы способы получения молибдена,
вольфрама и рения
Применяют в промышленности: ОАО «Полема»
(Тула, Мо, W ), ОАО «Победит» (Владикавказ,
Мо, W), ОАО «КЗТС» (Кировград, W))
Исходное вещество – MeO3
Восстановитель – H2
Химизм: MeO3 + 3H2 = Me + 3H2O
Температура: варьируется
Аппаратура: многотрубчатые (муфельные) печи
220. Производство редких металлов. Молибден и вольфрам
Восстановление водородом. ОсобенностиПроцесс восстановления водородом оксидов
молибдена и вольфрама – многостадийный
MoO3 + H2 = MoO2 + H2O + 84 кДж/моль
(1)
MoO2 + 2 H2 = Mo + 2 H2O – 105.1 кДж/моль (2)
Первую стадию восстановления ведут при
450-5000С, вторую – при 900-11000С
Для снижения кислорода в порошке
осуществляют выдержку при 1000-1100 0C
(Kравн(2), 10000С =0.64, Kравн(2), 11000С =1.05)
221. Производство редких металлов. Молибден и вольфрам
Восстановление водородом. ОсобенностиНеобходимо
Восстановление
WO3 – более
сложный
использовать
хорошо
осушенный
процесс,
состоящий
из нескольких
водород,
подавая его
в печь с большой
эндотермических
реакций,
константы
скоростью
и избытком
(в 5-10
раз больше, чем
равновесия
которых
с повышением
требуется
по растут
стехиометрии)
температуры
WO3 WO2.9(W20O58) WO2.72(W18O49) WO2 W
Процесс восстановления ведут в 1 стадию при
800-950 ºС с прямоточной подачей водорода в
печь, что позволяет снизить концентрацию
паров воды и увеличить скорость процесса
222. Производство редких металлов. Молибден и вольфрам
Восстановление водородом. ОсобенностиВодород для производства вольфрамового
порошка получают электролизом воды
Перед использованием водород проходит
очистку от примесей кислорода (в
присутствии палладиевого катализатора) и
осушку (колонка с силикагелем)
После выхода из печей его регенерируют
путем
удаления
влаги вводорода:
холодильнике
и
Система
регенерации
1 – печь
специальном 2
осушителе
восстановления;
– коллектор; 3 – водяной затвор;
4 – трубчатый холодильник; 5 – осушитель; 6 –
рукавный фильтр; 7 – компрессор; 8 – осушительная
колонна, 9 – гасители с вольфрамовой проволокой
223. Производство редких металлов. Молибден и вольфрам
Восстановление водородом. АппаратураПечи для восстановления оксидов водородом
состоят из следующих блоков:
• нагревательная камера;
• автоматическое загрузочное (толкательное)
устройство;
• автоматическое разгрузочное устройство;
• система автоматического регулирования
температуры и КИПиА;
• система регенерации газа-восстановителя;
• система технологических трубопроводов
224. Производство редких металлов. Молибден и вольфрам
Восстановление водородом. АппаратураВосстановление WO3 производят в
многомуфельных (многотрубчатых) печах в
прямоугольных лодочках из молибденоникелевого сплава
В печах с высокими муфелями применяют
трехъярусные лодочки, в которых
вольфрамовый ангидрид размещен тремя
Принципиальная
конструкция муфельной печи для
тонкими слоями.
1 – загрузочная
камера;
2–
водородотермии:
Производительность
муфельной
печи
с свеча;
– труба (муфель);
4 – ротаметр;
5 – вентиль;
43 муфелями
составляет
15-16 кг/ч
по Wмет
6 – корпус печи; 7 – разгрузонная камера; 8 – датчик
влажности водорода
225. Производство редких металлов. Электролиз
ЭлектролизЭлектролизом называется разложение
электролитов постоянным электрическим
током, которое сопровождается
образованием новых веществ
Анод
Окисление
Анионы отдают
электроны
Катод
Восстановление
Катионы принимают
электроны
226. Производство редких металлов. Электролиз
Преимущества электрохимическоговосстановления
Продукты восстановления не загрязняются
остатками металла-восстановителя и
примесями, присутствующими в нем
Возможна очистка от более
электроотрицательных примесей,
содержащихся в исходном сырье
Дешевизна и доступность восстановителя
Возможность получения катодных осадков с
заданными свойствами (размеров и т.п.)
227. Производство редких металлов. Электролиз
ЭлектролизБольшинство редких металлов
характеризуется отрицательным значением
стандартного электродного потенциала
Получение их из
водных растворов
невозможно из-за
выделения водорода
Электролиз ведут из
расплавленных
солей (галогенидов,
оксигалогенидов)
228. Производство редких металлов. Электролиз
ЭлектролизЭлектрохимические свойства на границе
aMe n
Потенциал
R
T
0
электрод/раствор(расплав)
характеризуют
E
E
ln
k
k
катода/катиона
величиной электродного потенциала
n F
aMe
Если электродная реакция протекает в2
(a A )
Rтоке,
T
равновесных
Потенциал условиях (при
0
E
E
ln
a
a
стремящимся
к
нулю),
скачок
потенциала
анода/аниона
2 F
p A2
между электродом и электролитом
называют равновесным потенциалом
Значение равновесного потенциала
определяется уравнением Нернста
229. Производство редких металлов. Электролиз
ЭлектролизСумму равновесных потенциалов анода и
катода называют
напряжением
разложения
ПОЛЯРИЗАЦИЯ
– следствие
замедленности
одного
Для осуществления
электролиза
в или
нескольких
процессов,
равновесных условиях
необходимо
приложить внешнее
напряжение
на
протекающих
на электроде
бесконечно малую
превышающее
при величину,
прохождении
тока
напряжение разложения
При прохождении тока через систему
происходит сдвиг потенциалов электродов от
их равновесного значения
230. Производство редких металлов. Электролиз
ПоляризацияПри электролизе расплавов катодный
процесс чаще всего контролируется
Концентрационная
диффузией (массопереносом), Химическая
а анодный –
Диффузия
диффузией и фазообразованием Побочная
разряжающихся Электрохимическая химическая
Увеличение плотности тока приводит к
ионов к
Электрохимическая
(фазовая)
явлению
наступления
предельного
тока,
поверхности
реакция
реакция
когда
все
подходящие
ионы
разряжаются
и
электрода
их концентрация в приэлектродном слое
равна нулю
Лимитирующая стадия
231. Производство редких металлов. Электролиз
Предельная плотность тока:D n F C0
ilim
где D – коэффициент диффузии;
n – число электронов;
С0 – концентрация ионов в объеме;
- толщина диффузионного слоя
Концентрационная поляризация:
R T
ik
Econc
ln 1
n F ilim
232. Производство редких металлов. Электролиз
ЭлектролизВ технологии наиболее часто применяют
Явление резкого увеличения
напряжения
гальваностатический
режим электролиза
на ванне и уменьшения силы тока,
Катодную плотность тока выбирают так,
вызванное образованием газовой пленки,
чтобы она была выше предельных
отделяющей анод от электролита
плотностей примесей (электроположительных) и ниже предельной плотности
тока выделения основного металла
Выбор анодной плотности тока обусловлен
исключением явления анодного эффекта
233. Производство редких металлов. Электролиз
Электролиз. Выход по токуПричины снижения выхода по току:
Выход по току – коэффициент полезного
Совместный разряд ионов-примесей
использования тока, равный отношению
Растворение выделяющихся на катоде
количества электричеств, практически и
металлов в расплаве
теоретически расходуемого на единицу массы
Образование соединений в низшей степени
катодного продукта
окисления на катоде
Испарение металлов
Побочные реакции продуктов электролиза с
материалом электролизера и между собой
Потери при обработке катодных осадков
234. Производство редких металлов. Электролиз. Литий
Электролиз расплавленных солейсегодня является основным
промышленным способом
получения лития
В качестве электролита
используют
эквивесовую
смесь LiCl - KCl
Температура процесса
400-430 0С
235. Производство редких металлов. Электролиз. Литий
Электрохимические основы процесса:Катод: Li+ + e- → Li φLi+/Li= -3.78 В;φК+/К= -3.89
В;
Анод: 2Cl- - 2e → Cl2
Возможен совместный разряд ионов лития и
калия :
при снижении концентрации хлорида лития в
электролите за счет сдвига потенциала выделения при
концентрационной поляризации;
за счет сближения потенциалов выделения при
сплавообразовании.
236. Производство редких металлов. Электролиз. Литий
Для получения наиболее чистого продуктаследует:
очистить электролит от солей кальция, магния и
натрия;
постоянно регулировать содержание расходуемого в
процессе электролиза хлорида лития в электролите,
сохраняя его на уровне 57- 59 мол. %;
поддерживать оптимальную величину катодной
плотности тока;
поддерживать в заданном интервале температуру
ванны.
237. Производство редких металлов. Электролиз. Литий
АппаратураПроизводительность
ванны 25 – 28 т лития в
год.
Катодная плотность тока
1- 3 А/см2 ;
анодная 0.3 – 0.5 А/см2.
238.
Производство редких металлов.Электролиз. Литий
Состав лития, полученного электролизом
Примеси, не более %
Марка
Li, %
ЛЭ1
Li0
K
Na
Mg
Ca
Al
Fe
Mn
Si
N
98.0
0.2
0.8
0.3
0.05
0.03
0.01
0.005
0.1
0.05
99.9
0.005
0.04
0.02
0.03
0.003
0.005
0.001
0.01
0.05
239. Производство редких металлов. Электролиз. Цирконий
Электролитическое получение цирконияЭлектролит: K2ZrF6-KCl (исходный)
K2ZrF6(12-18%)-KCl(19-22%)-KF(60-70%)
Химизм: катод – Zr4++4e Zr
анод –
2Cl—2e Cl2
xF-+C-xe CFх
Условия: температура – 740-780 0C
катодная плотность тока – 2.5-3 А/см2
анодная плотность тока – 0.2-0.3 А/см2
Выход по току: < 60 %
240. Производство редких металлов. Электролиз. Цирконий
Электролиз циркония. ОсобенностиПеред электролизом соли должны быть
хорошо высушены (ФЦК - 3000С, KCl - 4000C)
Перед запуском на стенки электролизера
наплавляют гарниссаж – слой застывшего
электролита – для чего в загруженном
солями электролизере замыкают селитовой
перемычкой 2 электрода, а после
расплавления электролита включают
внешнее охлаждение водой
241. Производство редких металлов. Электролиз. Цирконий
1 – бункерисходных солей;
Производство редких металлов. 2 – аноды;
3 – смотровое
Электролиз. Цирконий
окно;
4 – стальной
Электролиз циркония. Особенности
полый
вал;
Перед запуском в открытом режиме
в расплав
5 – катод;
добавляют электролит, слитый из работающих
6 – сгарниссаж;
электролизеров, а также ФЦК и КCl
целью
7 – рубашка
получения необходимой концентрации
водяного
циркония и фтор-ионов
охлаждения;
После получения необходимого уровня
приемник
расплава электролизер переводят8в– закрытый
катодного
режим (атмосфера – Ar, анодные газы),
1 – бак для
холодной
воды; 2
– система
ввода9 –
опускают
катоды
и подают
ток
продукта;
охлаждающей воды; 3 – стальной полый
вал
шибер;
10– –
Продолжительность кампании определяется
токоподвод к катоду; 4 – водо–воздушная смесь;
система(3мес)
среза
скоростью расхода графитовых анодов
5 – анод; 6 – бункер питания солями; 7 – бункера для
катодного
катодного продукта; 8 – стальной катод; 9 – система
продукта
среза катодного продукта
242.
243. Производство редких металлов. Электролиз. Цирконий
Электролиз циркония. Анодные газыАнодные газы содержат 30-50 об. % хлора,
18-36 об. % фреонов, до 5 % азота, до 2 %
кислорода, до 10 % аргона
Технологический процесс очистки анодных
газов от хлора включает в себя:
Улавливание хлора в скрубберах
NiCl2:CuSO4:H2O
Ca(ClO)молоком
известковым
2=CaCl2+O2
Доулавливание
хлора
в абсорберах
Cl2+H
O=HCl+HClO
2
известковым молоком
2 HCl+Ca(OH)
Разложение
гипохлорита
кальция
2=CaCl
2+H2Oпри
0C в присутствии каталитической смеси
80-90 2
HClO+Ca(OH)2=Ca(ClO)2+H2O
244. Производство редких металлов. Электролиз. Цирконий
Электролиз циркония.Переработка катодных осадков
После образования на катоде необходимого
количества циркония производится
извлечение катода из расплава и срез
катодного осадка, который поступает в
бункер для охлаждения
Состав катодного продукта: Zrмет-28-30 %,
К2ZrF6 – 10 %, KF – 44 %, KCl – 14 %,
K (K2O)– 1-2 %, C – до 0.5 %
245. Производство редких металлов. Электролиз. Цирконий
Переработка катодных осадковКатодный осадок дробят и измельчают до
5-10 мм в щековых и роторных дробилках
Для выщелачивания соли осадок двукратно
обрабатывают карбонатом аммония
С целью очистки порошка циркония от частиц
углерода
К2ZrF6 + применяют
2 (NH4)2CO3флотацию
=
Для разрушения
и гидрокси= (NH4)2флотореагентов
[ZrF2(CO3)2] + 2 KF
+ 2 NH4F
дов осадок промывают серной кислотой
(50 г/л) в пульсоколонне
После водной отмывки катодный продукт
фильтруют и сушат (80 0С) на нутч-фильтрах
246.
Катодный продуктДробление (25-40 мм)
Измельчение (5-10 мм)
(NH4)2CO3
50 г/л
I карбонатная обработка (Т:Ж=1:3), 1ч
-1мм
Декантация
Грохочение
Измельчение (0.5-1 мм)
твердое
(NH4)2CO3 II карбонатная обработка
25 г/л
(Т:Ж=1:1.2), 1ч
твердое
+1мм
Декантация
раствор
На извлечение
циркония
раствор
247.
твердоеH 2O
Промывка (до pH=8)
керосин
сосновое
масло
Флотация (Т:Ж=1:4)
Водный
продукт
твердое
H2SO4
50 г/л
пар
Декантация
на
сжигание
раствор
на сброс
Кислотная обработка (Т:Ж=1:3, 4ч)
твердое
H 2O
Пенный продукт
Декантация
Промывка (до pH=6)
Фильтрация и сушка (80 0C)
Порошок циркония
раствор
пром. воды
фильтрат
на извлечение
циркония
248. Производство редких металлов. Электролиз. Цирконий
Примесный состав электролитическогоциркония, мас. %
Fe -0.05
Si – 0.02
Hf – 0.05
Al – 0.01
K – 0.04
Cr – 0.02
N – 0.006
C – 0.02
F – 0.05
O – 0.1
Качество полученного циркония не отвечает
требованиям, предъявляемым к металлу в
Прямой выход – 60-70 %
атомной промышленности, поэтому ведут
дополнительное рафинирование
249. Производство редких металлов. Электролиз. Редкоземельные металлы
Электролитическое получение РЗМЧистота металлов, полученных электролизом,
обычно ниже тех, которые выплавляют
металлотермией
Промышленное значение имеют технологии
получения легкоплавких РЗЭ технической
чистоты и мишметалла, т.е. тех РЗМ, к чистоте
которых не предъявляют высоких требований,
а себестоимость их производства является
определяющим фактором
Тяжелые РЗЭ электролизом не получают
250. Производство редких металлов. Электролиз. Редкоземельные металлы
Электролитическое получение РЗМЭлектролит: LnF3(55-65%)-LiF(15-25%)-BaF2 (10-15%)-Ln2O3(до 5 %)
Химизм: катод – Ln3++3e Ln
анод –
LnOF2--2e LnF3+F-+O
2O O2
Условия: температура – 900-1050 0C
катодная плотность тока – 5-7 А/см2
анодная плотность тока – 0.2-0.5 А/см2
Выход по току: < 75 %
251. Производство редких металлов. Электролиз. Редкоземельные металлы
Электролиз РЗМ. ОсобенностиПолучаемые лантоноиды содержат до
98 % РЗМ
Основные примеси – кислород, углерод,
железо, кальций, алюминий и кремний
Выделяющиеся на катоде РЗМ образуются в
жидком виде
252. Производство редких металлов. Электролиз. Редкоземельные металлы
Производство редких металлов.1 – графитовые
Электролиз. Редкоземельные металлы
аноды;
2 – катод из
Электролиз РЗМ. Аппаратура
молибдена;
Ванны для электролитического
3 –получения
графитовый
РЗМ состоят из стальной емкости,тигель;
футерованной графитом или 4
огнеупорами
– электролит;
Для получения металлов повышенной
5 – танталовый
чистоты электролизеры футеруюттигель;
молибденом или наплавляют гарниссаж
6 – РЗМ;
Катодом служит сам сосуд или тугоплавкий
7 графитовые
– сливная
металл, анодом – вертикальные
трубка;
стержни
– изложница;
По мере накопления жидкий 8
металл
9 – камера
извлекают со дна вакуум-ковшом
электролизера
253.
Рафинирование редких металлов.Рафинирование металлов - очистка первичных
(черновых) металлов от примесей (черновые
металлы, получаемые из сырья, содержат
96-99% основного металла)
Различают 3 основных метода
рафинирования: пирометаллургический,
электролитический и химический.
Для получения чистых металлов нередко
используют последовательно несколько
методов рафинирования
254.
Рафинирование редких металлов.Литий
Удаление оксидов и нитрида лития
Фильтрование;
(250 0С, металокерамика, сетки из Fe, Ti, Mo)
Взаимодействие с металлами –геттерами;
(800 0С губка Zr, Ti)
Удаление Na и K
Гидрирование; (700-800 0С, Н2)
Удаление щелочных, щелочноземельных и тяжелых металлов
Вакуумная дистилляция.
1.450 0С, 10-1 – 10 -3 Па( удаление ЩМ);
2.600-800 0С ( возгонка лития).
255. Рафинирование редких металлов. Ванадий
Методы рафинированияиодидное рафинирование
вакуумная
черновой
ванадийдуговая
реагируетплавка
с иодом при 800-900
0С с образованием паров VI , которые затем
2
счет использования вакуума
удается защитить
Заэлектронно-лучевая
плавка
разлагаются
на ванадиевой
проволоке
с
металл
от загрязнения
вследствие
взаимодействия
0С
образованием
чистого
металла
при
1300-1400
более
электролитическое
рафинирование
низкие давления
и медленные
скорости
его
с атмосферой
и обеспечить
удаление
газовых
из-за
относительно
высокого
давления
в
зоне
дуги
плавки
примесей
и низкокипящих
и короткого
времени
пребыванияметаллов
металла в
расплавленном
состоянии
неотудается
невозможно
очистить
ванадий
хрома, удалить
циркония
примеси
с относительно
Tкип
и других
элементов,
иодидывысокими
которых имеют
вытеснил
электродуговую
плавку
близкие
к VI
2 термические свойства
256. Рафинирование редких металлов. Ванадий
1 – двухкаскаднаяРафинирование редких металлов.
термоэлектрон-ная
пушка;
Ванадий
2 – электромагнитные линзы;
Электронно-лучевая плавка
3 - (ЭЛП)
вакуумный
затвор;
Характеристики плавки:
4 - плавильная
-4
-5
• Остаточное давление 10 -10камера;
мм рт.5ст.
- шток
• Скорость плавки 1.5 – 2.0 кг/час подачи;
6 – переплавля• Потери на испарение 8 – 12 %
емый штабик;
7 – ветрикаль• Мощность пушки 40-50 кВт
ный кристаллиДля повышения эффективностизатор;
очистки
8 – закрииспользуют многократный переплав
сталлизовавшийся слиток;
9 - шток подачи
257. Рафинирование редких металлов. Ванадий
Электронно-лучевая плавкаМетод ЭЛП не позволяет очистить
металлы от примесей с большей
температурой плавления и
образующих тугоплавкие соединения
Для снижения концентрации
кислорода в расплав вводят алюминий
258. Рафинирование редких металлов. Ванадий
Электронно-лучевая плавкаДостоинства
Высокая чистота металла
Продуктом является компактный металл
Отсутствие невозвратимых потерь
Недостатки
Очень высокий расход э/энергии
Невозможность очистки от некоторых
примесей
Сложность аппаратуры
Низкая производительность
259. Рафинирование редких металлов. Ванадий
Электролитическое рафинированиеЭлектролиты – солевые расплавы
При анодном растворении в расплав вместе с
металлом переходят электроотрицательные
ионы,Хлоридные
которые при катодном осаждении
(Na-K)Cl
экв
остаются
в электролите
Двухстадийным электрорафинированием
2 VCl3 + V = 3 VCl2
получен ванадий с суммарным содержанием
примесей 0.0121 мас. %, а трехстадийным 9.3 10-3 мас. %
260. Рафинирование редких металлов. Ванадий
1- корпус печи;2 -нагреватель;
Рафинирование редких металлов.
3 - реторта из
нержавеющей стали;
Ванадий
4 - никелевый стакан;
5 - анодный металл;
Электролитическое рафинирование
6 - молибденовая
процесс ведут в электролизерахкорзина;
с
7 - электролит;
центральным катодом выполненным
из
8 – катод
молибдена или нержавеющей
стали
(нержавеющая
сталь);
штанга
черновой металл помещают9 в- катодная
специальные
(нержавеющая сталь);
анодные корзины из молдибдена
вдоль для
10 - контейнер
стенок никелевого тигля -катодного
контейнера
осадка; 11 термопара;
в аппарате поддерживают инертную
12 - узел среза
атмосферу очищенного аргона
катодного осадка;
13 - вакуумный вентиль
к аргонно-вакуумной
системе
261. Рафинирование редких металлов. Ванадий
Электролитическое рафинированиеДостоинства
Высокая чистота металла
Высокая производительность
Относительно низкий расход э/энергии
Недостатки
Большие потери (10-20 %)
Невозможность очистки от некоторых
примесей
Сложность аппаратуры
Получают порошки металлов
262. Рафинирование редких металлов. Ванадий
Наиболее чистые тугоплавкиеметаллы могут быть получены при
комбинировании методов
электронно-лучевого переплава и
электролитического рафинирования
263. Рафинирование редких металлов. Цирконий
Иодидное рафинированиеВ технологии циркония наибольшее
распространение для рафинирования
металла получило иодидное рафинирование,
основанное на транспортных реакциях
Химизм:
250 0C
1500 0C
Zr + I2
ZrI4
Zr + I2
Зона 1
Зона 2
Зона 2 – циркониевая нить (проволока) длиной
26-28 м с диаметром 1.5-2.5 мм
264. Рафинирование редких металлов. Цирконий
Йодидное рафинирование Zr. ОсобенностиИод реагирует с цирконием при
температурах выше 150 0С
Цирконий не образуется, а происходит
При температурах выше 300 0С возможно
разъедание нити
образование низших иодидов, имеющих
более низкие температуры кипения
При температурах ниже 1500 0С и высоком
Скорость
переноса циркония
снижается
давлении
тетраиодида
возможно
образование на нити «черного тумана»
низших иодидов циркония
265. Рафинирование редких металлов. Цирконий
Иодидное рафинирование. ОсобенностиТемпературу нити контролируют, пропуская
через нее заданный электрический ток
С течением времени толщина нити
увеличивается, что приводит к
уменьшению сопротивления и возрастанию
электрического тока
Процесс ведут по заранее рассчитанным
вольтамперным характеристикам, исходя
Для сохранения условий
(температуры)
из зависимости: I·U3=const
необходимо уменьшить напряжение на нити
266. Рафинирование редких металлов. Цирконий
1 – корпус; 2 – внешняястенка; 3 – ампула с I2;
4 – токоподвод; 5 –изолятор;
6,9 - сетка (нихром, Mo);
Цирконий
7, 24 – циркниевая стружка; 8
– циркониевая нить;
Иодидное рафинирование.
Аппаратура
10 – труба
воздушного
охлаждения
(нагрева); 11,
Установка для иодидного
рафинирования
12, 13 – система натяжения
состоит из цилиндрического
реактора из
нити; 14,15 – внутренняя и
жаропрочной спецстали
с герметичной
наружная
стенка рубашки
крышкой, вакуумной системы,
охлаждения;
16,25 – шибера;
электрической и контрольно17 – управление шибера;
измерительной аппаратуры
18 – вентилятор;
19 – тройник для
присоединения аппарата к
аргонно-вакуумной системе;
20-23 – верхняя подвеска
циркониевой нити;
26 – труба отвода горячего
воздуха
Рафинирование редких металлов.
267.
268.
Электролитический ZrПрессование и спекание (вакуум, 1050 0С)
Получение стружки
NH4OH
pH=8
H2SO4 0.1M
0.1 % КF
Обезжиривание
Травление
Зашихтовка
воздух
Сушка аппарата
Сборка аппарата
Обезгаживание, 300 0С, 12 ч
Ar
Заполнение аргоном
269.
ArI2
Заполнение аргоном
Заполнение иодом, 200 0С
Рафинирование, 35 ч, Траб
Охлаждение, 5 ч
NH4OH
pH=8
Улавливание иода, 30 мин
Разборка аппарата
H2O
Промывка циркония
Иодидный Zr
270. Рафинирование редких металлов. Цирконий
Иодидное рафинирование. Эффект очисткиЭлемент
Содержание, ppm (10-4 мас. %)
Ni
160
10-20
Si
210
130
Fe
420
20-30
Al
110
50-100
O
1200
20-100
Иодидное рафинирование не позволяет
Cr
200
12-30
очиститься от элементов, свойства которых
N
110
10-40
(элементов, иодидов) похожи на цирконий
C
290
60-100
(Hf, Ti, V, Th)








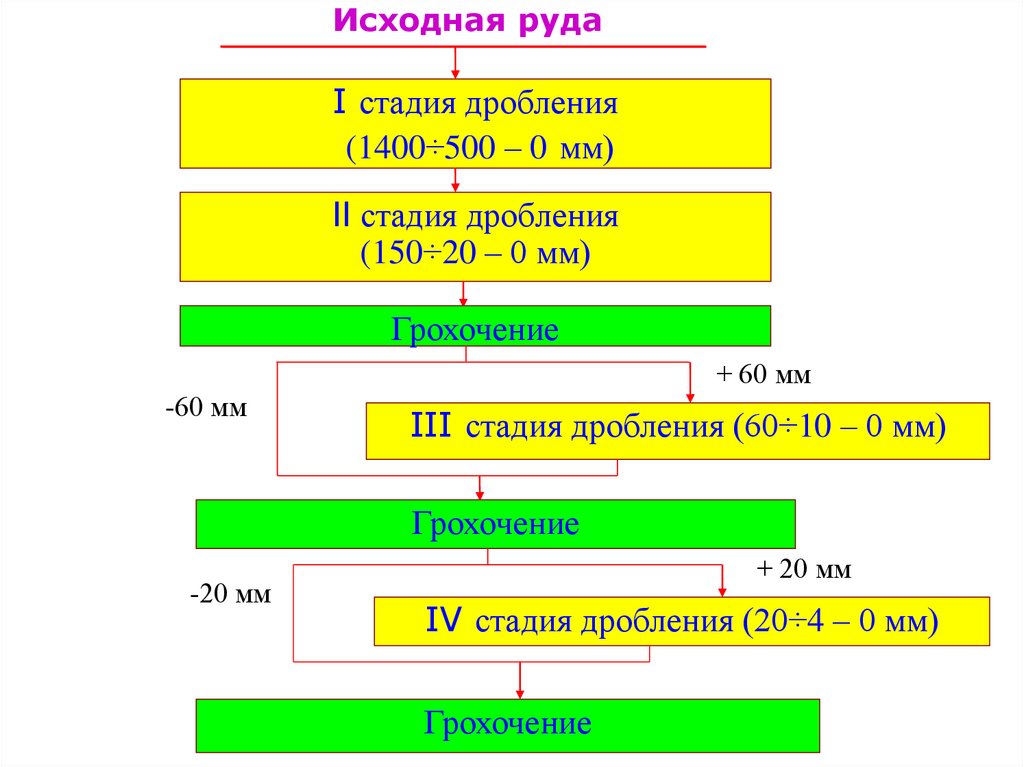

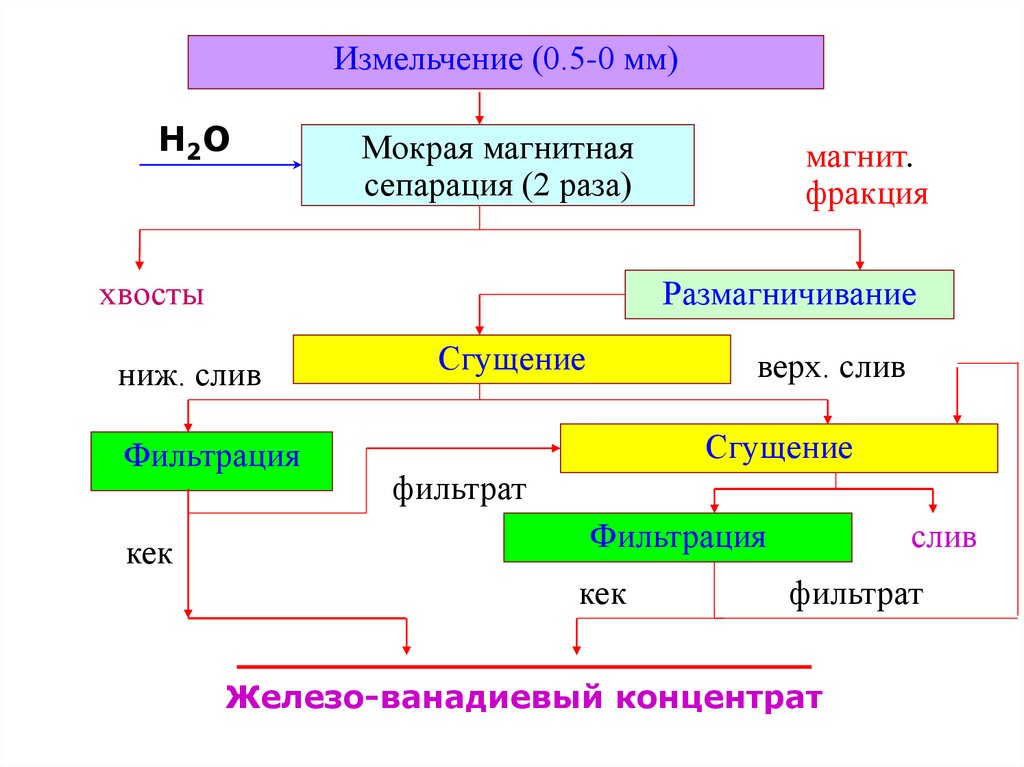



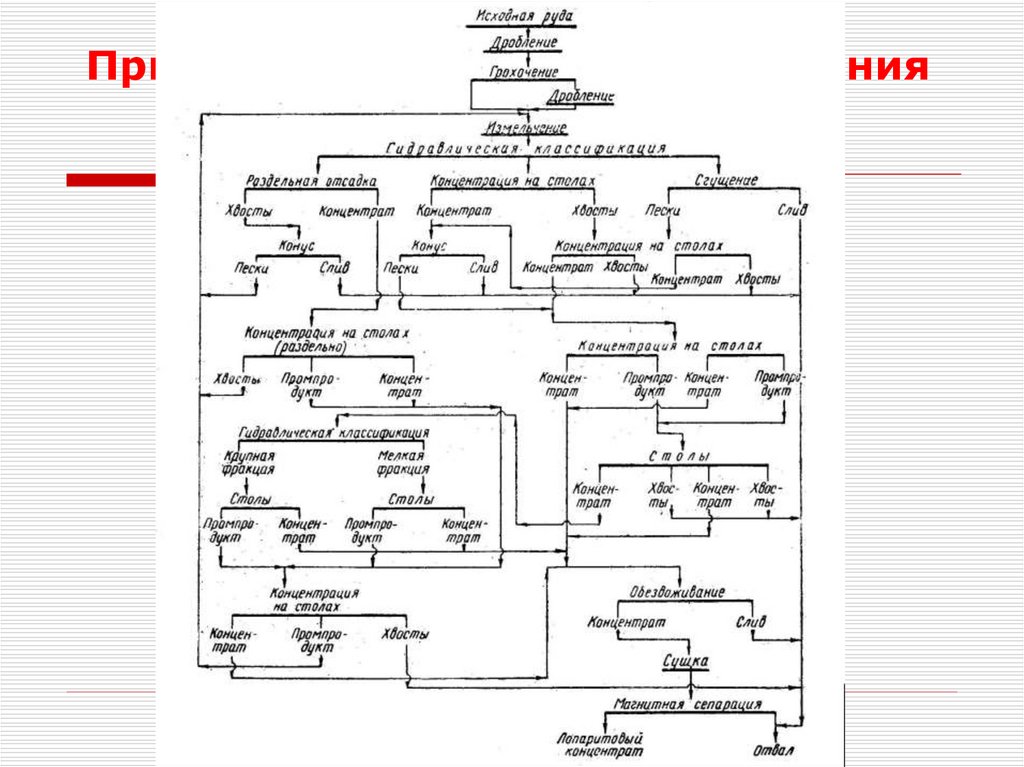
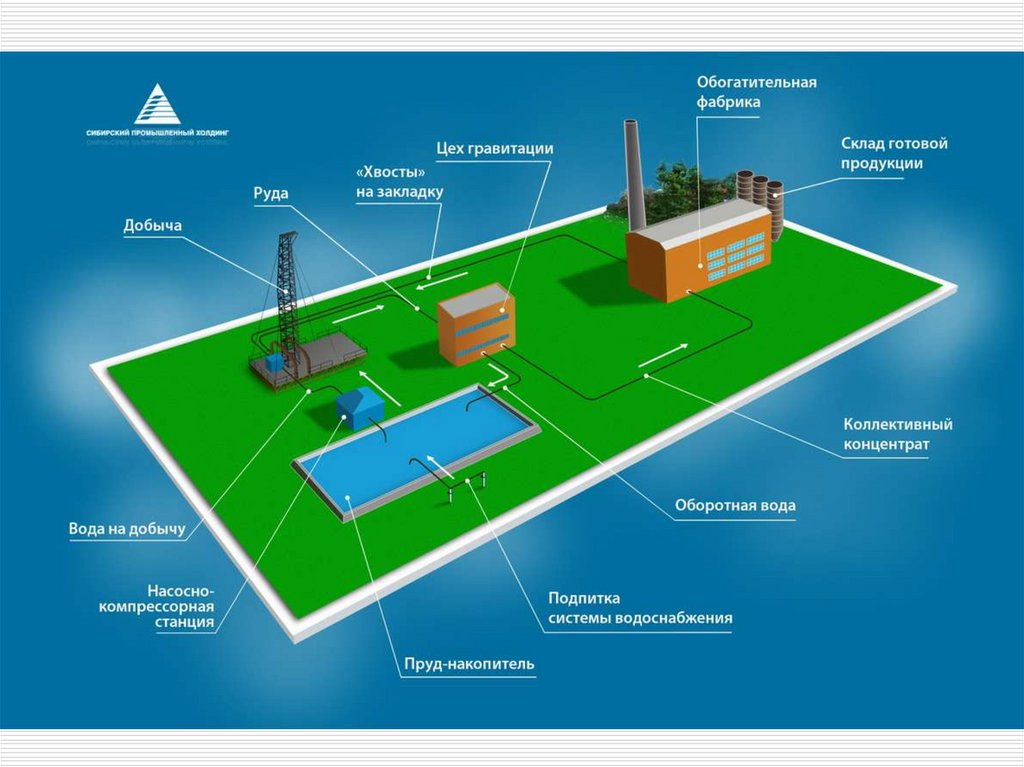
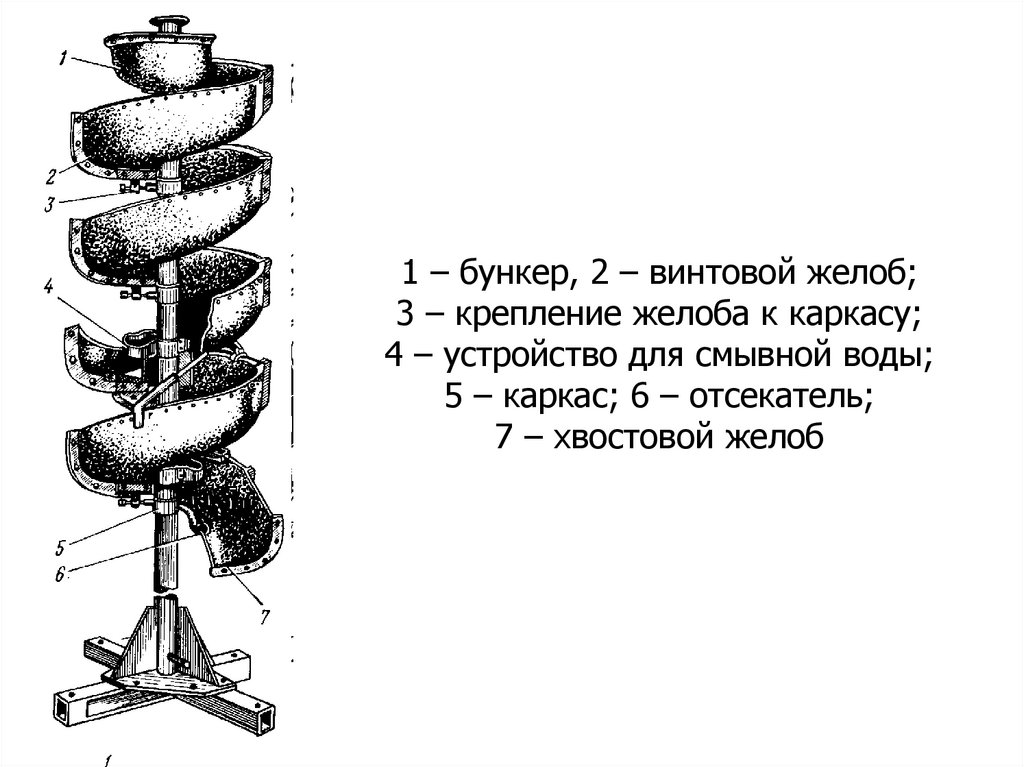


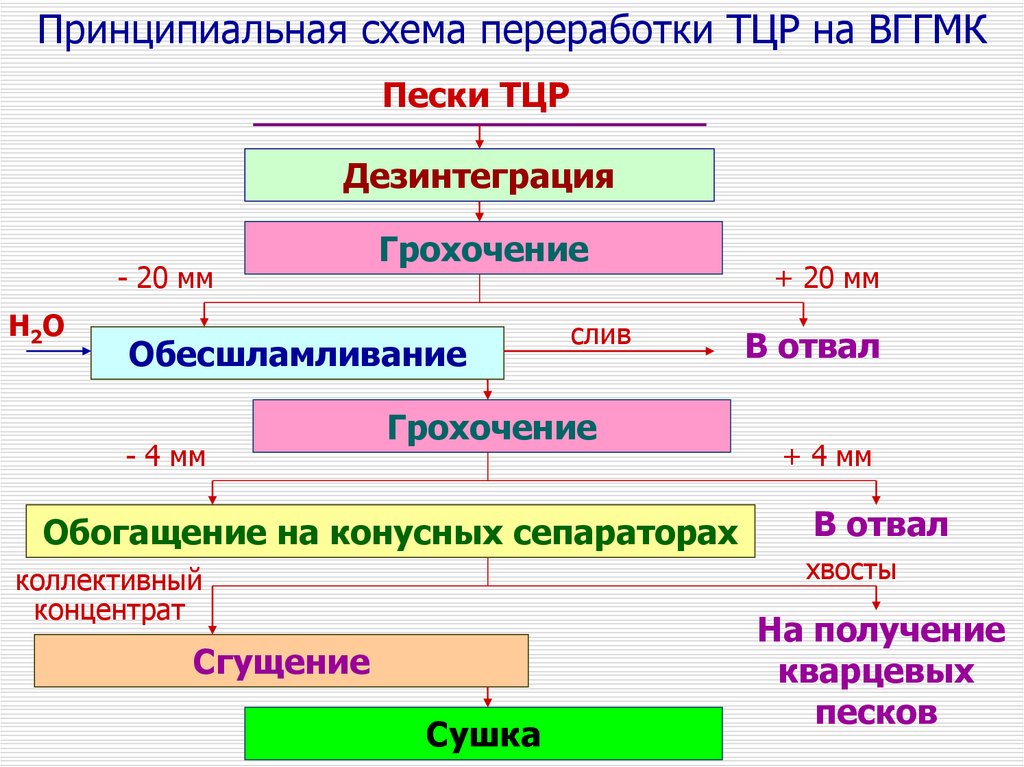
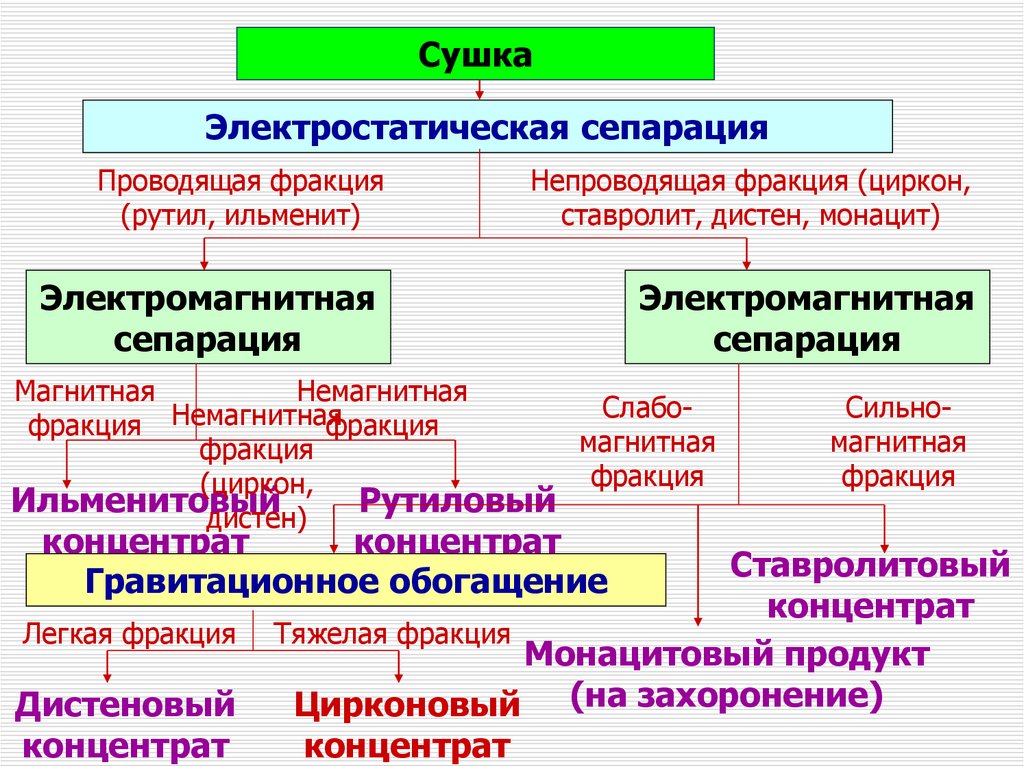



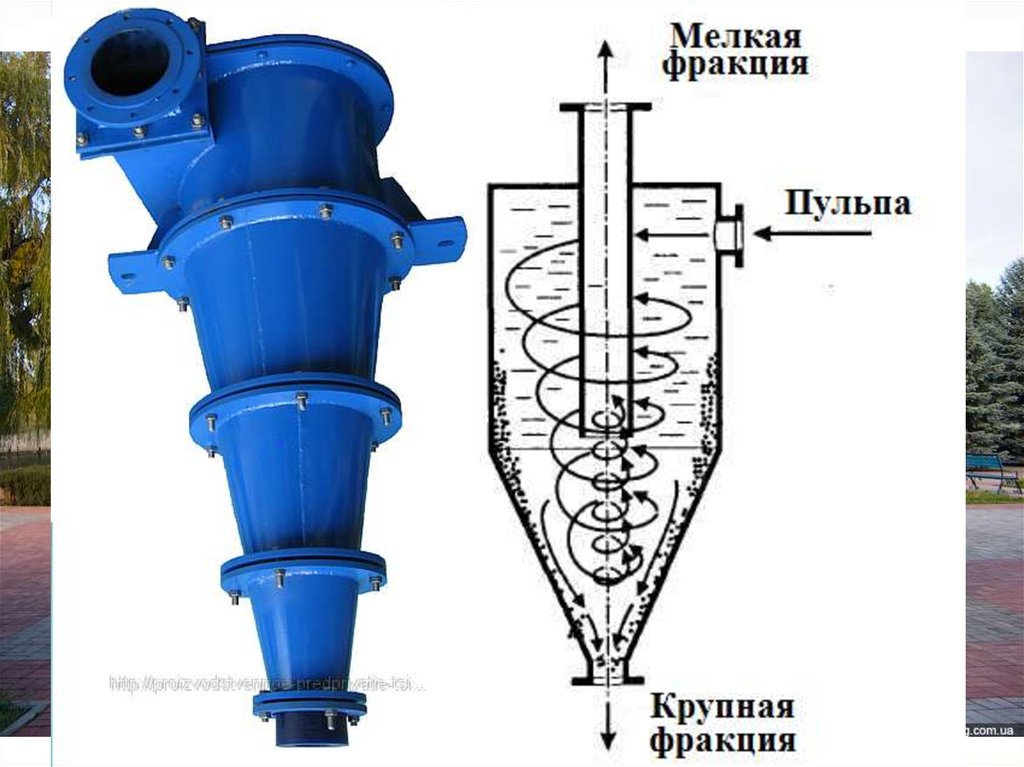


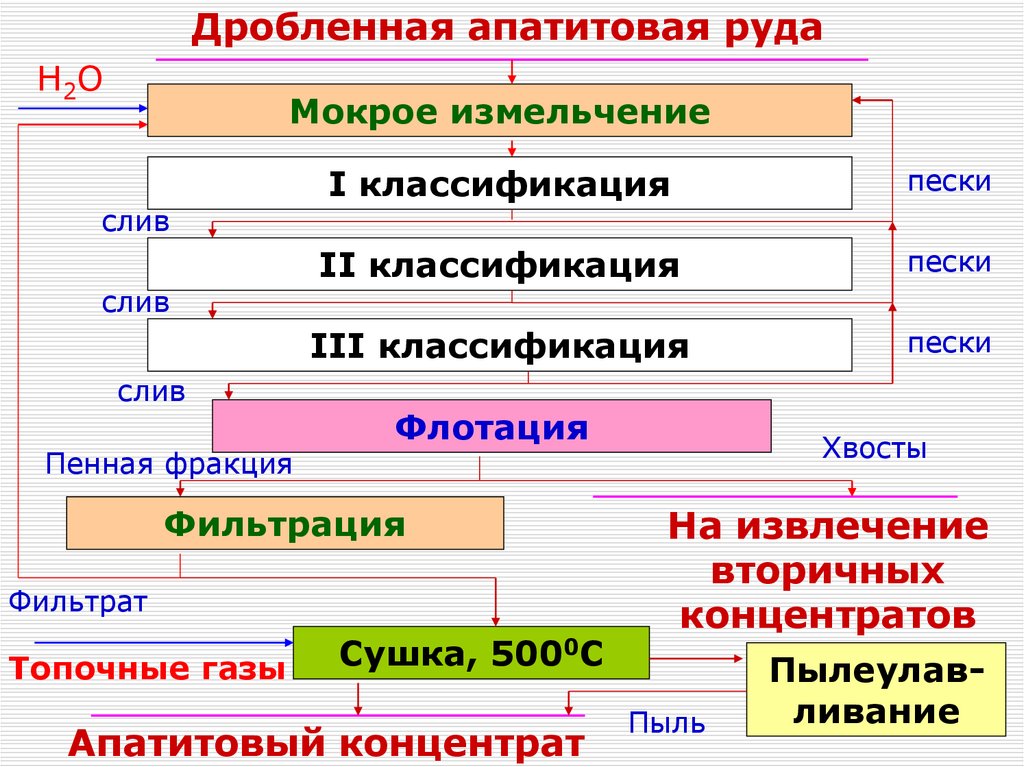








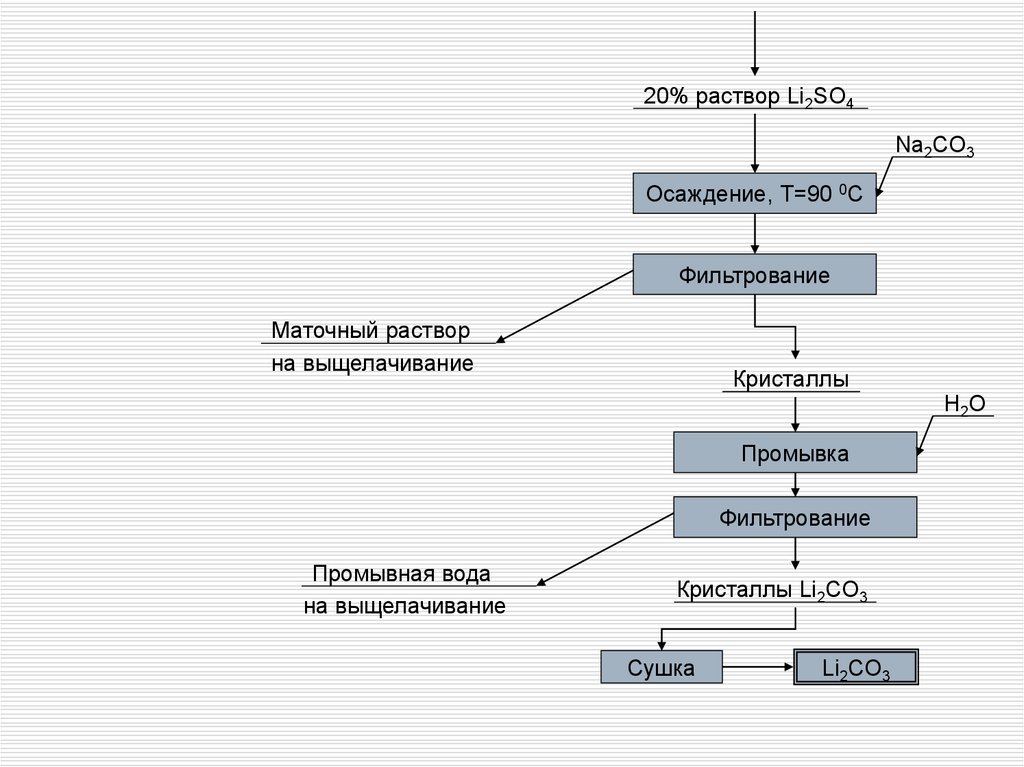

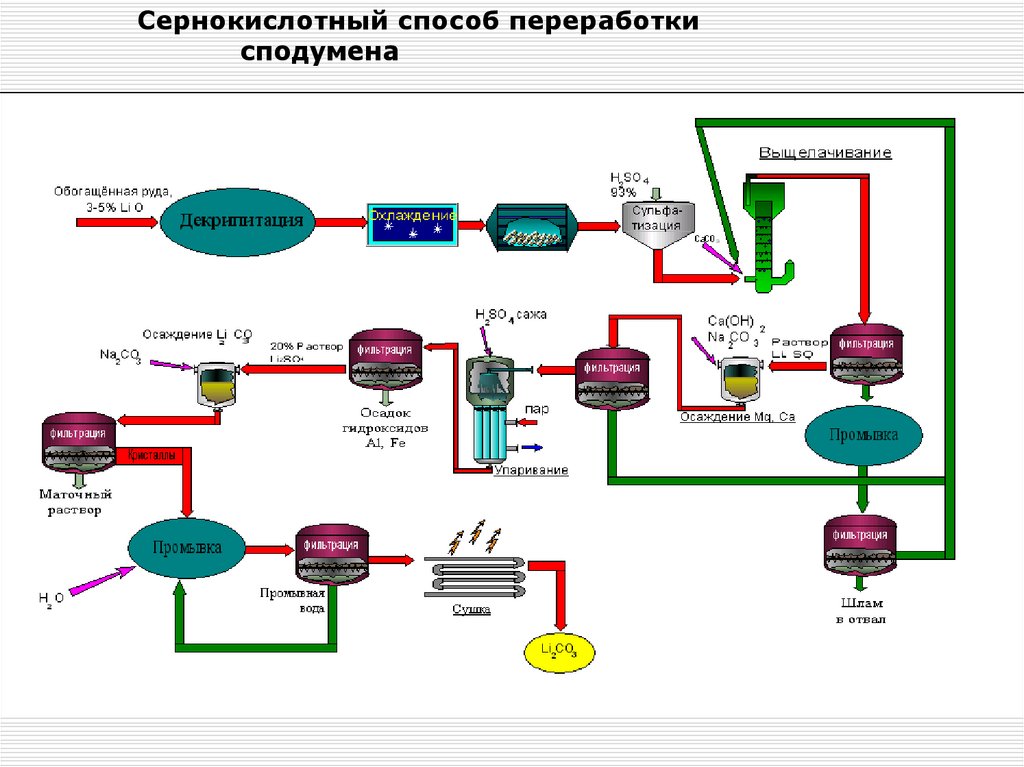












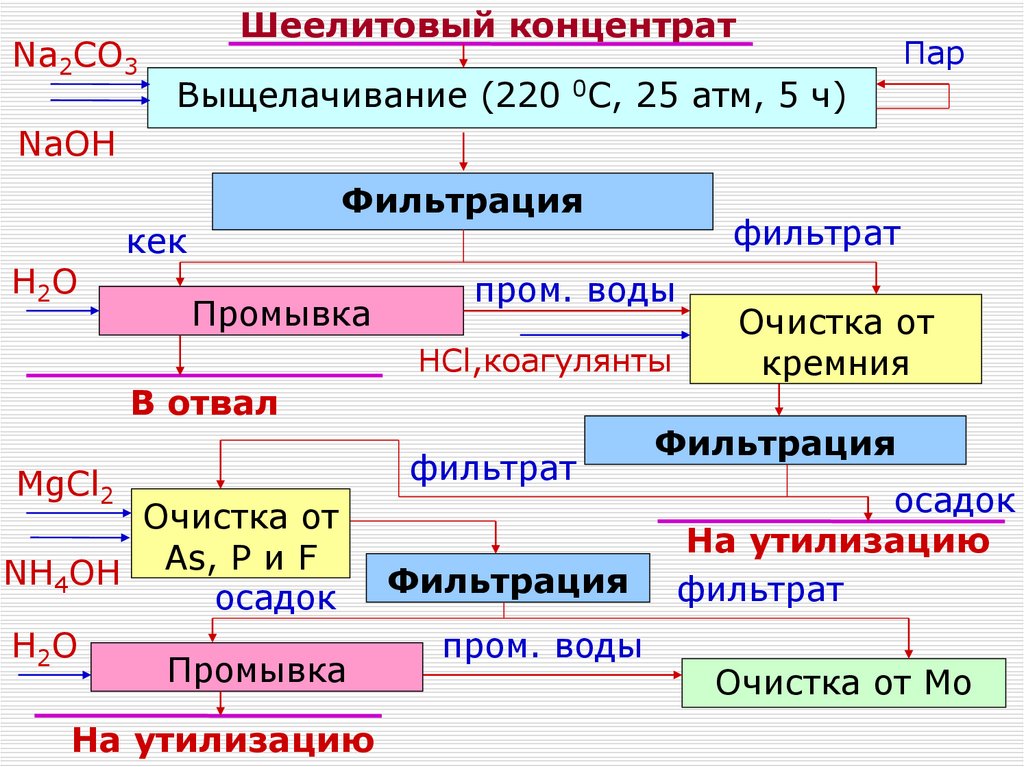
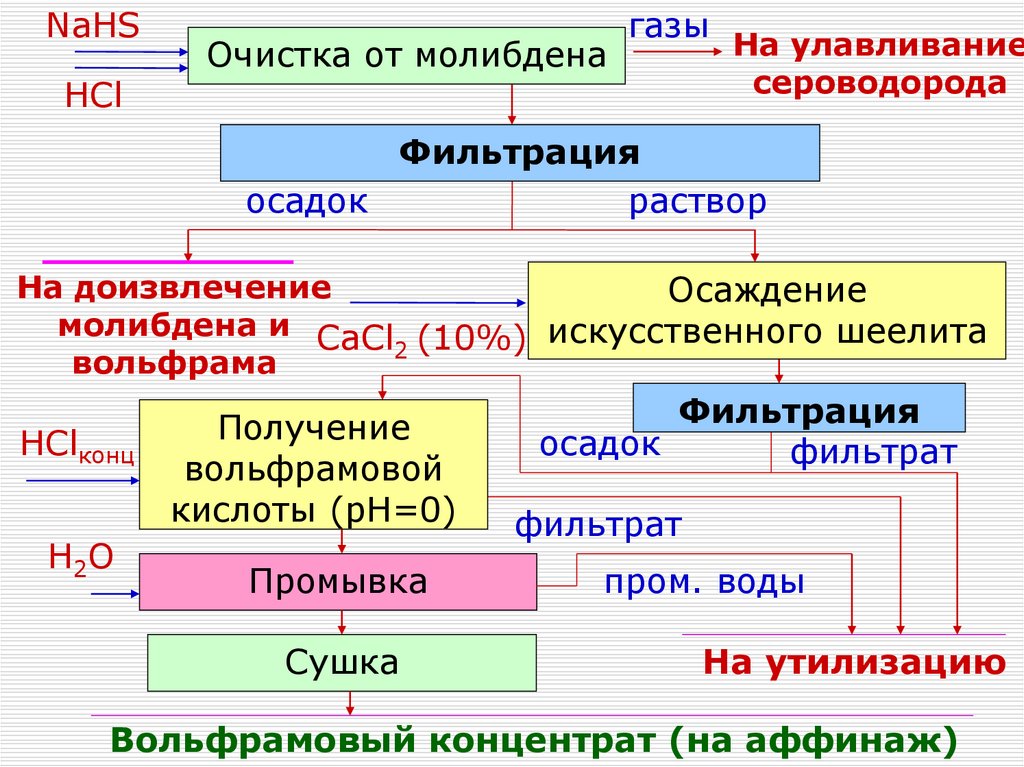




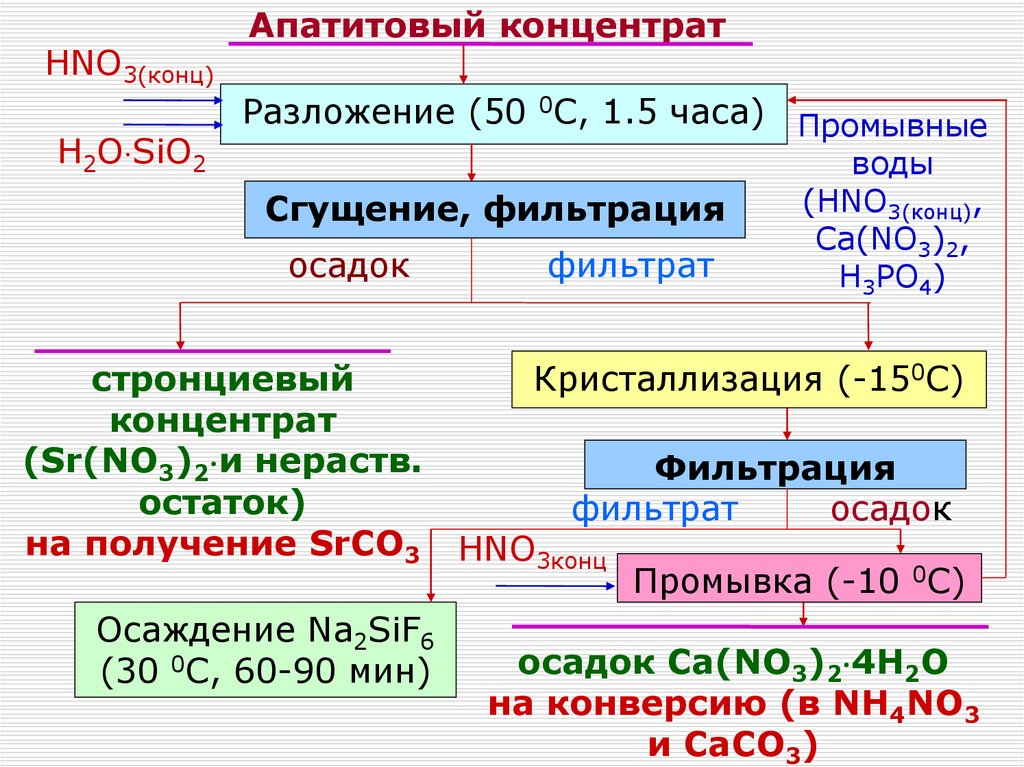
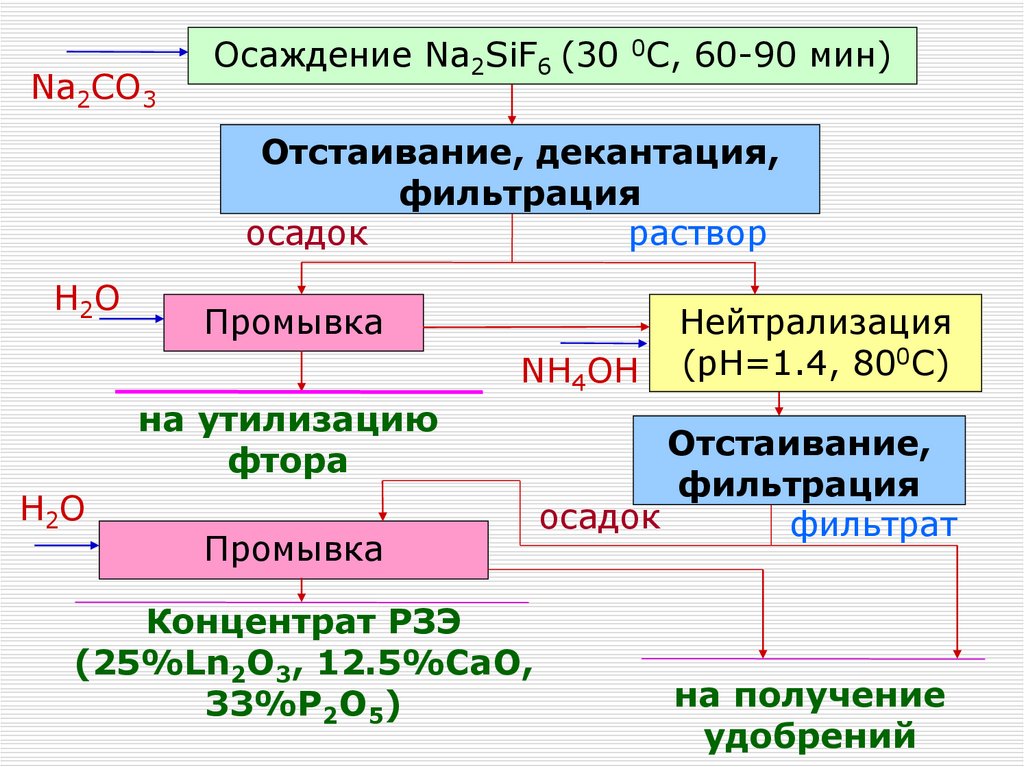





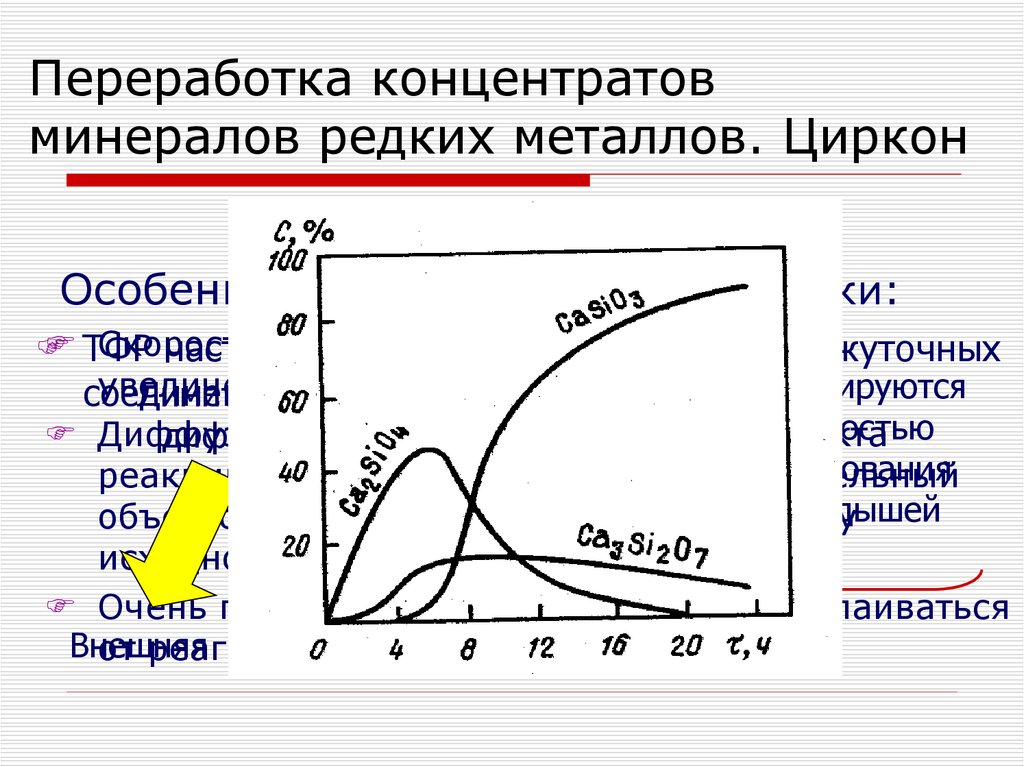











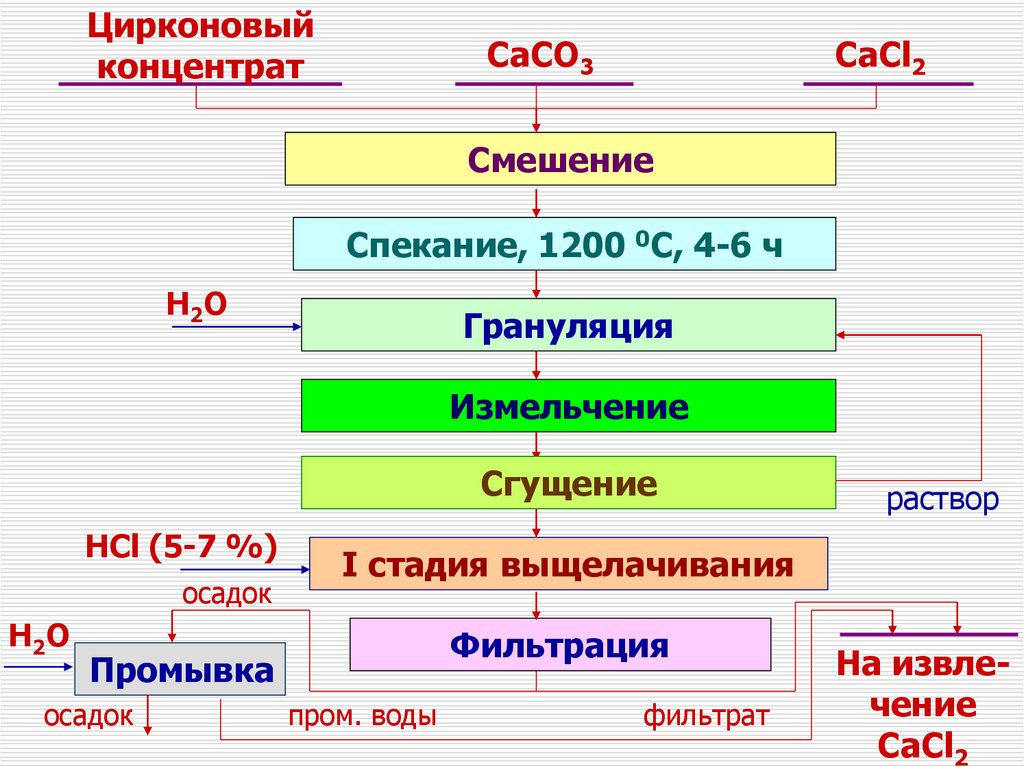

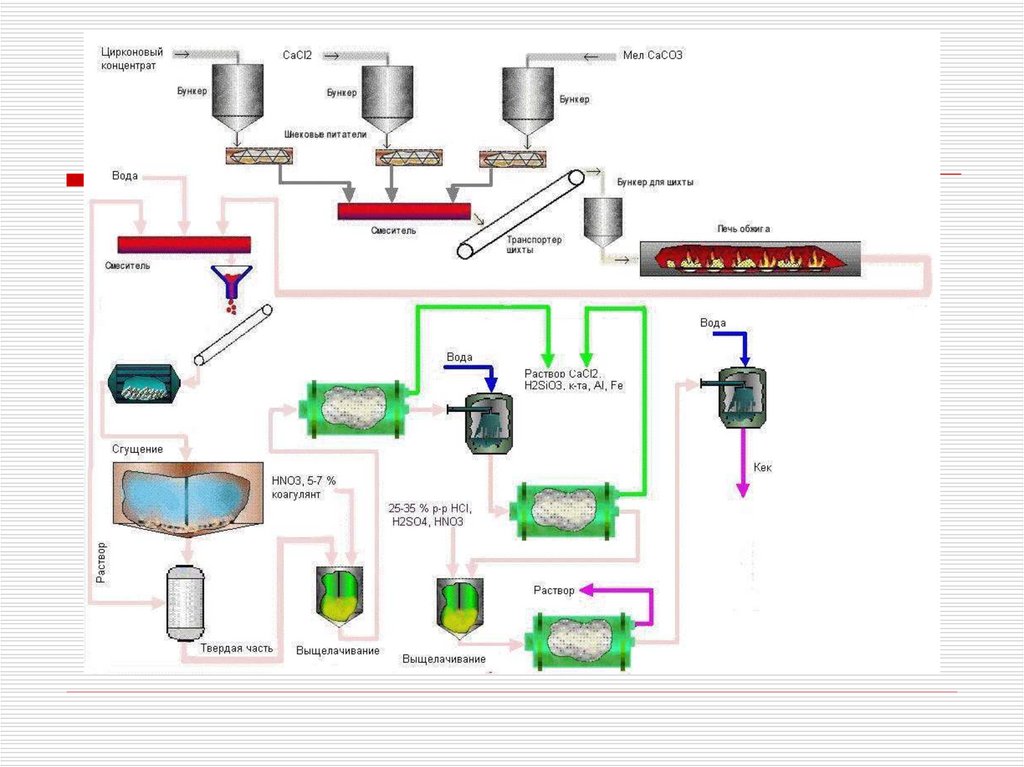









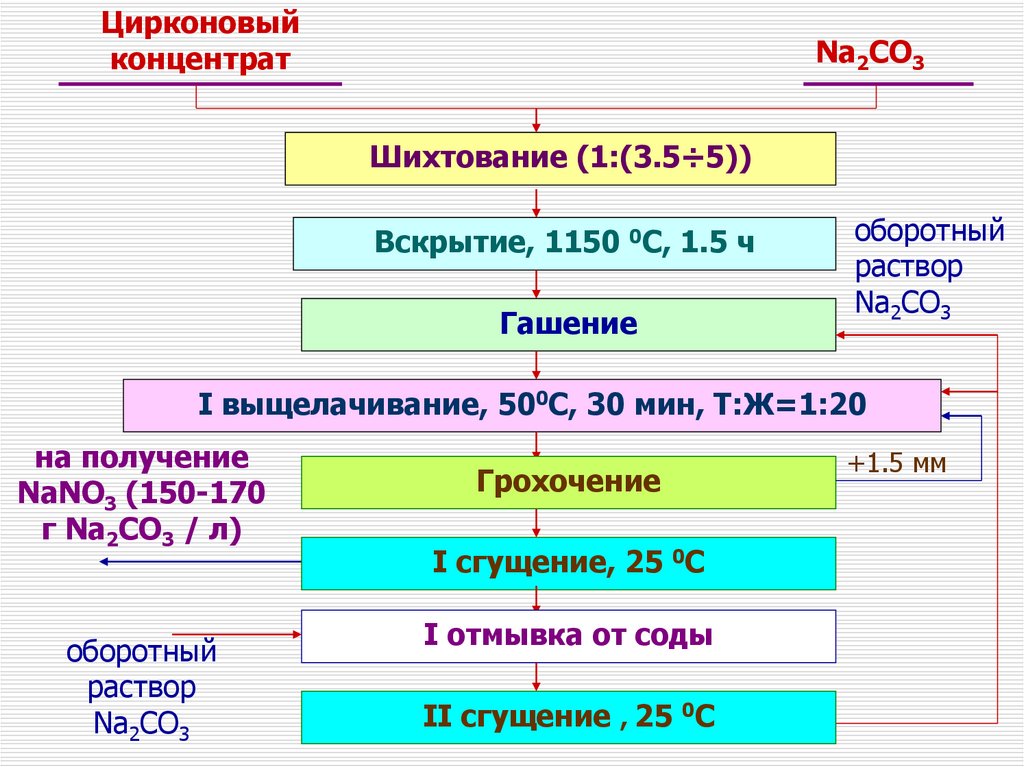
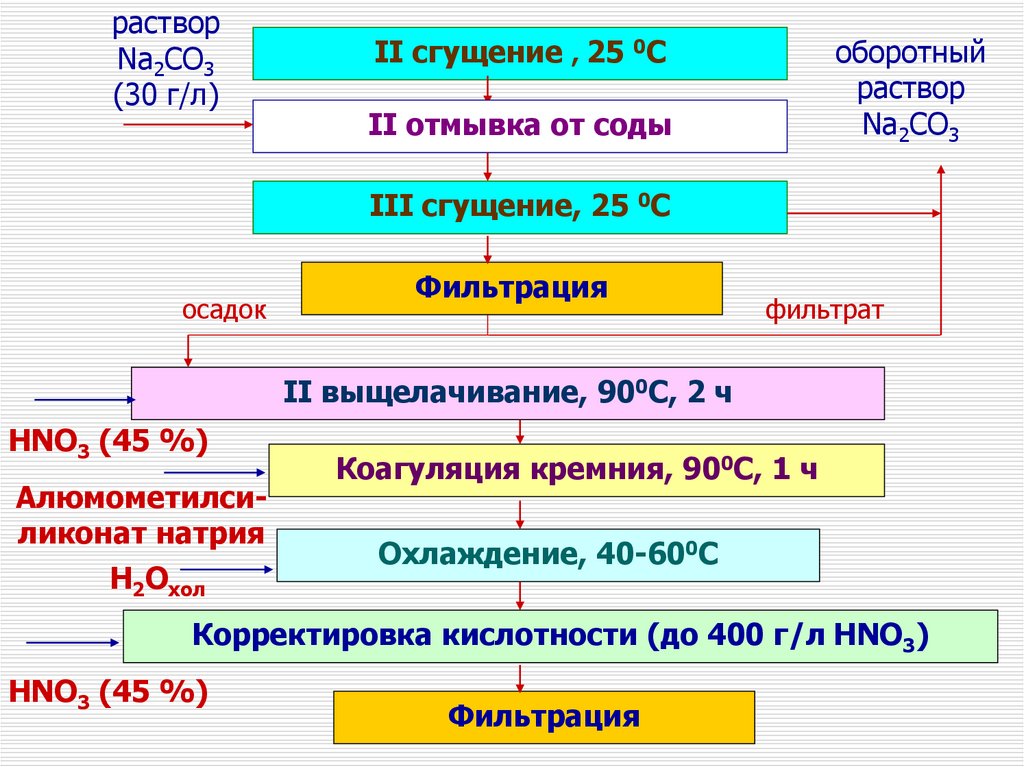
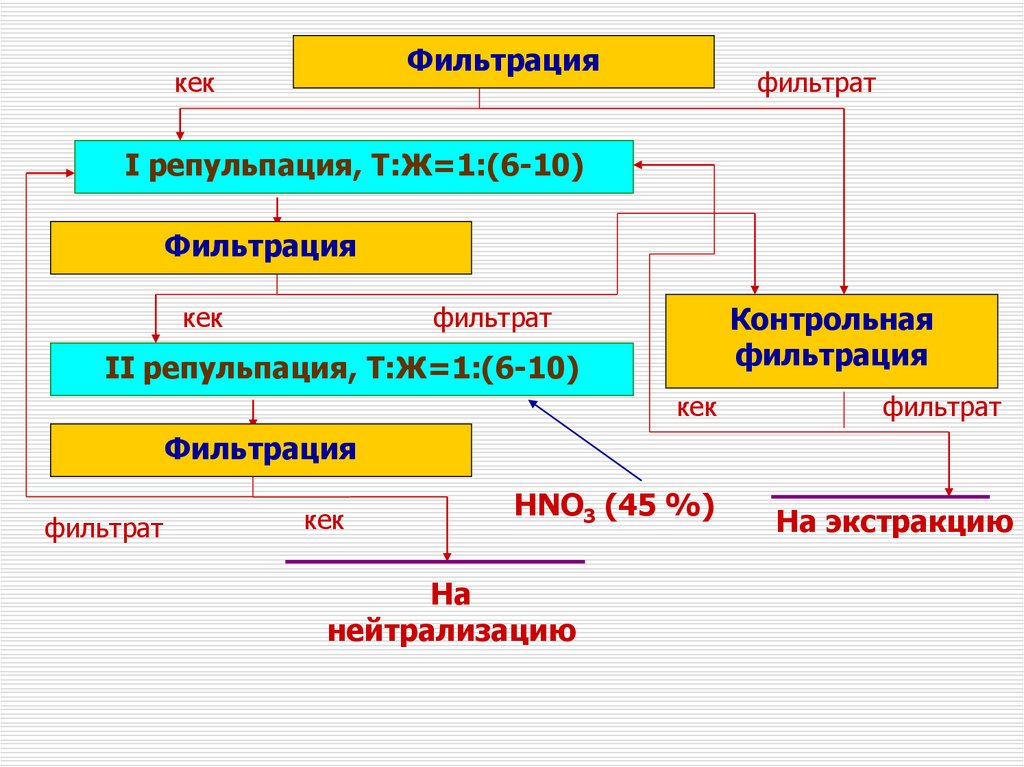



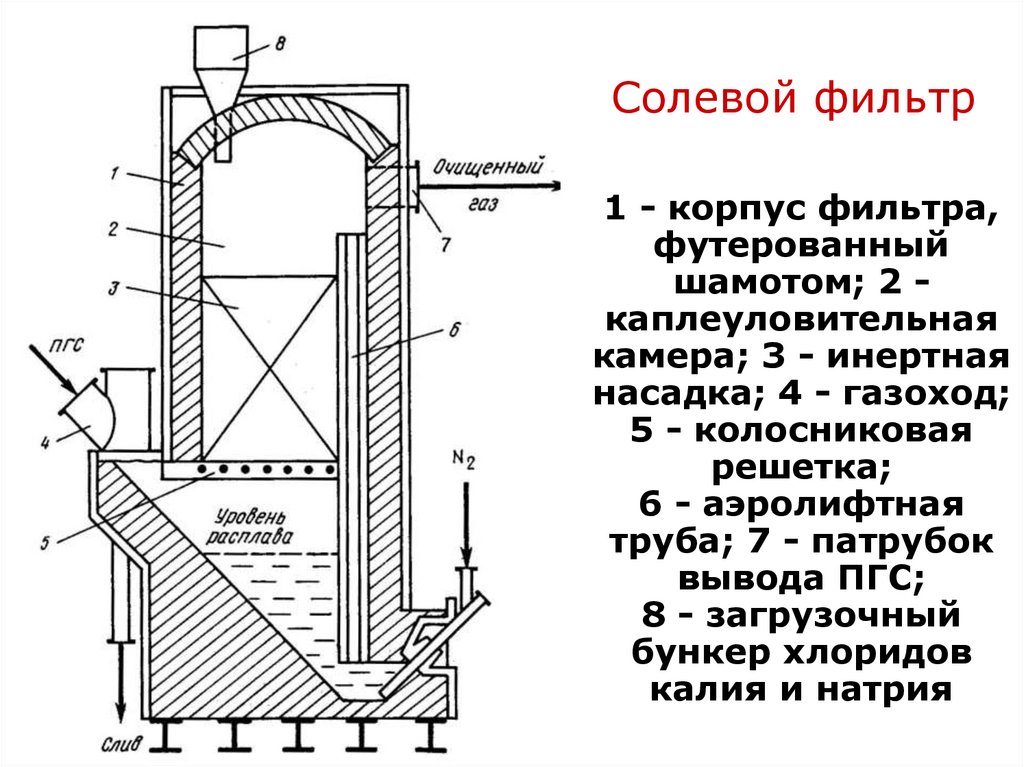
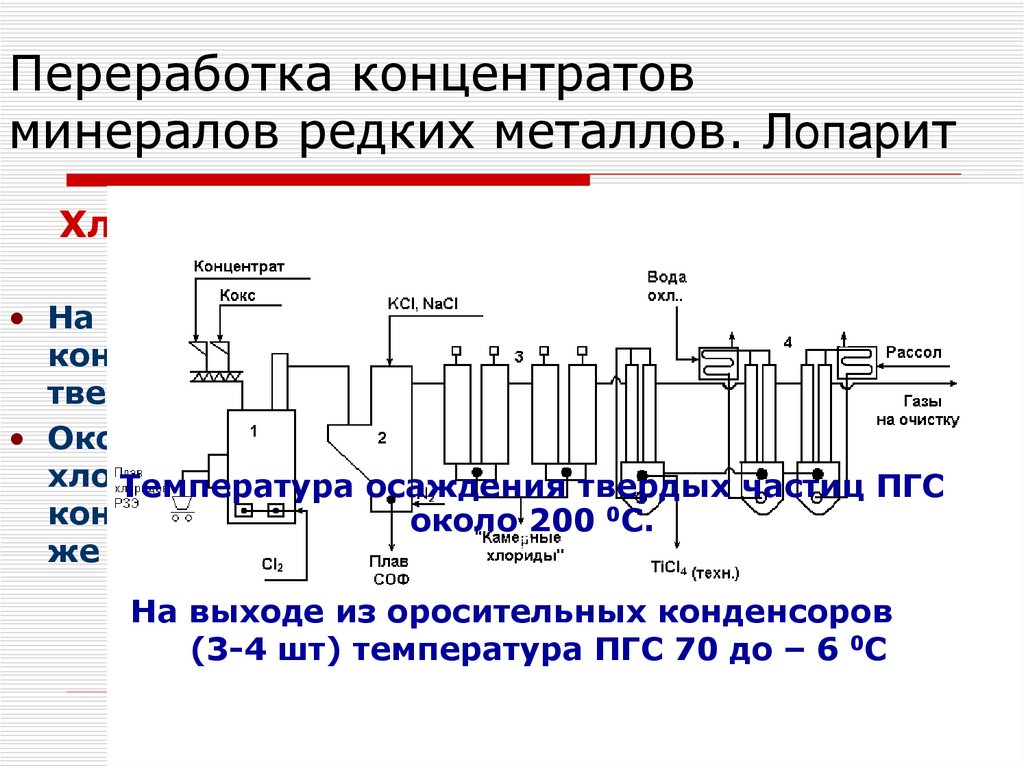


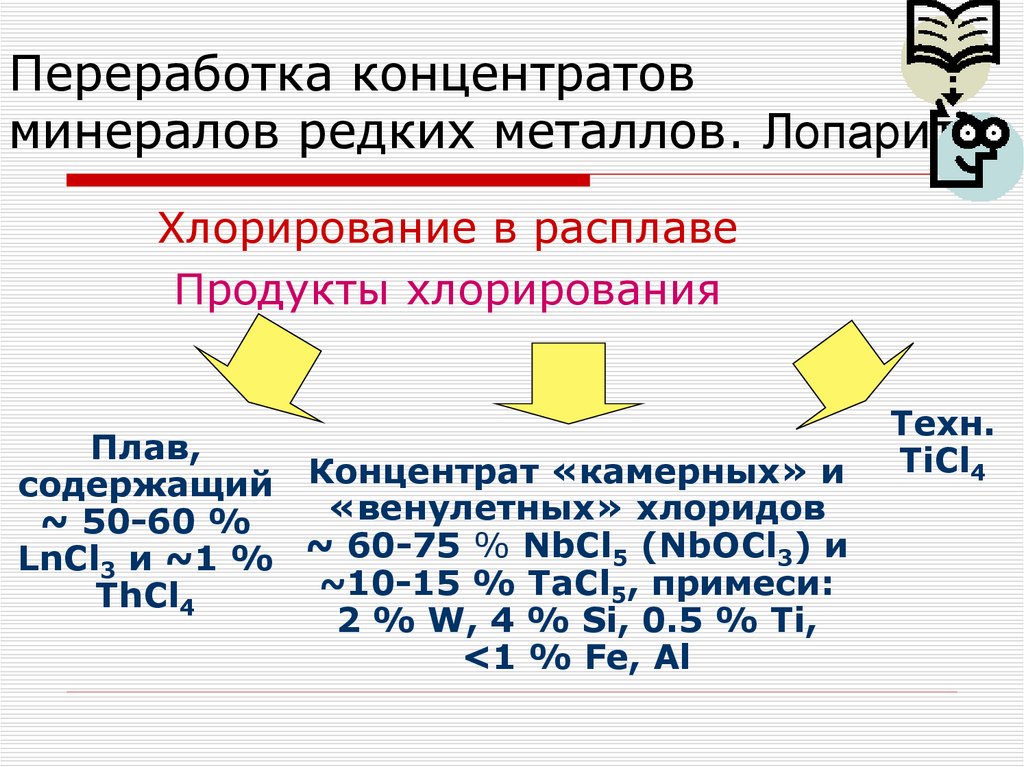

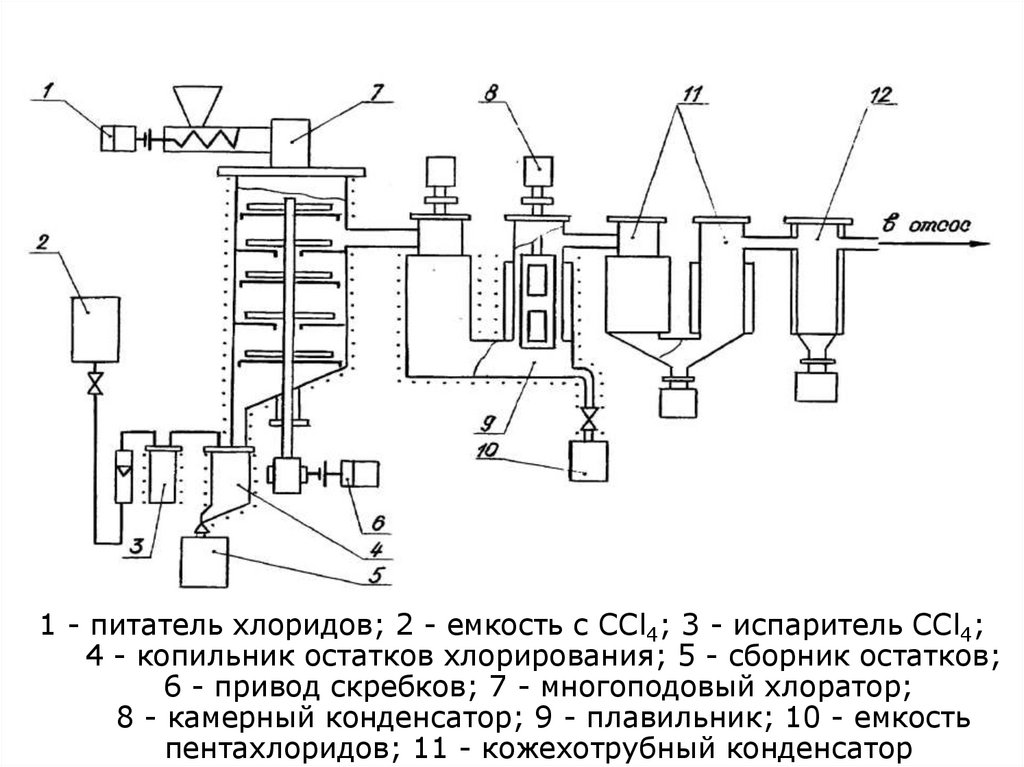




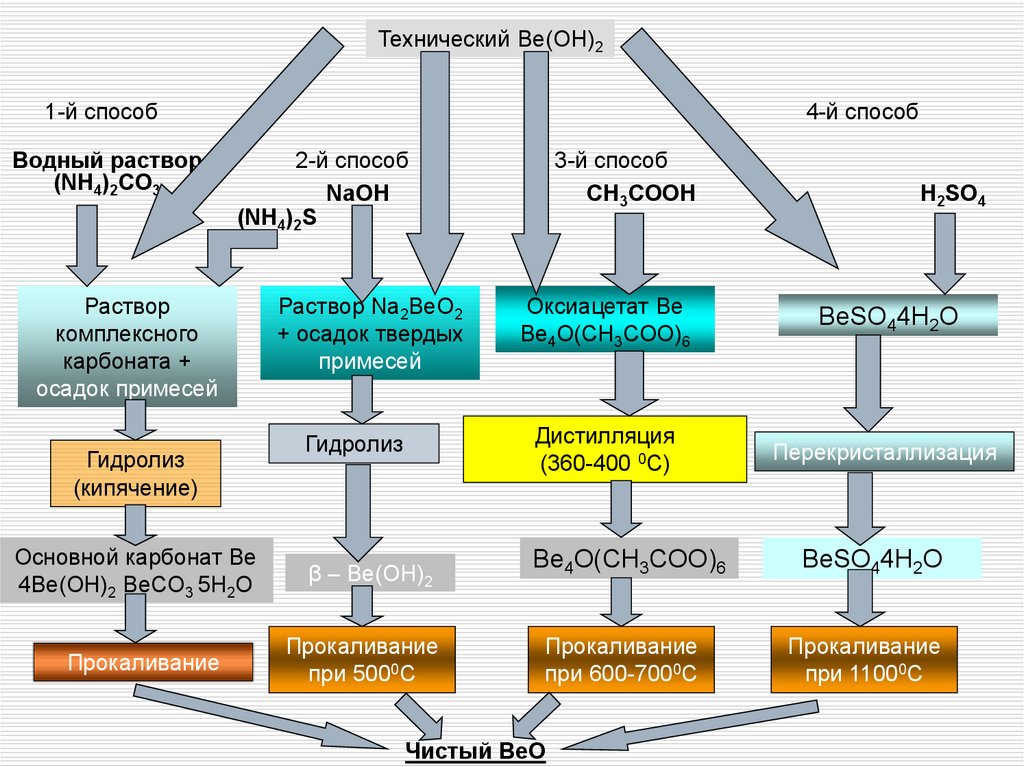







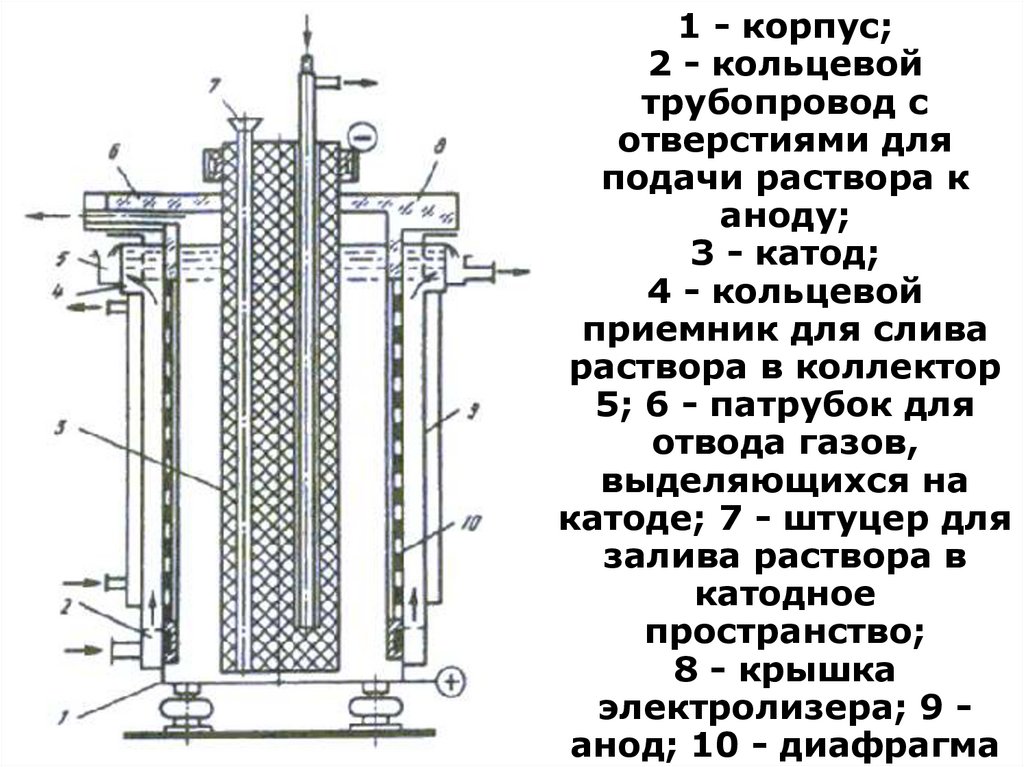



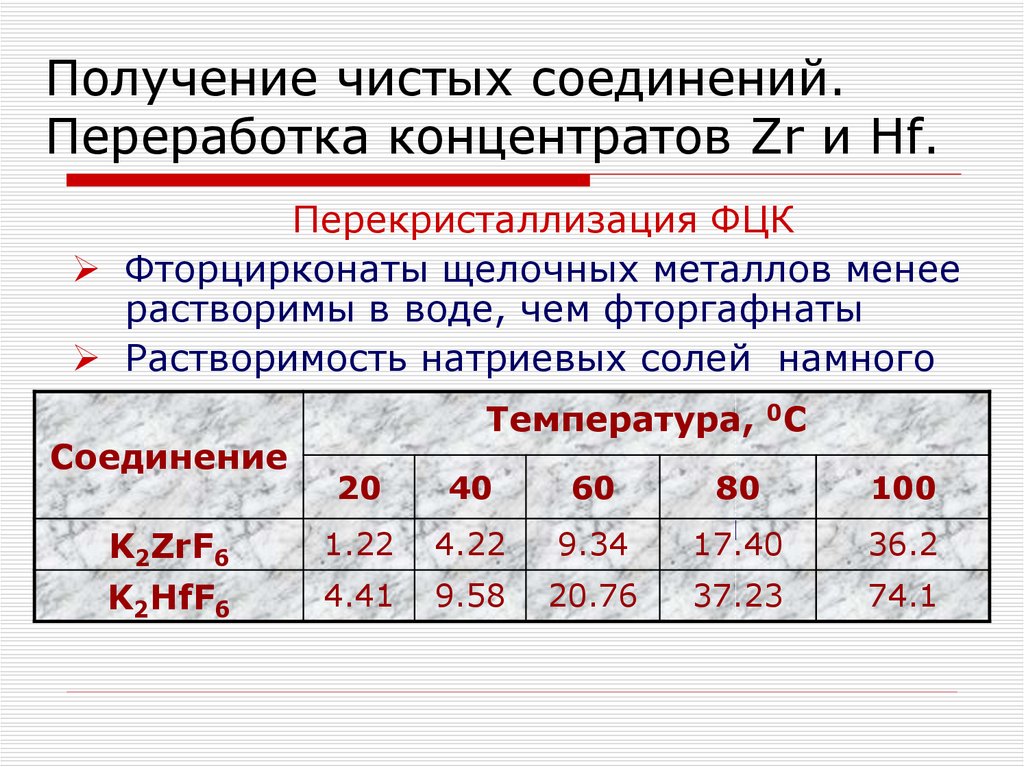
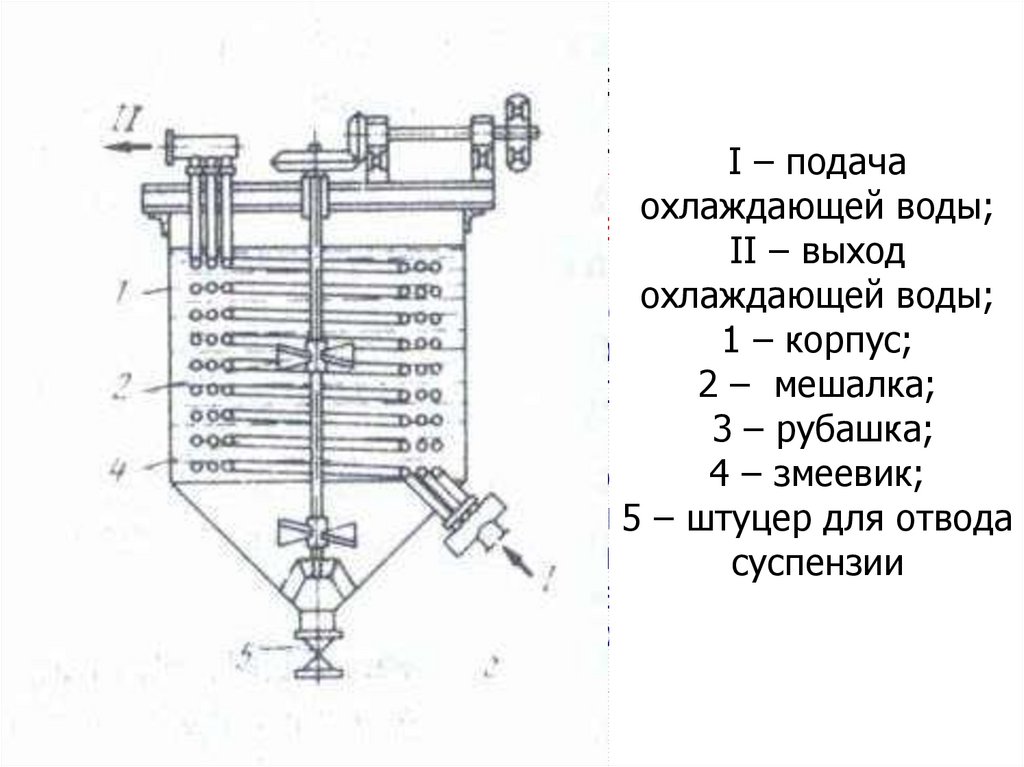

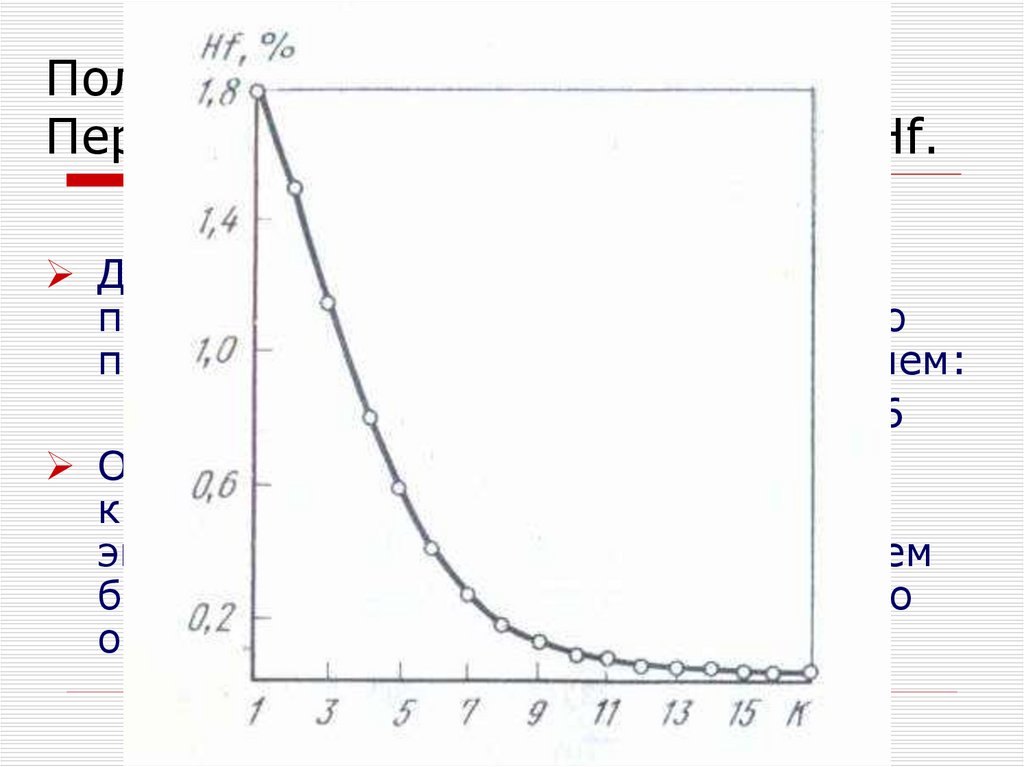
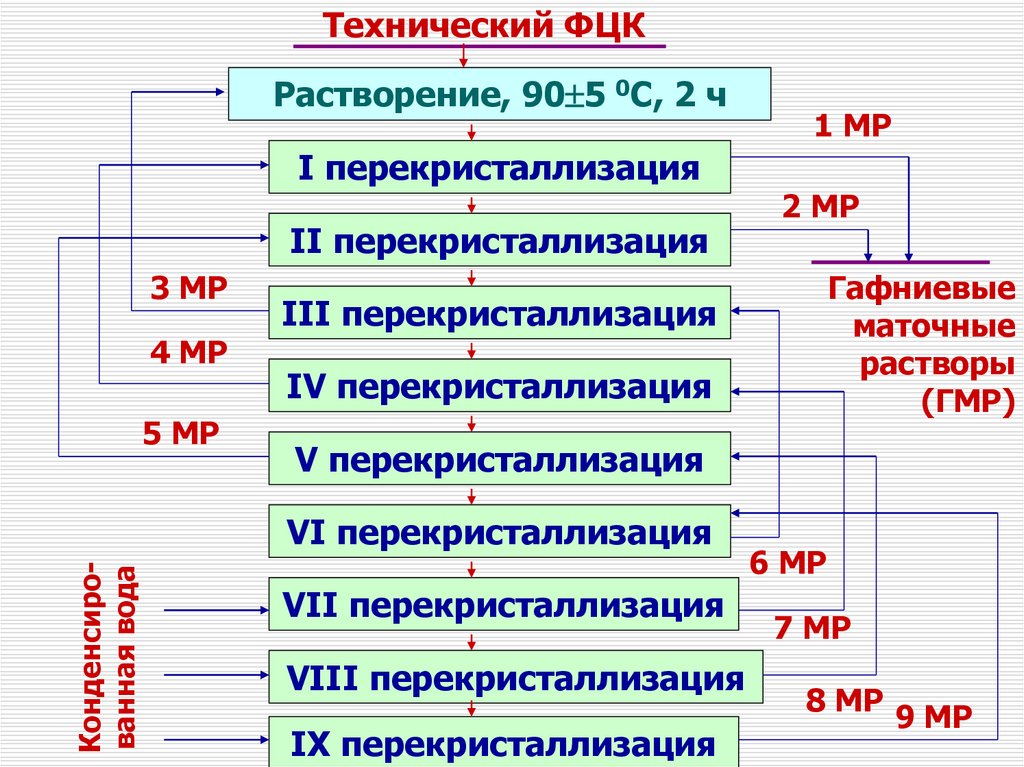
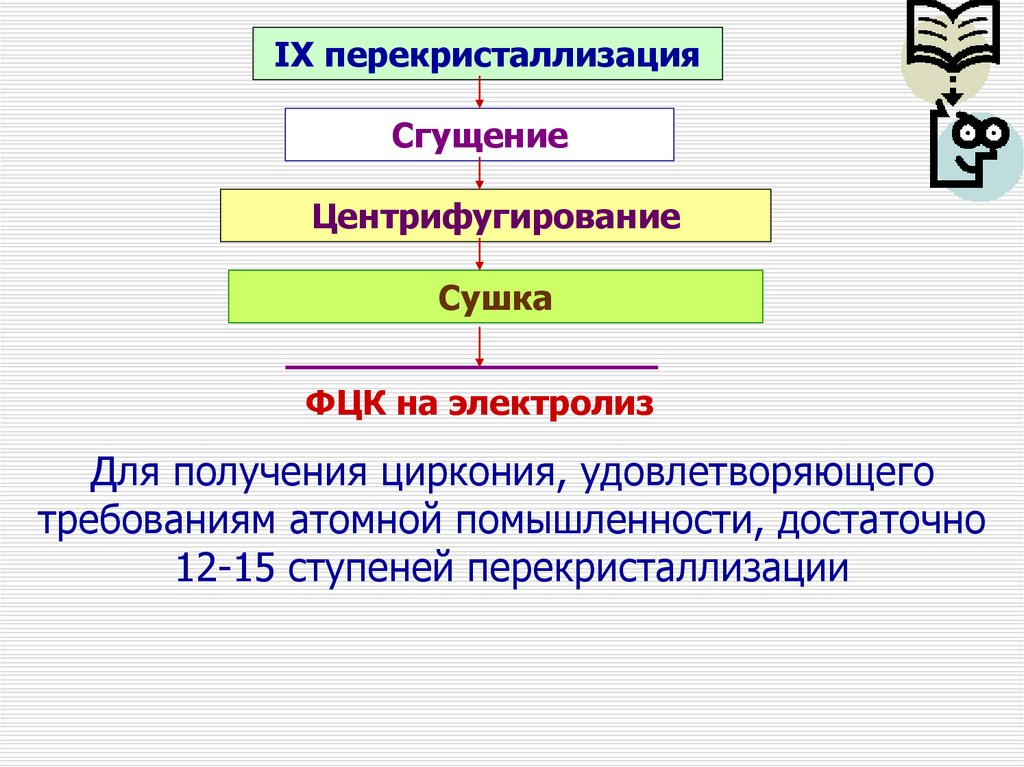
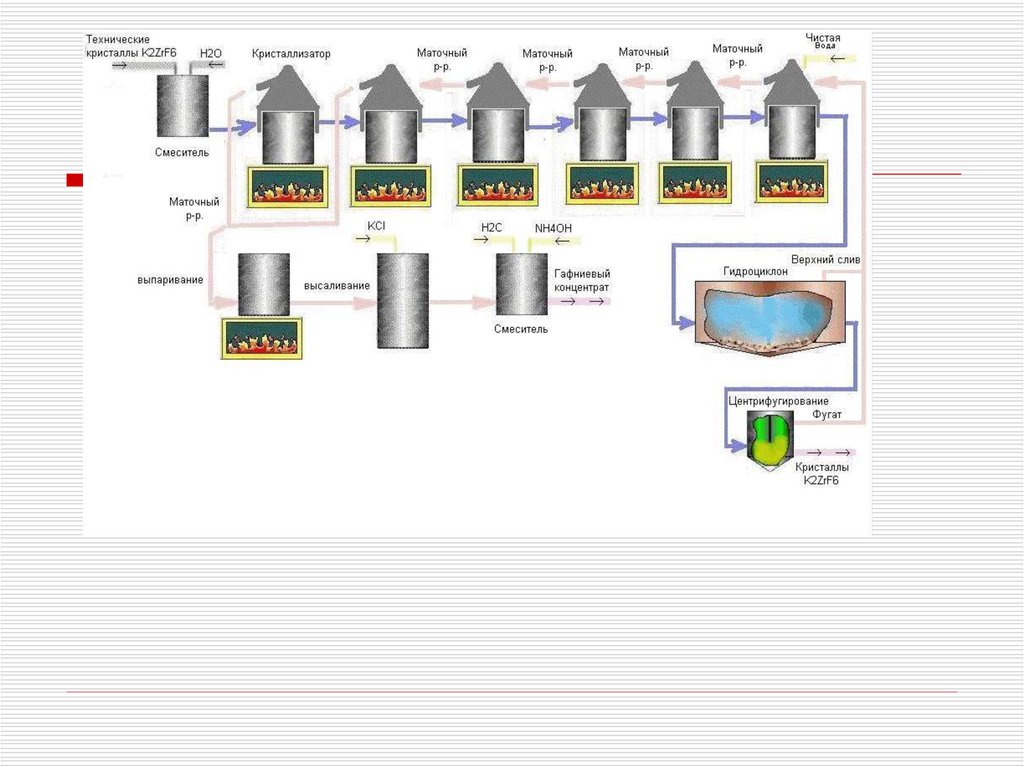


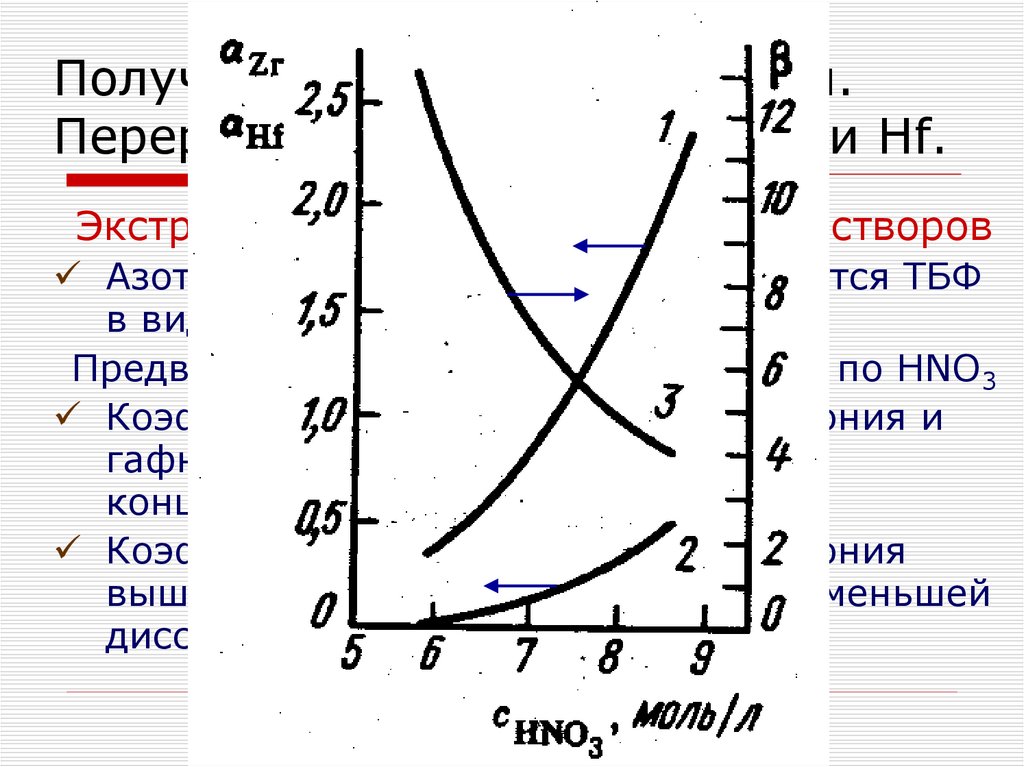


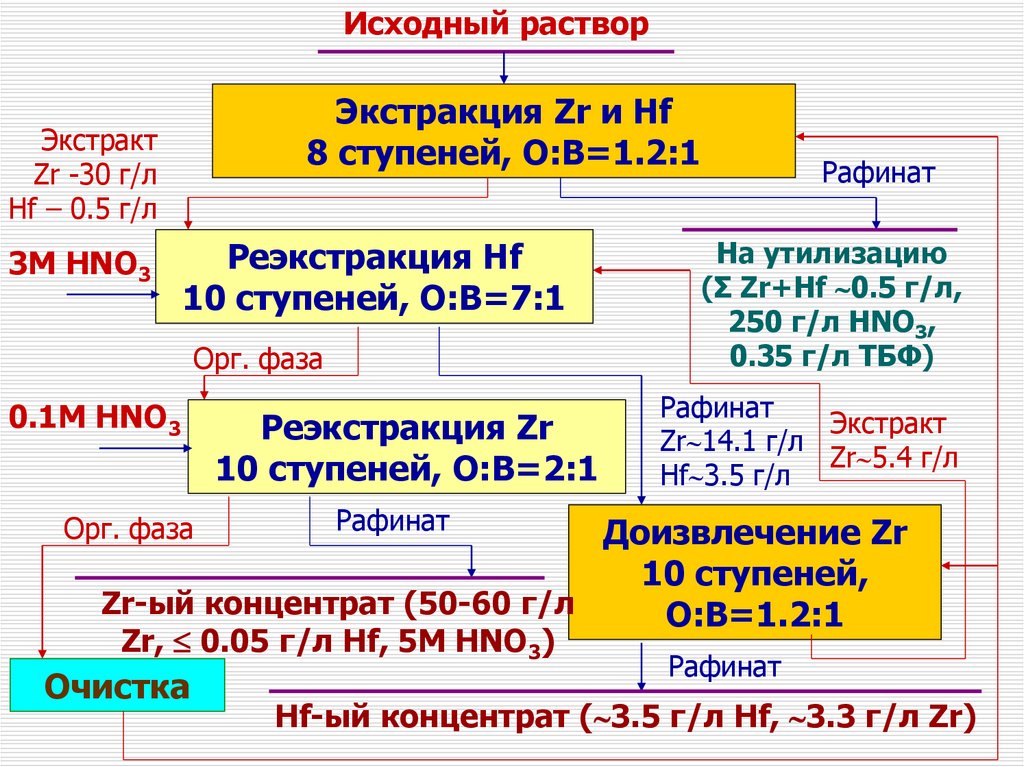


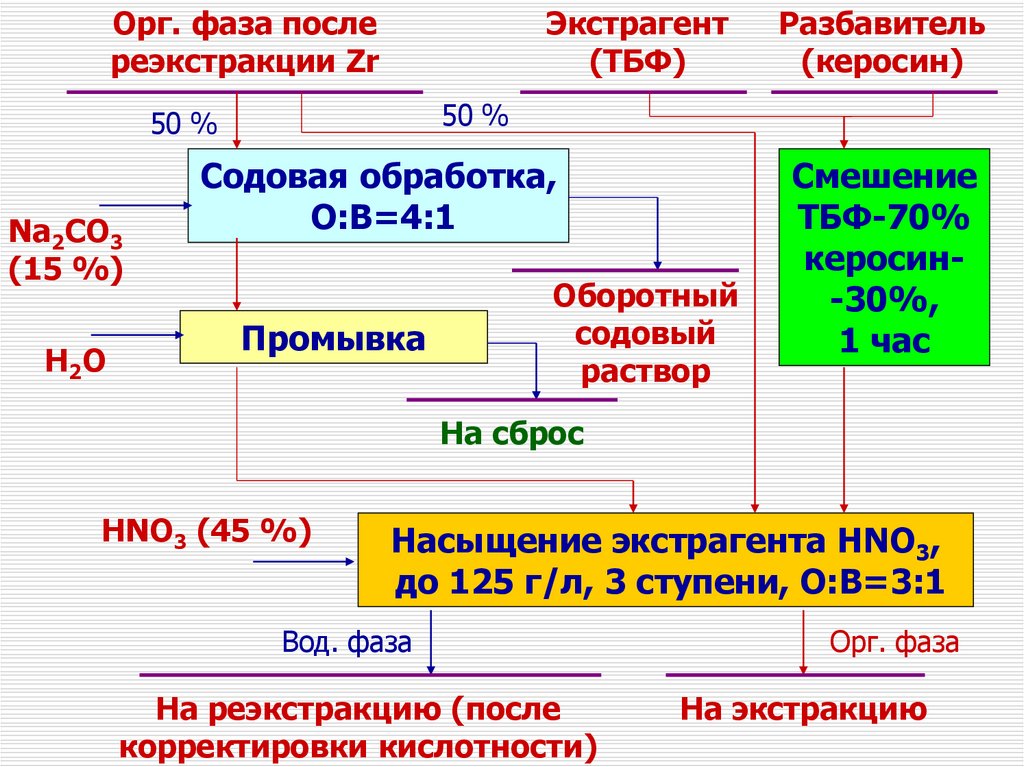



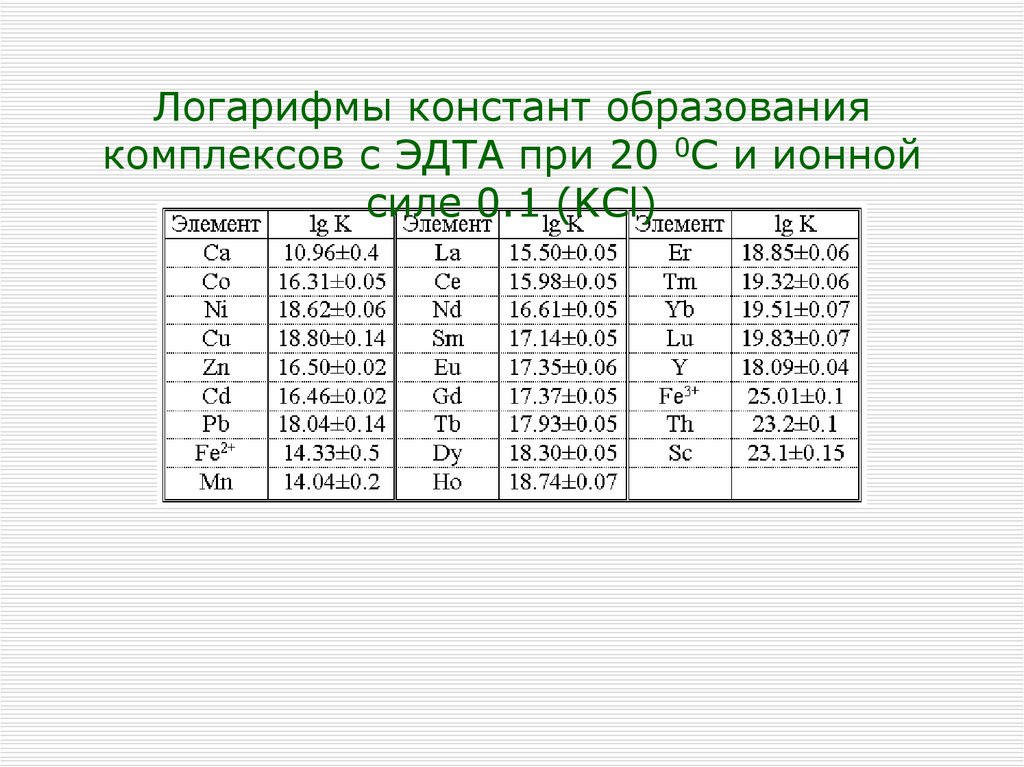



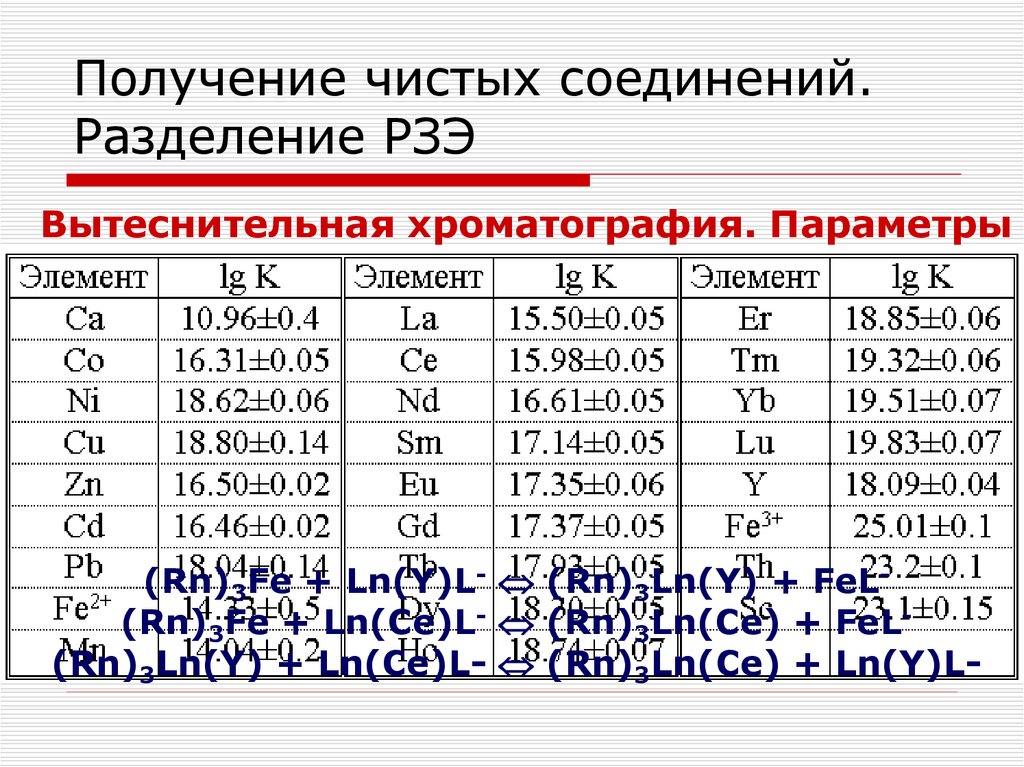




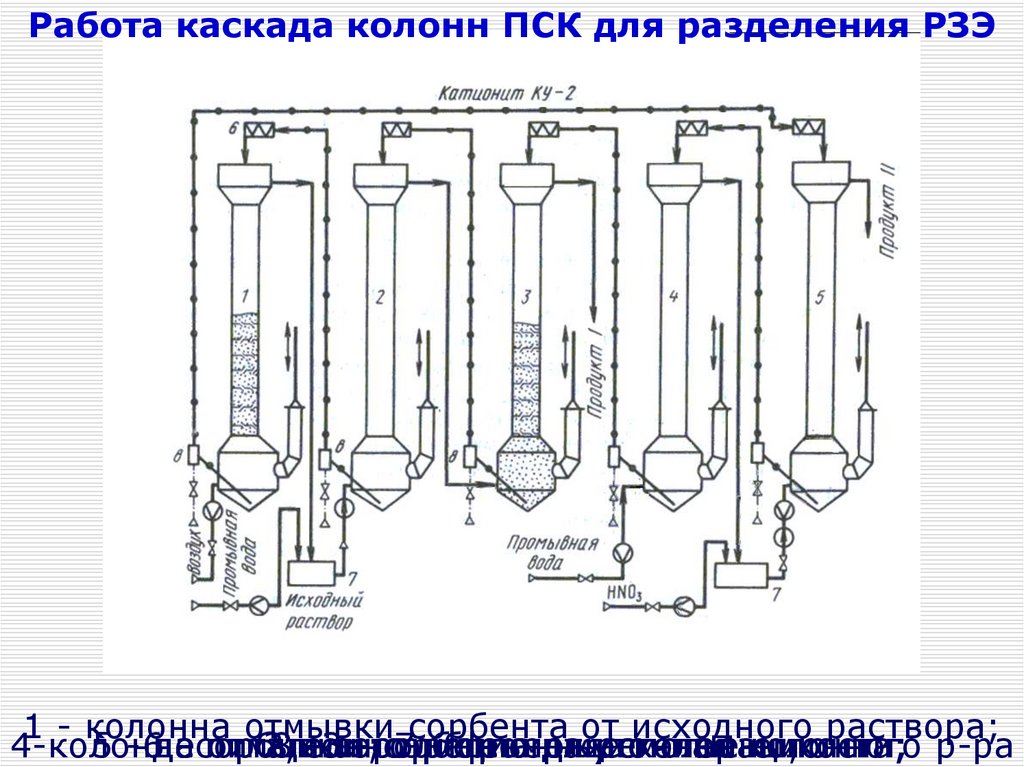


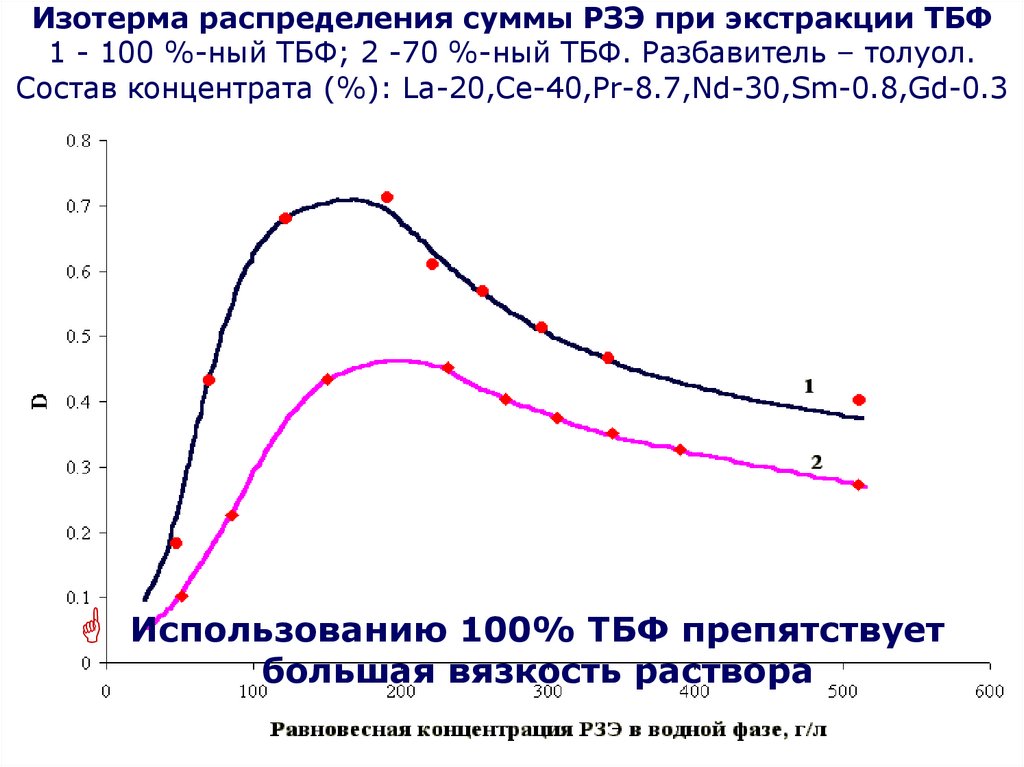
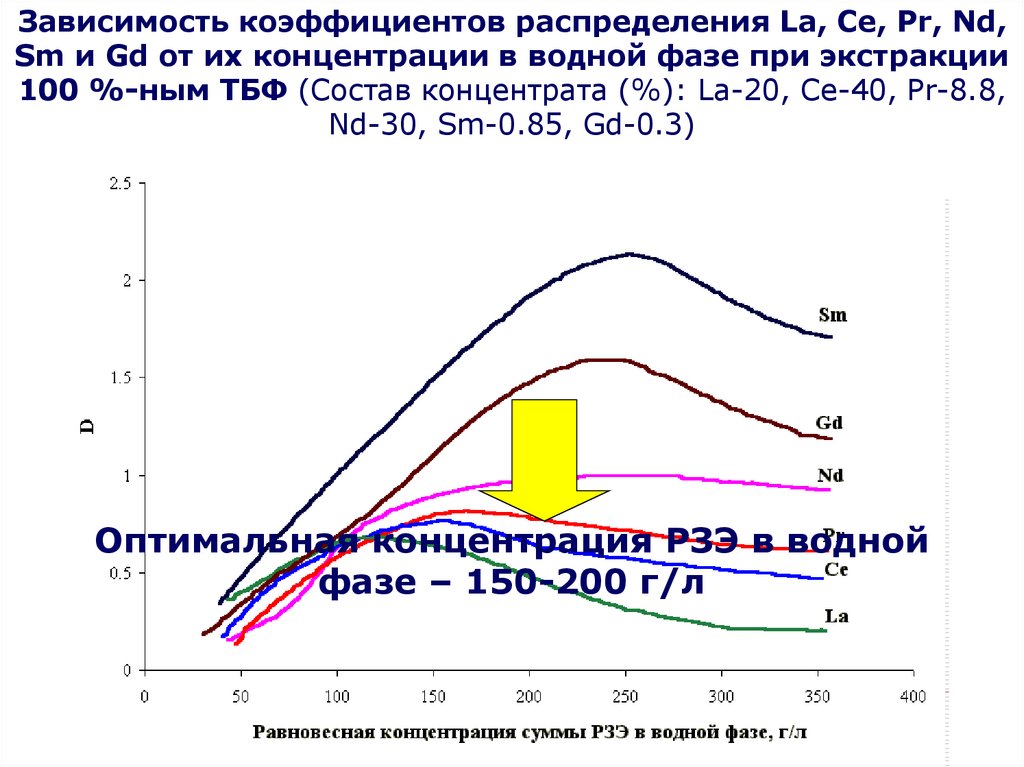
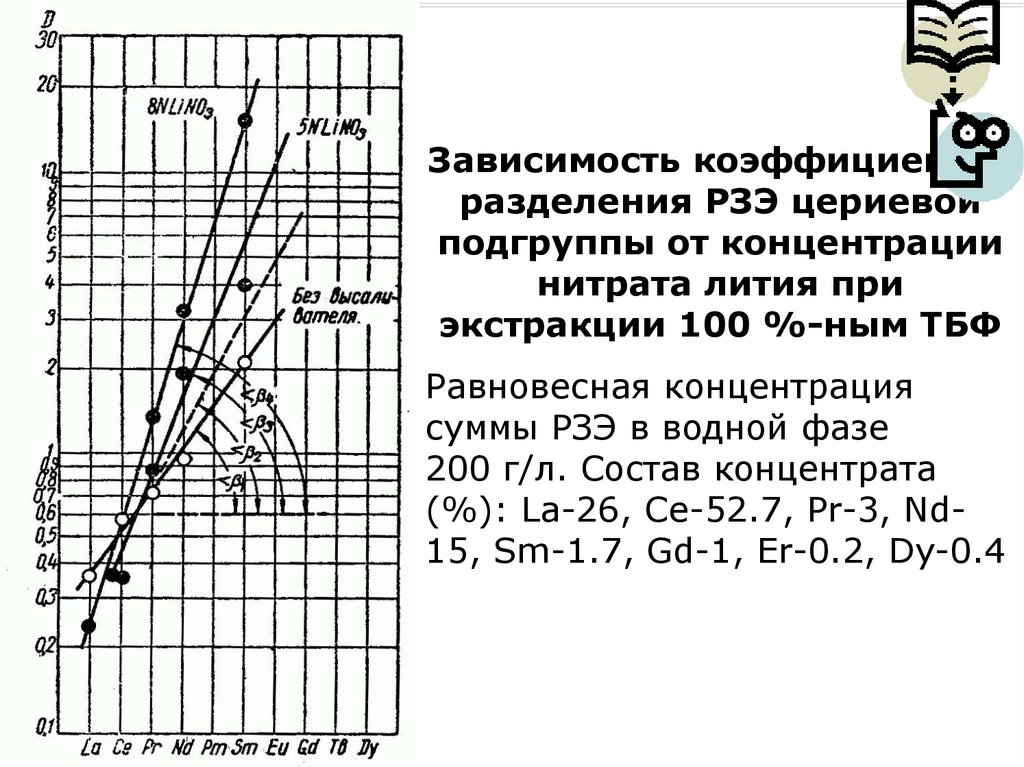

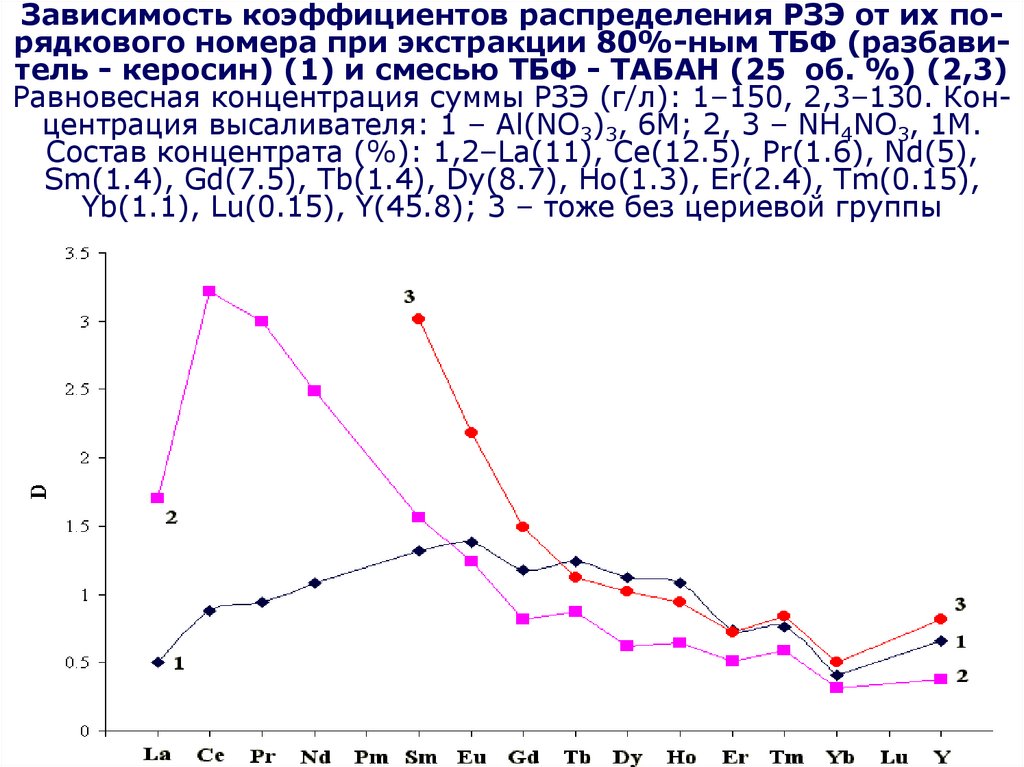

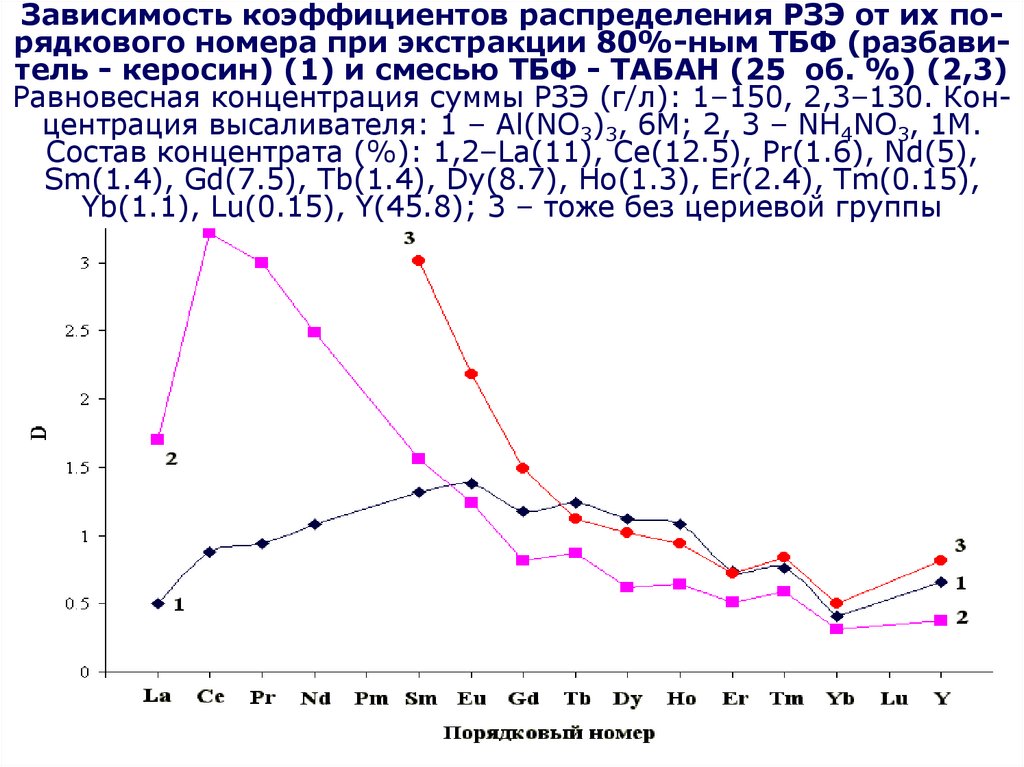
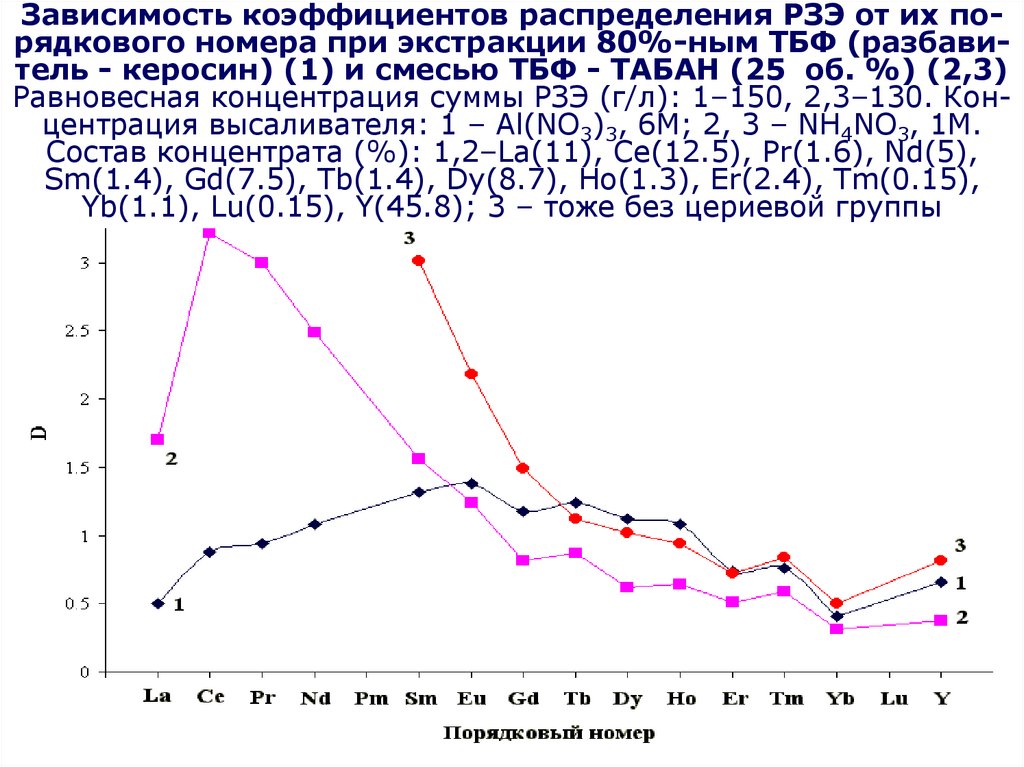
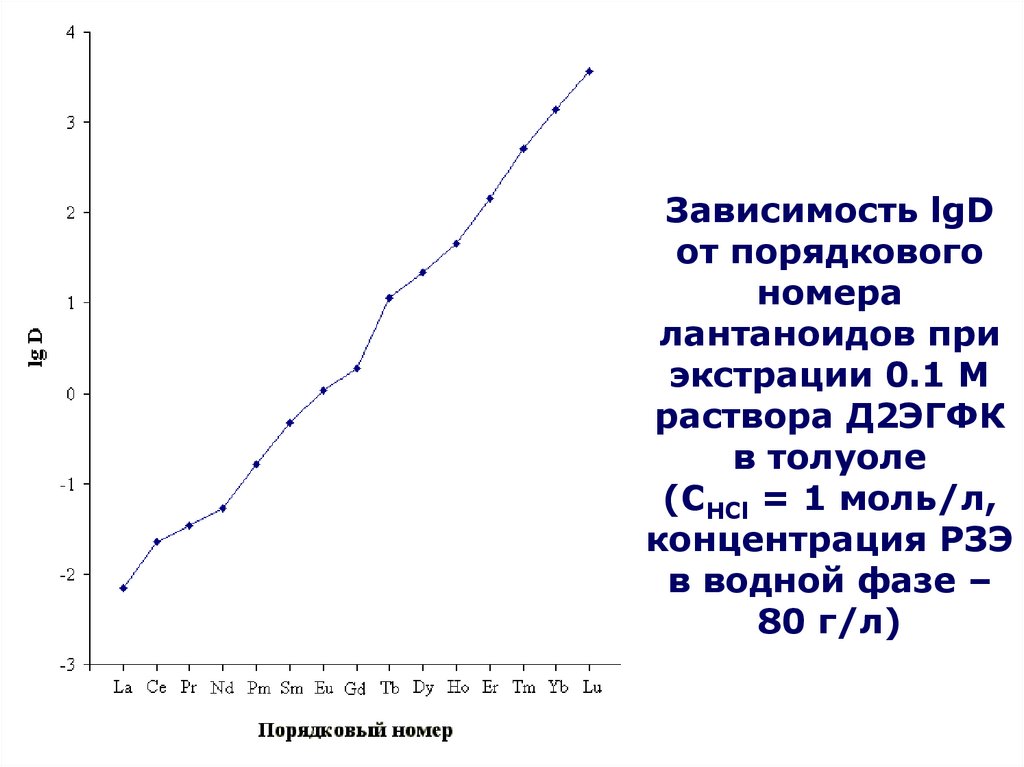
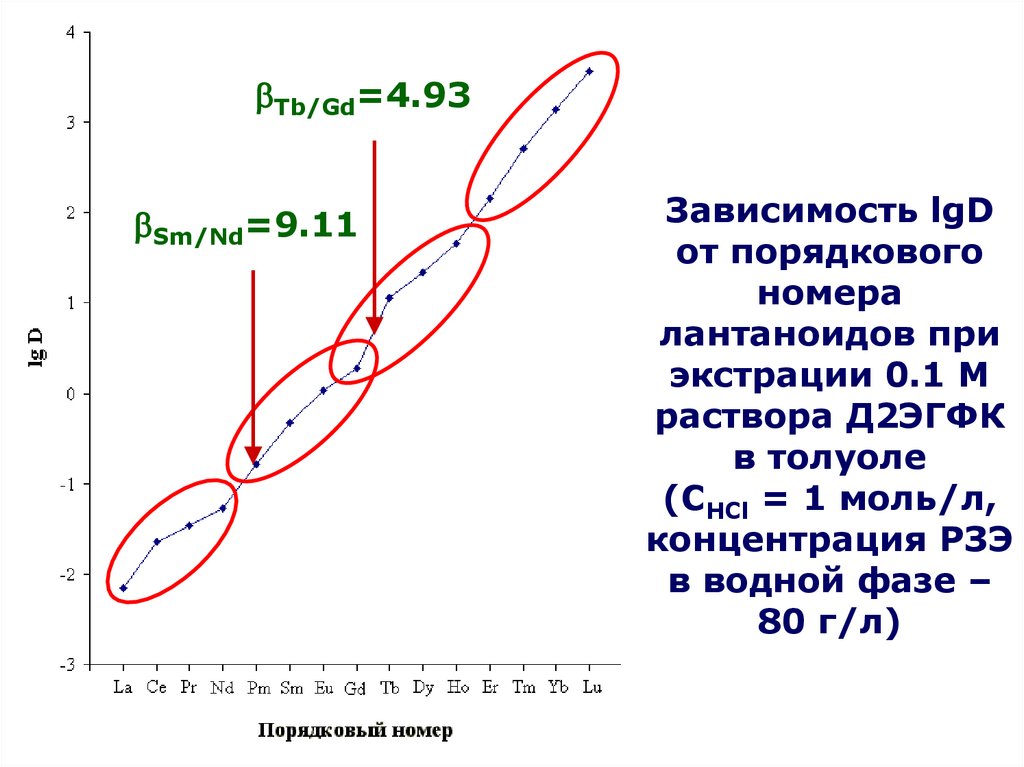
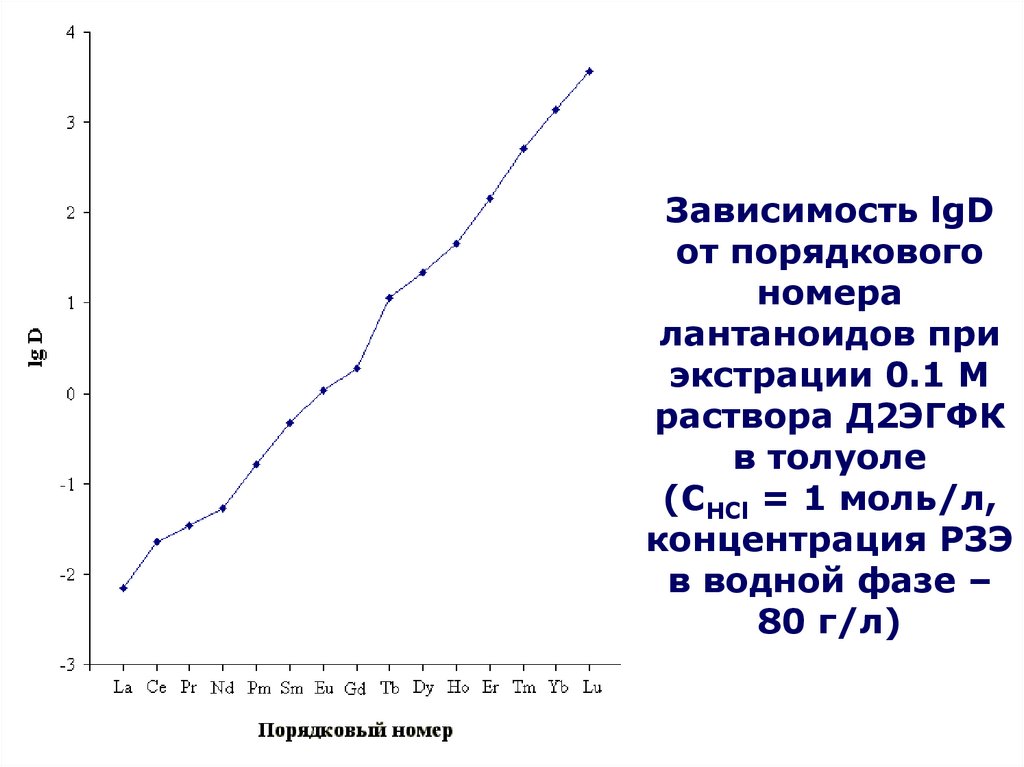

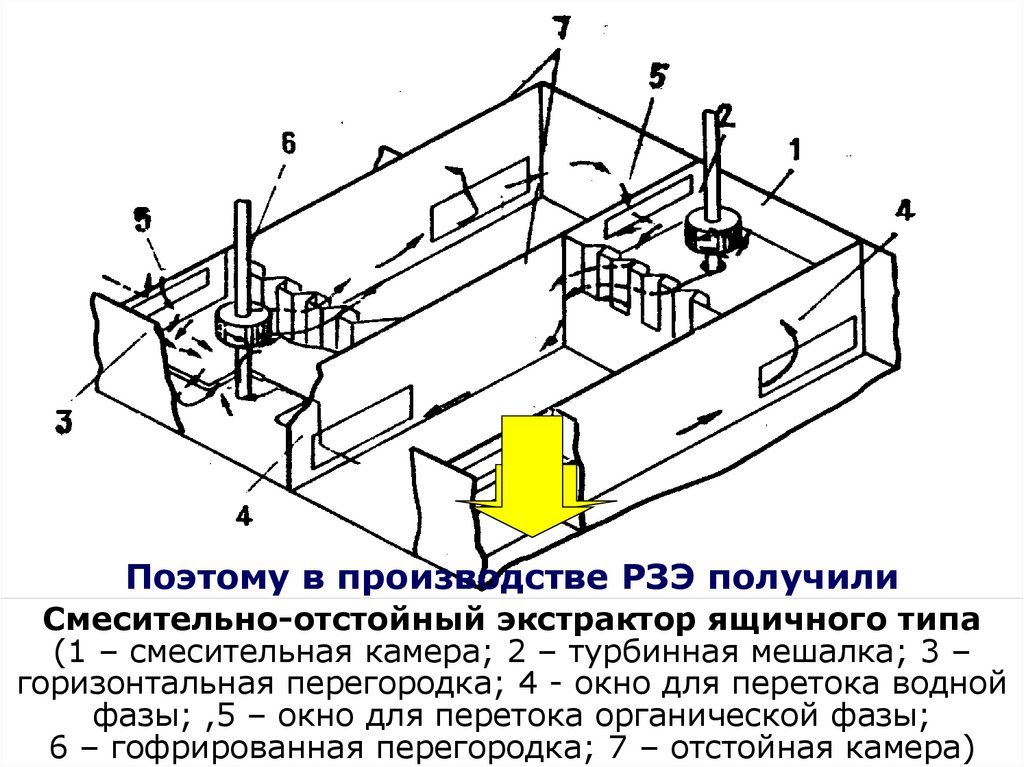



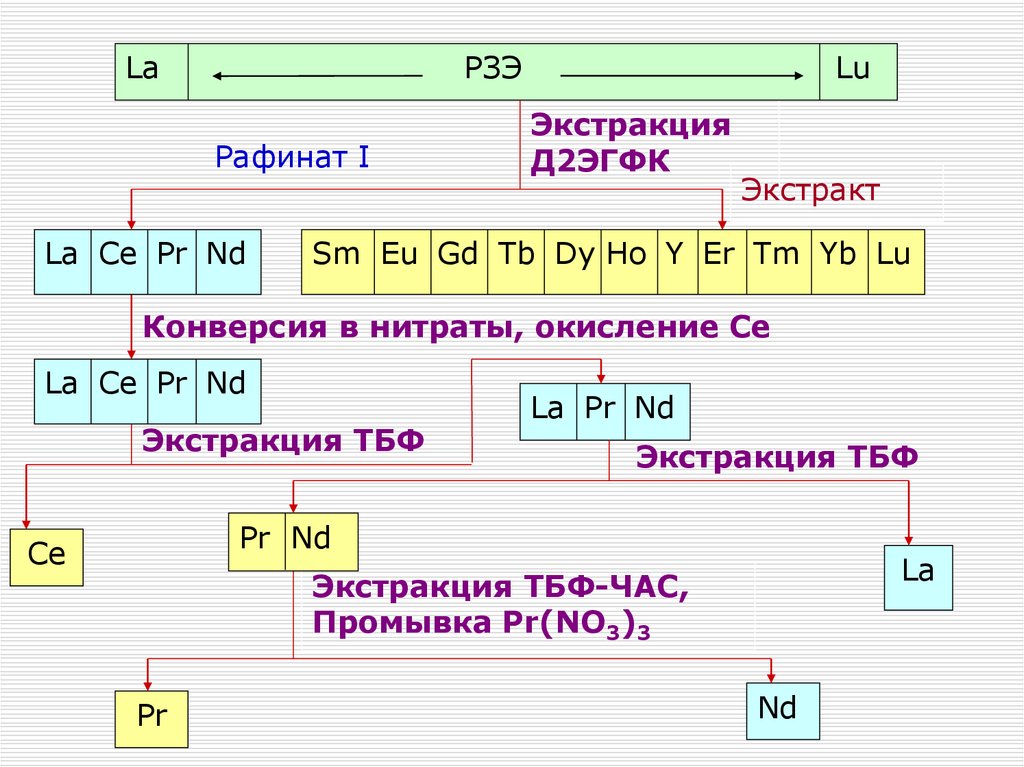
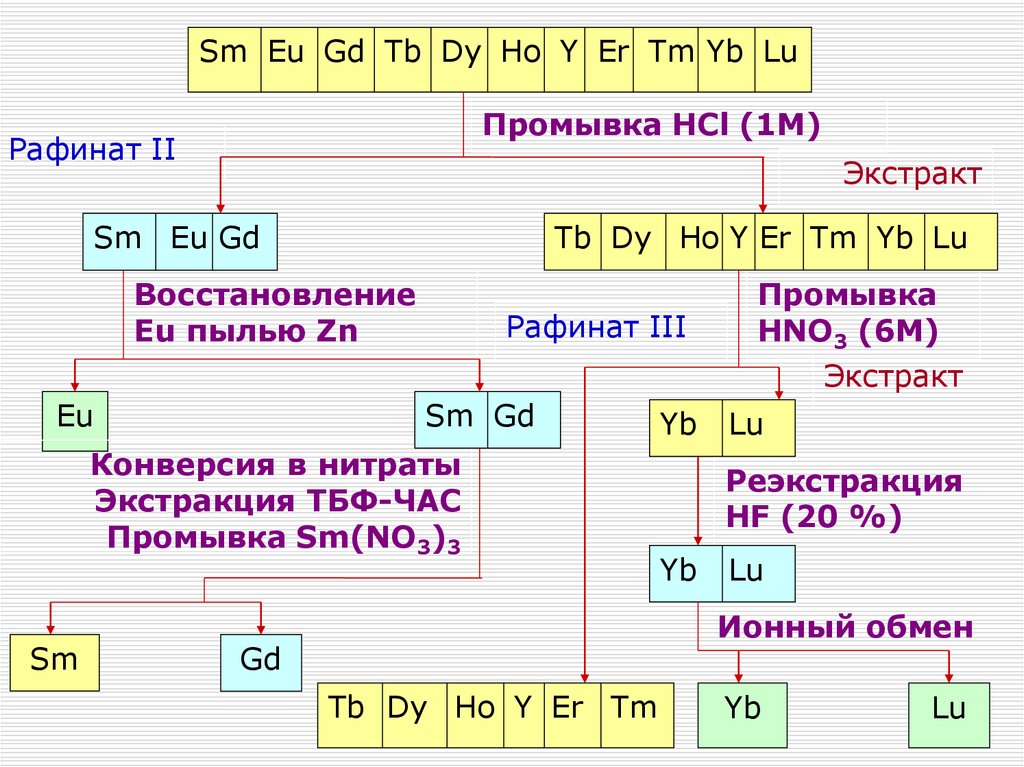
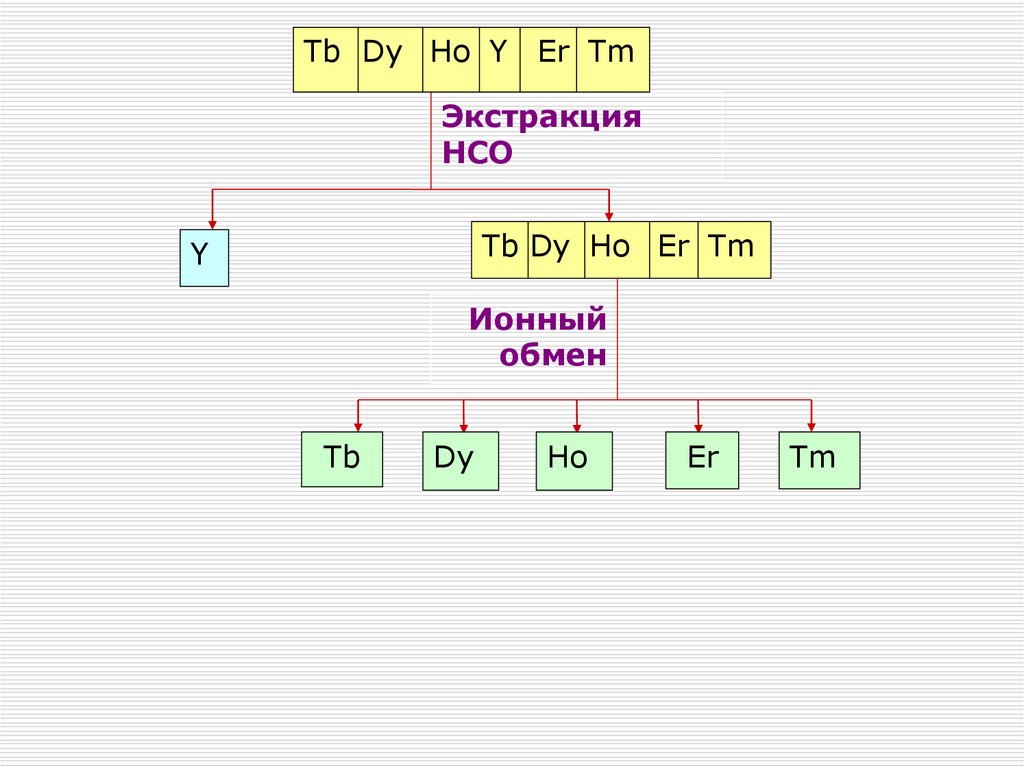

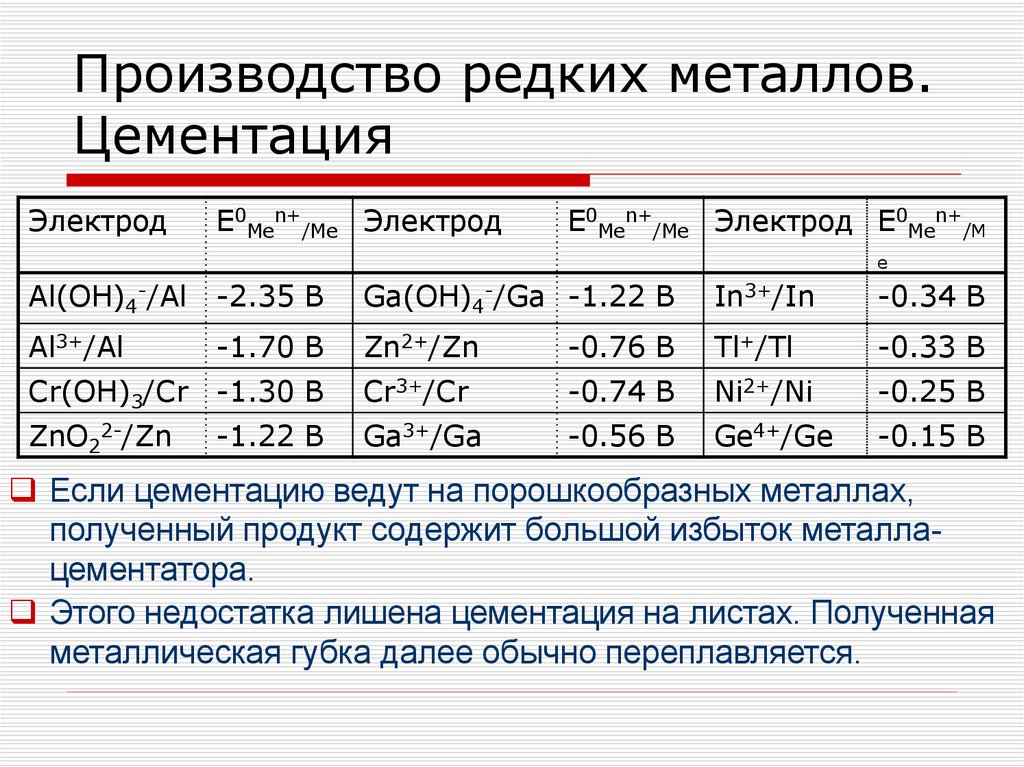

























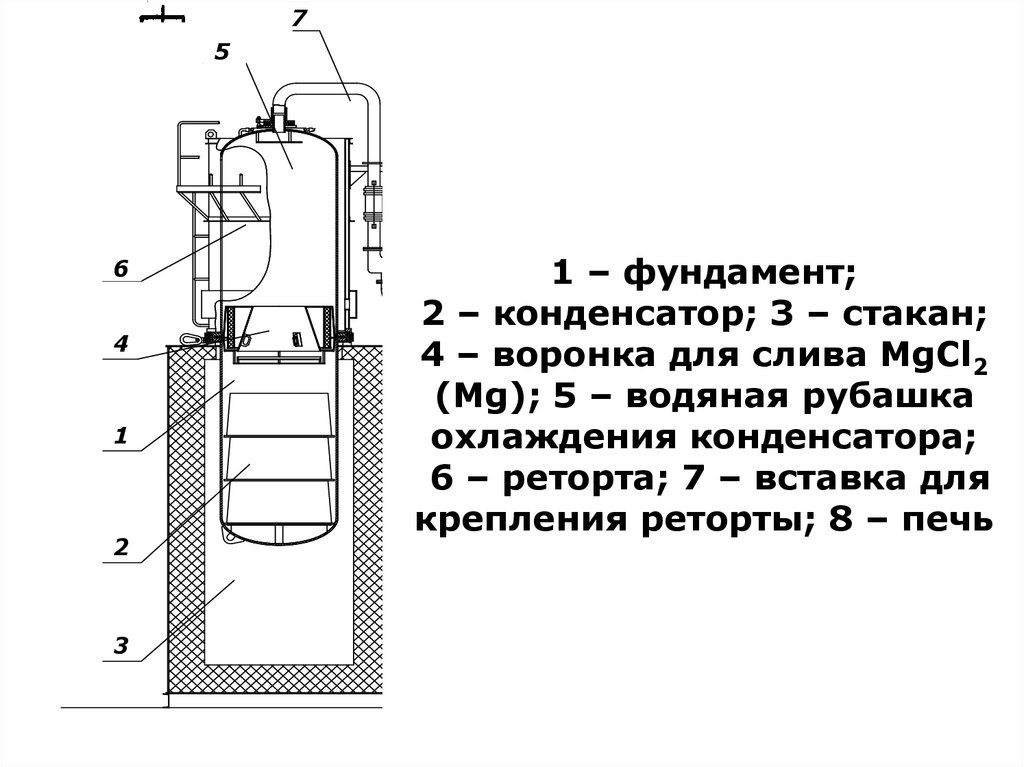
















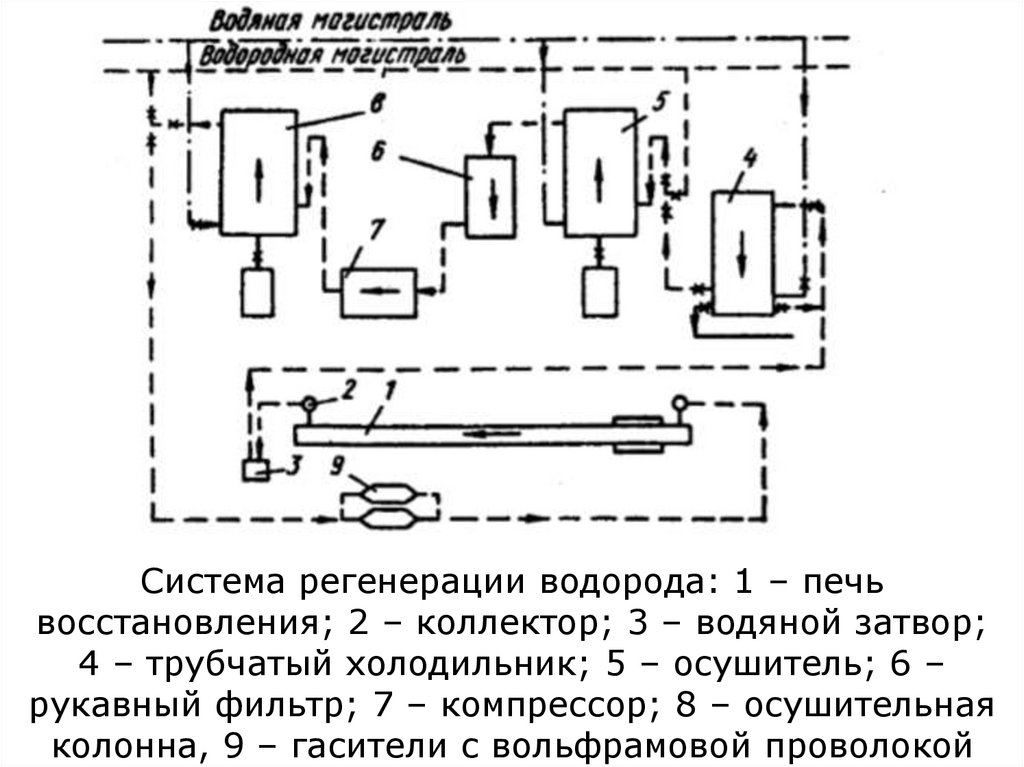














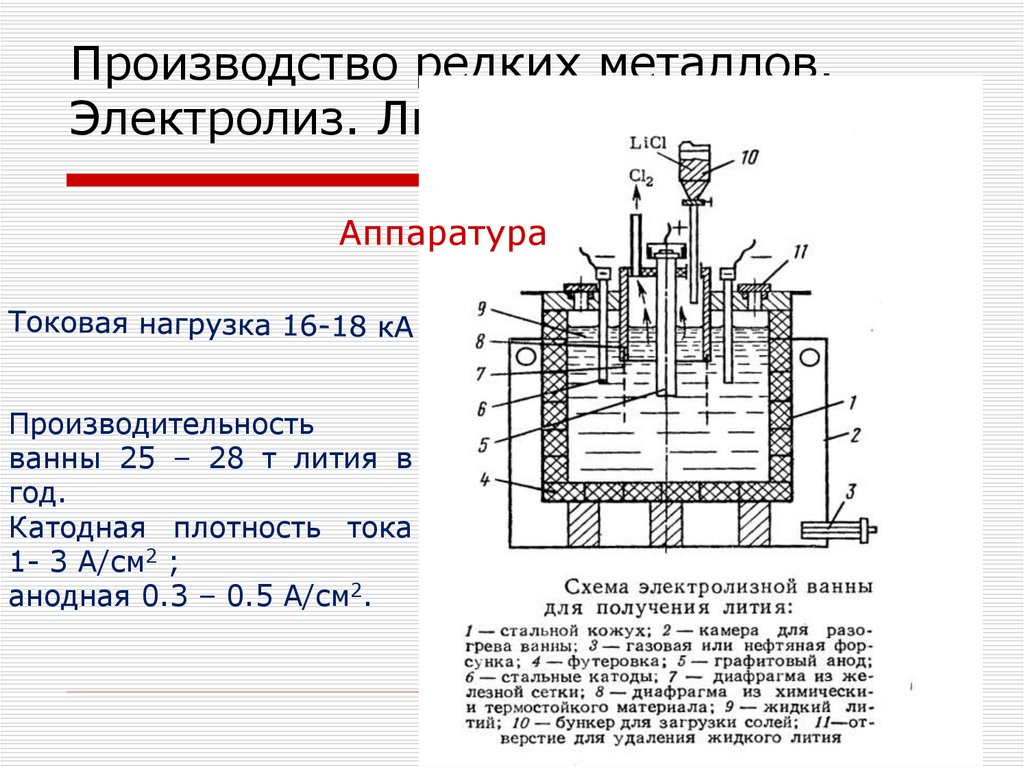
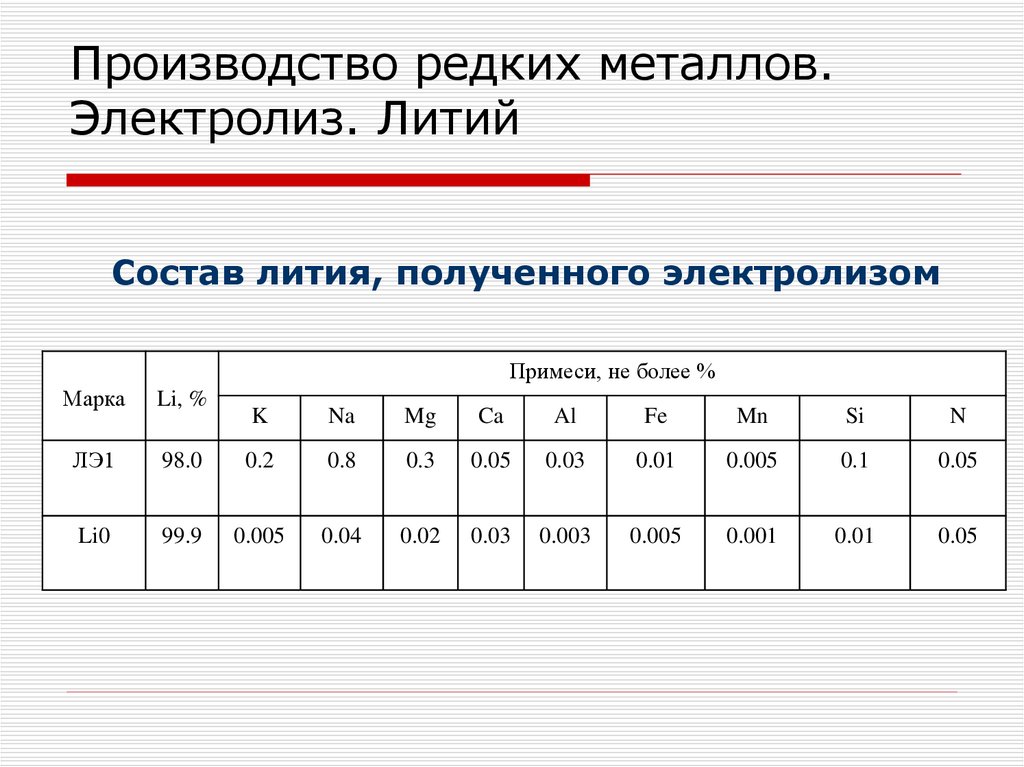


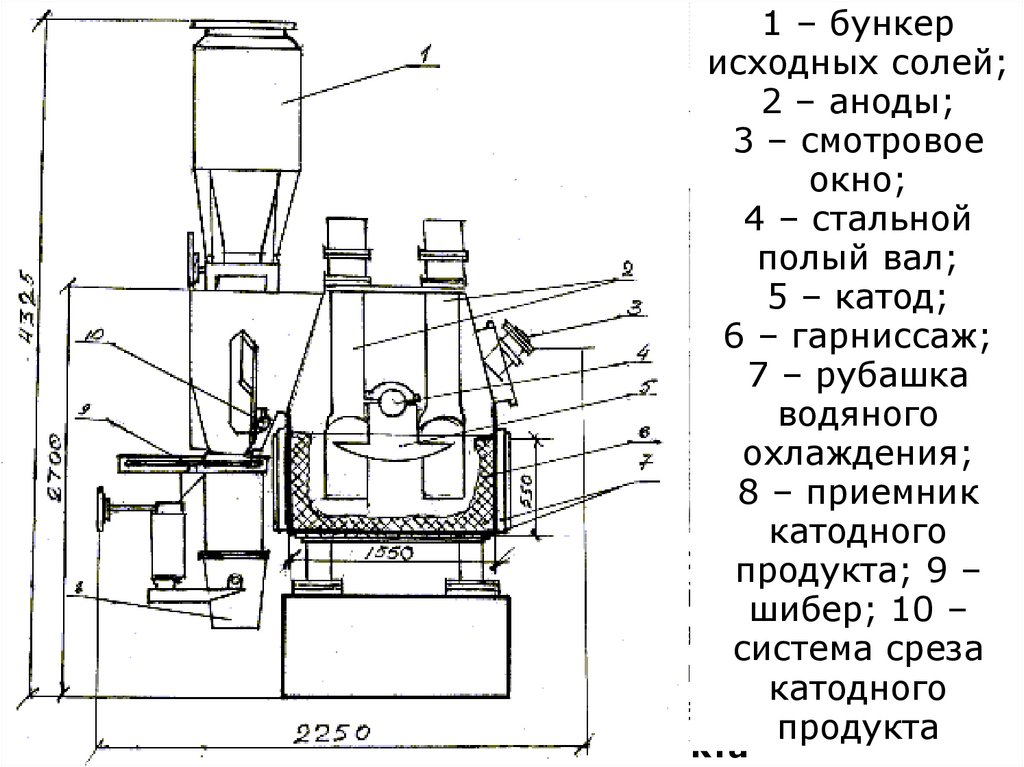




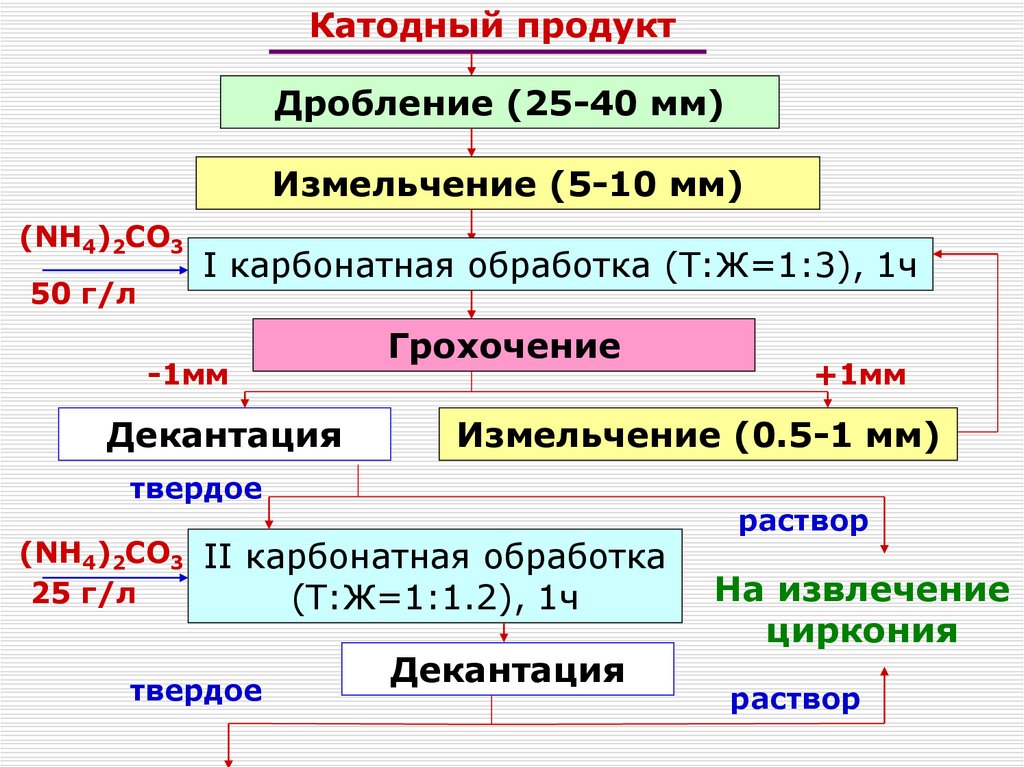
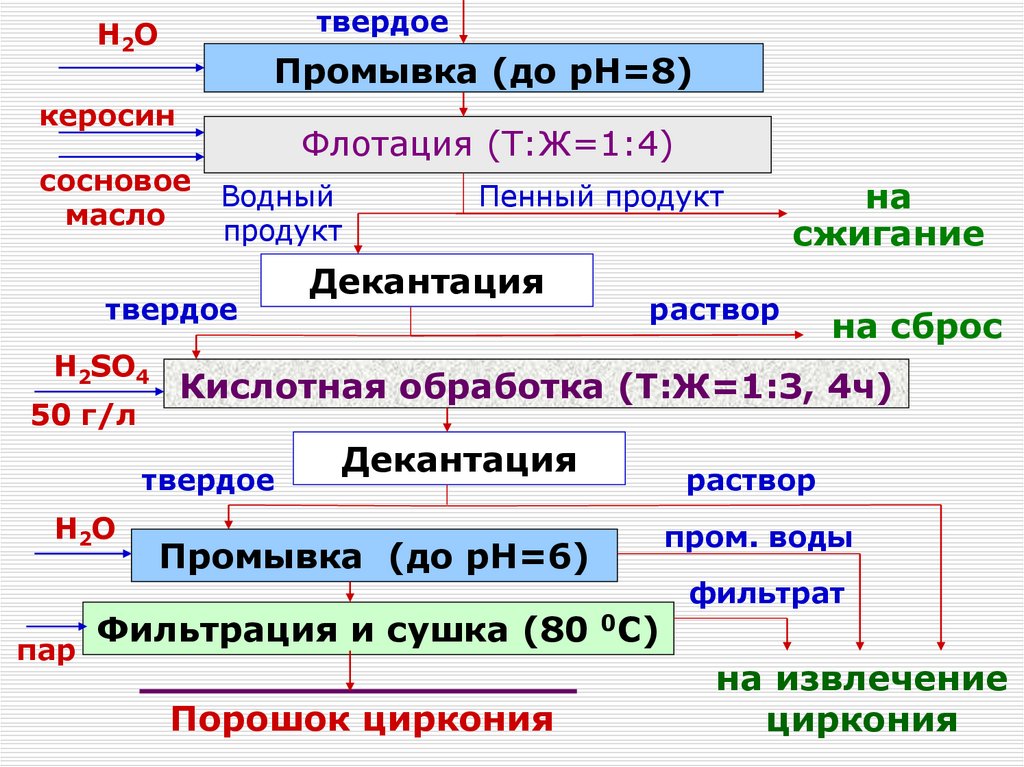







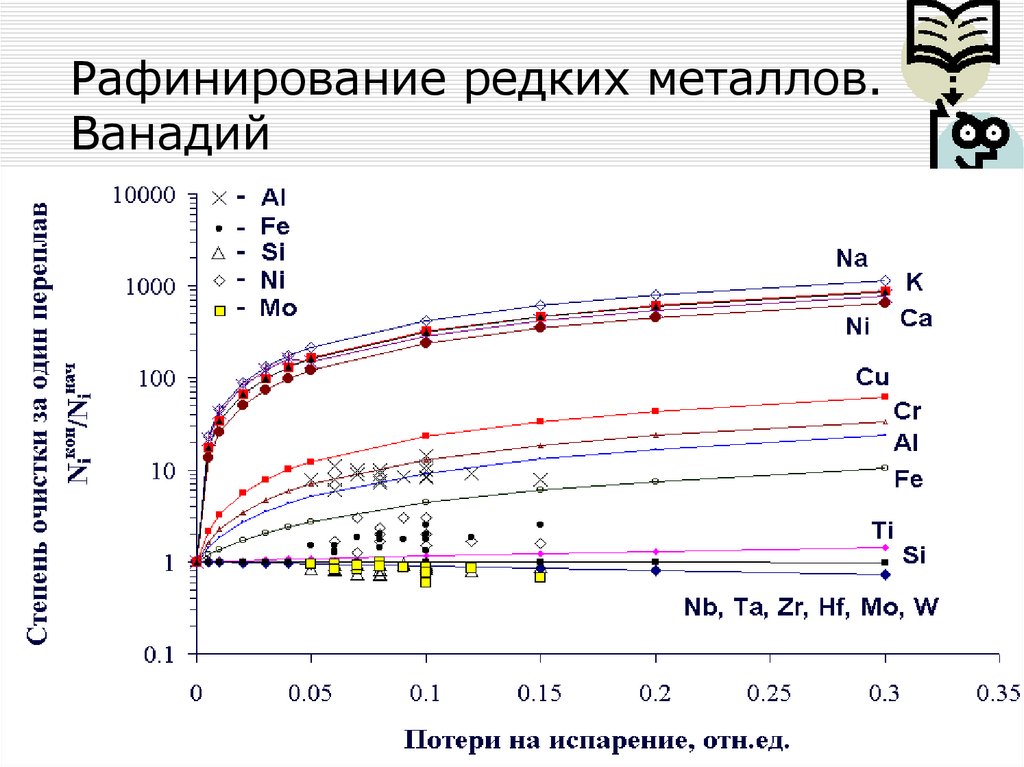


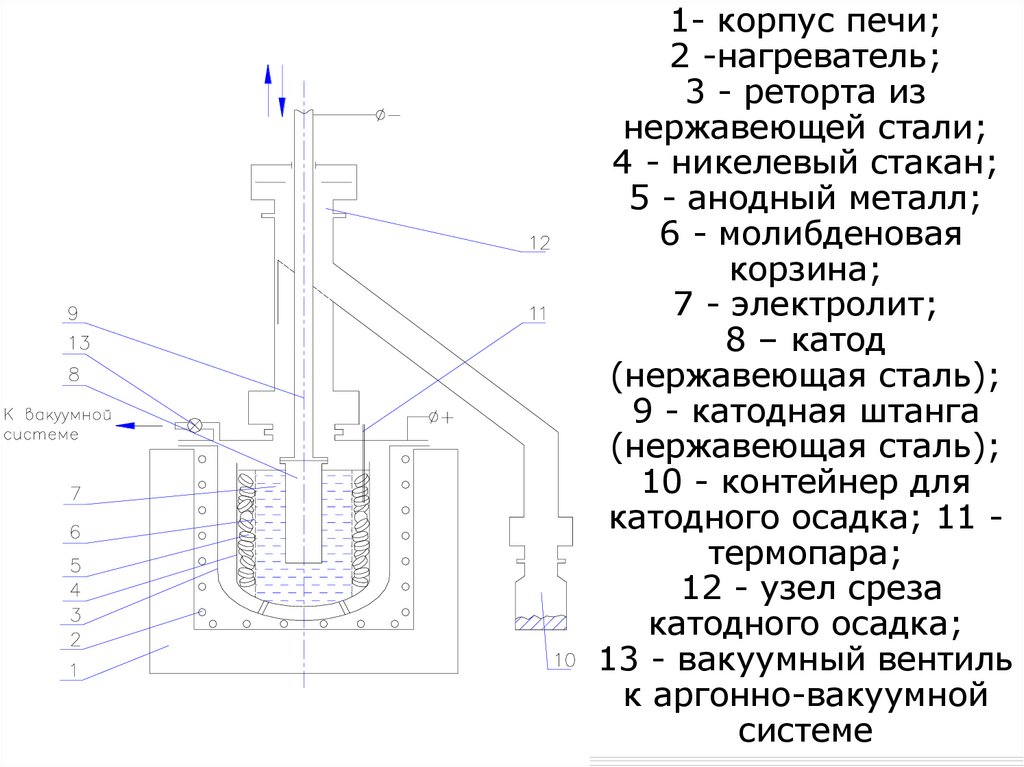



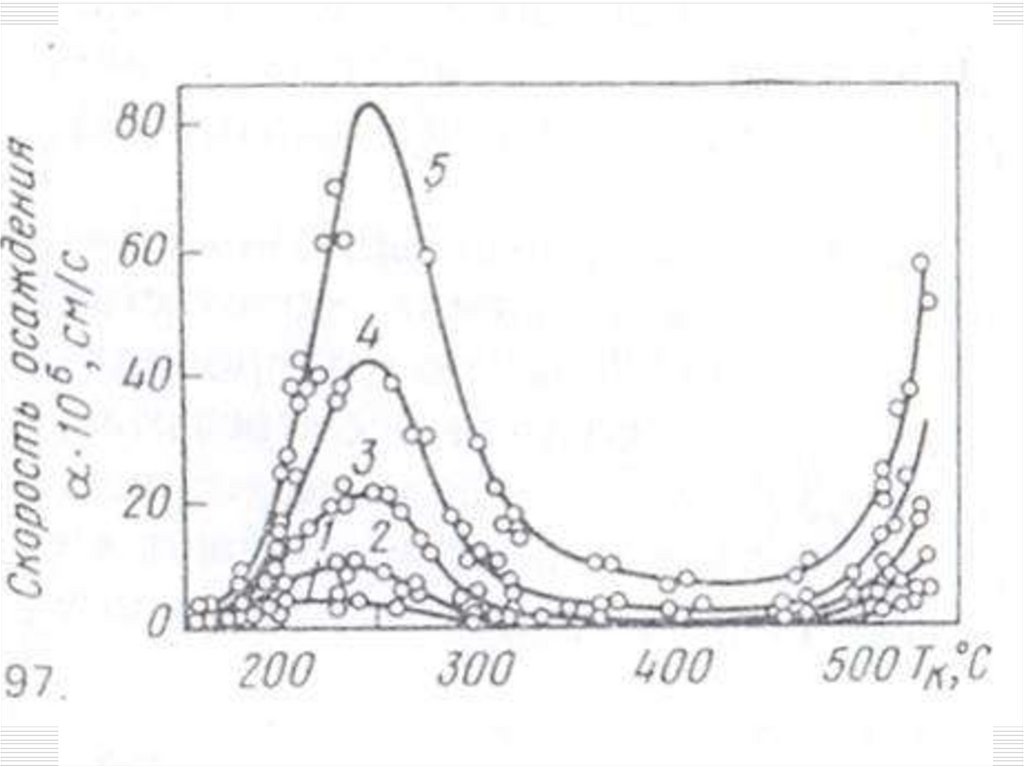

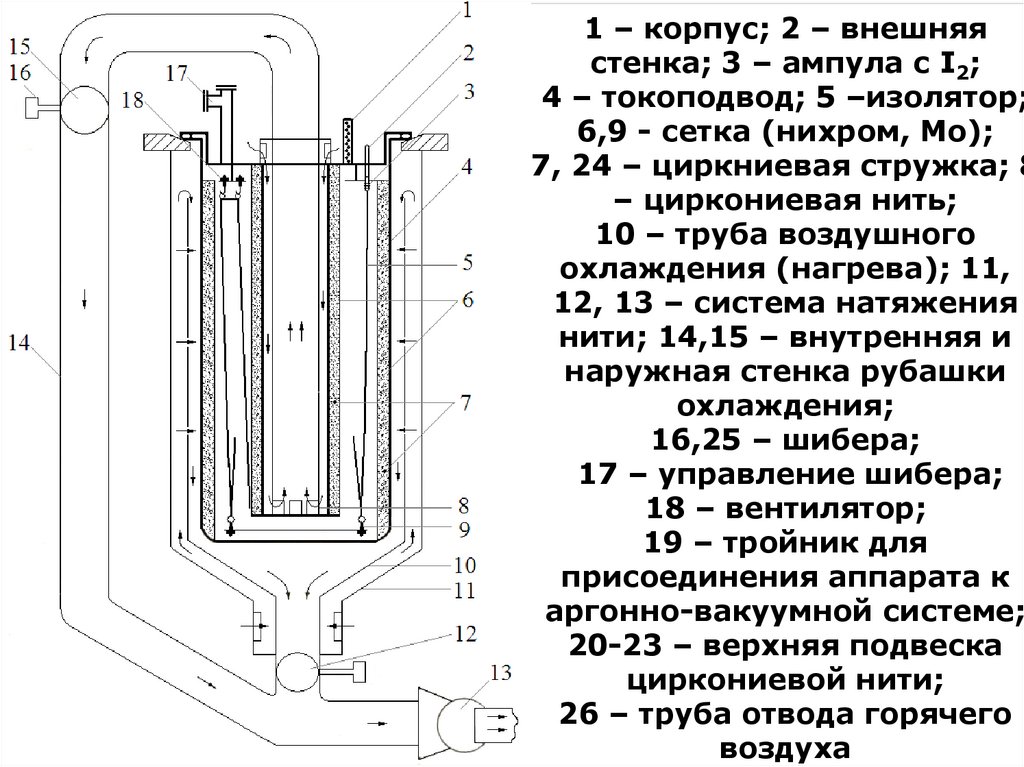

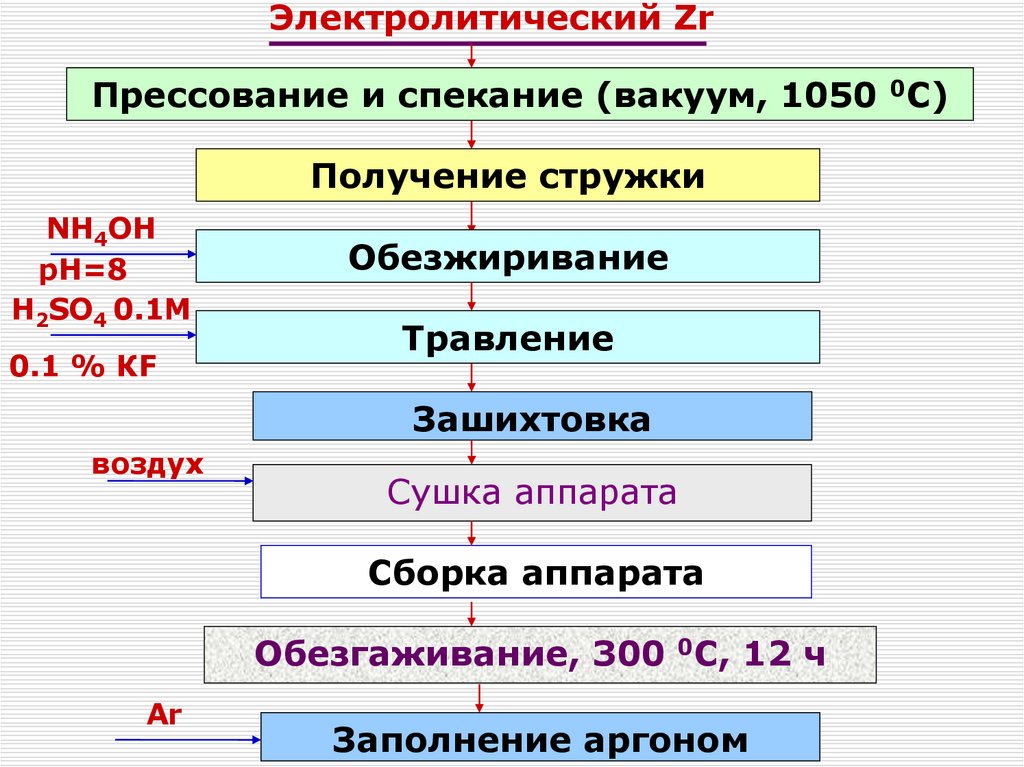
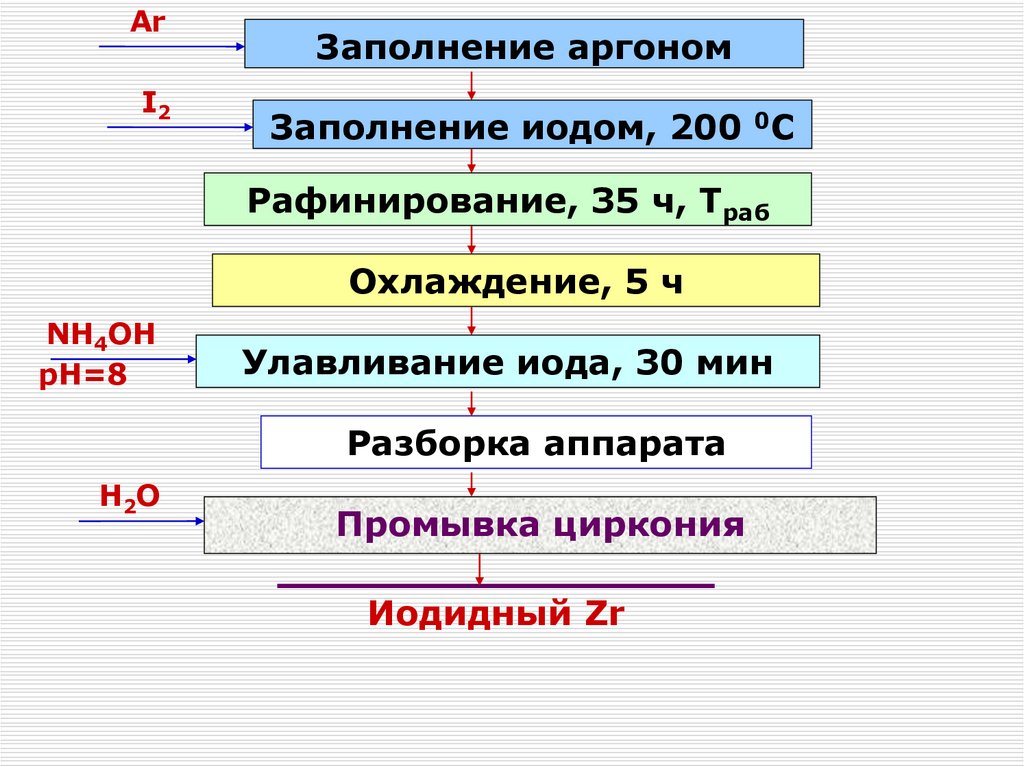
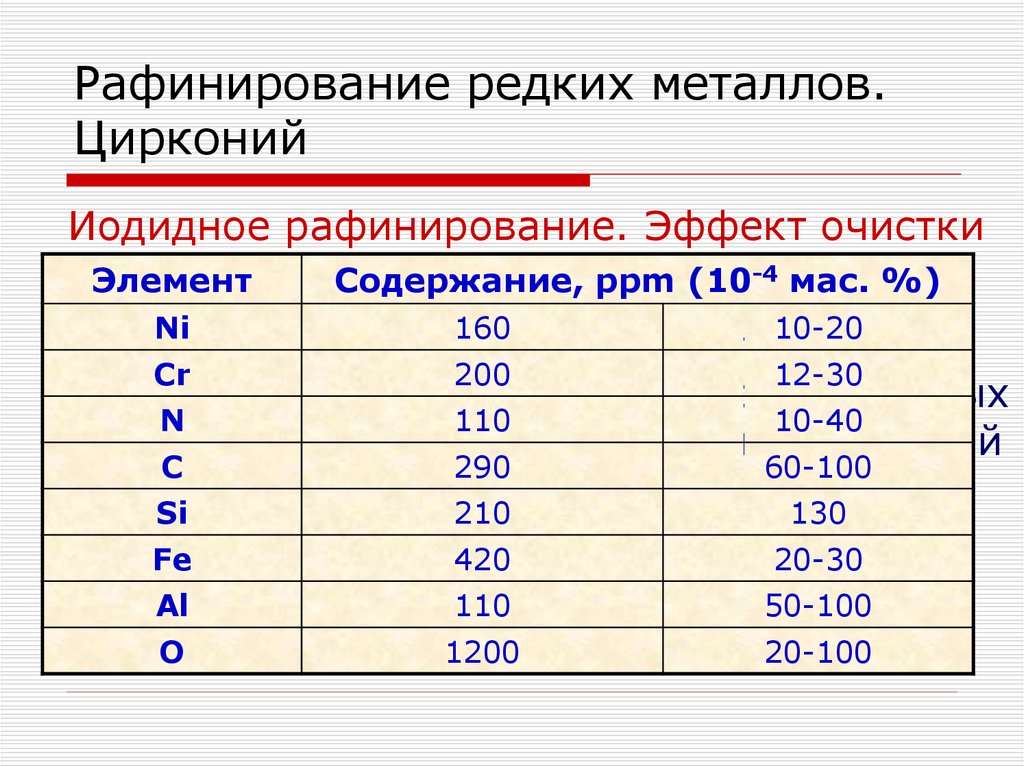
 Промышленность
Промышленность








