Похожие презентации:
Химические уравнения
1.
ХИМИЧЕСКИЕУРАВНЕНИЯ
2.
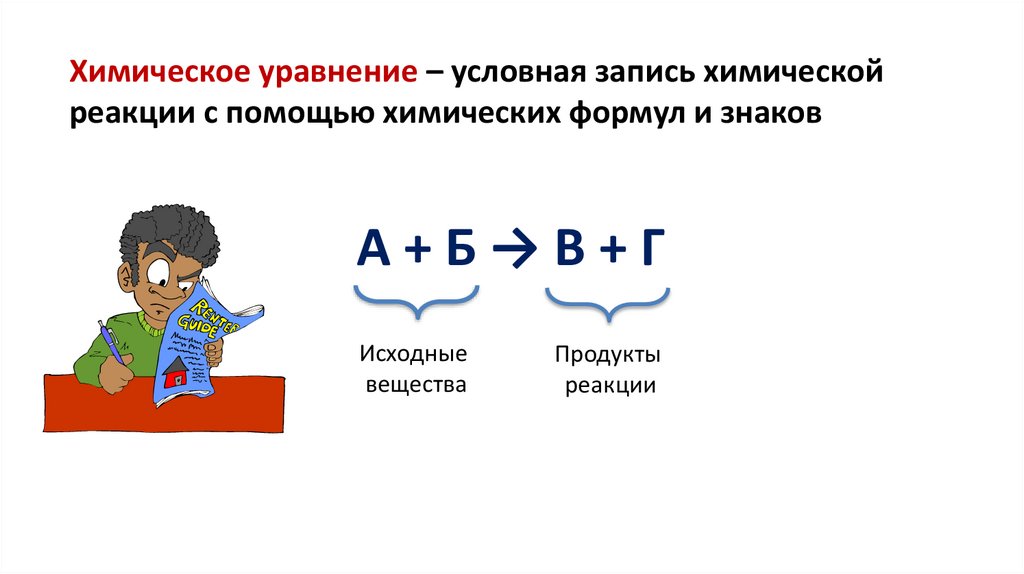
Химическое уравнение – условная запись химическойреакции с помощью химических формул и знаков
А+Б→В+Г
Исходные
вещества
Продукты
реакции
3.
Молекулярное уравнение – это уравнение, в которомисходные вещества и продукты реакции записаны в виде
молекул
Осадок
↓
Газ
↑
2Н2 + О2→ 2Н2О
2H2 + O2 = 2H2O
4.
Перед формулой простого вещества можно записыватьдробный коэффициент
С4Н10 + О2 → СО2 + Н2О
С4Н10 + 6,5О2 → 4 СО2 + 5Н2О
2С4Н10 + 13О2 → 8СО2 + 10Н2О
5.
Если в схеме реакции есть соль, то сначала уравниваютчисло ионов, образующих соль
Н3РО4 + Са(ОН)2 → Са3(РО4)2 + Н2О
2Н3РО4 + 3Са(ОН)2 → Са3(РО4)2 + Н2О
6.
Если в схеме реакции есть атомы водорода и кислорода, тосначала уравниваются атомы водорода, а только потом
кислорода
2Н3РО4 + 3Са(ОН)2 → Са3(РО4)2 + Н2О
2Н3РО4 + 3Са(ОН)2 → Са3(РО4)2 + 6Н2О
2Н3РО4 + 3Са(ОН)2 = Са3(РО4)2 + 6Н2О
7.
Если в схеме реакции имеется несколько формул солей, тоначинать уравнивание следует с ионов, входящих в состав
соли, содержащей большее их число
Ba(NO3)2 + Al2(SO4)3 → BaSO4↓ + Al(NO3)3
3Ba(NO3)2 + Al2(SO4)3 = 3BaSO4↓ + 2Al(NO3)3
8.
Если число атомов какого-то элемента в одной части схемыуравнения чётное, а в другой нечётное, то необходимо перед
формулой с нечётным числом атомов поставить
коэффициент 2
Al + O2 → Al2O3
4Al + 3 O2 → 2Al2O3
4Al + 3O2 = 2Al2O3







 Химия
Химия








