Похожие презентации:
Химическая связь (метод валентных связей)
1.
Химическая связь(метод валентных связей)
1
2.
От характера сил, действующих междуатомами элементов, зависят и свойства
образующихся веществ: механические,
оптические, электрические, химические и
другие.
Например,
зависимость
электрических свойств от типа связей в них
обнаруживается
в
электрической
проводимости.
2
3.
Различают четыре основных видахимической связи:
- ковалентную: между атомами
неметаллов,
- ионную: между атомами металлов и
неметалов,
- металлическую и
- водородную.
3
4.
Химическая связьПричиной образования химической связи является
стремление системы к более устойчивому состоянию с
минимально возможным запасом энергии.
Основное условие образования химической связи —
понижение полной энергии системы по сравнению с
суммарной энергией изолированных атомов. Молекула
может образоваться только в том случае, если при
взаимодействии атомов их общая энергия уменьшается.
Образование химической связи всегда сопровождается
выделением энергии, которая называется энергией
химической связи.
4
5.
При образовании химической связи атомы стремятся приобрестиустойчивую электронную оболочку. Эта идея была выдвинута в 1916 г.
Г. Льюисом. Он предположил, что наиболее устойчивым является
завершённый внешний энергетический уровень, который имеют атомы
благородных газов. Завершённый внешний электронный уровень атомов
всех благородных газов, кроме гелия, содержит восемь электронов
ns2np6,
атом гелия — два электрона. При образовании химической связи атомы
стремятся изменить свои электронные оболочки до конфигурации
устойчивой электронной оболочки ближайшего благородного газа, т. е. до
двух, как у гелия, или до восьми электронов, как у остальных благородных
газов. Это утверждение называется правилом октета (от лат. окто —
восемь). Завершение внешних электронных оболочек становится
возможным путём отдачи или присоединения электронов, а также путём
образования общих электронных пар (поделённые электронные пары).
Такие изменения электронных оболочек атомов приводят к образованию
устойчивых структур.
5
6. Свойства ковалентной связи
• Прочность или энергия связи• Тип
• Насыщаемость
• Кратность
• Длина связи
• Полярность
• Поляризуемость
• Направленность
7.
78.
Метод валентных связей (МВС) иначе называют теорией локализованных электронных пар. В основе метода лежит предположение, что химическая связь между двумя атомами осуществляется с помощью одной илинескольких электронных пар, которые локализованы между ними. Число
химических связей, которые способен образовывать атом или ион, равно
его валентности. Впервые эту концепцию выдвинул Льюис.
8
9.
910.
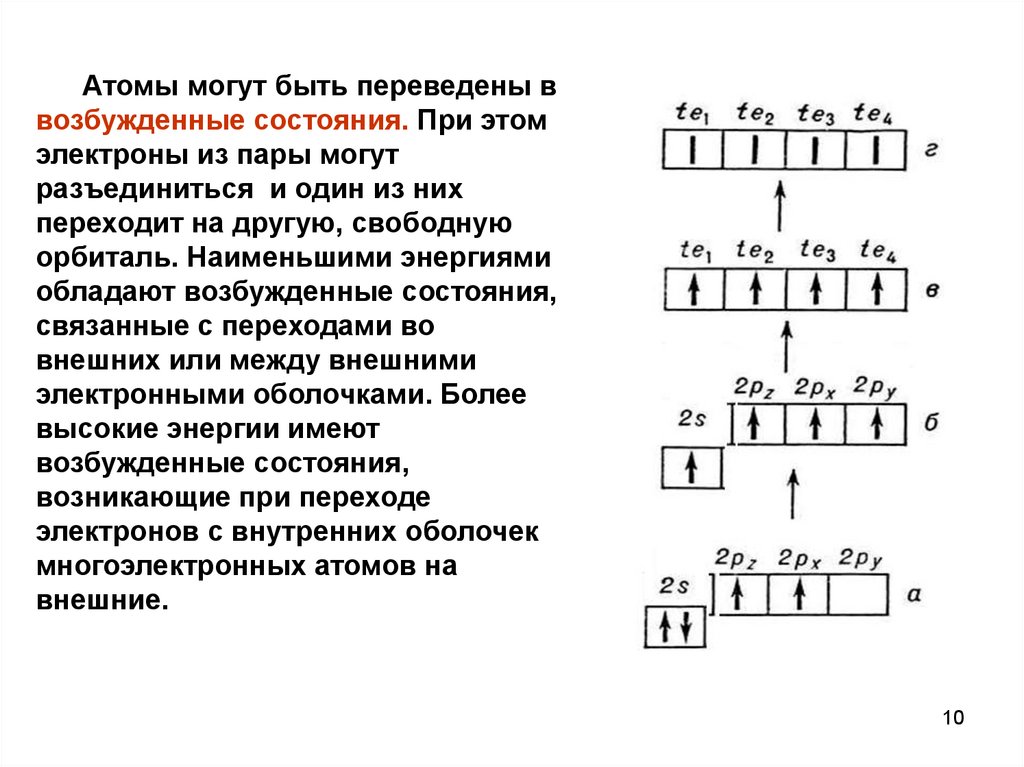
Атомы могут быть переведены ввозбужденные состояния. При этом
электроны из пары могут
разъединиться и один из них
переходит на другую, свободную
орбиталь. Наименьшими энергиями
обладают возбужденные состояния,
связанные с переходами во
внешних или между внешними
электронными оболочками. Более
высокие энергии имеют
возбужденные состояния,
возникающие при переходе
электронов с внутренних оболочек
многоэлектронных атомов на
внешние.
10
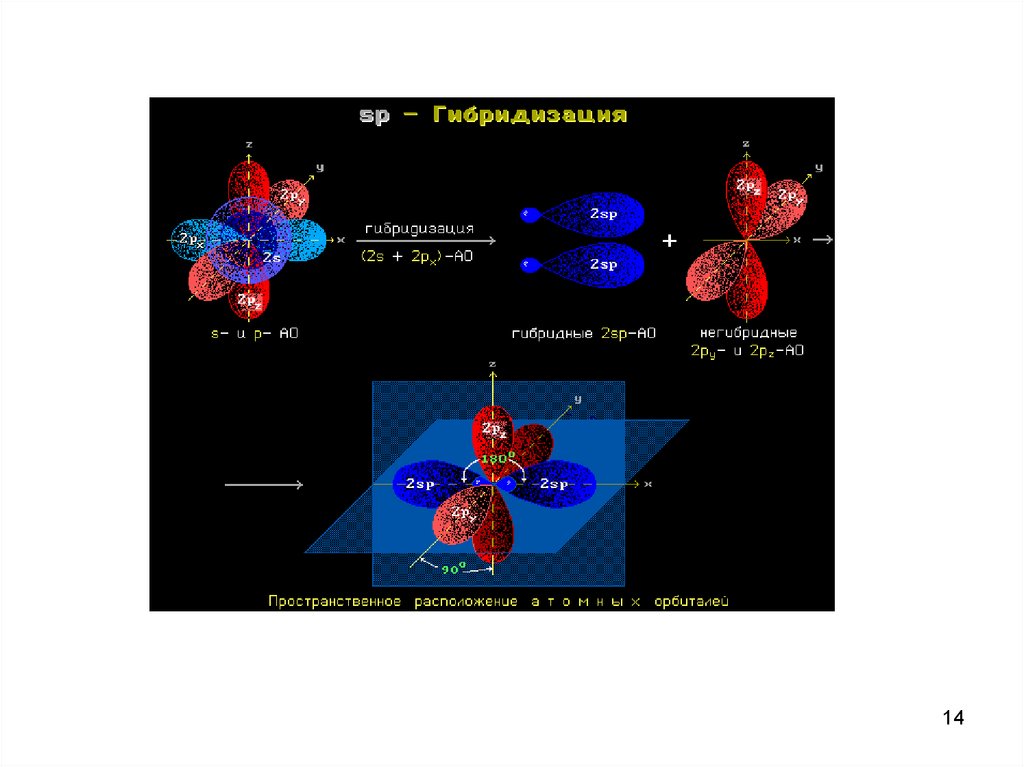
11. После возбуждения атома возможен переход (перестройка) в ГИБРИДНОЕ состояние
Гибридизация атомных орбиталей –изменение формы и уравнивание энергии
орбиталей атома для достижения более
эффективного перекрывания орбиталей
при образовании ковалентной связи.
12.
Различные орбитали, не сильно отличающиеся энергиями,образуют соответствующее число гибридных орбиталей.
Г = НЭП + σ
Число гибридных орбиталей равно числу атомных орбиталей,
участвующих в гибридизации. Гибридные орбитали одинаковы
по форме электронного облака и по энергии. По сравнению с
атомными орбиталями они более вытянуты в направлении
образования химических связей и поэтому обуславливают
лучшее перекрывание электронных облаков.
12
13.
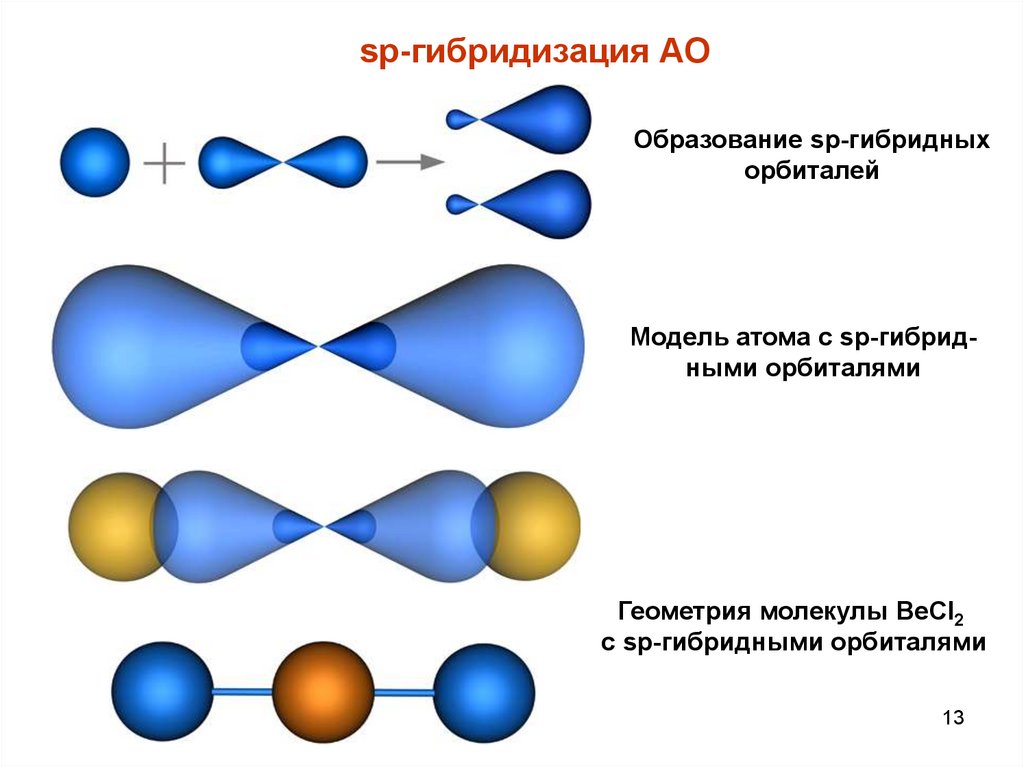
sp-гибридизация АООбразование sp-гибридных
орбиталей
Модель атома с sp-гибридными орбиталями
Геометрия молекулы BeCl2
с sp-гибридными орбиталями
13
14.
1415.
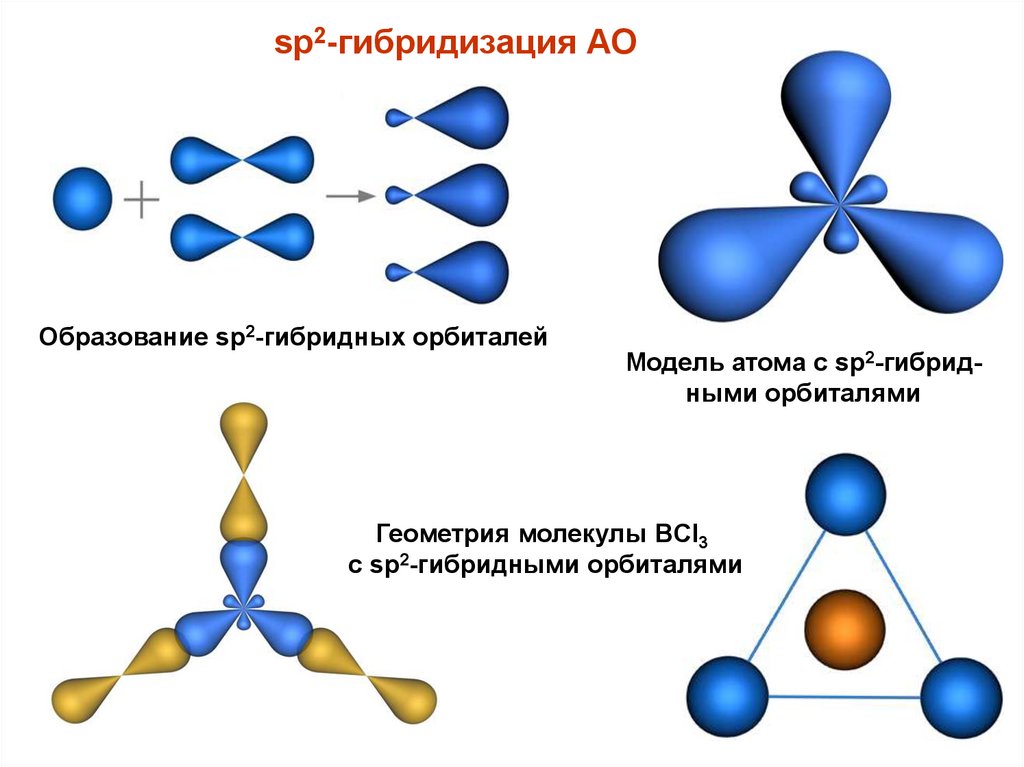
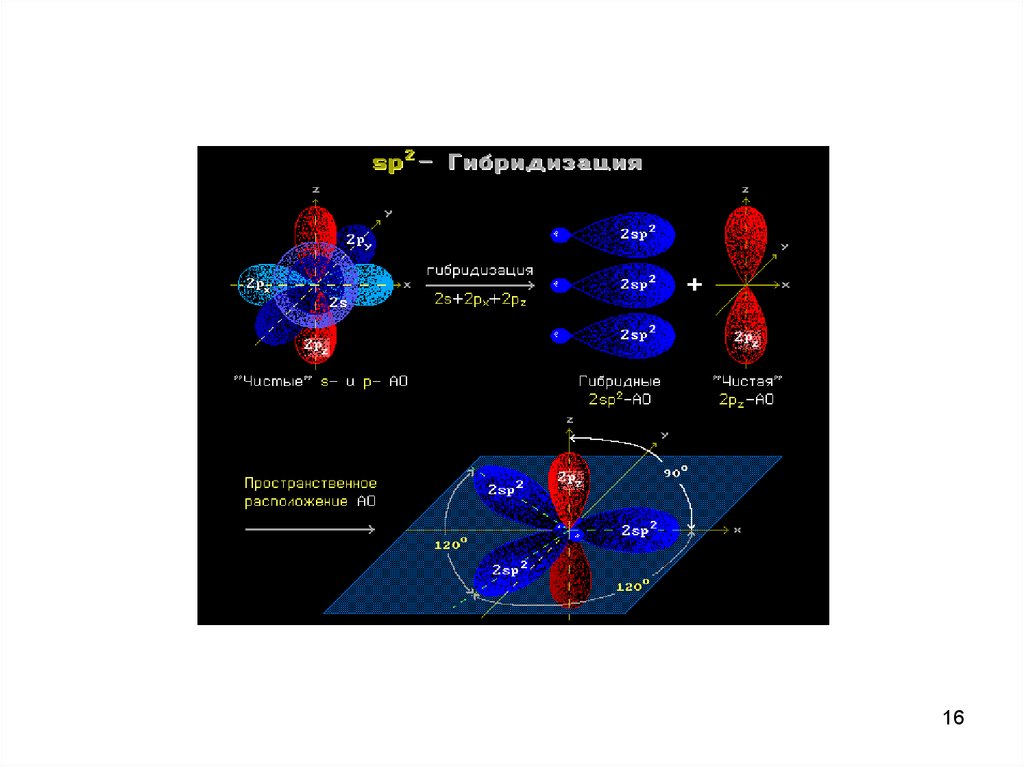
sp2-гибридизация АООбразование sp2-гибридных орбиталей
Модель атома с sp2-гибридными орбиталями
Геометрия молекулы BCl3
с sp2-гибридными орбиталями
15
16.
1617.
sp3-гибридизация АООбразование sp3-гибридных орбиталей
Модель атома с sp3-гибридными орбиталями
Геометрия молекулы CH4
с sp3-гибридными орбиталями
17
18.
Геометрия молекулы csp2d-гибридными орбиталями
[PdCl4]2-, [Pt(NH3)4]2+,
[Ni(CN)4]2-.
Геометрия молекулы с
sp3d2-гибридными орбиталями
SF6, PF6-, SiF62-
18
19.
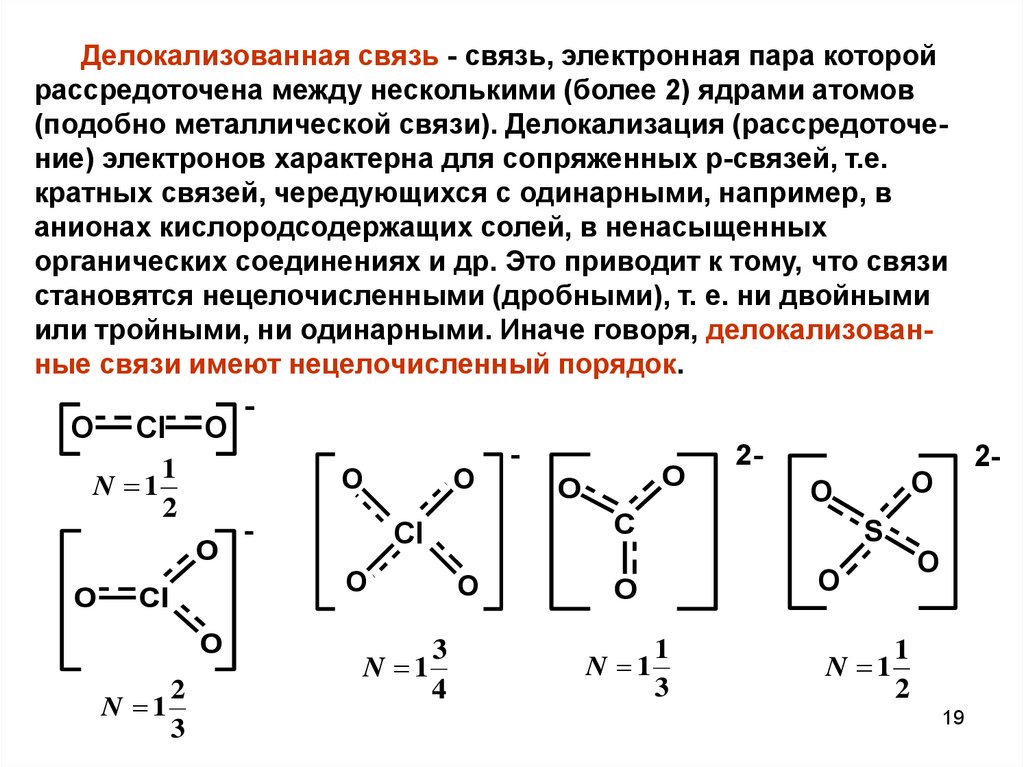
Делокализованная связь - связь, электронная пара которойрассредоточена между несколькими (более 2) ядрами атомов
(подобно металлической связи). Делокализация (рассредоточение) электронов характерна для сопряженных p-связей, т.е.
кратных связей, чередующихся с одинарными, например, в
анионах кислородсодержащих солей, в ненасыщенных
органических соединениях и др. Это приводит к тому, что связи
становятся нецелочисленными (дробными), т. е. ни двойными
или тройными, ни одинарными. Иначе говоря, делокализованные связи имеют нецелочисленный порядок.
O
Cl
O
1
N 1
2
O
O
O
-
O
O
2
3
N 1
-
O
O
2-
O
3
4
S
O
O
O
N 1
2-
O
O
C
Cl
O
Cl
N 1
-
1
3
N 1
1
2
19
20.
2021.
2122.
2223.
2324.
2425.
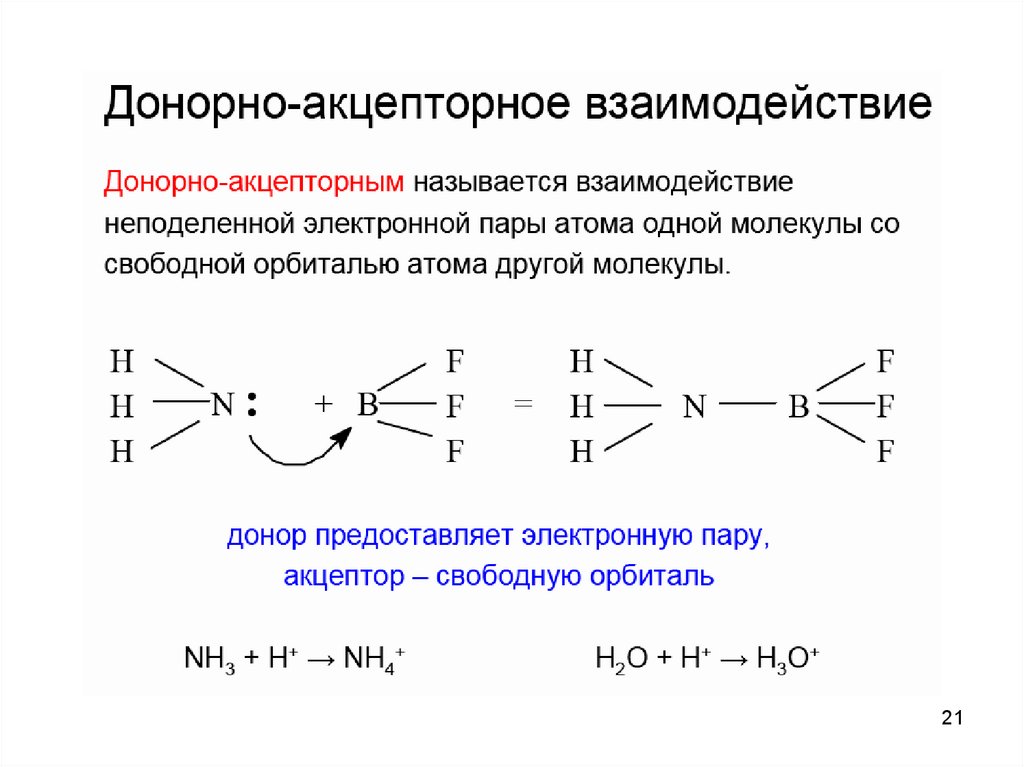
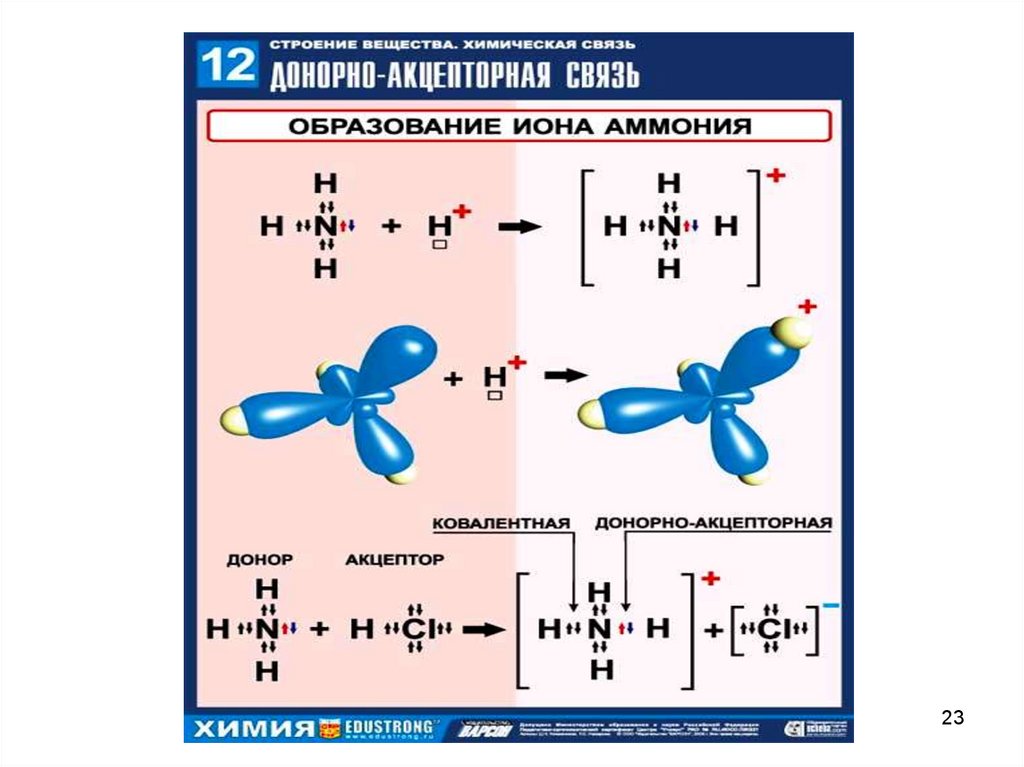
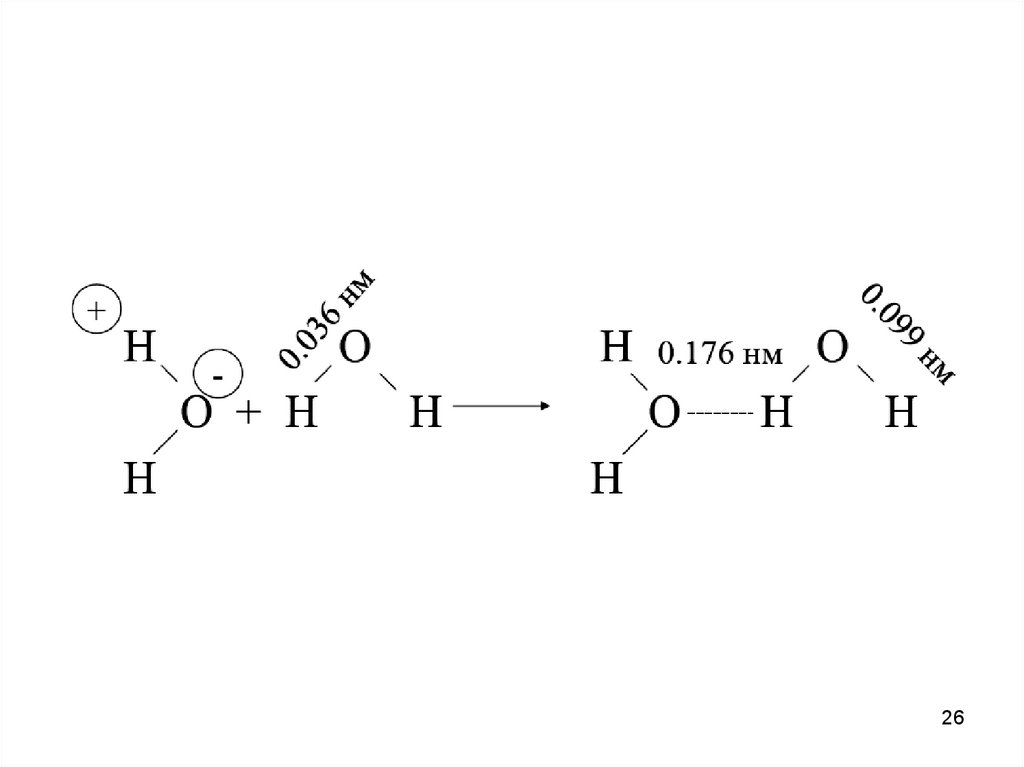
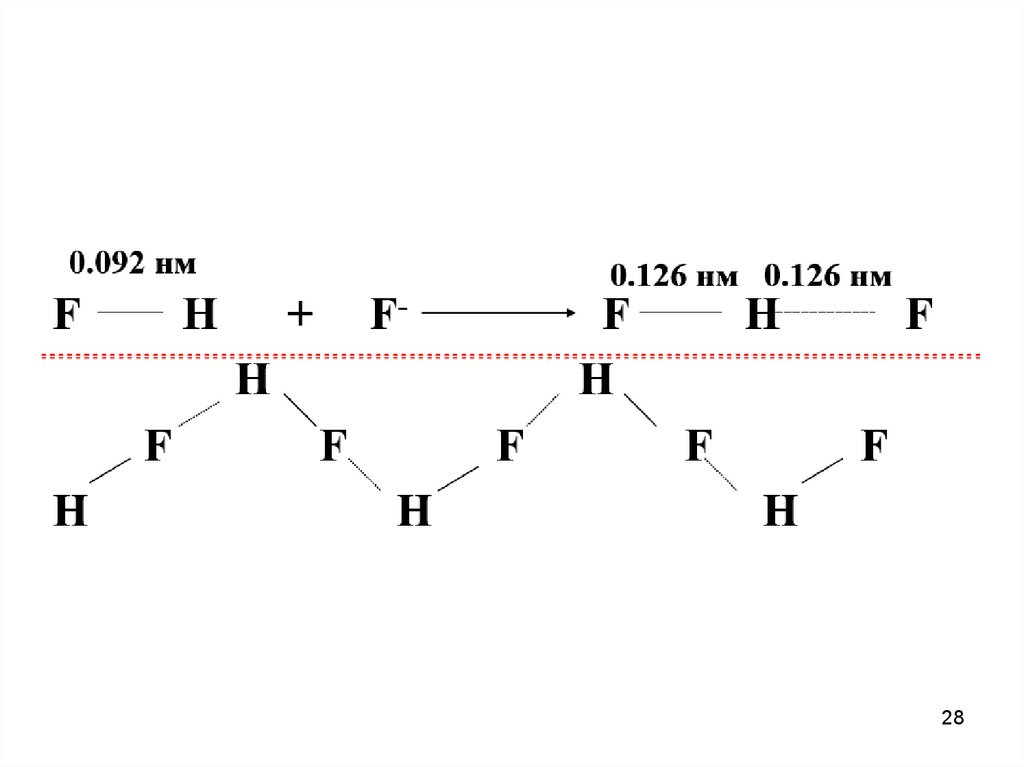
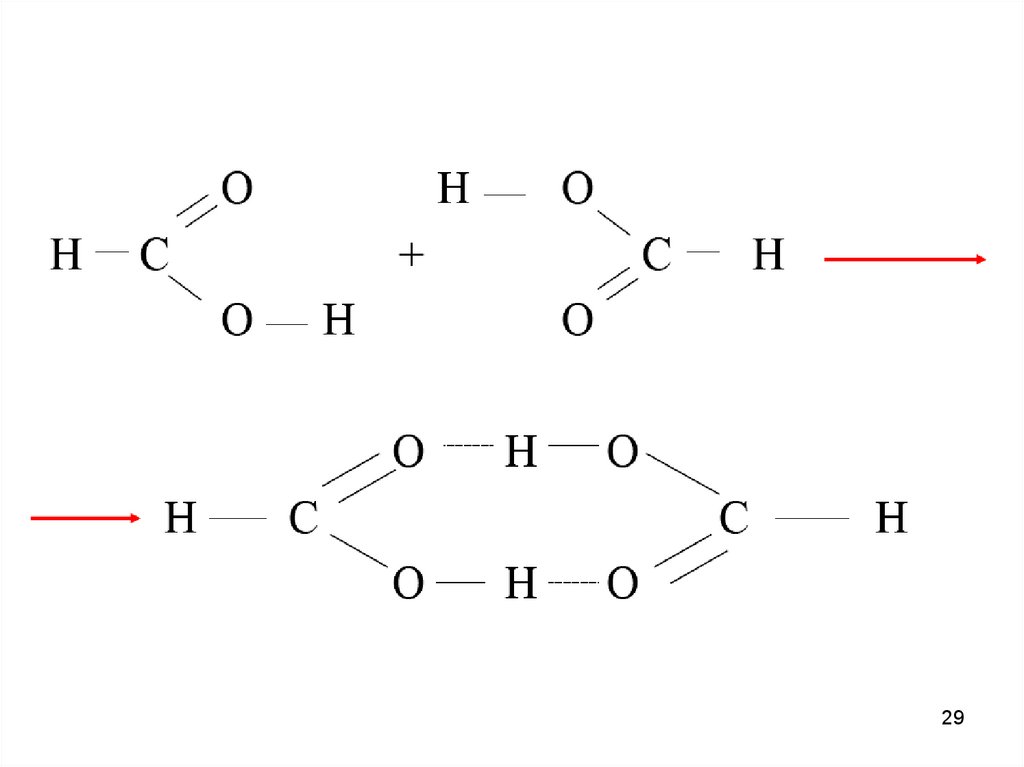
Водородная связь — разновидность донорно-акцепторнойсвязи, невалентное взаимодействие между атомом водорода H,
ковалентно связанным с атомом A группы A-H молекулы RA-H и
электроотрицательным атомом B другой молекулы (или функциональной группы той же молекулы) BR'. Результатом таких
взаимодействий являются комплексы RA-H•••BR' различной
степени стабильности, в которых атом водорода выступает в
роли «моста», связывающего фрагменты RA и BR'.
Особенностями водородной связи, по которым её выделяют
в отдельный вид, является её не очень высокая прочность,
распространенность и важность, особенно в органических
соединениях.
Ранее образование водородной связи объясняли действием
электростатических сил, то есть атом водорода, несущий
слабый положительный заряд, притягивается к электроотрицательному атому, который несет небольшой отрицательный заряд. Теперь ученые склоняются к тому, что водородная
связь может быть частично ковалентной - это означает, что при
ее формировании происходит обобщение электронов водорода
и второго образующего связь атома.
25
26.
2627.
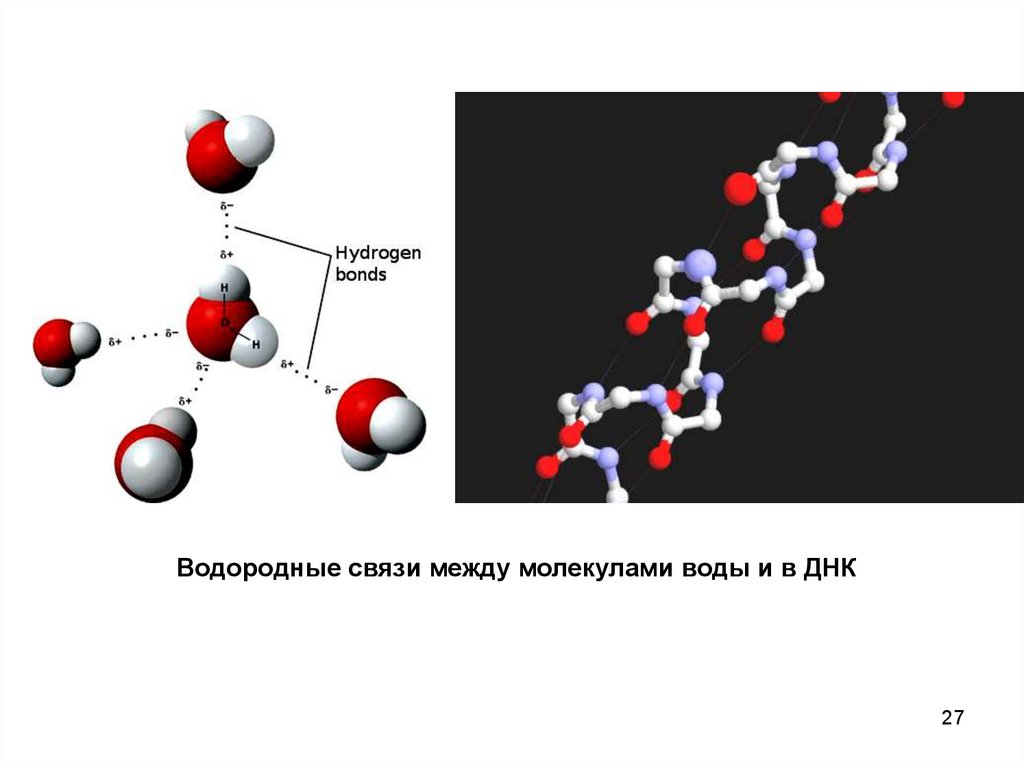
Водородные связи между молекулами воды и в ДНК27
28.
2829.
2930.
3031.
3132.
Итак, силы межмолекулярного взаимодействия обусловливаютсвойства веществ. Проявление этих сил объясняет различие в
температурах кипения или температурах плавления веществ. Например:
Вещество
Н2О
Н2S
Н2Sе
Н2Те
или
НF
НС1
НВr
НI
tкип., оС
tпл., оС
100
-60,3
-41,4
-2
0
-85,6
-65,7
-51
19
-84
-67
-35
-85
-114,2
-86,9
-50,8
32
33.
3334.
3435.
3536.
3637.
3738.
3839.
3940.
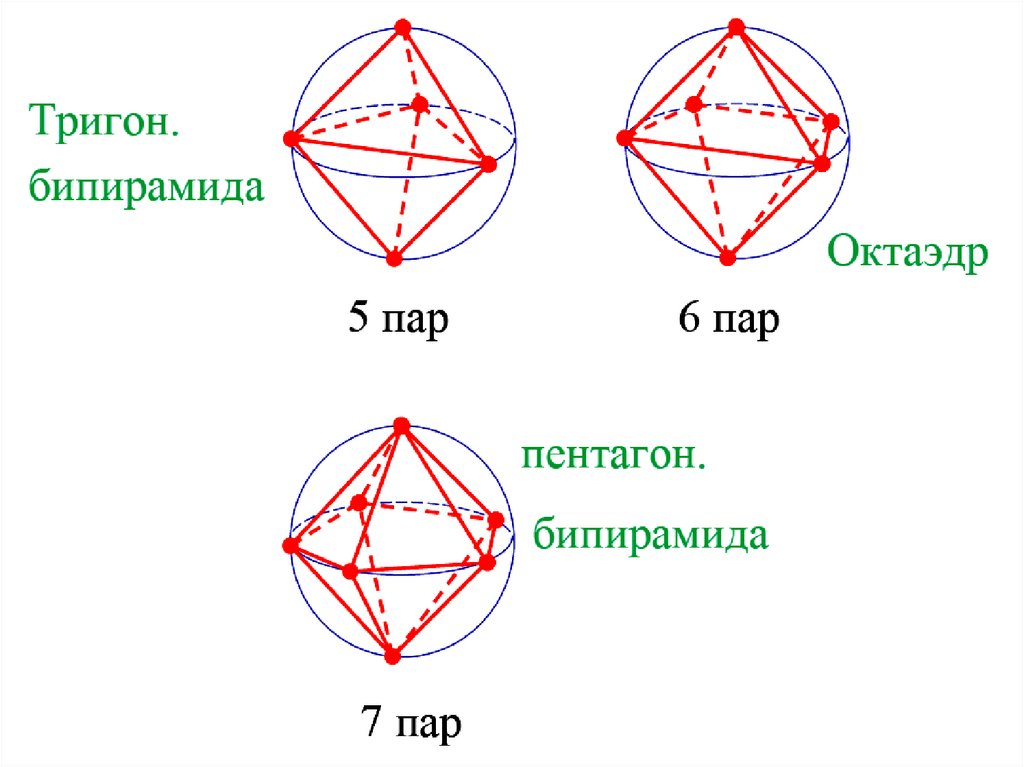
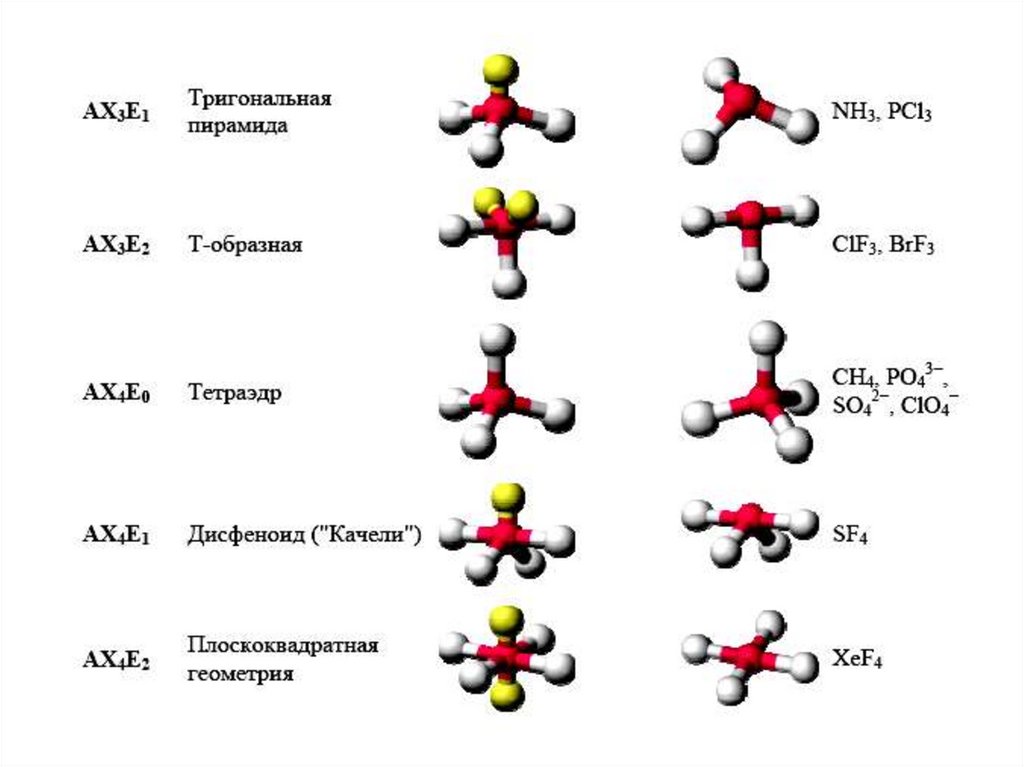
Конфигурация молекул по Гиллепси40
41.
4142.
4243.
4344.
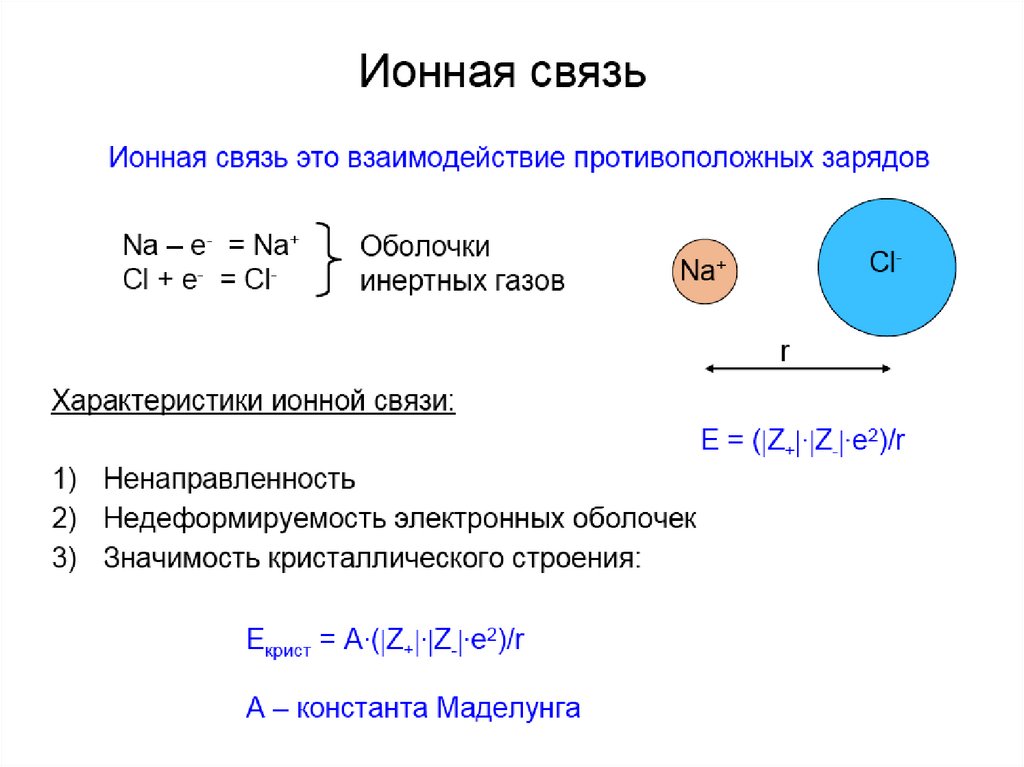
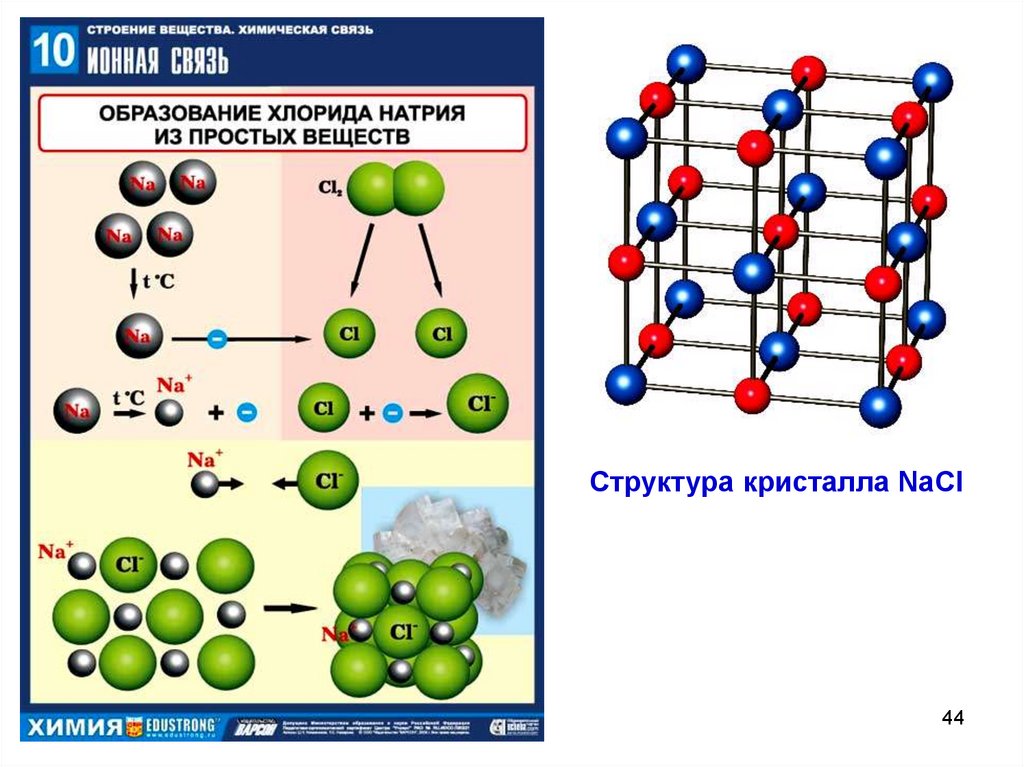
Структура кристалла NaCl44
45.
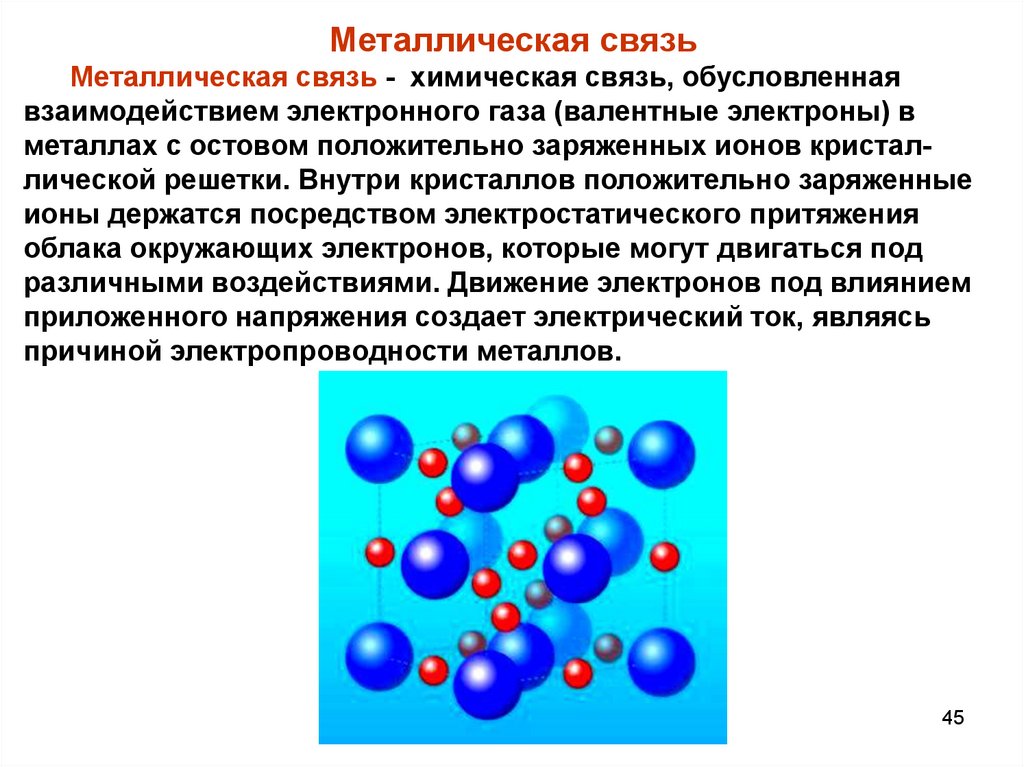
Металлическая связьМеталлическая связь - химическая связь, обусловленная
взаимодействием электронного газа (валентные электроны) в
металлах с остовом положительно заряженных ионов кристаллической решетки. Внутри кристаллов положительно заряженные
ионы держатся посредством электростатического притяжения
облака окружающих электронов, которые могут двигаться под
различными воздействиями. Движение электронов под влиянием
приложенного напряжения создает электрический ток, являясь
причиной электропроводности металлов.
45
46.
Нами рассмотрены связи, обуславливающиеобразование молекул из атомов.
Однако между молекулами также существуют силы
взаимодействия. Они являются причиной сжижения газов,
превращения жидкостей в твёрдые вещества. Из
биологии мы знаем, что благодаря этим силам устойчивы
ДНК и РНК.
Первую формулировку этим силам
межмолекулярного взаимодействия дал в 1871 году Вандер-Ваальс. Его именем они и называются: силы Ван-дерВаальса.
46
47.
4748.
Ориентационное взаимодействиеПолярные молекулы, в которых центры тяжести положительного и отрицательного зарядов не совпадают, например HCl, H2O,
NH3, ориентируются таким образом, чтобы рядом находились
диполи с противоположными зарядами. Между ними возникает
притяжение.
Для взаимодействия двух диполей энергия притяжения между
ними (энергия Кеезома) выражается соотношением
2 μ12 μ22
EK
,
6
3 kTr
где μ1 и μ2 - дипольные моменты взаимодействующих диполей,
r - расстояние между ними. Притяжение диполь-диполь может
осуществляться только тогда, когда энергия притяжения
превышает тепловую энергию молекул; обычно это имеет место в
твердых и жидких веществах. Диполь-дипольное взаимодействие проявляется в полярных жидкостях (вода, фтороводород).
48
49.
Индукционное взаимодействиеЕсли полярная молекула окажется рядом с неполярными, она
начнет влиять на них. Поляризация нейтральной молекулы под
действием поля другой молекулы (наведение диполя) происходит благодаря поляризуемости. Под действием диполей полярных молекул электронные облака неполярных молекул смещаются в сторону положительного заряда и отдаляются от отрицательного. Неполярная молекула становится полярной, и молекулы начинают притягиваться друг к другу, только слабее, чем
обычные полярные молекулы.
Энергия притяжения между постоянным и наведенным
диполем (энергия Дебая) определяется выражением
2 α1 μ 2
EД 6 ,
r
где – поляризуемость неполярных молекул. Этот вид
взаимодействия проявляется главным образом в растворах
полярных соединений в неполярных растворителях.
49
50.
Дисперсионное взаимодействиеМежду неполярными молекулами также может возникнуть
притяжение. Электроны, которые находятся в постоянном
движении, на миг могут оказаться с одной стороны молекулы,
т. е. неполярная частица станет полярной. Это вызывает перераспределение зарядов в соседних молекулах, и между ними
устанавливаются кратковременные связи
Энергия такого взаимодействия (энергия Лондона) имеет
следующий вид:
3 hν0 α 2
ЕЛ
4r6 ,
где ν0 – частота возникновения мгновенного диполя. Лондоновские силы притяжения между неполярными частицами являются
весьма короткодействующими. Значения энергии такого
притяжения зависят от размеров частиц и числа электронов в
наведенных диполях. Эти связи очень слабые - самые слабые из
всех межмолекулярных взаимодействий.
50
51.
Чем больше деформируемость атомных орбиталей,чем слабее внешний электрон связан с ядром, чем
крупнее
атом,
тем
сильнее
дисперсионное
взаимодействие:
F2 - газ;
С12 – газ;
Вr2 – жидкость;
I2 - твёрдое вещество при обычных
условиях.
В ряду однотипных веществ дисперсионное
взаимодействие усиливается с ростом размеров атомов,
составляющих молекулы этих веществ.
51
52.
Межмолекулярное отталкиваниеЕсли бы молекулы только притягивались друг к другу, это
привело бы к их слиянию. Но на очень малых расстояниях их
электронные оболочки начинают отталкиваться. Энергия отталкивания дается выражением
k
Eот n ,
r
где k - постоянная отталкивания, n принимает различные целые
значения (5-15). Общее уравнение межмолекулярного взаимодействия при постоянной температуре (уравнение ЛеннардаДжонсона) в большинстве случаев имеет вид
a
b
Eм 6 12
r r
и носит название "потенциала 6-12", поскольку энергия притяжения пропорциональна 1 / r6, а энергия отталкивания - 1 / r12.
52
53.
Благодарю за внимание53
































 Химия
Химия








