Похожие презентации:
I закон термодинамики
1.
I закон термодинамики2.
Закон сохранения энергииЭнергия в природе не возникает
из ничего и не исчезает:
количество энергии неизменно,
она только переходит из
одной формы в другую.
3.
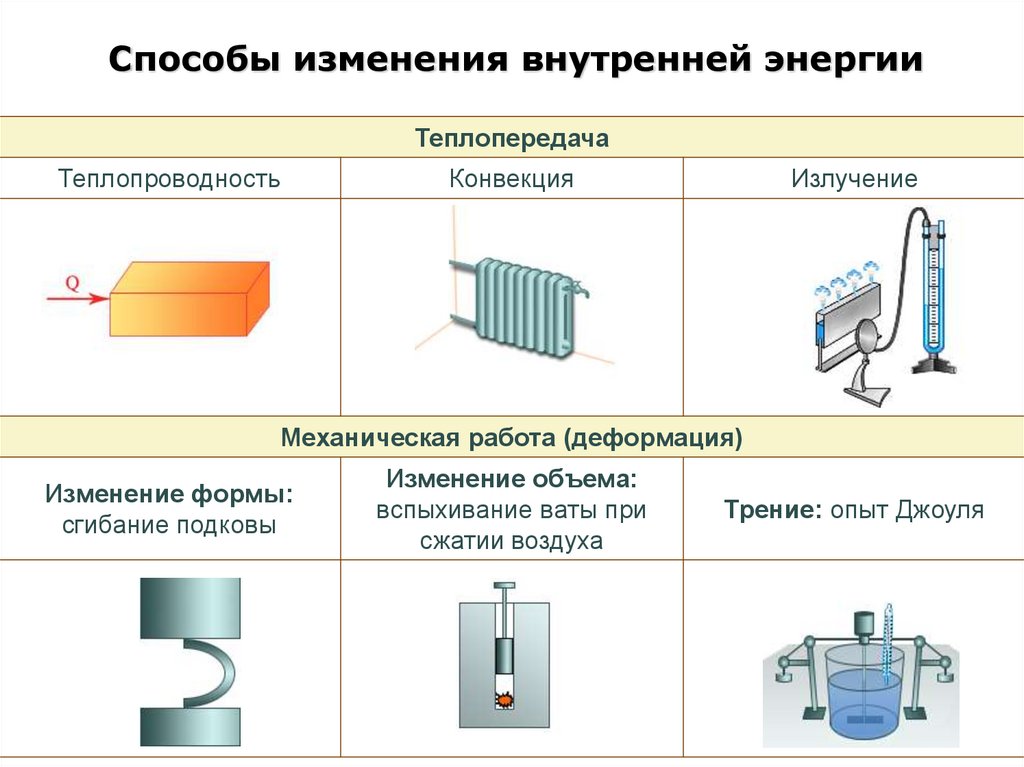
Способы изменения внутренней энергииТеплопередача
Теплопроводность
Конвекция
Излучение
Механическая работа (деформация)
Изменение формы:
сгибание подковы
Изменение объема:
вспыхивание ваты при
сжатии воздуха
Трение: опыт Джоуля
4.
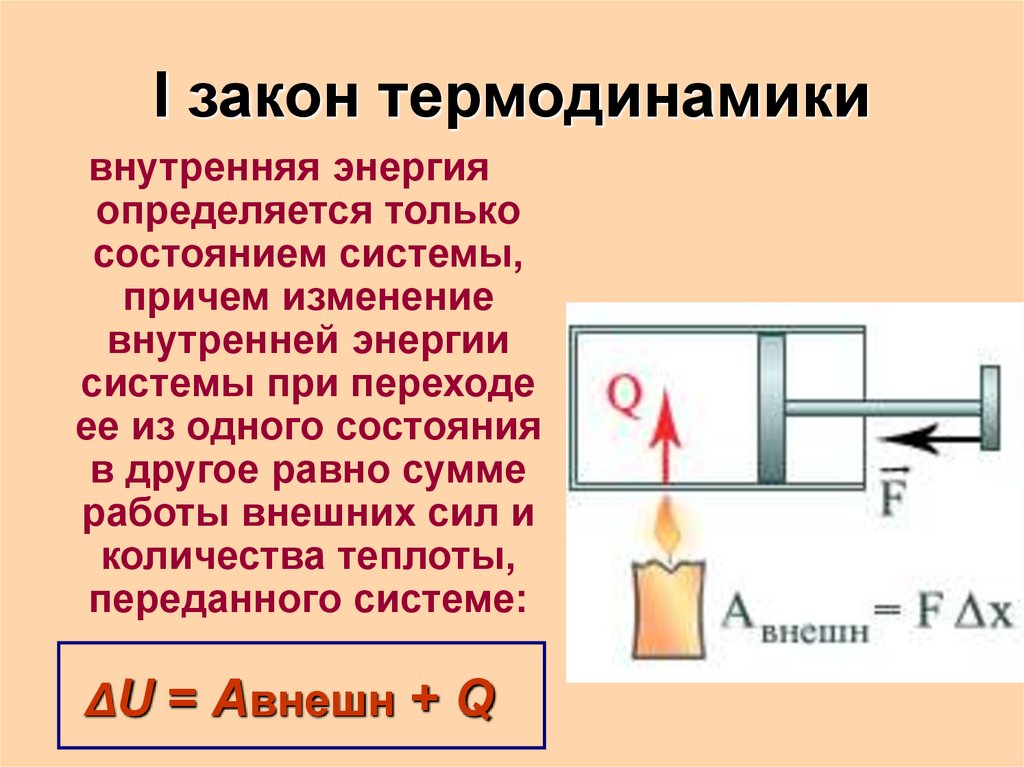
I закон термодинамикивнутренняя энергия
определяется только
состоянием системы,
причем изменение
внутренней энергии
системы при переходе
ее из одного состояния
в другое равно сумме
работы внешних сил и
количества теплоты,
переданного системе:
ΔU = Aвнешн + Q
5.
Если при нагревании газ расширяется ипри этом совершает работу A, то
первый закон термодинамики можно
сформулировать по-другому:
Q = ΔU + A I
Количество теплоты, переданное газу, равно
сумме изменения его внутренней энергии и
работы, совершенной газом.
Так как работа газа и работа внешних сил
вследствие 3-го закона Ньютона равны по
модулю и имеют противоположный знак:
Aвнешн = –AI
6.
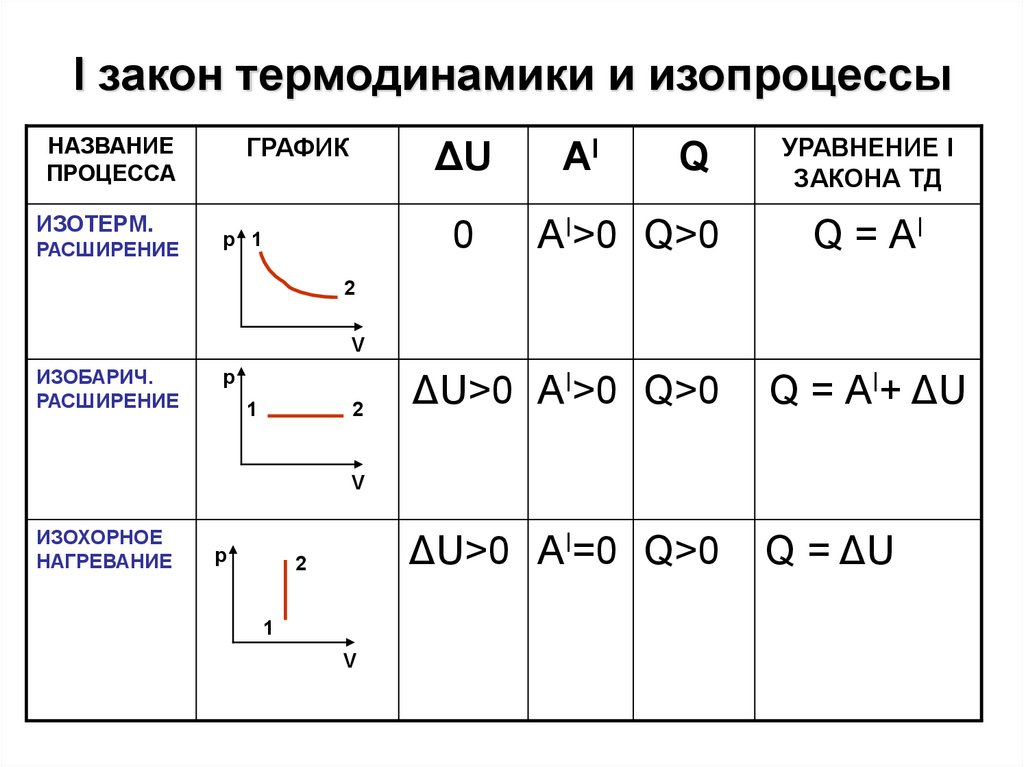
I закон термодинамики и изопроцессыНАЗВАНИЕ
ПРОЦЕССА
ИЗОТЕРМ.
РАСШИРЕНИЕ
ГРАФИК
р 1
ΔU
AI
0
АI>0 Q>0
Q
УРАВНЕНИЕ I
ЗАКОНА ТД
Q = АI
2
V
ИЗОБАРИЧ.
РАСШИРЕНИЕ
р
1
2
ΔU>0 АI>0 Q>0
Q = АI+ ΔU
ΔU>0 АI=0 Q>0
Q = ΔU
V
ИЗОХОРНОЕ
НАГРЕВАНИЕ
р
2
1
V
7.
I закон термодинамики и изопроцессыНАЗВАНИЕ
ПРОЦЕССА
ИЗОТЕРМ.
СЖАТИЕ
ГРАФИК
р 2
ΔU
AI
0
АI<0 Q<0
Q
УРАВНЕНИЕ I
ЗАКОНА ТД
Q = АI
1
V
ИЗОБАРИЧ.
СЖАТИЕ
р
2
1
ΔU<0 АI<0 Q<0
Q = АI+ ΔU
ΔU<0 АI=0 Q<0
Q = ΔU
V
ИЗОХОРНОЕ
ОХЛАЖДЕНИЕ
р
1
2
V
8.
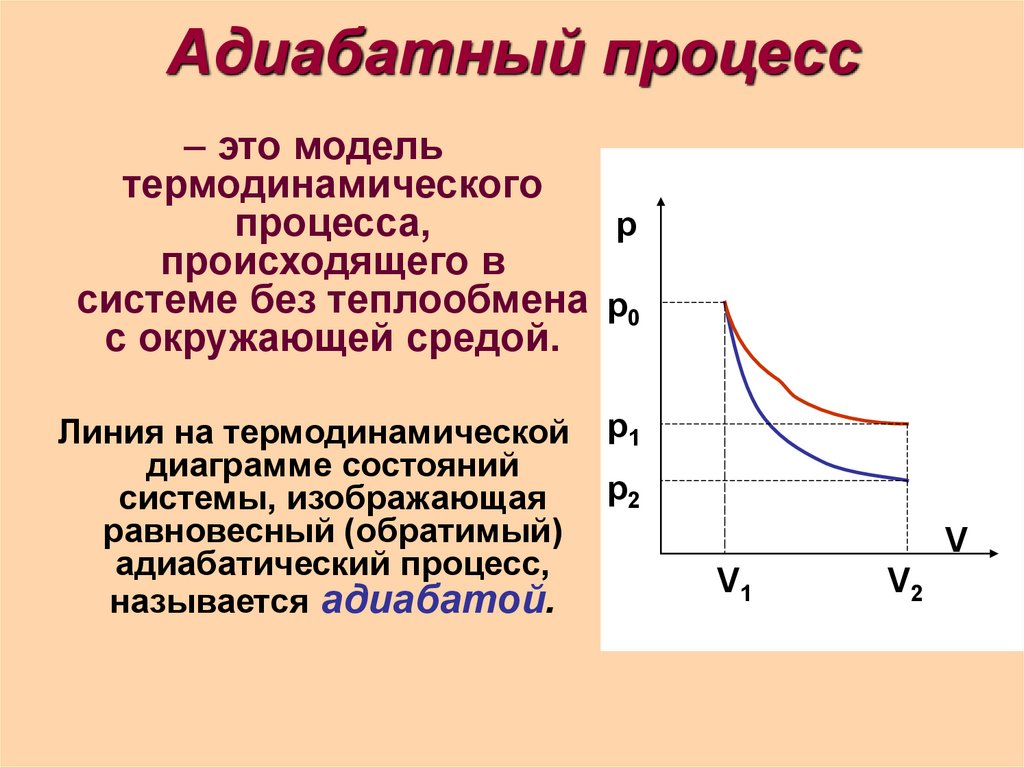
Адиабатный процесс– это модель
термодинамического
процесса,
р
происходящего в
системе без теплообмена р0
с окружающей средой.
Линия на термодинамической
диаграмме состояний
системы, изображающая
равновесный (обратимый)
адиабатический процесс,
называется адиабатой.
р1
р2
V
V1
V2
9.
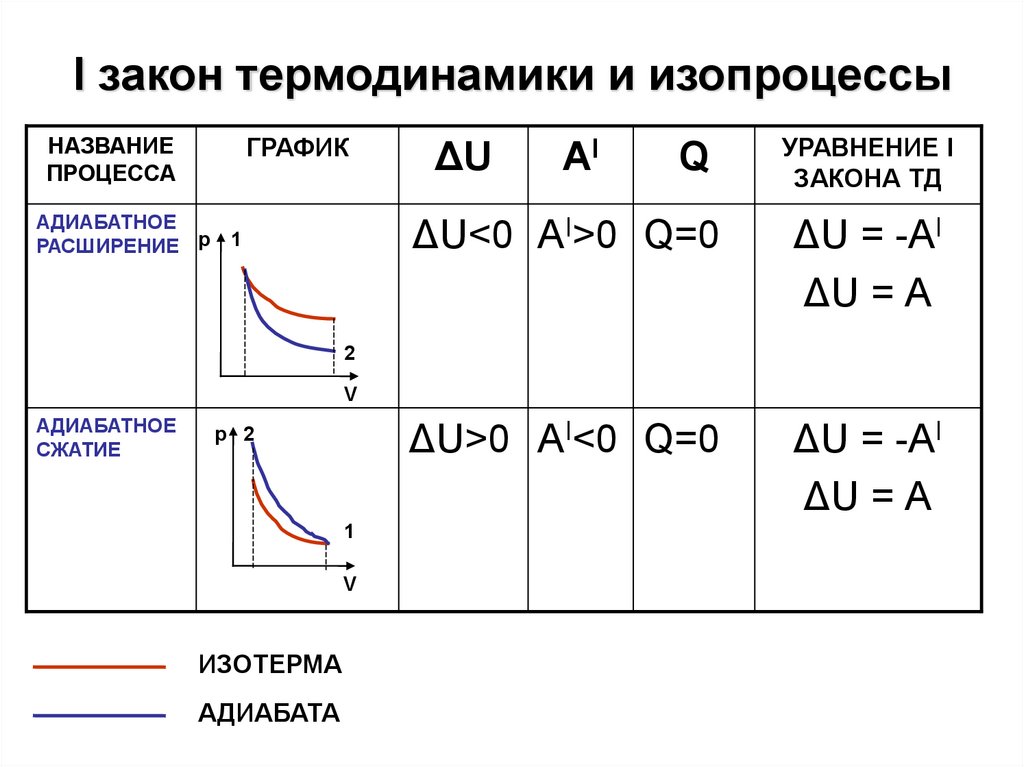
I закон термодинамики и изопроцессыНАЗВАНИЕ
ПРОЦЕССА
ГРАФИК
АДИАБАТНОЕ
РАСШИРЕНИЕ р
1
Q
УРАВНЕНИЕ I
ЗАКОНА ТД
ΔU<0 АI>0 Q=0
ΔU = -АI
ΔU = А
ΔU>0 АI<0 Q=0
ΔU = -АI
ΔU = А
ΔU
AI
2
V
АДИАБАТНОЕ
СЖАТИЕ
р 2
1
V
ИЗОТЕРМА
АДИАБАТА




 Физика
Физика








