Похожие презентации:
Скорость химических реакций. Химическая кинетика изучает скорость и механизмы химических реакций
1.
Скорость химическихреакций
Химическая кинетика изучает скорость
и механизмы химических реакций
2.
Гомогенные игетерогенные системы
Фаза – совокупность всех
гомогенных частей системы,
одинаковых по составу и по всем
физическим
и химическим свойствам
и отграниченных от других
частей системы поверхностью
раздела.
Гомогенные системы
состоят из одной фазы
Гетерогенные системы
3.
Учение о скорости химическойреакции называется
химической кинетикой.
Химическая реакция:
Исходное вещество → продукты реакции ± ∆Н
(разрыв химической связи)
(образование связей)
(разная прочность
связей)
∆Н = Н продукта – Н исходного вещества
энтальпия - ∆Н= – Q
Стремление перейти к минимуму энергии –
движущая сила химической реакции.
4.
Скорость химической реакцииСкорость гомогенной реакции – это
изменение концентрации одного из
реагирующих веществ или одного из
продуктов реакции в единицу времени.
С – молярная концентрация вещества,
[C]=1 моль/л
С = n/V
t – время, [t]=1 c
5.
Скорость химической реакцииСкорость гетерогенной реакции –
это изменение количества вещества в
единицу времени на единицу
поверхности
6.
Факторы, от которыхзависит скорость реакции
Природа реагирующих веществ
Концентрация веществ в системе
Площадь поверхности (для
гетерогенных систем)
Температура
Наличие катализаторов
Опыт: щелочные металлы реагируют с водой
Опыт: влияние концентрации
Рубидий и цезий с водой
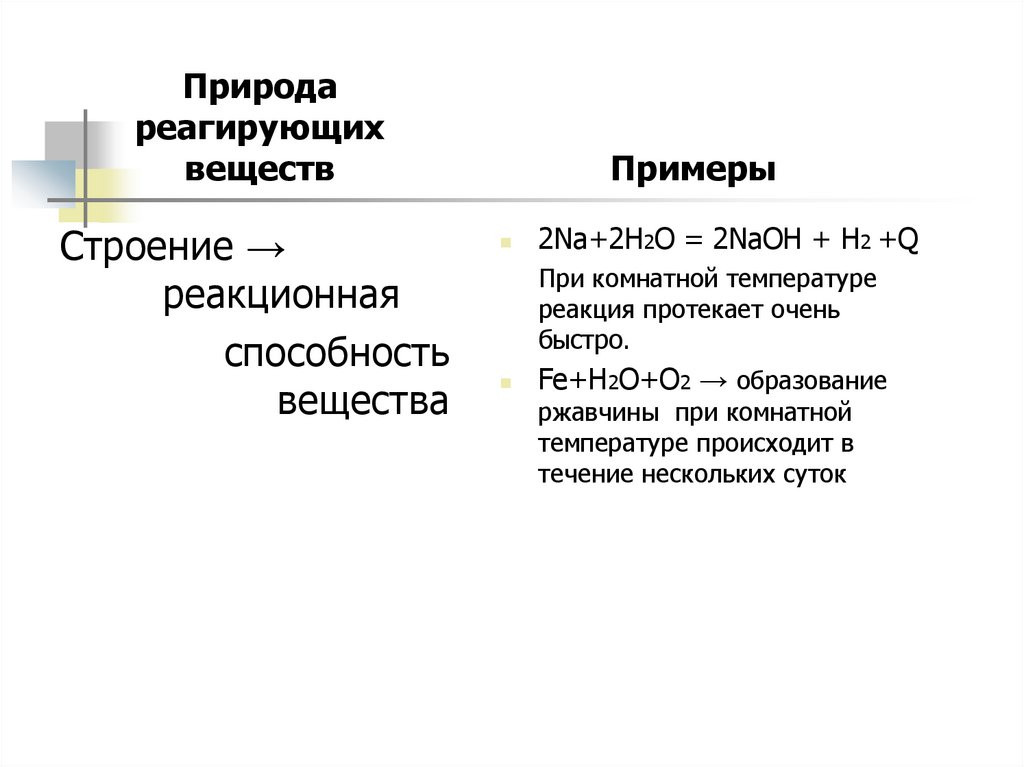
7.
Природареагирующих
веществ
Строение →
реакционная
способность
вещества
Примеры
2Na+2H2O = 2NaOH + H2 +Q
При комнатной температуре
реакция протекает очень
быстро.
Fe+H2O+O2 → образование
ржавчины при комнатной
температуре происходит в
течение нескольких суток
8.
Концентрацияреагирующих
веществ
Скорость химической реакции
прямо пропорциональна
произведению концентраций
реагирующих веществ (для
жидкостей и газов) – закон
действующих масс.
Примеры
S+O2 = SO2+Q
а) горение в воздухе
б) горение в кислороде
va < vb
Zn+2HCl = ZnCl2+H2+Q
а) раствор HCl (1:1)
б) раствор HCl (1:10)
[A], [B] – концентрации
исходных веществ (моль/л).
m, n – коэффициенты в
уравнении реакции
k – константа скорости
va > vb
9.
ТемператураЗависимость скорости от
температуры определяется
правилом Вант–Гоффа (1884):
При повышении температуры
на каждые 10о скорость
реакции возрастает в 2-4 раза
(γ – температурный коэффициент)
Примеры
2H2 + O2 = 2H2O +Q
а) при tо=20oC химическая
реакция практически не идет
б) при tо=500oC эта реакция
протекает за 50 мин.
в) при tо=600oC реакция
происходит мгновенно со
взрывом
10.
Влияние температурыЯкоб Вант-Гофф
(1852-1911)
Правило Вант-Гоффа
При нагревании системы на 10 ˚С скорость реакции возрастает в 2-4 раза
- температурный коэффициент
Вант-Гоффа
v v0
t
10
11.
КатализЙенс Якоб Берцелиус
ввел термин «катализ»
в 1835 г.
Вильгельм Оствальд
1909 г. – Нобелевская премия
«в признание работ по катализу»
Катализатор – вещество, изменяющее скорость реакции,
участвует в промежуточных стадиях реакции,
но не входит в состав продуктов реакции.
2SO2 (г.) + O2 (г.)
2SO3 (г.)
1) 2NO (г.) + O2 (г.) 2NO2 (г.)
2) SO2 (г.) + NO2 (г.) SO3 (г.) + NO (г.)
12.
Механизм разложенияпероксида водорода
2H2O2 = 2H2O + O2
(1) H2O2 = H+ + HO2(2) HO2- + H2O2 = H2O + O2 + OH(3) OH- + H+ = H2O
Посмотрите опыт «Разложение пероксида водорода»
Перейти к теме «катализ»
13.
Особенностиферментативного катализа
Высокая избирательность и
специфичность катализатора
Жесткие требования к условиям
протекания реакций
Классификация ферментов
Оксиредуктазы
Трансферазы
Гидролазы
Лиазы
Изомеразы
Лигазы (синтетазы)













 Химия
Химия








