Похожие презентации:
Разработка газовых и газоконденсатных месторождений. Часть 1
1. Разработка газовых и газоконденсатных месторождений
Самарский ГосударственныйТехнический Университет
2. Состав и классификация природных газов
Основной состав природных газов описывается общей формулойCnH2n+2 , то есть природные газы состоят из углеводородов
гомологического ряда метана. Кроме того, они содержат: азот (N2),
углекислый газ (CO2), сероводород (H2S), инертные газы (гелий, аргон,
криптон, ксенон), ртуть.
Углеводороды, содержащие в молекуле до 4-х атомов углерода – газы (от
CH4 до C4H10).
Углеводороды имеющие пять или более атомов углерода – жидкости
(C5H12+в).
Углеводороды от C18H38+в находятся в твердом состоянии (битумы).
По составу газов определяется тип залежи. Если по данным, полученным
по результатам исследования пробы отношения iC4H10 / nC4H10 1 и
находится в пределах 1,1-4 , то залежь чисто газовая, если 1 (от 0,9 до
1,1), то залежь газоконденсатная, если 1 (от 0,5 до 0,8), то залежь
газонефтяная.
Тяжелые углеводороды в зависимости от Т и P могут быть растворены в
легких углеводородах, либо находиться в жидком состоянии.
Кроме того, природные газы, как правило, насыщены парами воды,
содержание которых зависит от P, Т состава газа и воды.
Самарский
Государственный
2
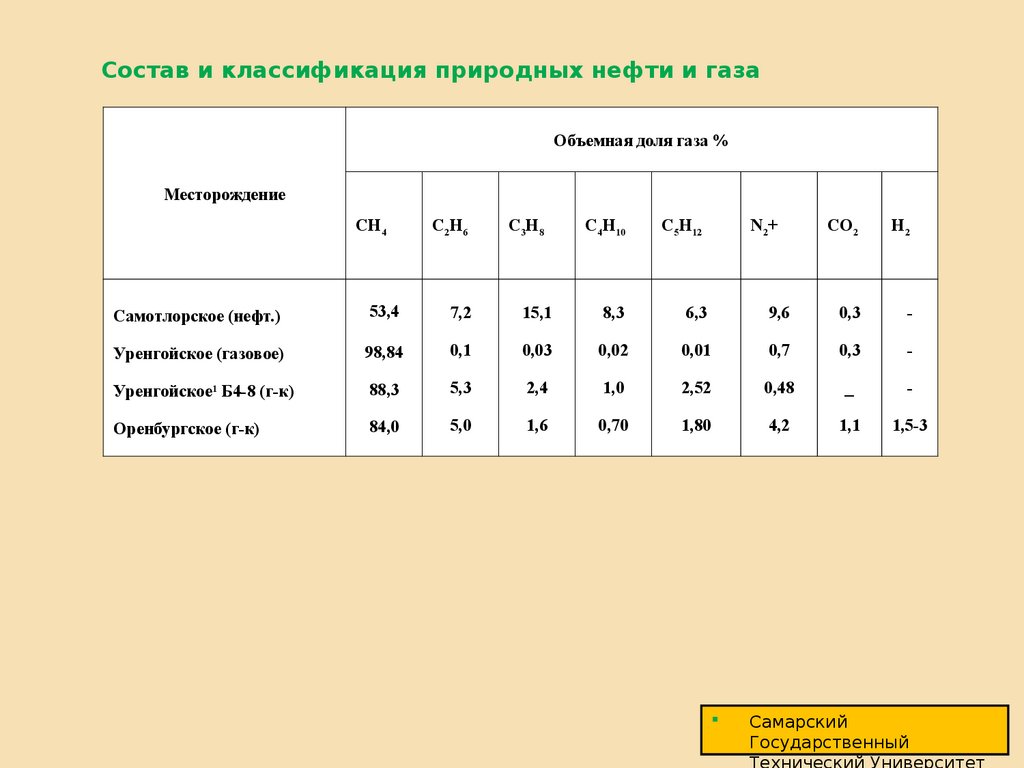
3. Состав и классификация природных нефти и газа
Объемная доля газа %Месторождение
CH4
C2H6
C3H8
C4H10
C5H12
N2+
CO2
H2
Самотлорское (нефт.)
53,4
7,2
15,1
8,3
6,3
9,6
0,3
-
Уренгойское (газовое)
98,84
0,1
0,03
0,02
0,01
0,7
0,3
-
Уренгойское1 Б4-8 (г-к)
88,3
5,3
2,4
1,0
2,52
0,48
_
-
Оренбургское (г-к)
84,0
5,0
1,6
0,70
1,80
4,2
1,1
1,5-3
Самарский
Государственный
4. Состав и классификация природных газов
Природные газы подразделяются на 3 группы:Газы, добываемые из чисто газовых месторождений. Это сухой газ,
свободный от тяжелых углеводородов.
Газы, добываемые вместе с нефтью (попутные). Это смесь сухого газа и
пропан-бутановых фракций.
Газы, добываемые из газоконденсатных месторождений, состоят из
сухого газа и жидкого углеводородного конденсата, который содержит
большое число тяжелых углеводородов.
.
Самарский
Государственный
5. Газоконденсатные месторождения
Газоконденсатные месторождения в зависимости отколичества в пластовой продукции углеводородов
С5+высш. условно подразделяются на следующие
группы по конденсатному фактору:
а) с содержанием до 50 г/м3, см3/м3;
б) с содержанием от 50 до 200 г/м3, см3/м3;
в) с содержанием свыше 200 г/м3, см3/м3
Многие газовые месторождения имеют нефтяную или
конденсатную оторочку.
При снижении давления во время эксплуатации конденсатных
залежей ниже давления насыщения газа конденсатом или
точки росы (Рр) конденсат выпадает из газовой фазы.
Состояние насыщенности газовой смеси конденсатом в процессе
разработки описывается изотермой конденсации.
Изотерму конденсации получают путем исследования
газоконденсатной смеси на бомбе PVT
Самарский
Государственный
6. Состав и свойства природных газов
Молекулярная масса и плотность природных газовГазовые смеси характеризуются массовыми или молярными
концентрациями компонентов.
Объемный (молярный) состав газа можно пересчитать в
массовый, для каждого компонента смеси по формуле:
xM
qi n i i
xi M i
j 1
где
qi – массовая доля i-го компонента в газе;
xi – объемная доля i-го компонента;
Mi – молекулярная масса i-го компонента (определ. из
таблицы).
Объемный состав газовой смеси примерно совпадает с
молярным, так как объемы 1 кмоля идеальных газов при
одинаковых физических условиях (t0,P) по закону Авогадро
имеют одно и то же численное значение, в частности при
нормальных условиях равны 22,41 м3.
Самарский
Государственный
7. Состав и свойства природных газов
Молекулярная масса и плотность природных газовЕсли известен молярный состав смеси, то средняя молекулярная
масса вычисляется по формуле:
x M x M ...x M
M CM 1 1 2 2 n n
100
или Мсм= xi Мi
где
x1 ,x2 – молярные (объемные) концентрации компонентов в %;
M1….Mn – молекулярные массы компонентов.
Если задан массовый состав смеси (в %), то её средняя
молекулярная масса вычисляется по формуле:
100
M СМ
q
q1 q 2
... n
M1 M 2
Mn
где
q1…..qn – массовые концентрации компонентов.
Для характеристики газовой смеси надо знать её молекулярную
массу и среднюю плотность по воздуху.
Самарский
Государственный
8. Состав и свойства природных газов
Молекулярная масса и плотность природных газовПод плотностью понимают отношение массы тела в состоянии покоя
к его объему. Для плотности газов единица измерения в СИ – кг/м3.
Плотность газа или смеси газов см (кг/м3) в нормальных условиях
(0,1033 МПа и 2730 К) можно определить по его молекулярной массе:
СМ
M СМ
22,41
Если плотность задана при нормальных условиях (0,1 МПа или 760
мм рт. ст.), то пересчет её на другое давление (при той же to) для
идеального газа проводится по формуле:
0
1,033
где P – заданное давление.
Относительная плотность газа по воздуху равна:
где
0
в
- плотность воздуха.
0
в
Самарский
Государственный
9. Состав и свойства природных газов
Молекулярная масса и плотность природных газовПлотность газа известного состава (или газовой смеси)
определяется как сумма произведений плотности отдельных
компонентов i на их объемное (молярное) содержание xi:
см= xi i
или по известным молекулярным массам:
M СМ
СМ
22,41
Парциальное давление и парциальный объем компонента
в смеси идеальных газов
Парциальное давление компонента газовой смеси представляет
собой то давление, которое оказывает он один при удалении из
объема, занимаемого смесью, остальных компонентов при
неизменных первоначальных объеме и температуре.
Под парциальным объемом понимают объем, который имел бы
данный компонент смеси газов, если бы из неё были удалены
остальные компоненты, при условии сохранения первоначального
P и to .
Самарский
Государственный
10. Состав и свойства природных газов
Парциальное давление и парциальный объем компонентав смеси идеальных газов
Смесь идеальных газов характеризуется аддитивностью
парциальных давлений и парциальных объемов. Это означает,
что каждый газ в смеси идеальных ведет себя так, как если бы
он в данном объеме был один.
Аддитивность парциальных давлений выражается законом
Дальтона:
P= Pi или Pi = yi P
где
P – общее давление смеси газов;
Pi – парциальное давление i – го компонента в смеси;
yi – мольная доля i – го компонента в смеси.
Или – парциальное давление компонента в смеси идеальных
газов Pi равно произведению его мольной доли в смеси yi на
общее давление смеси газов P.
Самарский
Государственный
11. Состав и свойства природных газов
Парциальное давление и парциальный объем компонентав смеси идеальных газов
Аддитивность парциальных объемов компонента газовой смеси
выражается законом Амага:
V= Vi или Vi = yi V
где:
V – общий объем смеси;
Vi – парциальный объем i – го компонента в смеси.
Или – парциальный объем компонента в смеси идеальных газов
Vi равен произведению его мольной доли в смеси yi на общий
объем смеси газов V.
Самарский
Государственный
12. Аналитические методы расчета физических свойств природных газов
Для определения многих физических свойств природных газовиспользуют законы или уравнение газового состояния.
Такими законами являются аналитические зависимости между
параметрами, описывающими изменение простого или сложного
вещества. В качестве таких параметров используют давление (P),
объем (V) и температуру (T).
Закон – Бойля – Мариотта устанавливает связь между
давлением и объемом газа. Согласно этому закону для данной
массы газа при t =const давление меняется обратно
пропорционально объему, то есть
PV = const
Из уравнения следует, что с увеличением давления увеличивается
плотность газа, а с уменьшением уменьшается, т. е. Плотность
газов суммируется прямо пропорционально давлению (при t =
const , процесс изотермический).
Самарский
Государственный
12
13. Аналитические методы расчета физических свойств природных газов
Закон Гей – Люссака – объем данной массы газа при постоянномP меняется линейно с T, т. е. при постоянном давлении все газы с
повышением t0 на 10K расширяются на 0,003661 часть того объема,
который они занимают при 2730K, т.е. V= 0,003661 · V0T или:
V0 V
const
T0 T
Или при постоянном давлении отношение объема некоторой массы
газа к её абсолютной температуре есть величина постоянная
(изобарический процесс, P = const ).
Закон Шарля показывает, что давление меняется линейно с t0
при постоянном объеме системы (изохорический процесс):
P0 P
const
T0 T
Уравнение взаимозависимости давления газа P, объема V и T
предложили Менделеев и Клайперон.
Самарский
Государственный
13
14. Аналитические методы расчета физических свойств природных газов
Уравнение состояния идеальных газов Менделеева –Клапейрона имеет вид:
PV = GRT ,
где:
P – абсолютное давление, н / м2
V – объем, м3
G – масса вещества, кг
T – абсолютная температура, 0К
R – универсальная газовая постоянная, дж / кг оК (которая зависит от состава
газа).
Для реальных газов уравнение газового состояния имеет вид:
где:
PV=ZGRT ,
Z – коэффициент сверхсжимаемости газа, являющийся функцией давления,
температуры и состава газа.
Самарский
Государственный
14
15. Аналитические методы расчета физических свойств природных газов
Экспериментальная проверка уравнения Менделеева-Клапейрона показала, чтоизменения свойств реальных газов нельзя описать только введением коэффициента Z.
Ван – Дер – Ваальс предложил учесть собственный объем молекул и силы их взаимного
притяжения путем введения дополнительных членов в уравнение Менделеева –
Клайперона:
a
(P
где:
b
V
v
G
v
2
)(V b) RT
– удельный объем газа, м3/кг;
a
v2
– константа сцепления молекул
- поправка на собственный объем молекул, м3/кг.
Па м 6
кг 2
Ван – Дер – Ваальс показал, что поправка “b” равна учетверенному объему молекул.
a
Слагаемое
выражает внутреннее давление, которое является как бы
v2
равнодействующей сил притяжения всех молекул в объеме V. Оно прибавляется к
внешнему давлению. Это уравнение также является приближенным.
На самом деле коэффициенты a и b являются сложными функциями объема,
температуры и формы молекул.
Используя соотношение для критического состояния вещества были получены
значения этих коэффициентов через критическое давление Pкр и критическую
температуру Tкр:
Самарский
Государственный
15
16. Аналитические методы расчета физических свойств природных газов
2a
27Tкр R 2
64 Pкр
2
b
RTкр
8 Pкр
• Критическая температура чистого вещества Tкр это максимальная температура,
при которой жидкая и паровая фазы еще могут сосуществовать в равновесии. При
более высокой температуре существование жидкой фазы невозможно.
• Давление паров при критической температуре называют критическим давлением, а
объем вещества, отнесенный к одному молю или другой единице массы –
критическим удельным объемом.
•На рисунке 1. показана зависимость давления (упругости) насыщенных паров чистых
веществ от t о.
C – критическая точка для
однокомпонентных
систем
характеризуется наивысшими
значениями P и T, при
которых
еще
могут
существовать
обе
фазы
одновременно.
Самарский
Государственный
16
17. Аналитические методы расчета физических свойств природных газов
Приведенными параметрами индивидуальных компонентов называют безразмерныевеличины, показывающие во сколько раз действительные параметры состояния газа
больше или меньше критических.
P
Pпр
Pкр
T
Tпр
Tкр
V
Vпр
Vкр
Z пр
Z PT
Z кр
пр
PT
кр
•Реальные газы являются физическими смесями большого числа углеводородных и
неуглеводородных компонентов.
•Для природных газов, которые являются смесью углеводородных и неуглеводородных
компонентов, критические параметры определяют как псевдокритические по составу
газа.
Pп.кр = хiPкрi
Тп.кр = хiТкрi
•Приведенные параметры многокомпонентного газа определяются как отношения
заданных параметров к их псевдокритическим значениям.
Самарский
Государственный
17
18.
Аналитические методы расчета физическихсвойств природных газов
•Силы притяжения молекул различных веществ различны и действует в разных
направлениях.
•Для учета нецентричных сил вводится ацентрический фактор , который может быть
определен по формуле Эдмистера:
Pкр i
lq
3
PAT
1
i
7 Tкрi
1
T
КИП
•Где:
i – ацентрический фактор i – го компонента в смеси;
PАТ – атмосферное давление;
TКИП – t0 кипения компонента при атмосферном давлении
19. Аналитические методы расчета физических свойств природных газов
•Ацентрический фактор является третьим параметром (после приведенного давленияРпр и приведенной температуры Тпр) , оценивающим меру отношения коэффициента
сжимаемости Z природных газов, определяемого по теореме газовых состояний, т. е.
Z=Z(Pпр, Tпр, )
•При наличии неуглеводородных компонентов в составе газа (N2, CO2, H2S) следует
вводить поправку в расчетное значение Z по правилу аддитивности:
(например азота):
Z=ya Za + (1-ya)Zy
•где:
ya – мольная доля азота в смеси газов,
Za , Zy – коэффициенты сжимаемости азота и углеводородной части смеси газов.
• При решении задач, связанных с добычей, с транспортом, хранением и
переработкой природных газов, наиболее употребимо уравнение состояния Редлиха
– Кванга:
(P
a
)(V в ) RT
T 0,5 v(V в )
Самарский
Государственный
19
20. Аналитические методы расчета физических свойств природных газов
•Коэффициент сверхсжимаемости преобразуют из этого уравнения в следующем виде:Z3 – Z2 + Z (a2 +в2p - в)p – a2bвp2 = 0,
где:
a 0 ,4278
Tкр
0 , 25
Pкр T
2 ,5
в 0 ,0867
Tкр
PкрT
•Уравнение состояния Пенга – Робинсона широко используется для расчетов,
позволяет
наиболее
точно
определить
термодинамические
свойства
газожидкостных систем.
P
RT
a (T )
V в V (V в ) в (V в )
Z3 – (1-B)Z2 + (A - 3B2 - 2B)Z – (AB – B2 – B3)=0,
Где:
A
a (T ) P
R 2T 2
B
вP
RT
Самарский
Государственный
20
21. Определение физико-химических свойств природных газов
Определение плотности природного газа и насыщенного углеводородногоконденсата
Плотность природного газа может быть определена по формуле:
P1 T P0 T0
PT0
ZP0T
PV= GRTz ;
PV
R f ( 0 0)
GT0
P V VRTz
;
P
RTz
Самарский
Государственный
21
22. Определение физико-химических свойств природных газов
Определение плотности природного газа и насыщенного углеводородногоконденсата
Плотность насыщенного углеводородного конденсата определяется 2 способами:
1. Графоаналитический метод Катца и Стендинга заключается в следующем:
Сначала определяется плотность жидкости при стандартных условиях:
P T
0
0= xi i
0
xM
xM
i
i
i
i
i
Где:
xi, Mi , i – мольная доля, молекулярная масса и плотность i – го компонента
соответственно.
Далее определяются поправки к вычисляемой плотности при стандартных условиях –
на давление p и температуру - T (по графикам). Плотность насыщенной
жидкости (или конденсата) при заданном давлении и температуре определяется как:
P T P T P T
1
0 0
Самарский
Государственный
22
23. Определение физико-химических свойств природных газов
Определение плотности природного газа и насыщенного углеводородногоконденсата
2. Аналитический метод (универсальный). Расчет ведется по приведенным параметрам.
Основан на корреляционной зависимости плотности пр от среднекритического
коэффициента сверхсжимаемости Zск .
n
PT
1
( x1 M i ) пр
i 1
xV
i
крi
пр P T
кр
1
где:
пр – приведенная плотность;
Vкрi – критический молярный объем i – го компонента в смеси.
Приведенную плотность можно рассчитать по формуле Викса:
пр = 1,20 + (5,563 – 11,03Zск)(1-Tпр) 0,8 Zск +0,310
где:
Zск – среднекритический коэффициент сжимаемости жидкой смеси;
Tпр – приведенная температура насыщенной жидкости
Zск = xi Zкрi
Zкрi – критический коэффициент сжимаемости i – го компонента
Самарский
Государственный
23
24. Определение физико-химических свойств природных газов
Определение плотности природного газа и насыщенного углеводородногоконденсата
Его определяют из таблиц или по формуле Ганна и Ямады :
Zкрi = 0,2918 – 0,0928 i ,
i – ацентрический фактор.
Критический молярный объем i–го компонента определяется из формулы:
Vкрi
Z крi RTкрi
Pкрi
Самарский
Государственный
24
25. Определение физико-химических свойств природных газов
СамарскийГосударственный
25
26. Аналитические методы расчета физических свойств природных газов
Вязкость природных газов• Вязкостью называют свойство жидкостей и газов, характеризующее сопротивляемость
скольжению или сдвигу одной их части относительно другой. Количественно вязкость
характеризуется коэффициентом динамической вязкости .
•Вязкость углеводородных газов зависит от T и P. Вязкость входит во многие
гидродинамические расчеты.
•Согласно закону Ньютона сила внутреннего трения (F), проявляющаяся при
перемещении одного слоя жидкости или газа относительно другого, прямо
пропорциональна графику относительной скорости перемещения и площади
соприкосновения слоев:
F S
где:
- коэффициент динамической вязкости;
S
dW
dx
- площадь параллельно перемещающихся слоев;
dW - градиент скорости, в направлении перпендикулярном к плотности
dx соприкосновения слоев.
н с
В системе СИ вязкость выражается в
и называются паскаль – секунда (Па·с).
м2
Можно выражать вязкость и через дин·с/см2. Эта единица называется пуазом.
(1 Па·с = 10 пуазам). Наиболее распространен сантипуаз (сП). 1 Пуаз = 100сПуазам.
Самарский
Государственный
26
27. Аналитические методы расчета физических свойств природных газов
Вязкость природных газовИногда в расчетах пользуются коэффициентом кинематической вязкости:
В системе СИ – м2/с
В системе СГС – см2/с – стокс.
Коэффициент динамической вязкости природных газов можно рассчитать по
приведенным параметрам. Для природных газов коэффициент динамической вязкости
при Pат и различных температурах можно рассчитать по формуле:
1 ( Pат ) 0 0,0101t 1/ 8 1,07 10 3 Mсм1/ 2
где Мсм молекулярная масса смеси газов.
При давлениях более P 5мПа коэффициент динамической вязкости газа при заданных
P и T можно рассчитать по формуле:
Р Т ат
10 ,8 10 ( e
5
1 ,439 пр
где: ПР - приведенная плотность.
пр
кр
)
1
Р1Т
e
1 ,111 пр1 , 857
Tкр
M см
1/ 6
1/ 2
Pкр
2/3
Самарский
Государственный
27
28. Аналитические методы расчета физических свойств природных газов
Вязкость природных газовПри содержании в природном газе более 5% (объемных) азота или других
неуглеродных компонентов следует учитывать его влияние на вязкость газа по правилу
аддитивности:
см ya a (1 ya ) y
ya – мольная доля азота в составе смеси;
а , у
– коэффициенты динамической вязкости азота и углеводородной части смеси
газов.
• Для определения коэффициента динамической вязкости смеси газов неизвестного
состава, но известной относительной плотности его по воздуху используют номограмму
С. Г. Ибрагимова.
• Вязкость газов с ростом их молекулярной массы уменьшается, а жидкостей – растет.
Самарский
Государственный
28
29. Аналитические методы расчета физических свойств природных газов
см ya a (1 ya ) yСамарский
Государственный
29
30. Аналитические методы расчета физических свойств природных газов
Определение изобарной молярной теплоемкостиприродных газов
Теплоемкость газонефтяной смеси зависит от давления, температуры и количества
вещества (газа). Различают изобарную CP и изохорную CV
удельные
теплоемкости.
Удельной теплоемкостью называется то количество теплоты, которое надо подвести
к единице массы вещества, чтобы изменить его температуру на один градус.
С P (
Q
)P
T
CV (
Q
)V
T
Согласно первому началу термодинамики изменение количества теплоты можно
определить по формуле:
где:
Q – количество теплоты,
V – объем системы,
i – энтальпия.
dQ d i Vdp
Самарский
Государственный
30
31. Аналитические методы расчета физических свойств природных газов
Определение изобарной молярной теплоемкостиприродных газов
Энтальпия – это скрытая теплота парообразования для чистых веществ или энергия
необходимая для испарения единицы вещества при постоянных P и T.
В изобарном процессе (P=const) изменение количества теплоты системы равно
изменению её энтальпии:
dQ d i C p dT
Или
C p (
di
)Р
dT
то есть изобарная молярная теплоемкость идеальных газов зависит от температуры.
Изобарная молярная теплоемкость идеальных газов определяется по правилу
аддитивности:
С Pсм yi C Pi
где:
yi – молярная доля i-го компонента в смеси;
Cpi – изобарная молярная теплоемкость i-го компонента.
Самарский
Государственный
31
32. Аналитические методы расчета физических свойств природных газов
Определение изобарной молярной теплоемкостиприродных газов
Изобарная теплоемкость природных газов в реальных условиях зависит как от T, так и
от P и определяются по формуле:
0
C P C Pсм
C P
где:
0
- изобарная теплоемкость газа при атмосферном давлении и заданной T;
С Pсм
СP - поправка на давление (по специальным графикам).
Величина С P определяется по формуле (или по графикам):
С P0 i Ei nFi n 2 Gi n 3 H i
Ni
n
где:
Е, F, G, H, N – коэффициенты определяемые для каждого компонента по таблицам;
T
n
100
Поправка на давление определяется в зависимости от состава газа по приведенным
параметрам Pпр , Tпр .
Самарский
Государственный
32
33. Аналитические методы расчета физических свойств природных газов
0C P C Pсм
C P
С P0 i Ei nFi n 2 Gi n 3 H i
Ni
n
Самарский
Государственный
33
34. Аналитические методы расчета физических свойств природных газов
Дросселирование газаКоэффициент Джоуля – Томпсона
При прохождении газа через суженные участки он преодолевает местные
гидравлические сопротивления, которые сопровождаются изменением температуры. Это
так называемый эффект дросселирования.
Дросселирование – термодинамический процесс, характеризующийся постоянством
энтальпии (i = const).
В процессе дросселирования реального природного газа при его движении через штуцер,
задвижки и т.д. уменьшается температура газа. При этом образуются твердые
соединения углеводородов с водой – гидраты.
Изменение температуры газов при адиабатическом расширении называется эффектом
Джоуля – Томпсона.
Адиабатическими называют процессы, проходящие в энергетически изолированной
систем тел, т.е. без обмена теплотой или работой с окружающей средой.
Изменение температуры при снижении давления на 1кГ с/см2 называется
коэффициентом Джоуля – Томпсона.
Коэффициент Джоуля – Томпсона для природных газов определяется по формуле:
Di
где:
Tкр f ( Di )
Pкр С р
С р - изобарная теплоемкость ккал/кг· моль0С;
f ( Di ) – функция Джоуля – Томпсона, определяется по приведенным параметрам;
Tкр Pкр
– определяются для смеси газов как псевдокритические.
Самарский
Государственный
34
35. Аналитические методы расчета физических свойств природных газов
DiTкр f ( Di )
Pкр С р
Самарский
Государственный
35
36. Аналитические методы расчета физических свойств природных газов
Упругость насыщенных паров•Упругость или давление насыщенных паров характеризует сопротивление изменению
объема газа при изменении давления и создается тепловым движением молекул
вещества в газовой фазе при определенной температуре.
• Давление или упругость насыщенных паров чистого вещества – функция t0 .
•При повышении температуры жидкости – упругость увеличивается за счет перехода
части жидкости в парообразное состояние. С переходом всей жидкости в парообразное
состояние давление повышается за счет объемного расширения газа.
• Благодаря тепловому движению молекул газ оказывает давление на стенки
заключающего его сосуда. Молекулы газа, сталкиваясь со стенками сосуда, передают им
некоторый импульс, изменение которого определяет действующую силу.
• Если отнести силу, действующую со стороны газа (или жидкости), к единице
поверхности стенки, то получим давление P, оказываемое на стенки сосуда – упругость
данного газа, измеряющегося в МПа или кГ·с/см2.
•Если углеводороды находятся в смеси, то общее давление смеси влияет на упругость
паров каждого компонента. Как правило, упругость паров компонента повышается с
увеличением общего давления. Это влияние мало при низких давлениях, но сильно
возрастает при высоких. У индивидуального углеводорода в чистом виде упругость есть
функция только t0 , а у смеси еще и общего давления т. е.
Q f (t , Pсм)
Самарский
Государственный
36
37. Аналитические методы расчета физических свойств природных газов
Аналитические методы расчета физическихУпругость насыщенных паров
свойств природных газов
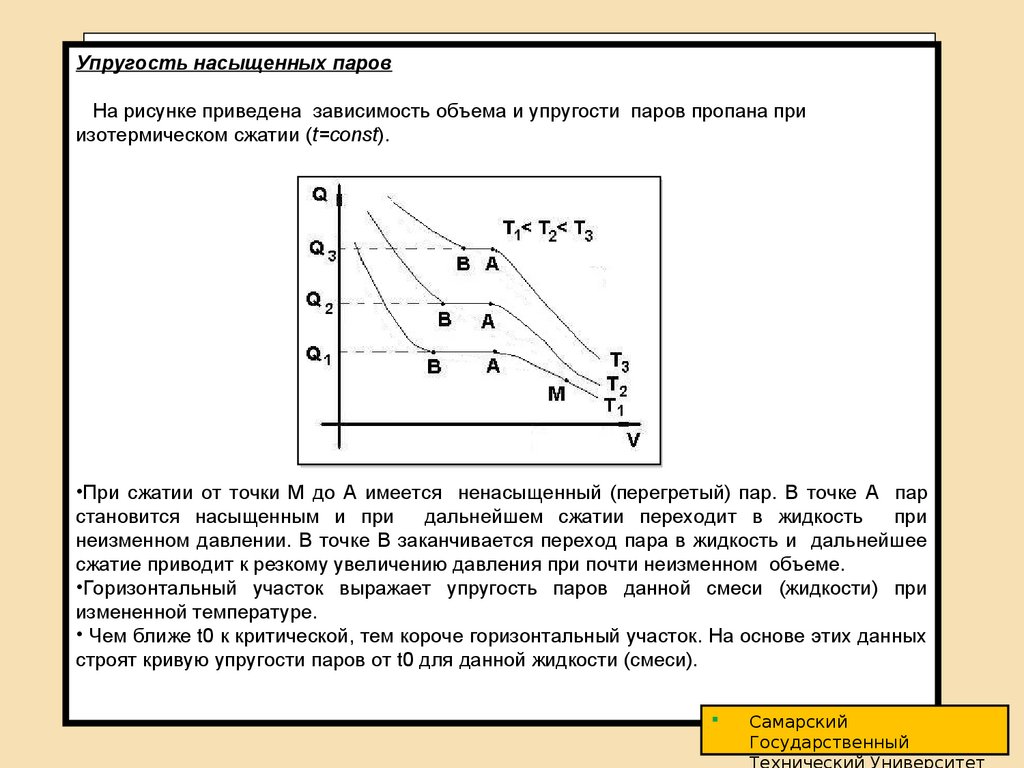
На рисунке приведена зависимость объема и упругости паров пропана при
изотермическом сжатии (t=const).
•При сжатии от точки М до A имеется ненасыщенный (перегретый) пар. В точке A пар
становится насыщенным и при
дальнейшем сжатии переходит в жидкость
при
неизменном давлении. В точке B заканчивается переход пара в жидкость и дальнейшее
сжатие приводит к резкому увеличению давления при почти неизменном объеме.
•Горизонтальный участок выражает упругость паров данной смеси (жидкости) при
измененной температуре.
• Чем ближе t0 к критической, тем короче горизонтальный участок. На основе этих данных
строят кривую упругости паров от t0 для данной жидкости (смеси).
Самарский
Государственный
37
38. Аналитические методы расчета физических свойств природных газов
Упругость насыщенных паров•На основе этих данных строят кривую упругости паров от t0 для данной жидкости
(смеси).
•Для смеси углеводородов взаимосвязаны
три переменные: давление смеси Pсм
(определяемая по ее составу), t0 и упругость паров. В этом случае вводится константа
равновесия, К представляющая отношение упругости паров индивидуального
углеводорода Q к давлению смеси Pсм.
K
Q
Pсм
Самарский
Государственный
38
39. Аналитические методы расчета физических свойств природных газов
Упругость насыщенных паров•Упругость паров жидкой смеси определяется по закону Рауля и зависит от упругости
паров каждого компонента и их молярных концентраций. Парциальное давление каждого
компонента определяется как произведение его молярной концентрации на упругость
паров в чистом виде Pi = xi Qi .
• Сумма же парциальных давлений компонентов равна общему давлению над смесью
P P1 P2 .... Pn x1Q1 x2Q2 ....xnQn
P xi Qi
Самарский
Государственный
39
40. Аналитические методы расчета физических свойств природных газов
Константы фазовых равновесий• Константой фазовых равновесий или распределение i – го компонента в паровую и
жидкую фазы Ki , называют отношение мольной доли i –го компонента в паровой фазе yi
к мольной доле его в жидкой фазе xi :
y
Ki i
xi
•Константа фазового равновесия может быть определена экспериментально и расчетным
путем. Первый способ требует больших затрат времени, полученные константы
равновесия нельзя использовать для другого состава исходной смеси.
• Расчетный метод состоит в использовании уравнений газового состояния реальных
газов для определения летучести компонентов. Понятие летучести введено Льюисом.
Летучесть представляет собой “исправленное” давление, после подстановки которого в
уравнение для идеальных газов, они становятся пригодны для описания свойств
реальных газов.
•Для идеального однокомпонентного газа летучесть равна давлению, а для смеси
идеальных газов – парциальному давлению компонента, т.е. летучесть:
f i yi P
•Приближенно летучесть f = произведению коэффициента сжимаемости Z на давление
паров смеси P:
f zP
Самарский
Государственный
40
41. Аналитические методы расчета физических свойств природных газов
Константы фазовых равновесий•Летучесть i – го компонента в равновесных паровой и жидкой фазах многокомпонентной
смеси можно определить из уравнений:
f iг
1 р
RT
ln
(
V
)dP
iг
yi P RT р
P
р
fiж
1
ln
(Viж Viж 0 )dP
xi f iж 0 RT р
о
о
.
•где:
f iг f iж - летучести компонентов в паровой и жидкой фазах;
P - давление смеси газов;
f iж
- летучесть чистого компонента при t0 смеси;
•, V
iг Viж
- молярные объемы i – го компонента в паровой и жидкой фазах;
V
iж0 молярный объем i – го компонента в чистом виде при P и T.
0
f ia
• Отношение y P в термодинамике фазовых превращений называется коэффициентом
i
f iж - коэффициентом активности
летучести i , а отношение
. i .
xi f iж
0
•Константу фазовых равновесий определяют как отношение летучести компонента в
паровой фазе к его летучести в жидкой фазе:
K iп
i
iж
Самарский
Государственный
41
42. Аналитические методы расчета физических свойств природных газов
Уравнения фазовых концентрацийРассмотрим многокомпонентную смесь заданного состава, находящуюся в сосуде в
двухфазном состоянии. Температура и масса поддерживаются постоянными. Давление
смеси меняется только за счет изменения объема.
Процесс изменения соотношения между фазами и переход компонентов смеси из одной
фазы в другую при постоянной массе и составе смеси и изотермическом изменении
давления называется контактной конденсацией или контактным испарением.
Общее число молей исходной смеси N , находящееся в данной емкости равно числу
молей паровой Nп и жидкой Nж фаз при давлении P и температуре t, т.е.:
Число молей i – го компонента распределяется между фазами следующим образом:
.
(1)
где:
- мольные доли i – го компонета в исходной смеси, паровой и жидкой фазах.
Преобразуя формулу (1) и используя константу
равновесия можно получить:
(2)
(3),
Самарский
Государственный
42
43. Аналитические методы расчета физических свойств природных газов
Уравнения фазовых концентрацийУравнения (2) и (3) называют уравнениями фазовых концентраций компонентов смеси .
(Они позволяют определить концентрацию компонентов в фазах) Это фундаментальные
уравнения термодинамики фазовых равновесий многокомпонентных смесей. Они лежат в
основе расчета парожидкостного равновесия природных нефтяных и газоконденсатных
смесей.
Где:
N
- мольная доля паровой фазы;
V n
.
N
y
K i i - константа равновесия.
xi
Самарский
Государственный
43
44. Аналитические методы расчета физических свойств природных газов
Влажность природных газов.
Природный газ в пластовых условиях насыщен парами воды. Пары воды при
движении газа могут конденсироваться, скапливаться в газопроводах и
аппаратах. Вода, соединяясь с кислыми газами, способствует интенсивной
коррозии оборудования. Кроме того, при определенных давлениях и
температурах образуются твердые соединения конденсационной воды с
углеводородами – гидраты, которые образуют гидратные пробки.
Содержание влаги в газе характеризуется абсолютной или относительной
влажностью.
Абсолютной влажностью W называется содержание водяных паров в единице
объема газа. Абсолютная влажность измеряется в г/м3 или кГ/1000м3.
Относительная влажность Wо – это отношение – это отношение
фактического содержание паров воды в единице объема газа при данных P и t к
количеству водяных паров, которые могли бы содержаться в единице объема
газа при условиях насыщения (называемого влагоемкостью).
Относительная влажность измеряется в долях или % (относительная влажность
насыщения парами воды газа равна 100%).
Самарский
Государственный
44
45. Аналитические методы расчета физических свойств природных газов
Влагосодержание природных газов зависит от P, t0 , состава газа и воды, вконтакте с которой находится газ, а также от характеристики пористой среды, в
которой он содержится.
Влагосодержание природного газа с относительной плотностью 0,6
определяется по номограмме вида:
.
Влажность газа с относительной плотностью выше 0,6 , находящуюся в контакте
с соленой водой, определяют из выражения:
где:
- влажность газа определяется по графику;
- поправочный коэффициент, учитывающей влияние солености воды;
- поправочный коэффициент, учитывающей влияние состава газа.
Самарский
Государственный
45
46. Аналитические методы расчета физических свойств природных газов
Наличие в газе неуглеводородных компонентов оказывает различное по величине изнаку влияние на влагосодержание газов. Так наличие азота в газе снижает, а
наличие углекислого газа и сероводорода повышает влажность природного газа.
Поэтому при наличии неуглеводородных компонентов номограмму можно
использовать только для оценочных расчетов.
Для аналитических расчетов влагосодержания используется формула:
.
A – коэффициент равный влагосодержанию идеального газа при заданной T;
P – заданное давление; (кГс/см2);
B – коэффициент, зависящей от состава газа.
Коэффициенты A и B в зависимости от t0 приведены в специальных таблицах.
где
- упругость водяных паров при заданной t0,
- молекулярная масса паров воды.
Самарский
Государственный
46












































 Промышленность
Промышленность








