Похожие презентации:
Карбоновые кислоты
1.
Карбоновыекислоты
2.
Карбоновые кислоты – это органическиевещества, содержащие одну или несколько
карбоксильных групп – СООН, соединенных с
углеводородным радикалом.
O
R–C
или R – COOH общие фор-лы
OH
Н – СООН – муравьиная (метановая)
СН3 – СООН – уксусная (этановая)
С2Н5 – СООН – пропионовая (пропановая)
С3Н7 – СООН – масляная (бутановая)
С4Н9 – СООН – валериановая (пентановая)
С5Н11 – СООН – капроновая (гексановая)
3.
Высшие карбоновые кислотыС15Н31 – СООН – пальмитиновая
С16Н33 – СООН – маргариновая
С17Н35 – СООН - стеариновая
4.
Классификация карбоновых кислот1) По количеству карбоксильных групп:
а) одноосновные
б) многоосновные
2) По радикалу:
а) предельные
б) непредельные
в) ароматические
5.
Физические свойстваС1 - С8 – жидкости с резкими запахами,
хорошо растворимы в воде.
С увеличением молекулярной массы
растворимость кислот уменьшается.
С9 … - твердые вещества, без запаха, в
воде не растворяются.
6.
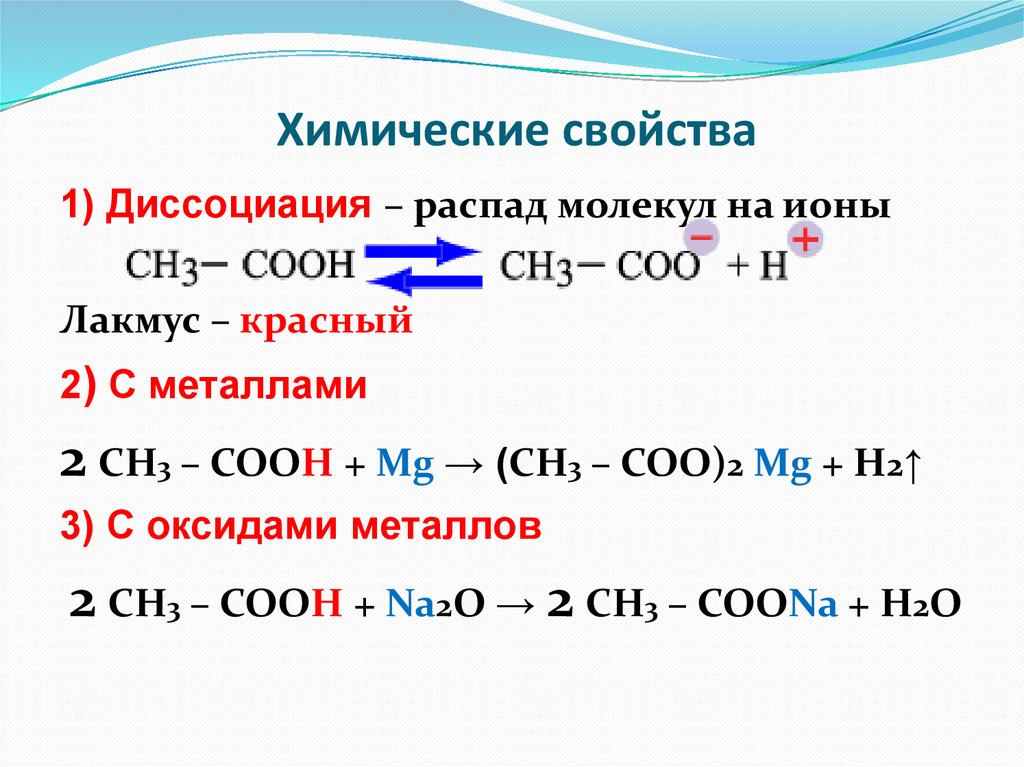
Химические свойства1) Диссоциация – распад молекул на ионы
Лакмус – красный
2) С металлами
2 СН3 – СООН + Mg → (СН3 – СОО)2 Mg + H2↑
3) C оксидами металлов
2 СН3 – СООН + Na2O → 2 СН3 – СООNa + H2O
7.
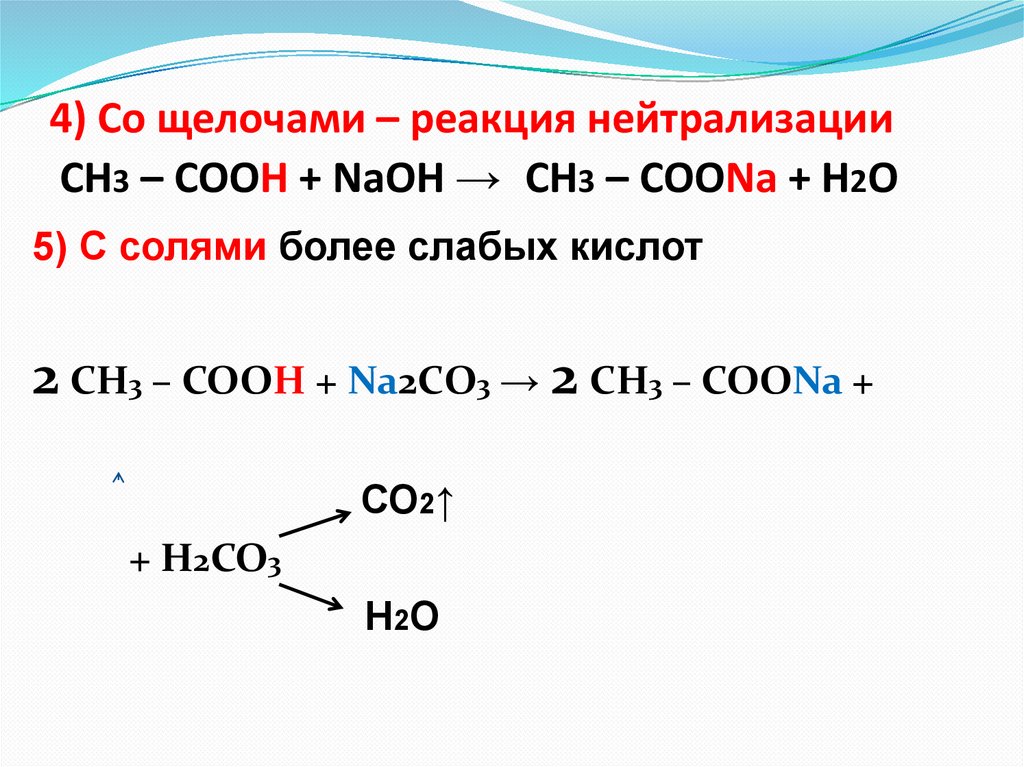
4) Cо щелочами – реакция нейтрализацииСН3 – СООН + NaOН → СН3 – СООNa + H2O
5) С солями более слабых кислот
2 СН3 – СООН + Na2СO3 → 2 СН3 – СООNa +
СО2↑
+ Н2СО3
Н2О
8.
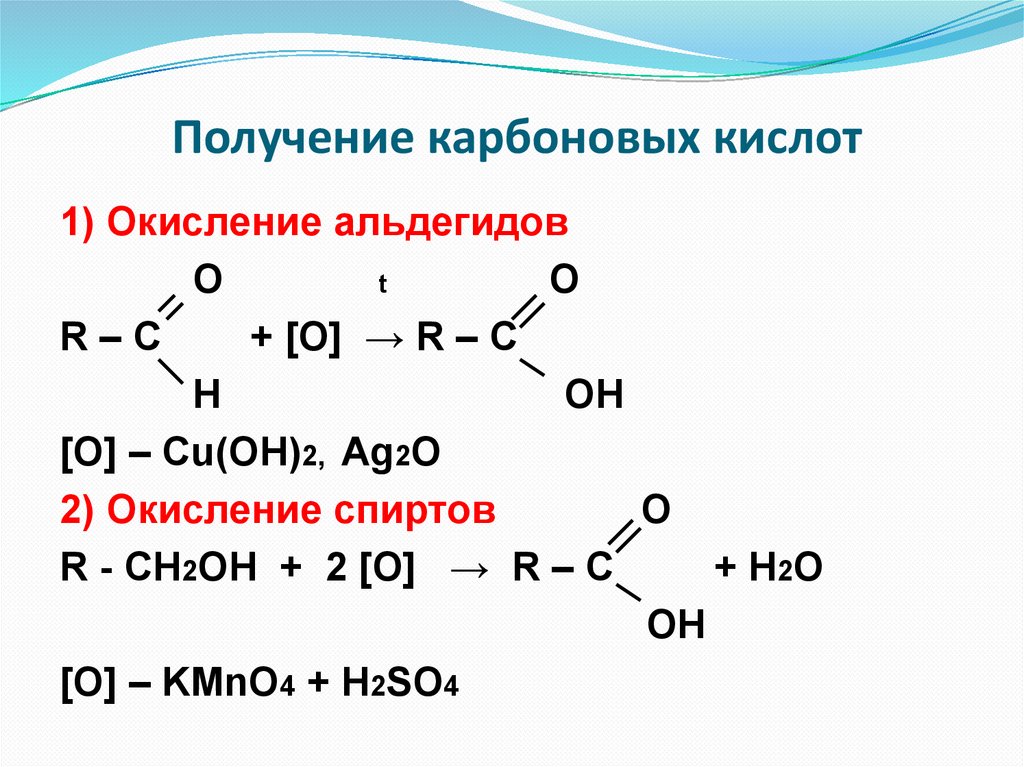
Получение карбоновых кислот1) Окисление альдегидов
O
t
O
R–C
+ [O] → R – C
H
OH
[O] – Cu(OH)2, Ag2O
2) Окисление спиртов
O
R - CH2OH + 2 [O] → R – C
+ H2O
OH
[O] – KMnO4 + H2SO4
9.
Жесткость водыэто количество ионов кальция и магния,
содержащихся в воде.
Если концентрация ионов:
< 4 мг/л – мягкая вода
4 – 8 мг/л – средней жесткости
> 8 мг/л - жесткая
10.
Мыло – это натриевая сольпальмитиновой кислоты - С15Н31 – СООNa
1. Взаимодействие мыла с соляной кислотой
С15Н31 – СООNa + HCI
С15Н31 – СООH↓ + NaCI
белый, крупяной осадок
2. Поведение мыла в жесткой воде – мыло
сворачивается и теряет мылящую способность
2С15Н31 – СООNa + CaCI2
(С15Н31 – СОО)2Ca ↓ + 2 NaCI
11.
Отдельные представителикарбоновых кислот
12.
Масляная кислота СН3 - СН2 - СН2 - СООНсообщает прогорклому маслу его типичный запах, её
эфиры содержатся в коровьем масле и нефти.
Эфиры масляной кислоты применяют как
душистые вещества, пластификаторы,
эмульгаторы.
13.
Среди изомеров валериановой кислоты наибольшеезначение имеет 3-метилбутановая кислота
(изовалериановая кислота) СН3-СH(СН3)-СН2-СООН,
которую получают из валерианового корня или
синтетически. Она применяется для синтеза
лекарственных веществ: валидола, бромурала и др. В
пищевой промышленности используют изоамиловый
эфир изовалериановой кислоты (яблочная эссенция).
14.
Капроноваякислота
CH3(CH2)4COOH входит в состав
козьего жира (от латинского caper—
коза). Это бесцветная маслянистая
жидкость с неприятным запахом. В
природе
капроновая
кислота
находится в различных животных
жирах. Многие эфиры капроновой
кислоты
обладают фруктовым
запахом и применяются в качестве
эссенций.
15.
Называется так потому,что была выделена из
так называемого
винного камня. Помимо
винограда
виннокаменная кислота
содержится во многих
фруктах. Также
используется при
изготовлении
лимонадов, печенья, и
при окрашивании
тканей.
16.
• Щавелевая кислота –НООССООН. Бесцветное
вещество в виде кристаллов.
Содержится в щавеле,
ревене, шпинате, клевере и
помидорах.
Применяется в текстильной
промышленности,
органическом
синтезе, для отчистки
металлов от ржавчины и
накипи.
17.
Впервые лимонная кислотабыла выделена в 1784 году из
сока недозрелых лимонов
шведским аптекарем Карлом
Шееле.
Лимонная кислота
содержится не только в
лимонах, но и в землянике,
смородине, ананасах и
других фруктах. Чаще всего
ее используют как вкусовое
вещество в кондитерских
изделиях и напитках. Для
выведения пятен от чернил и
ржавчины на белье.
18.
Была открыта в 1780 г. Шведскимхимиком-фармацевтом К. Шееле.
Она содержится в квашеной
капусте, соленых огурцах,
образуется при созревании сыра.
Она есть везде, где есть сахар.
Молочную кислоту применяют в
текстильном производстве и
кожевенной промышленности,
ветеринарии, кондитерской
промышленности. Молочная
кислота – консервант, т. е. ее
добавка предохраняет продукты от
порчи.
19.
Впервые получена в XVII векеперегонкой янтаря.
Содержится недозрелых
фруктах и буром угле.
Используется, как
лекарственное средство, для
получения пластмасс, смол,
в пищевой промышленности
используется в качестве
пищевой добавки E363.
20.
Стеариновая кислота былаоткрыта в свином сале в 1816
году французским химиком
Шеврелем.
Стеариновая кислота — главная
составная часть многих жиров и
масел, из которых её выделяют
гидролизом. Соли стеариновой
кислоты — составная часть мыл.
Пальмитиновую кислоту
используют в производстве
стеарина (свечи), моющих и
косметических средств,
смазочных масел и
пластификаторов.
Пальмитат кальция используют
в качестве компонента составов
для удаления воды из тканей,
кожи, дерева, эмульгатора в
косметических препаратах.
21.
Применяют в медицине при кожныхзаболеваниях как наружное
антисептическое, противогрибковое
средства, а её натриевую соль – как
отхаркивающее средство. Кроме того,
бензойную кислоту и её соли
используют при консервировании
пищевых продуктов (пищевые добавки
E210, E211, E212, E213). Эфиры
бензойной кислоты (от метилового до
амилового) обладают сильным запахом
и применяются в парфюмерной
промышленности. Некоторые другие
производные бензойной кислоты,
широко применяются для синтеза
красителей.
22.
Аскорбиновая кислота (витамин С)является одним из самых ценных
веществ, содержащихся в плодах.
Одним из наиболее необходимых
веществ для устойчивости организма
к простудным заболеваниям.
Аскорбиновая кислота влияет на
образование соединительной ткани,
красных кровяных телец, она
ускоряет всасывание железа и
предохраняет другие витамины от
окисления. Суточная норма,
рекомендуемая для потребления
аскорбиновой кислоты – 60 мг.
23.
Применение муравьиной кислоты1. В пчеловодстве
24.
2. В медицине(муравьиный спирт)
25.
3. Душистые вещества26.
4. Растворители27.
Применение уксусной кислоты1. Пищевая промышленность
28.
2. Жаропонижающие средства29.
3. Искусственный шёлк30.
4. Растворители для лаков31.
5. Средства борьбы с вредителямии болезнями растений































 Химия
Химия








