Похожие презентации:
Карбонільні сполуки
1. Карбонільні сполуки
12.
Історія винайденняAlkohol dehydrogenatus
К. Шееле
А.Фуркруа
І.В. Деберейнер
Ю. Лібіх
Л.Воклен
2
3.
Карбонільні сполукиСn H2nO
Органічні сполуки в молекулах яких є
карбонільна група С=O
Альдегіди
Кетони
містять в молекулі
карбонільну групу у
вигляді
містять в молекулі
карбонільну групу у
вигляді
R –С – Н
R –С – R
║
O
║
O
3
4.
Карбонільні сполукиоксосполуки
Кетони
Альдегіди
Аліфатичні
Етаналь
Проп-2-он
Аліциклічні
Циклогексанметаналь
Ароматичні
4
бензметаналь
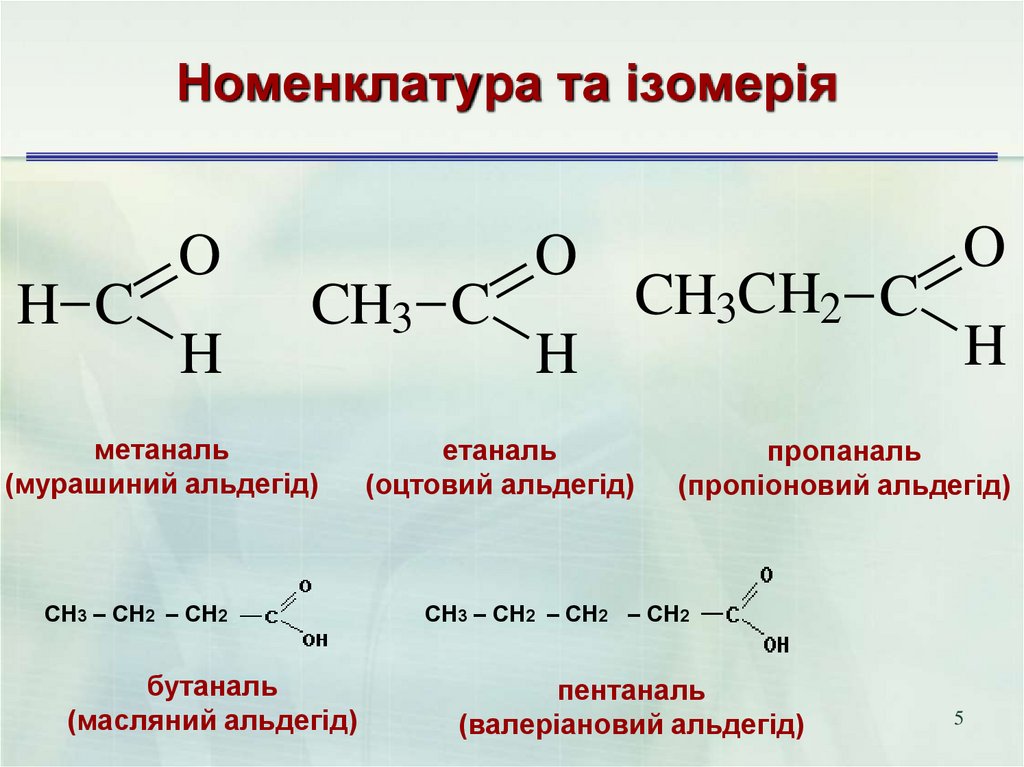
5. Номенклатура та ізомерія
H CO
H
CH3 C
метаналь
(мурашиний альдегід)
СН3 – СН2 – СН2
бутаналь
(масляний альдегід)
O
H
етаналь
(оцтовий альдегід)
CH3CH2 C
O
H
пропаналь
(пропіоновий альдегід)
СН3 – СН2 – СН2 – СН2
пентаналь
(валеріановий альдегід)
5
6. Номенклатура та ізомерія
OO
CH3 C CH3
CH3CH2 C CH3
Пропан-2-он,
(ацетон)
Бутан-2-он
(метилетилкетон)
6
7. Номенклатура та ізомерія
Види ізомерії:1. Структурна
2. Міжвидова
7
8.
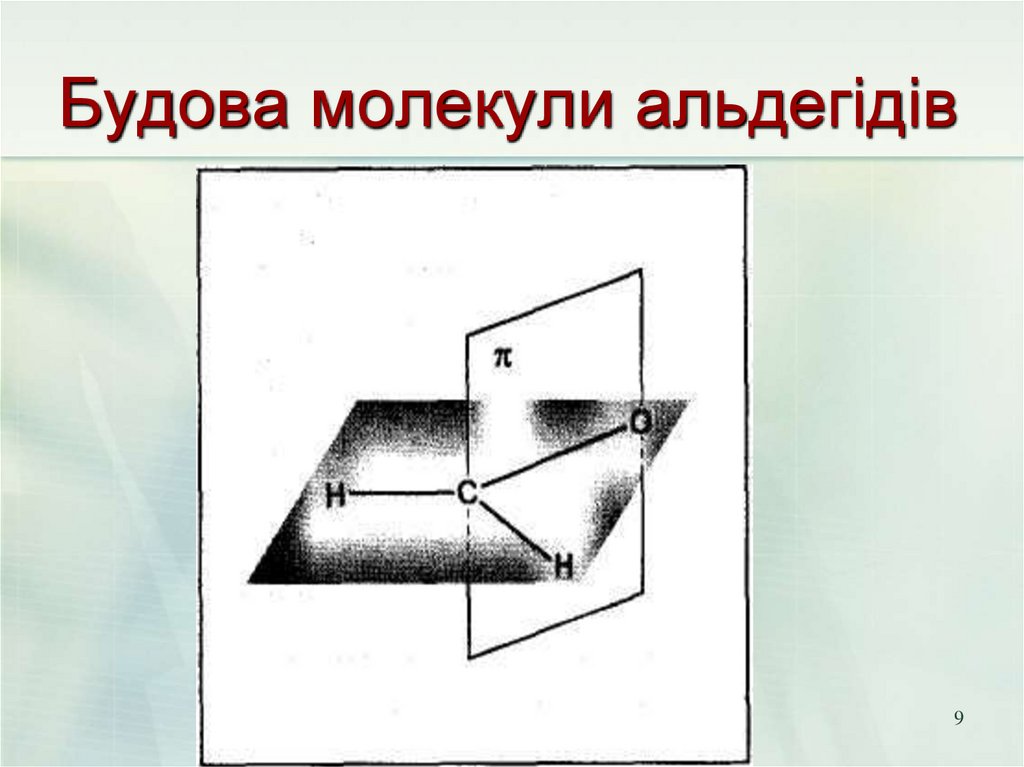
89. Будова молекули альдегідів
910. Будова молекули
Характеристики подвійних звязківС=С і С=О
Довжина, нм
С=С
Енергия,
кДж/моль
620
С=О
710
0.121
Связок
0.134
10
11. Фізичні властивості
ФормальдегідОцтовий альдегід
Бензальдегід
11
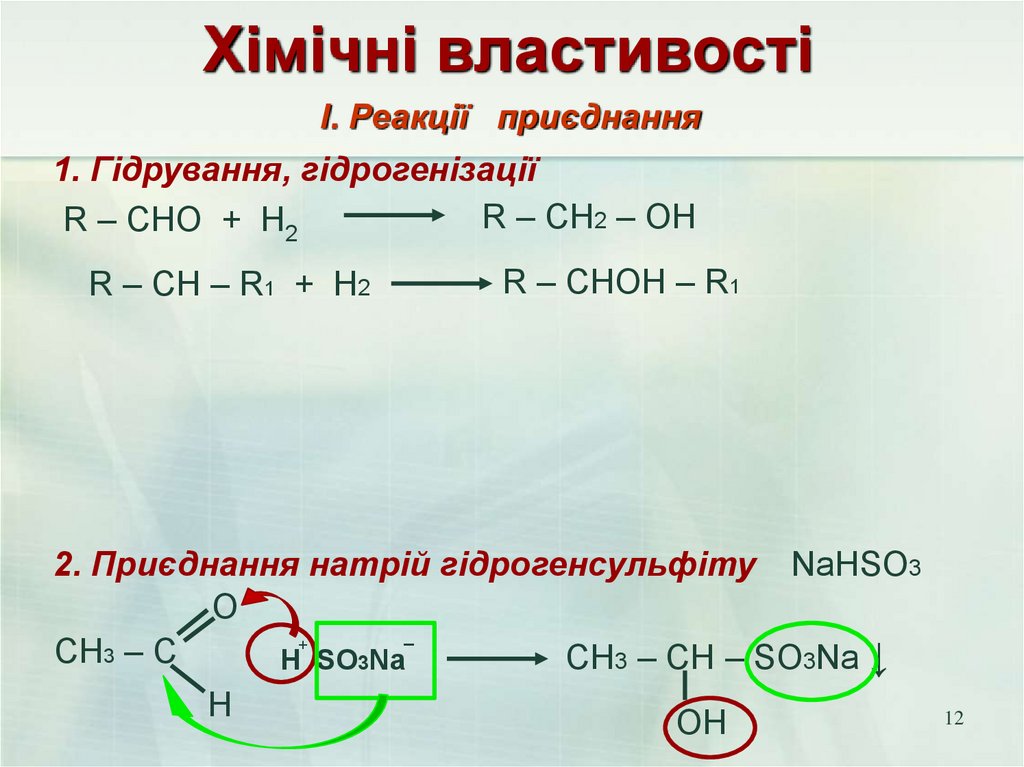
12. Хімічні властивості
І. Реакції приєднання1. Гідрування, гідрогенізації
R – CH2 – OH
R – CHO + H2
R – CH – R1 + H2
R – CHOH – R1
2. Приєднання натрій гідрогенсульфіту NaHSO3
O
_
+
CH3 – C
CH3 – CH – SO3Na ↓
Н SO3Na
H
12
OH
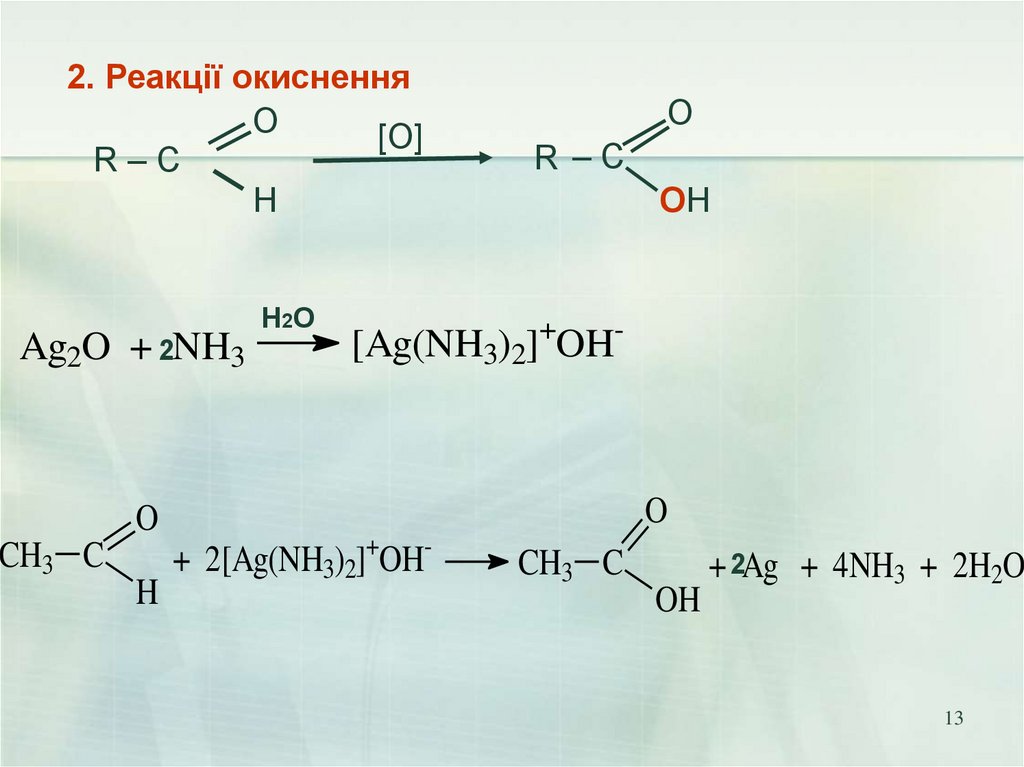
13.
2. Реакції окисненняO
[О]
R–C
H
Ag2O + 2NH3
O
CH3 C
H
H2O
O
R –C
OH
[Ag(NH3)2]+OH-
O
+ 2[Ag(NH3)2]+OH-
CH3 C
OH
+ 2Ag + 4NH3 + 2H2O
13
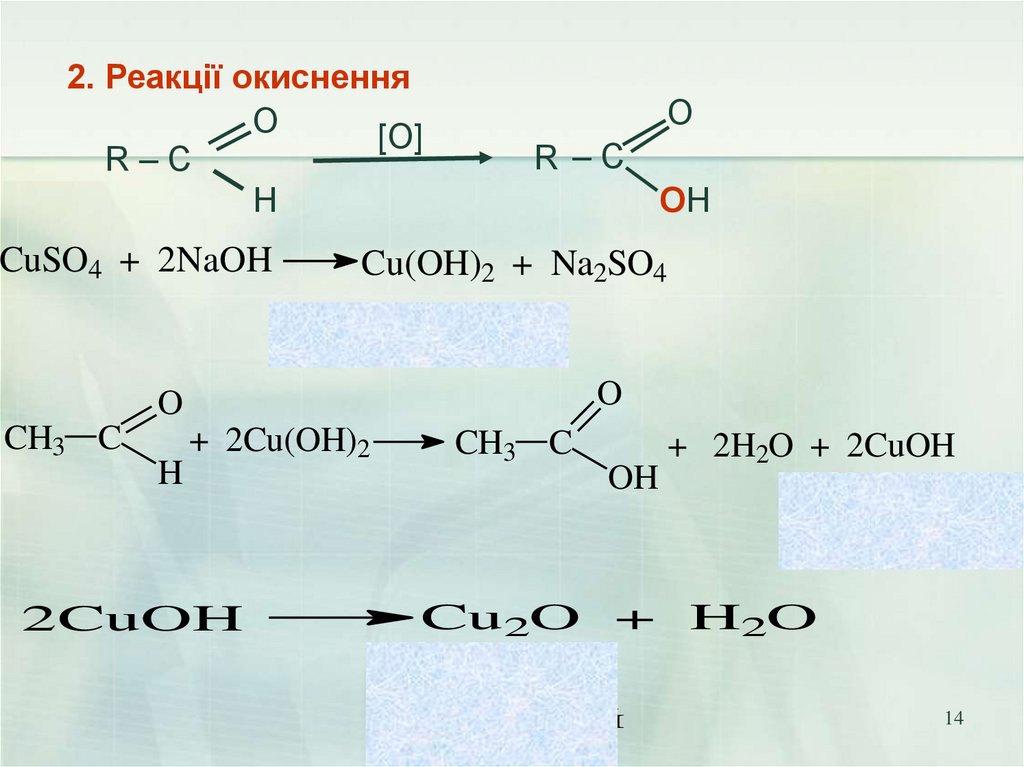
14.
2. Реакції окисненняO
[О]
R–C
H
CuSO4 + 2NaOH
O
R –C
OH
Cu(OH)2 + Na2SO4
гидроксид меди (II)
(голубой осадок)
O
O
CH3 C
H
+ 2Cu(OH)2
2CuOH
CH3 C
OH
+ 2H2O + 2CuOH
гидроксид
меди (I)
(желтый осадок)
Cu2O + H2O
о ксид
меди (I)
(кр а сный
о са до к)
14
15.
Хімічні властивостіРеакції за участю вуглеводневого радикалу
I
O
CH3 C
+ I2
KOH
I
C
H
ацетальдегид
I
O
C
H
иодаль
15
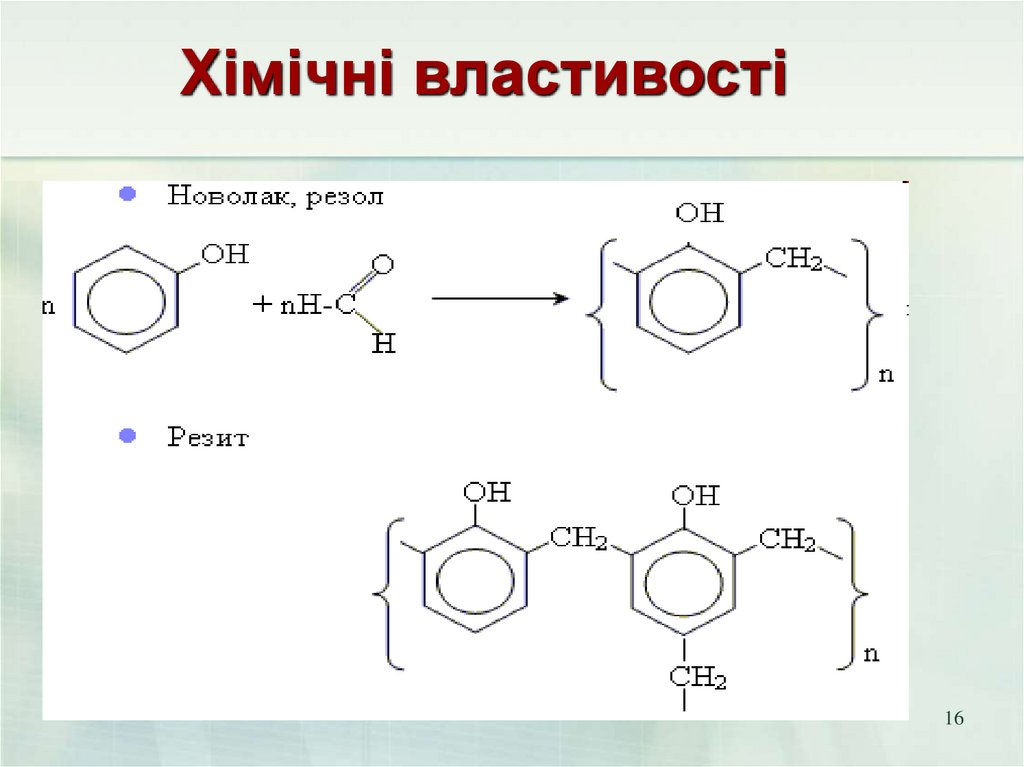
16.
Хімічні властивості16
17. Добування
1. Окиснення спиртівCH3CH2OH
[O]
O
CH3 C
H
[O]
– K2Cr2O7+ H2SO4; этаналь
CuO
этанол
CH3CHCH3
OH
пропанол-2
Пропан-2-ол
[O]
[O]
O
CH3 C
OH
этановая кислота
уксусная кислота
CH3CCH3
O
пропанон
Пропан-2-он
ацетон
17
18. Добування
2.Дегідрування спиртів
O
R
CH2OH
-2H
первичный
Первинний
спирт
спирт
R
CH
OH
вторичный
Вторинний
спирт
спирт
R
C
H
альдегид
Альдегід
R'
-2H
R
C
R'
O
кетон
18
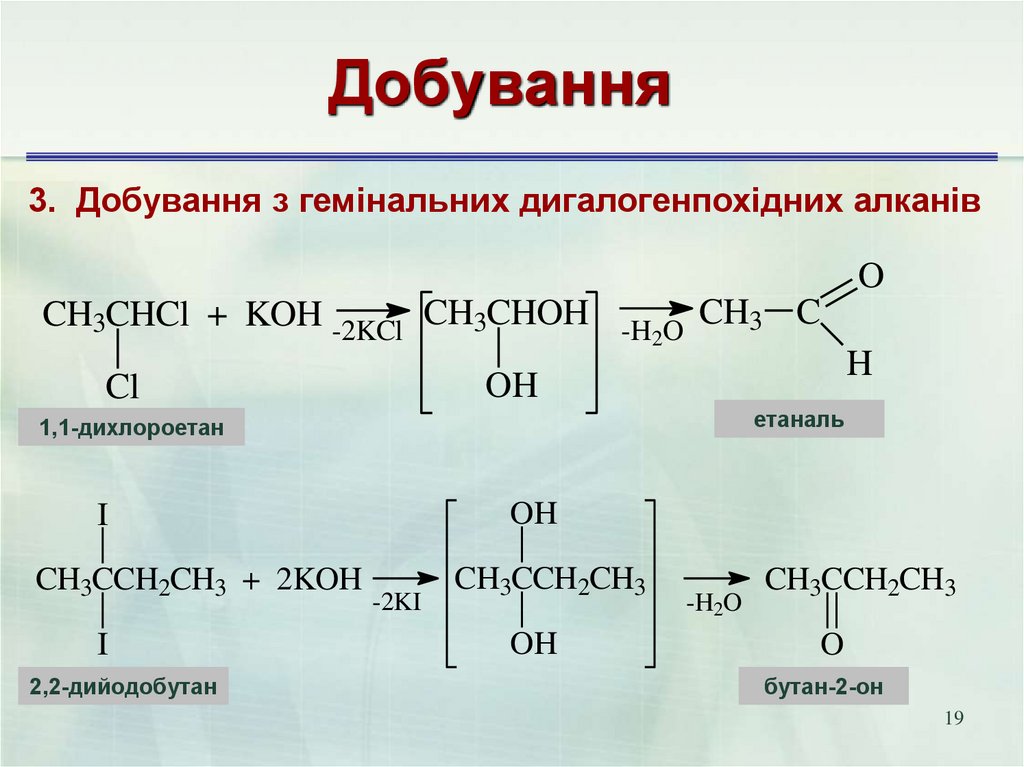
19. Добування
3. Добування з гемінальних дигалогенпохідних алканівO
CH3CHCl + KOH -2KCl CH3CHOH
-H2O
1,1-дихлорэтан
1,1-дихлороетан
етаналь
этаналь
OH
I
I
2,2-дииодбутан
2,2-дийодобутан
H
OH
Cl
CH3CCH2CH3 + 2KOH
CH3 C
-2KI
CH3CCH2CH3
OH
-H2O
CH3CCH2CH3
O
бутанон
бутан-2-он
19
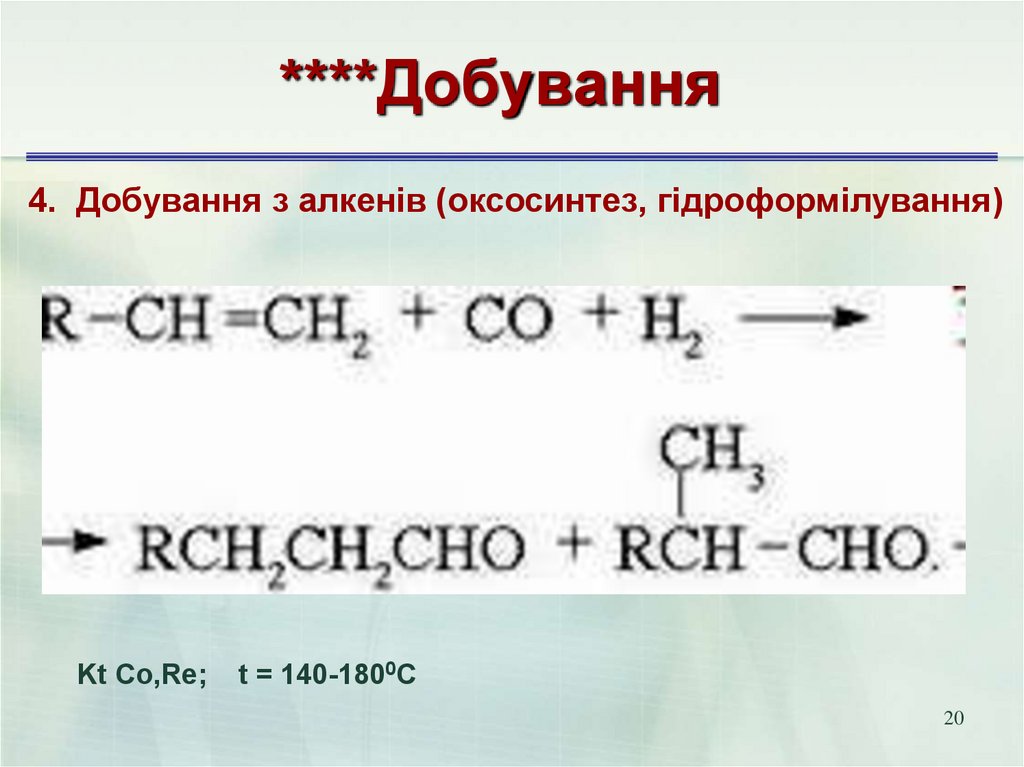
20. ****Добування
4. Добування з алкенів (оксосинтез, гідроформілування)Kt Co,Rе;
t = 140-1800C
20
21. Добування
5. Добування з вуглеводнівОкиснення алкенів
O
CH2 CH2 + PdCl2 + H2O
CH3 C
+ Pd + 2HCl
H
ацетальдегид, 98%
Гідратація алкінів – реакція Кучерова
21













 Химия
Химия








