Похожие презентации:
Основные законы химии
1.
Основные законы химииПреподаватель Юридического колледжа
Валентина Владимировна Киреева
2.
РЕМОНТ1.Закон сохранения массы
Эмпедокл (Vвек до н.э):
Ничто не может произойти из ничего, и никак
не может то, что есть, уничтожиться.
М.В. Ломоносов (1748):
Если к чему-либо нечто прибавилось, то это
отнимается у чего-то другого. Так, сколько материи
прибавляется к какому-либо телу, столько же
теряется у другого.
А. Лавуазье (1789):
Масса веществ, вступивших в реакцию, равна
массе веществ, образовавшихся в результате
реакции.
3.
РЕМОНТ4г
32г
?
Н2 + О2 = Н2О
Сколько г воды образуется в результате реакции?
Образуется 36 г: число атомов, вступивших в реакцию,
равно числу атомов, вышедших из реакции,
следовательно, масса веществ, образовавшихся в
результате реакции, будет равна массе веществ,
вступивших в реакцию.
4.
РЕМОНТ2.Закон постоянства
состава вещества
( Ж.-Л. Пруст ,1808 г.)
"От одного полюса Земли до другого соединения
имеют одинаковый состав и одинаковые
свойства. Никакой разницы нет между оксидом
железа из Южного полушария и Северного.
Малахит из Сибири имеет тот же состав, как и
малахит из Испании. Во всем мире есть лишь
одна киноварь".
5.
РЕМОНТСостав
соединений
молекулярной
структуры
является
постоянным
независимо от способа их получения.
6.
РЕМОНТМолекулярное строение имеют все
газообразные и жидкие вещества, а также
твёрдые вещества с низкими температурами
плавления: вода, сернистый газ, сероводород,
метан, аммиак, кислоты, спирт, сахар, глюкоза и
т. д..
Вещества
постоянного
состава
называют
дальтонидами, в честь английского химика и
физика Дальтона.
Состав дальтонидов выражается простыми
формулами с целыми стехиометрическими
индексами, например Н2О, НСl, СН4.
7.
РЕМОНТСостав соединений немолекулярной структуры
(с атомной, ионной или металлической
кристаллической
решеткой)
не
является
постоянным и зависит от способа их получения.
Вещества переменного состава – бертоллиды (в
память
французского
химика
Бертолле,
предвидевшего такие соединения).
8.
РЕМОНТСостав бертоллидов непостоянен, у них
дробные индексы. Так, оксид титана(II) ТiO в
действительности имеет состав от ТiO0,7 до ТiO1,3.
Химические
формулы
простых
веществ
(например, металлов) записывают просто
знаками
соответствующих
элементов
без
индексов: формула простого вещества железа —
Fe, меди — Cu, алюминия — Al.
9.
РЕМОНТ3. Закон Авогадро
В равных объемах различных газов при
одинаковых
условиях
содержится
одинаковое число молекул.
Следствие:
Один моль любого газа при одинаковых
условиях занимает один и тот же объем.
Этот объем, называемый молярным (VM),
при нормальных условиях (Т - 0°С, Р - 1
атм.) равен 22,4 л/моль.
Vm 22,4 л / моль
10.
РЕМОНТДля
расчёта
вещества:
количества
n= V / VM
Если
известно
количество
вещества, можно найти объем газа
при н.у.
V = n VM
11.
РЕМОНТЗадача
1. Каков объем 128 г сернистого
газа
при
нормальных
условиях?
12.
РЕМОНТЗаписываем условие задачи:
m (SO2) = 128 г
V-?
Решение:
V = n VM - формула, по которой находится объем газа
n = m/M - формула, по которой находится количество
вещества.
1. Находим молярную массу SO2:
М (SO3) = 32 + 16*2 = 64 г/моль
2. Находим количество вещества:
n = 128 : 64 = 2 моль
3. Находим объем газа:
V = 2 *22,4 = 44,8 л
13.
РЕМОНТЗадание
1. Какова
масса
пропана
С3Н8,
занимающего объем при н.у. 3, 36 л?
14.
РЕМОНТ4. Периодический закон химических
элементов Д.И. Менделеева
До Д.И. Менделеева было предпринято
более 50 попыток систематизировать
химические элементы
15.
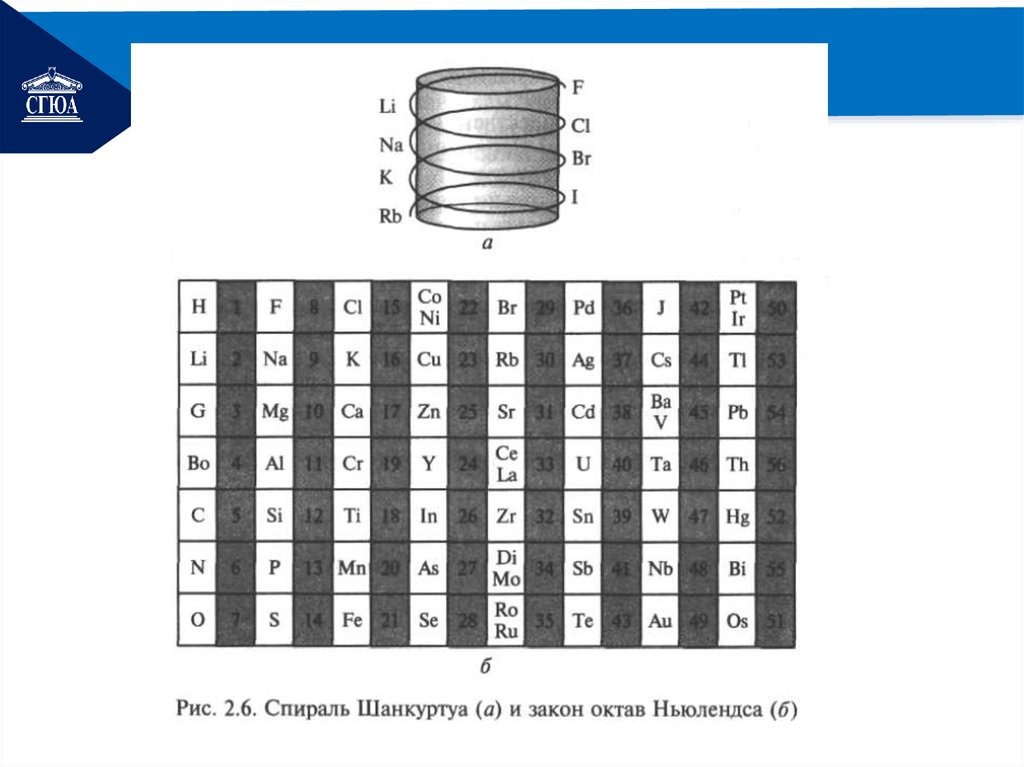
РЕМОНТЙ.Я.Берцелиус разделил все
элементы на металлы и неметаллы по их
химическим свойствам.
И.В.Деберейнер сходные по
свойствам элементы объединил в
триады:
литий, натрий и калий;
сера, селен и теллур;
хлор, бром и йод;
16.
РЕМОНТ17.
РЕМОНТД. И. Менделеев в основу своей работы
по классификации химических элементов
положил два их признака: атомную массу и
свойства образуемых этими элементами
веществ.
18.
РЕМОНТРасположив элементы (на тот момент
их было 63) в порядке возрастания
атомных масс, он обнаружил, что
свойства элементов изменяются линейно
(усиливаются или ослабевают), затем
после резкого скачка через определенное
число
элементов
(периодически)
повторяются.
19.
РЕМОНТ«Когда я стал окончательно
оформлять мою классификацию
элементов, я написал на отдельных
карточках каждый элемент и его
соединения, и затем, расположив их в
порядке групп и рядов, получил первую
наглядную таблицу периодического
закона» – писал Д.И.Менделеев.
20.
РЕМОНТДля того, чтобы периодичность
полностью
соблюдалась,
Менделеев
исправил атомные массы некоторых
элементов, несколько элементов разместил
в других ячейках, оставил в таблице
пустые клетки, где должны были
разместиться пока не открытые элементы.
21.
РЕМОНТ22.
РЕМОНТВ первом варианте системы элементы
были расставлены по девятнадцати
горизонтальным рядам и по шести
вертикальным столбцам.
17 февраля (1 марта) 1869 г.
Д.И. Менделеев сдал в набор рукопись
«Опыт
системы
элементов,
основанной на их атомном весе и
химическом сходстве»
23.
РЕМОНТВ 1870 г. Менделеев в «Основах химии»
опубликовал второй вариант системы:
горизонтальные столбцы элементованалогов превратились в восемь
вертикальных групп; шесть вертикальных
столбцов превратились в 7 периодов,
начинавшихся щелочным металлом и
заканчивающихся галогеном.
24.
РЕМОНТ2
25.
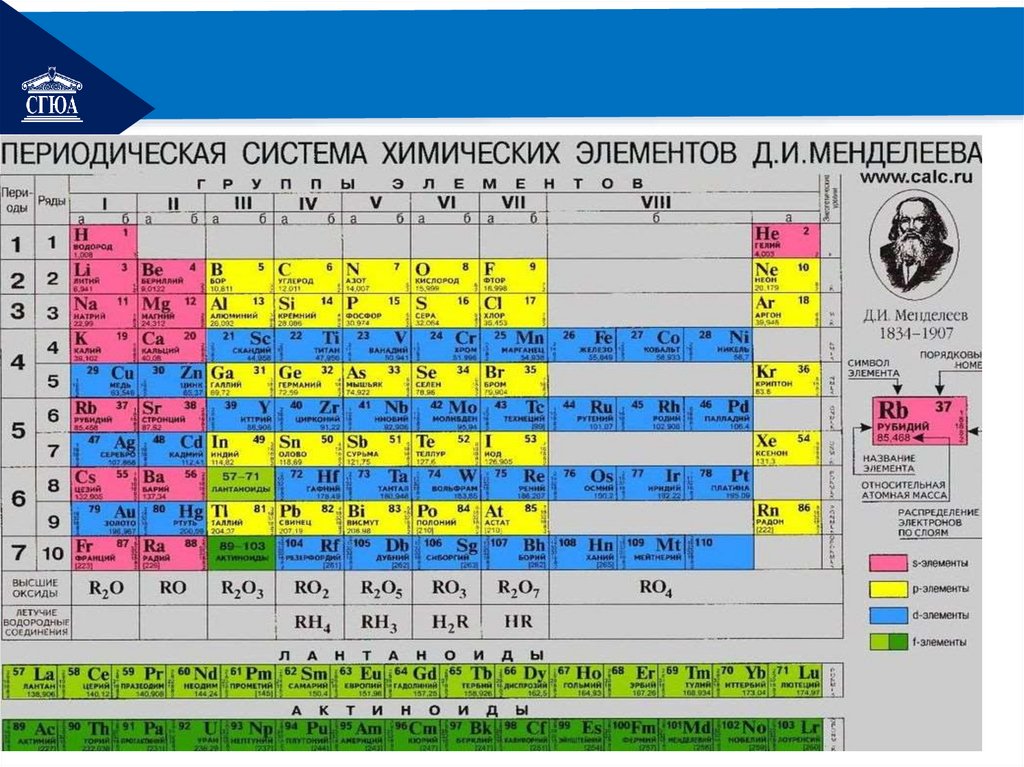
РЕМОНТПо горизонтали таблица Менделеева
делится на семь периодов:
период I включает два элемента: Н и
Не;
период II начинается Li и
оканчивается Ne;
период III начинается Na и
оканчивается Аr ;
26.
РЕМОНТпериоды IV, V содержат по 18 элементов;
период VI включает 32 элемента;
период VII содержит содержит 32 элемента Все
элементы седьмого периода являются
радиоактивными. Этот период содержит самый
тяжёлый элемент, встречающийся на Земле в
естественном виде — уран. Последующие
элементы были синтезированы искусственно.
Три первые периода, состоящие каждый из
одного ряда, называют малыми периодами.
Периоды IV, V, VI включают по два ряда
элементов; их называют большими периодами.
27.
РЕМОНТПо вертикали химические элементы
распределены по восьми группам.
Каждая группа состоит из двух подгрупп главной и побочной.
Подгруппа, в которую входят элементы и
малых, и больших периодов, называют
главной.
Подгруппа, в которую входят элементы
только больших периодов, называют
побочной.
2
28.
РЕМОНТТак, в главную подгруппу
I группы входят литий,
натрий, калий, рубидий и
франций. Это подгруппа
лития.
Побочная подгруппа I
группы включает медь,
серебро и золото (подгруппа меди).
29.
РЕМОНТВ июле 1871 г. на основе этих
работ Менделеев сформулировал
Периодический закон химических
элементов:
Свойства химических элементов и
образованных ими веществ находятся
в периодической зависимости от их
относительных атомных масс
30.
РЕМОНТНаучная достоверность
Периодического закона
получила подтверждение
очень скоро: в 1875—1886
годах были открыты галлий,
скандий и германий, для
которых Менделеев,
предсказал не только
возможность их существования, но и с
поразительной точностью описал целый ряд
физических и химических свойств
31.
РЕМОНТДальнейшее развитие периодической системы
связано с заполнением пустых клеток таблицы, в
которые помещались всё новые и новые
элементы: благородные газы, природные и
искусственно полученные радиоактивные элементы.
30 декабря 2015 года Международный союз
теоретической и прикладной химии объявил о том,
что открытие химических элементов 115, 117, 118 и
113 подтверждено официально.
32.
РЕМОНТВ начале XX века с открытием строения атома
было установлено, что периодичность изменения
свойств элементов определяется не атомным весом,
а зарядом ядра, равным атомному номеру и числу
электронов,
распределение
которых
по электронным оболочкам атома элемента
определяет его химические свойства.
33.
СПАСИБО ЗАВНИМАНИЕ!































 Химия
Химия








