Похожие презентации:
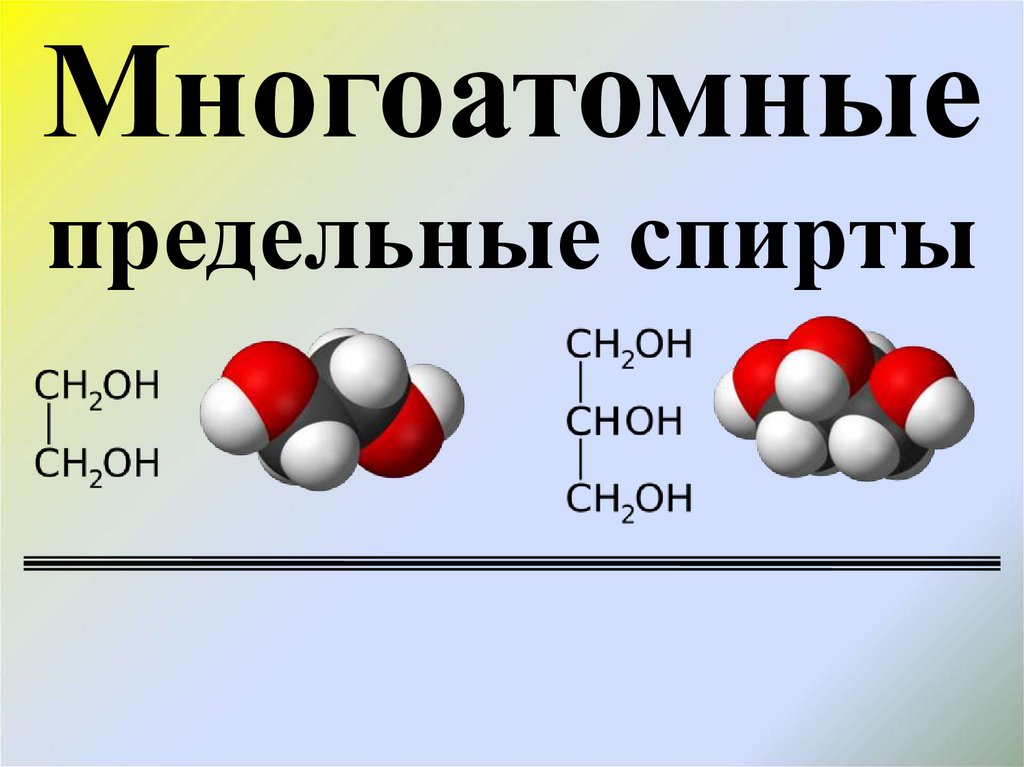
Многоатомные предельные спирты
1.
Многоатомныепредельные спирты
2.
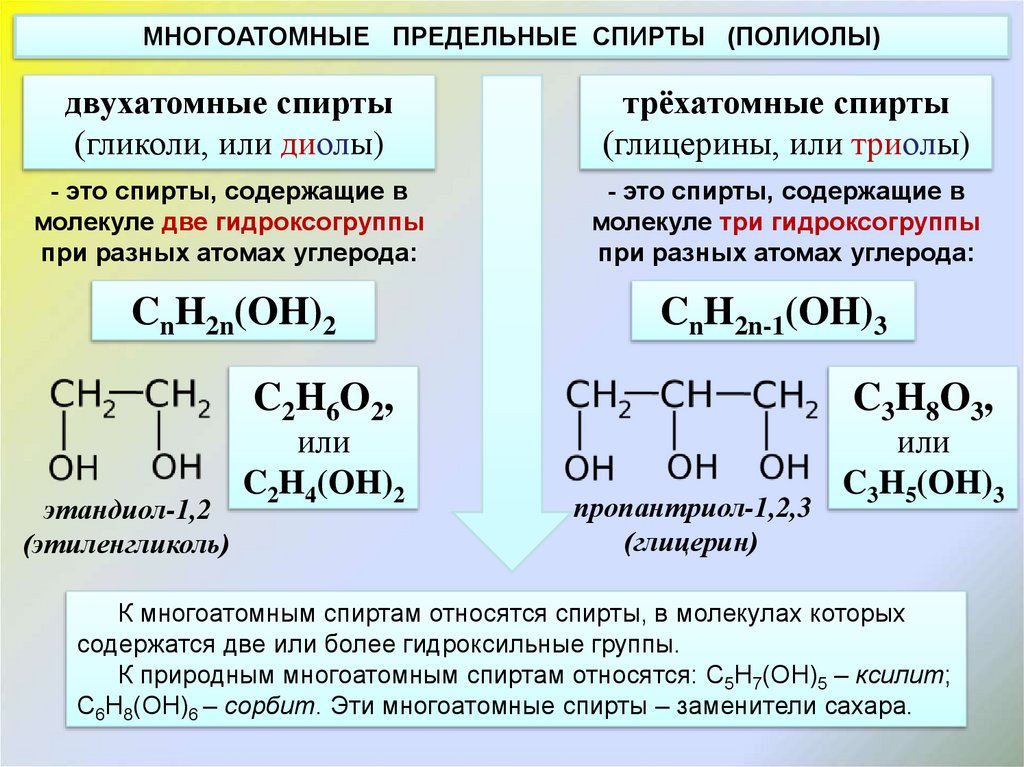
МНОГОАТОМНЫЕ ПРЕДЕЛЬНЫЕ СПИРТЫ (ПОЛИОЛЫ)двухатомные спирты
(гликоли, или диолы)
трёхатомные спирты
(глицерины, или триолы)
- это спирты, содержащие в
молекуле две гидроксогруппы
при разных атомах углерода:
- это спирты, содержащие в
молекуле три гидроксогруппы
при разных атомах углерода:
CnH2n(OH)2
CnH2n-1(OH)3
C2H6O2,
этандиол-1,2
(этиленгликоль)
или
C2H4(OH)2
C3H8O3,
пропантриол-1,2,3
(глицерин)
или
C3H5(OH)3
К многоатомным спиртам относятся спирты, в молекулах которых
содержатся две или более гидроксильные группы.
К природным многоатомным спиртам относятся: C5H7(OH)5 – ксилит;
C6H8(OH)6 – сорбит. Эти многоатомные спирты – заменители сахара.
3.
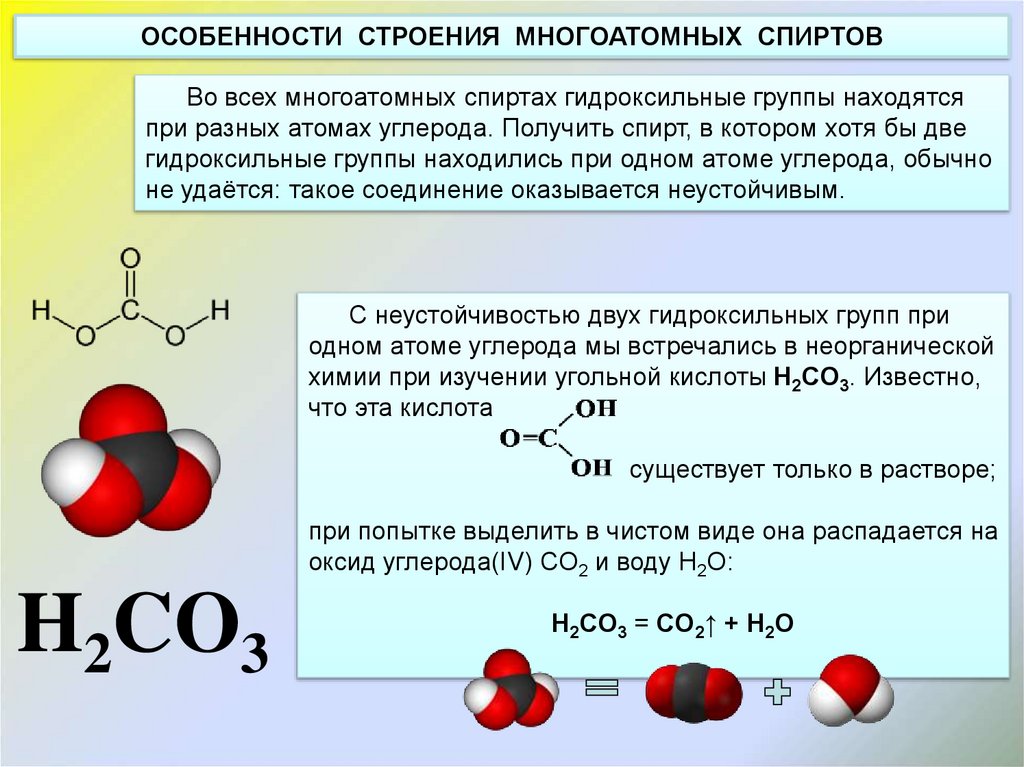
ОСОБЕННОСТИ СТРОЕНИЯ МНОГОАТОМНЫХ СПИРТОВВо всех многоатомных спиртах гидроксильные группы находятся
при разных атомах углерода. Получить спирт, в котором хотя бы две
гидроксильные группы находились при одном атоме углерода, обычно
не удаётся: такое соединение оказывается неустойчивым.
C неустойчивостью двух гидроксильных групп при
одном атоме углерода мы встречались в неорганической
химии при изучении угольной кислоты H2CO3. Известно,
что эта кислота
существует только в растворе;
при попытке выделить в чистом виде она распадается на
оксид углерода(IV) CO2 и воду H2O:
H2CO3
H2CO3 = CO2↑ + H2O
4.
ЭТИЛЕНГЛИКОЛЬC2H4(OH)2
HO-CH2-CH2-OH
ГЛИЦЕРИН
C3H5(OH)3
HO-CH2-CH(OH)-CH2-OH
5.
ФИЗИЧЕСКИЕ СВОЙСТВАЭТИЛЕНГЛИКОЛЬ
ГЛИЦЕРИН
вязкая, сиропообразная жидкость,
обладает сладким вкусом (от
греч. glykys – «сладкий»), без цвета.
Обладает спиртовым запахом;
очень ядовит, оказывает
опьяняющее действие и может
быть причиной тяжёлых
отравлений (интоксикаций)
вязкая, сиропообразная,
бесцветная жидкость сладкого
вкуса. Нетоксичен. Нелетуч.
Обладает гигроскопичностью, т.е.
жадно поглощает воду. Является
составной частью большинства
природных жиров и масел.
6.
ФИЗИЧЕСКИЕ СВОЙСТВАЭТИЛЕНГЛИКОЛЬ
ГЛИЦЕРИН
И этиленгликоль, и глицерин хорошо растворяются в воде и этаноле (смешиваются с водой и этанолом во всех соотношениях). Плохо растворимы
в органических растворителях. Имеют более высокую температуру кипения, чем соответствующие одноатомные предельные спирты:
tкип. (C2H4(OH)2) = 197,20С,
tкип. (C2H5OH) = 78,30С
tкип. (C3H5(OH)3) = 2900С,
tкип. (CН3СH2СH2OH) = 97,20С
Это связано с их строением. С увеличением групп –ОН увеличивается tкип.
и растворимость в воде, что объясняется установлением водородных
связей между молекулами спиртов, между молекулами спирта и воды.
7.
ПРИМЕНЕНИЕ ЭТИЛЕНГЛИКОЛЯ1) Водные растворы этиленгликоля применяют в качестве антифризов –
низкозамерзающих жидкостей для автомобильных радиаторов.
Антифризы заливаются в системы охлаждения, в частности
автомобильных двигателей (различные тосолы).
2) В гораздо больших количествах этиленгликоль используется в
производстве полимеров, которые являются основой некоторых видов
пластмасс и волокон. Так, этиленгликоль используется как один из
исходных продуктов в производстве синтетического волокна лавсана.
8.
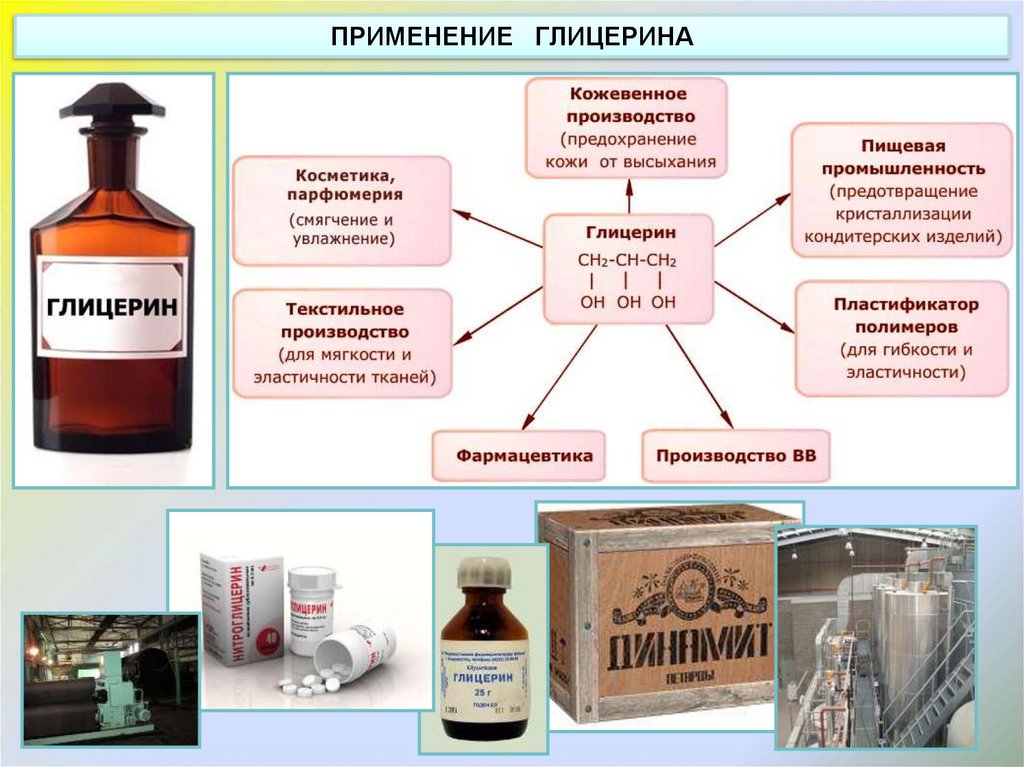
ПРИМЕНЕНИЕ ГЛИЦЕРИНА9.
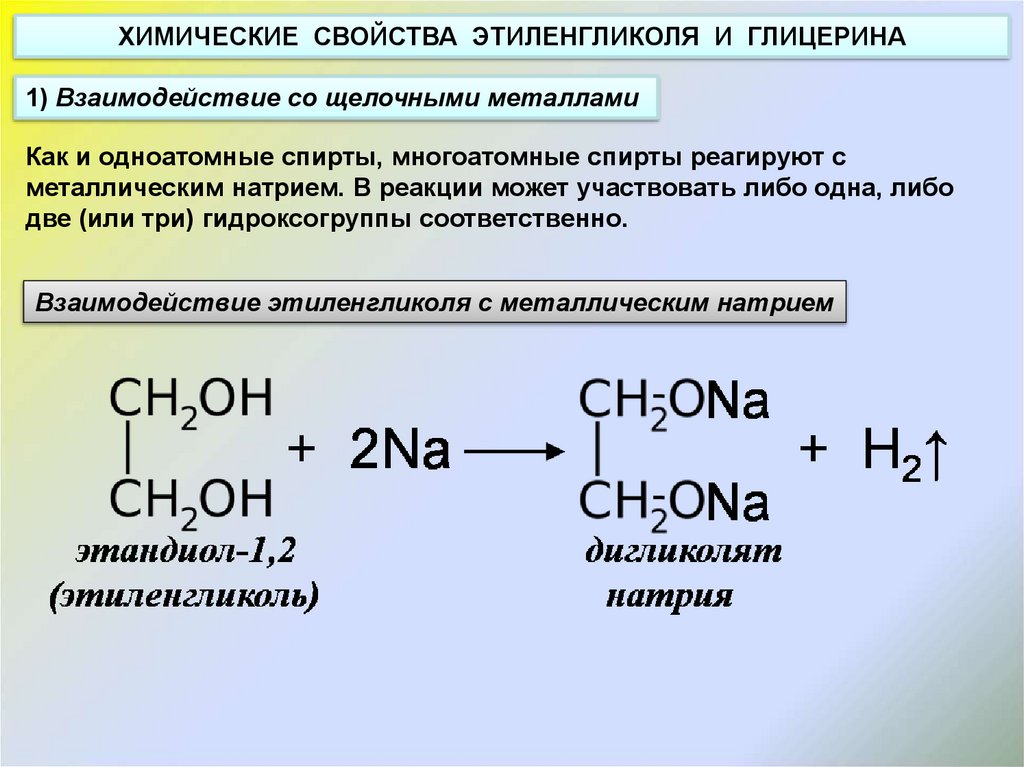
ХИМИЧЕСКИЕ СВОЙСТВА ЭТИЛЕНГЛИКОЛЯ И ГЛИЦЕРИНА1) Взаимодействие со щелочными металлами
Как и одноатомные спирты, многоатомные спирты реагируют с
металлическим натрием. В реакции может участвовать либо одна, либо
две (или три) гидроксогруппы соответственно.
Взаимодействие этиленгликоля с металлическим натрием
10.
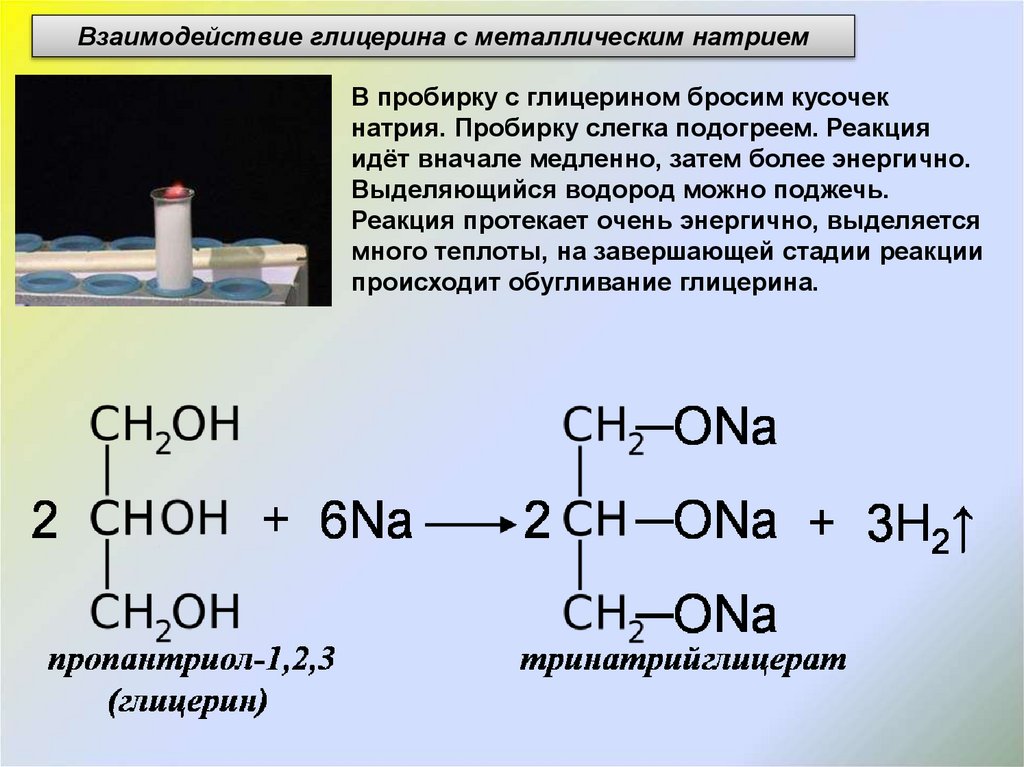
Взаимодействие глицерина с металлическим натриемВ пробирку с глицерином бросим кусочек
натрия. Пробирку слегка подогреем. Реакция
идёт вначале медленно, затем более энергично.
Выделяющийся водород можно поджечь.
Реакция протекает очень энергично, выделяется
много теплоты, на завершающей стадии реакции
происходит обугливание глицерина.
11.
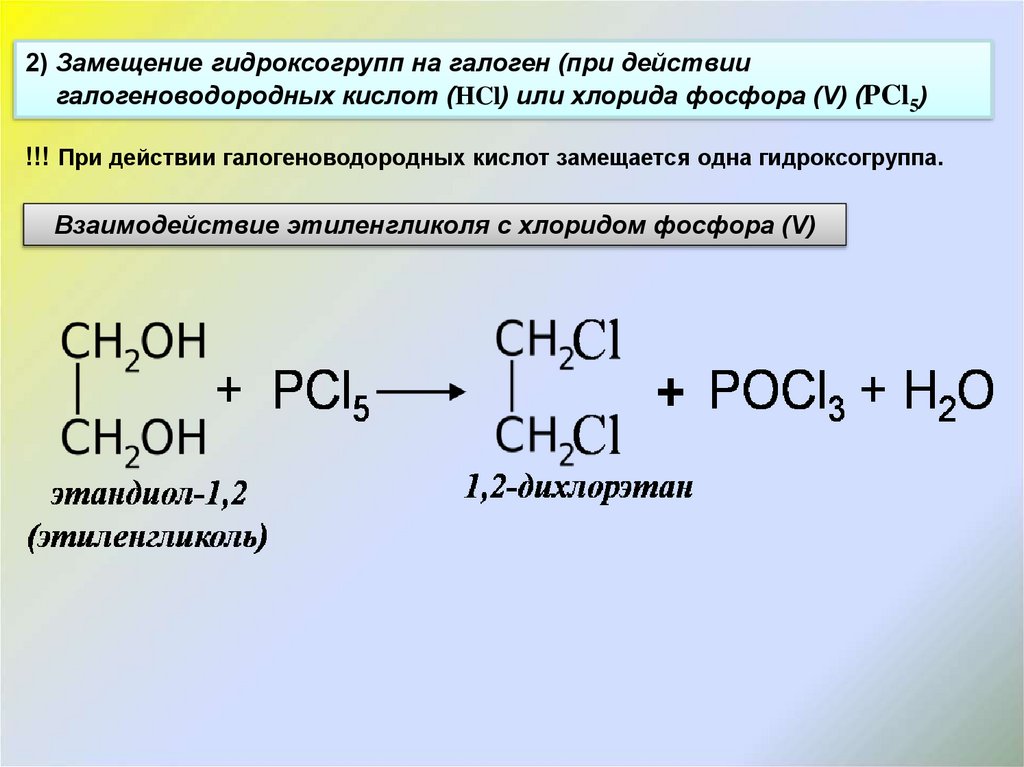
2) Замещение гидроксогрупп на галоген (при действиигалогеноводородных кислот (HCl) или хлорида фосфора (V) (PCl5)
!!! При действии галогеноводородных кислот замещается одна гидроксогруппа.
Взаимодействие этиленгликоля с хлоридом фосфора (V)
12.
Окисление многоатомных спиртов2С2Н6О2 + 5О2 → 4СО2 + 6Н2О
этандиол-1,2
(этиленгликоль)
Взаимодействие глицерина с кристаллическим
перманганатом калия KMnO4
К растёртому в тонкий порошок перманганату
калия прильём немного глицерина. Через
некоторое время над смесью появляется дымок, а
затем происходит загорание глицерина. Под
действием сильных окислителей глицерин
сгорает с образованием углекислого газа и воды.
2С3Н8О3 + 7О2 → 6СО2 + 8Н2О
пропантриол-1,2,3
(глицерин)





 Химия
Химия








