Похожие презентации:
Цитохром Р450. Биотрансформация лекарственных средств
1.
Федеральное государственное бюджетное образовательное учреждение высшегообразования "Северо-Западный государственный медицинский университет им. И.И.
Мечникова" Министерства здравоохранения Российской Федерации. Кафедра
внутренних болезней, клинической фармакологии и нефрологии.
«Цитохром Р450;
Биотрансформация
лекарственных средств»
Подготовил: Баранов И.А., 545А гр.,
Лечебный факультет, ФГБОУ ВО
СЗГМУ им. И. И. Мечникова
На основе лекции проф. Дадали В.А.,
доцента Павловой Р.Н.
Санкт-Петербург, 2023
2.
В последнее столетие человек оказался в агрессивной средеобитания, сформированной им самим. Эта среда враждебна
биологической сущности организма и все произошло настолько
стремительно,
что
организм
человека
оказался
неадаптированным к этим изменениям, что приводит к
напряжению его адаптационных механизмов и в итоге их срыву.
3.
Гидрофобные соединения включают:• Большиство ксенобиотиков техногенного
характера;
• Наркотики;
• До 70% лекарственных препаратов;
• Широкий круг эндогенных метаболитов –
холестерин, гормоны коры надпочечников,
половые гормоны, витамины D и А, высшие
жирные кислоты и т.д.
• Многие водорастворимые вещества имеют в
своей структуре гидрофобные фрагменты,
например, спирты.
4.
«…homosapiens
отличается
от
других
видов
млекопитающих
страстью к лекарствам:
один
из
феноменов
человеческого рода –
способность
выжить,
несмотря на лечение и
лекарства».
Норманн Казинс
(популяризатор
науки,
США)
5.
Токсичность гидрофобных соединенийобусловливает их способность проникать
через липидный бислой мембран и
нарушать
работу
клеточных
систем
(например,
активировать
свободнорадикальное и перекисное окисление и
соответствующие повреждение организма ,
вызывать мутации по типу необратимой
интерколяции, приводящих к раковым
опухолям и т.д.).
6.
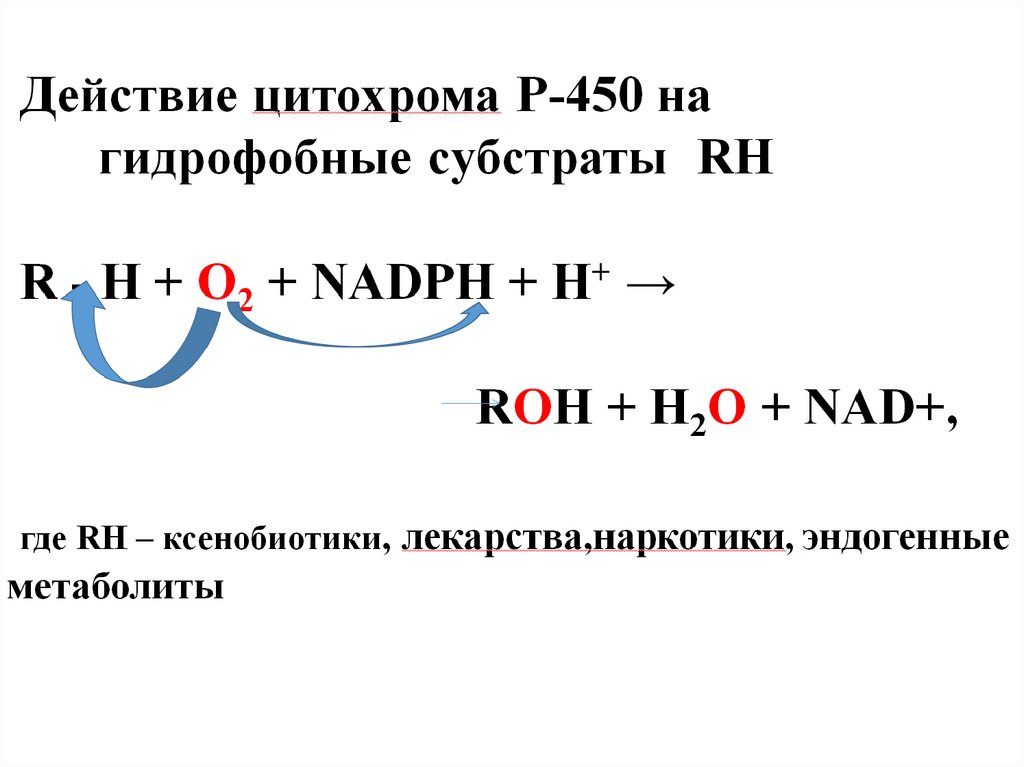
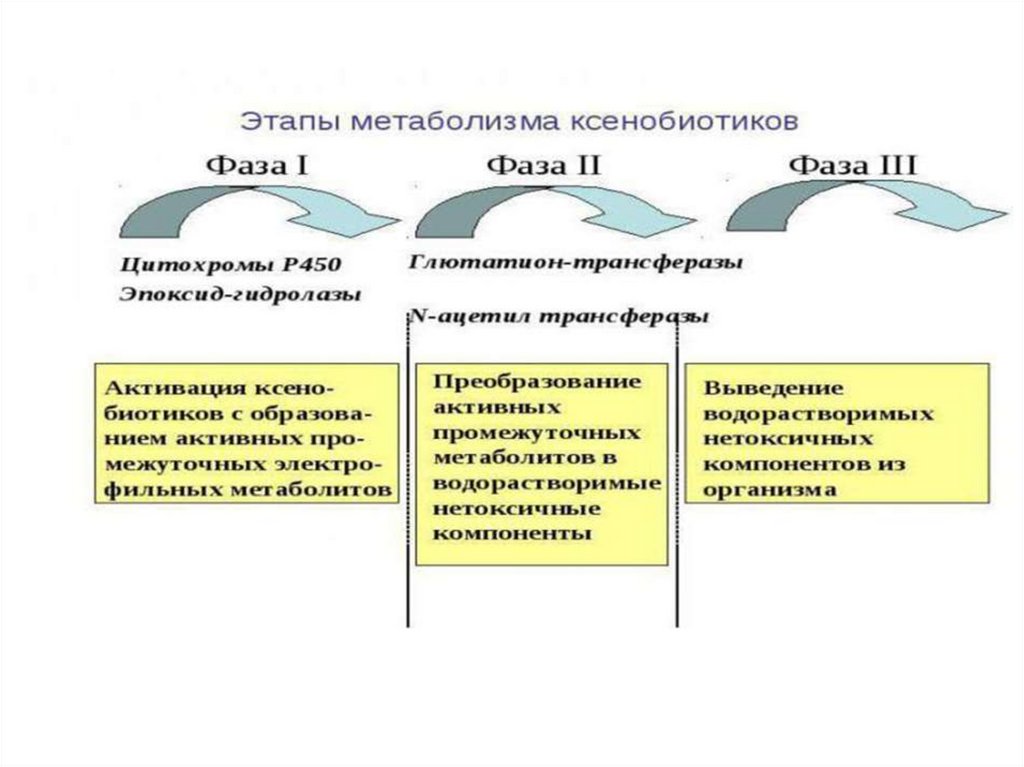
Биотрансформация гидрофобных соединений сих последующей детоксикацией включает две
согласованные фазы:
1.Фаза функционализации – введение активных
гидрофильных функциональных групп в
структуру
гидрофобной
молекулы
(микросомальное окисление)
2. Фаза реакций конъюгации.
Тесно связаны с этими процессами реакции
обезвреживания продуктов СР и ПО и система
антиоксидантной и перекисной защиты.
7.
Ферменты микросомального окисления(или цитохром Р-450 зависимая
система) локализованы в микросомах
(эндоплазматический ретикулум):
- всех пограничных тканей - печени,
стенки кишечника, легких, кожи;
- надпочечниках, половых железах,
тканях мозга.
8.
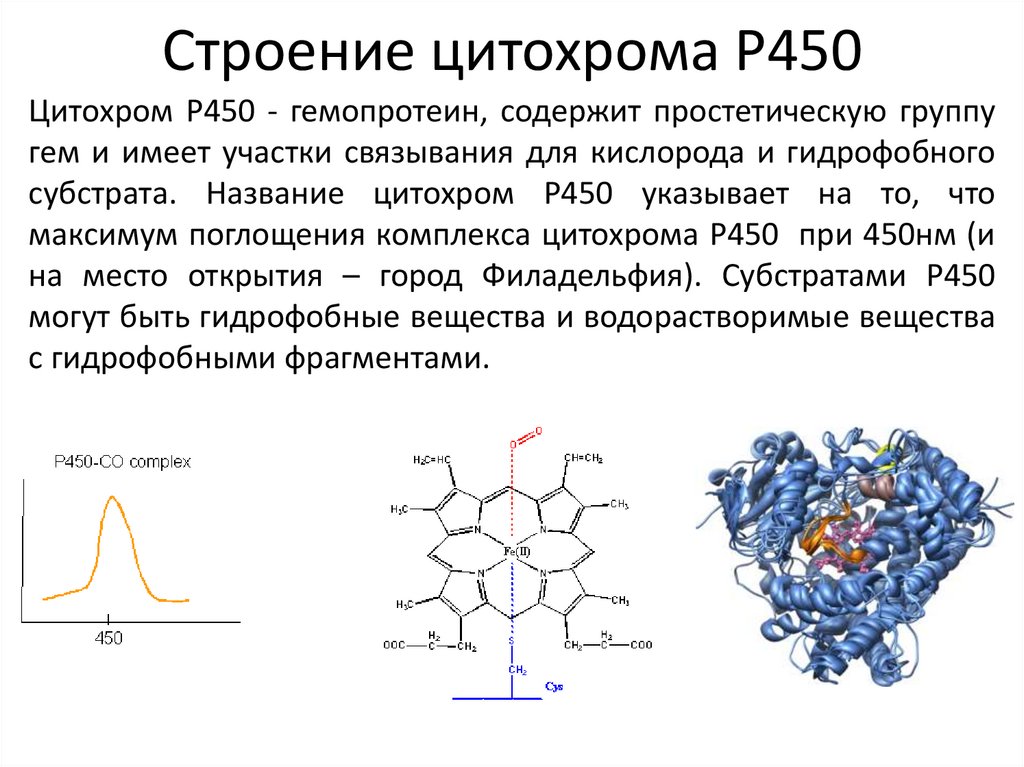
Строение цитохрома Р450Цитохром Р450 - гемопротеин, содержит простетическую группу
гем и имеет участки связывания для кислорода и гидрофобного
субстрата. Название цитохром Р450 указывает на то, что
максимум поглощения комплекса цитохрома Р450 при 450нм (и
на место открытия – город Филадельфия). Субстратами Р450
могут быть гидрофобные вещества и водорастворимые вещества
с гидрофобными фрагментами.
9.
10.
11.
12.
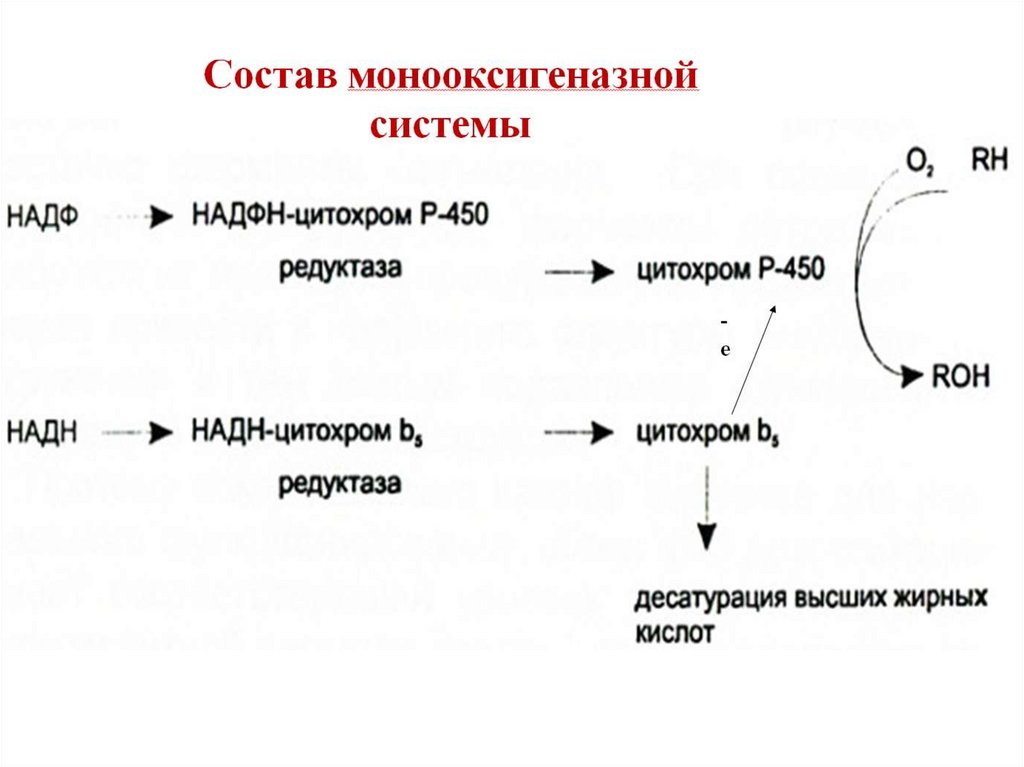
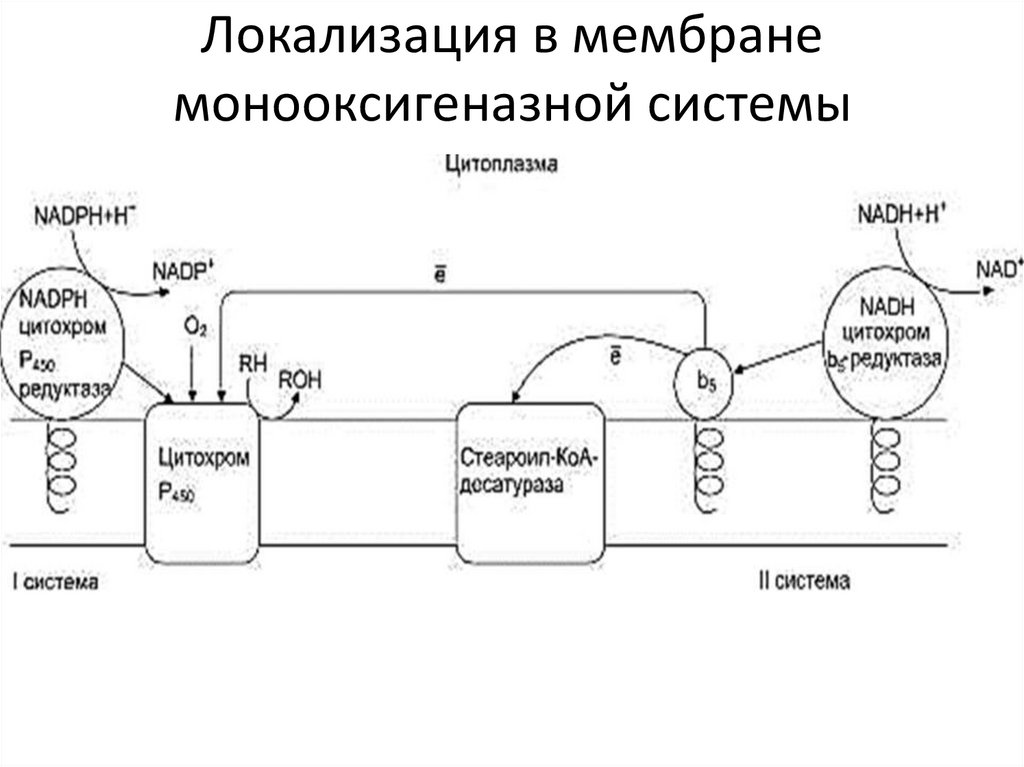
Локализация в мембранемонооксигеназной системы
13.
Цитохром b5 в некоторых случаях может быть доноромэлектронов (ē) для цитохрома Р450 или для стеароилКоА-десатуразы, которая катализирует образование
двойных связей в жирных кислотах, перенося электроны
на кислород с образованием воды.
NADH-цитохром b5 редуктаза - двухдоменный белок.
Глобулярный
цитозольный
домен
связывает
простетическую группу - кофермент FAD (витамин В2), а
единственный гидрофобный «хвост» закрепляет белок в
мембране.
Цитохром b5 - гемсодержащий белок, который имеет
домен, локализованный на поверхности мембраны ЭР, и
короткий «заякорен».
14.
Свойства системы микросомального окисленияШирокая субстратная специфичность, которая
позволяет обезвреживать самые разнообразные
по строению вещества, и регуляция активности по
механизму индукции.
Широкая
субстратная
специфичность
обусловлена множественными формами Р450.
К настоящему времени описано около 150 генов
цитохрома Р450, в отличии от изоферментов
множественные формы катализируют один тип
реакции, но с разными субстратами.
15.
16.
• СYP 2А1 и CYP 3A1 - биосинтез тестостерона;• СYP С19 – трансформация тестостерона в эстрадиол;
• CYP 1A1 – биотрансформация эстрадиола (норма);
• CYP 1В1 – биотрансформация эстрадиола
(канцерогенез);
• CYP 3A4 и CYP 2С9 – биотрансформация виагры;
• CYP 3A4 – токсификация афлатоксина В1;
• CYP 2E1 – токсификация нитрозаминов, винилхлорида
и др. хлорпроизводных;
• Наиболее важными в метаболизме ЛС являются CYP1A2, CYP2C9, CYP2C19, CYP2D6, CYP2E1 и CYP3A4.
17.
18.
19.
CYP1A220.
CYP2C921.
CYP2C1922.
CYP2D623.
CYP3A424.
CYP2E125.
26.
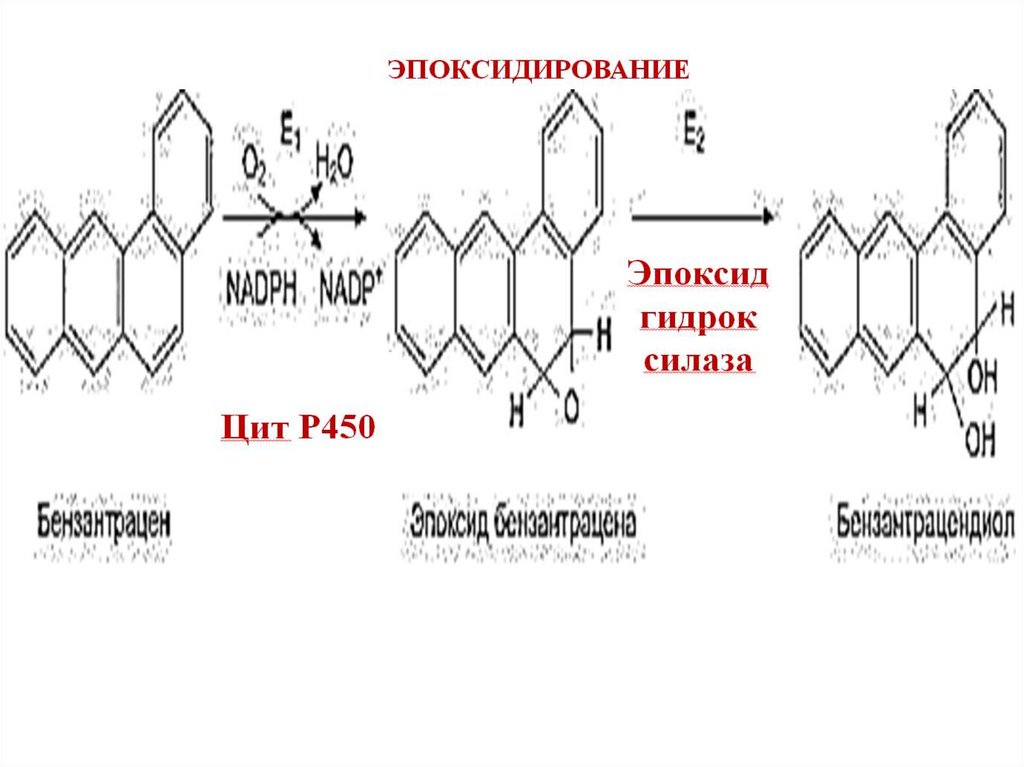
ОСНОВНЫЕ РЕАКЦИИ ЦИТ. Р4501.Гидроксилирование – образование
ОН группы;
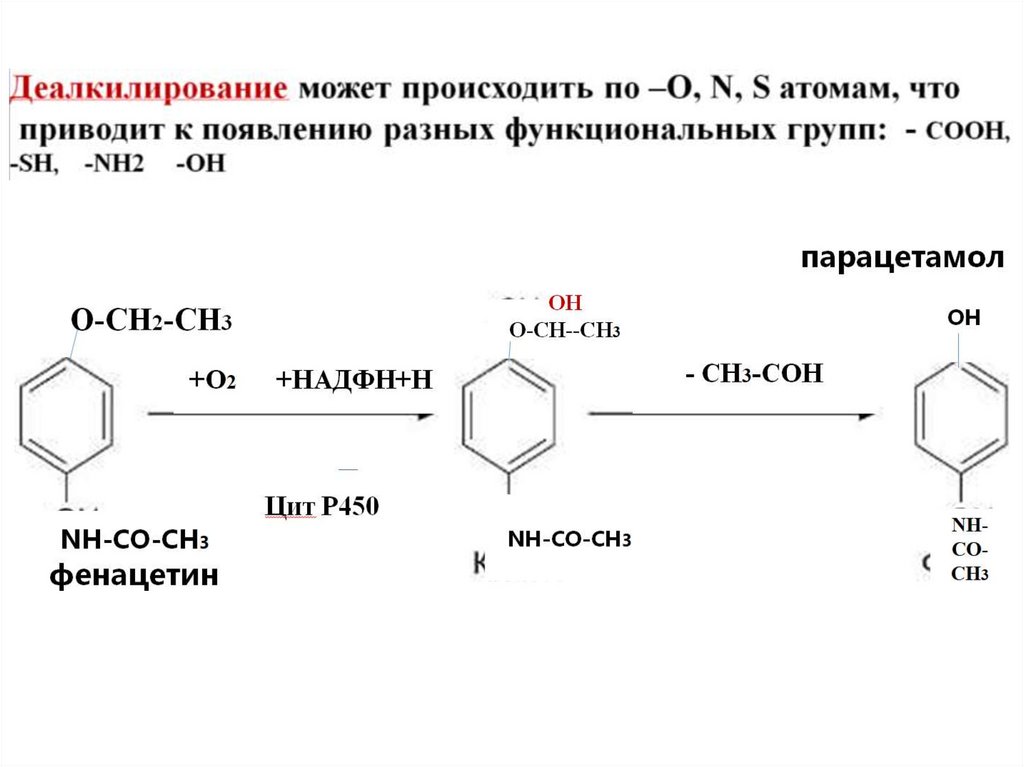
2.Деалкилирование
–
удаление
метильной и этильной групп;
3.Эпоксидирование – образование
активного трехчленного эпоксидного
кольца.
27.
28.
29.
30.
Эндогенные функции цитохрома Р4501.Синтез холестерина;
2.Синтез из холестерина желчных кислот;
3. Метаболизм катехоламинов в мозгу (болезнь
Паркинсона);
4.Синтез гормонов коры надпочечников;
5.Синтез эстрадиола из тестостерона;
6.Биотрансформация эстрадиола в конечные
продукты – в нормальные и канцерогены;
7.Синтез ПНЖК (цитохром в5);
8.Образование активных форм витамина D кальцидиола (печень) и кальцитриола (почки).
31.
32.
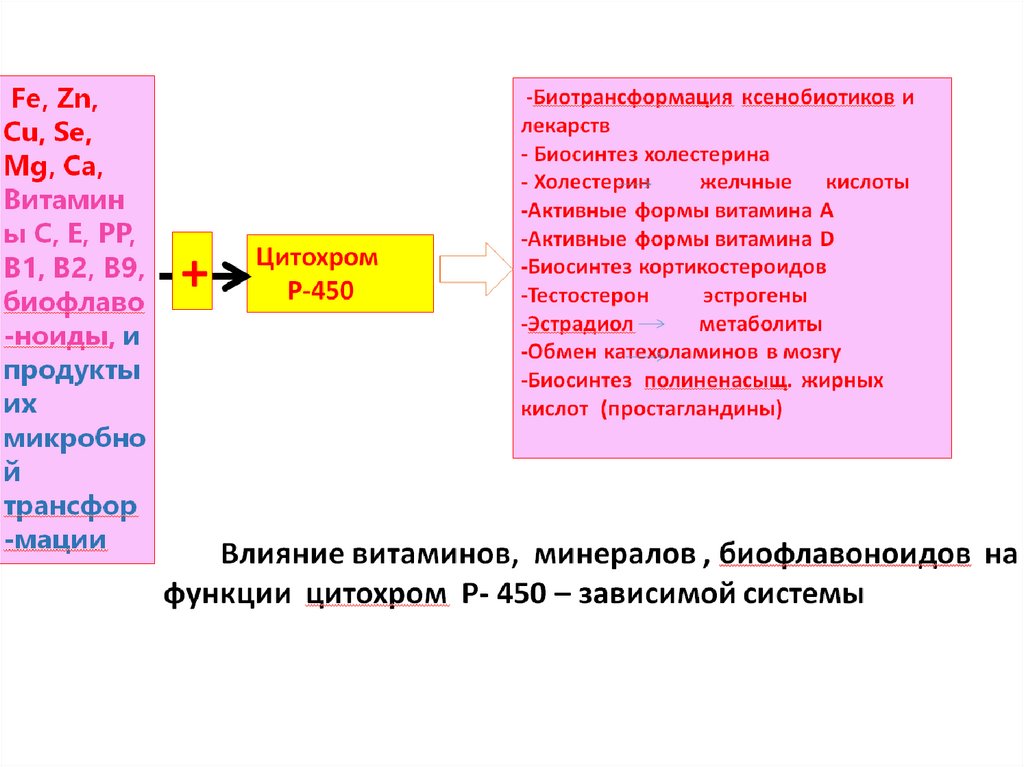
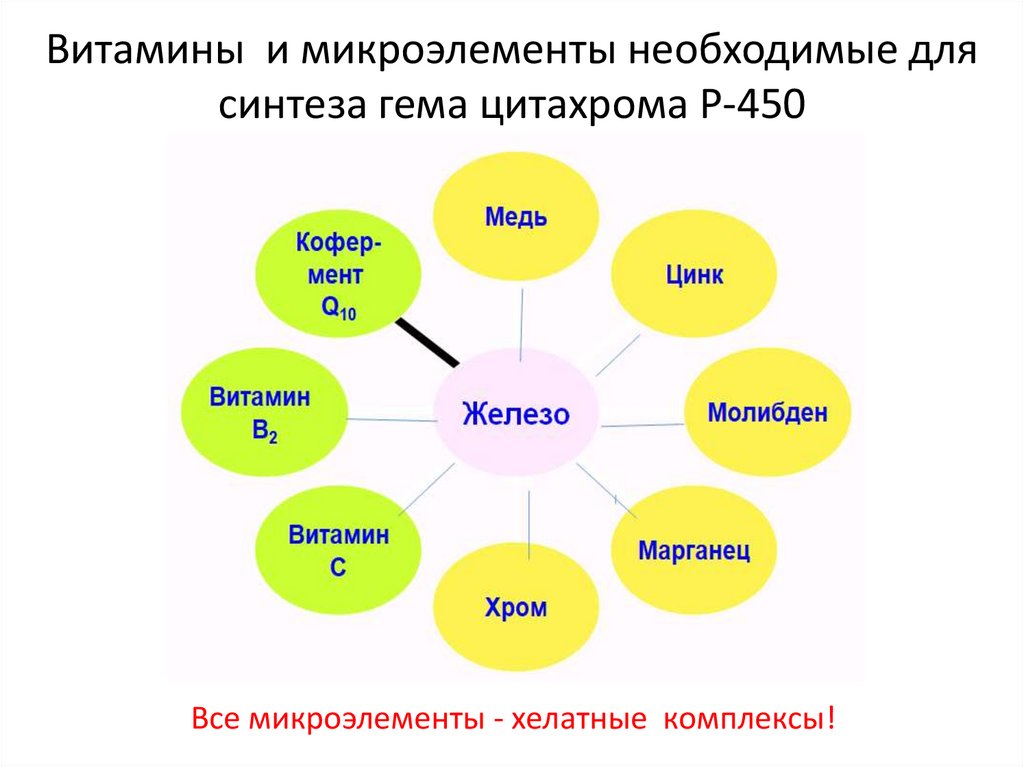
Витамины и микроэлементы необходимые длясинтеза гема цитахрома Р-450
Все микроэлементы - хелатные комплексы!
33.
Индукторы цитохрома Р450Система
цитохрома
Р450
обладает
индуцибельностью – т.е. при поступлении в
организм
ксенобиотика
происходит
индукция синтеза соответствующей формы
цитохрома Р450.
Это один из важных механизмов адаптации
организма к ксенобиотикам.
34.
Индукторы цитохрома Р450 делятся наиндукторы широкого и узкого спектра
действия.
К индукторам широкого спектра действия
относится
фенобарбитал,
который
индуцирует:
а)цитохром Р450 редуктазу;
б)цитохром Р450;
в)глюкуронилтрансферазу
–
использование в профилактике желтухи
новорожденных.
35.
К индукторам узкого спектра действия относятсяполиароматические
углеводороды
(ПАУ),
например, метилхолантрен, бензпирен, которые
индуцируют синтез только цитохрома Р448 и не
индуцирует синтез цитохрома Р450.
Индукция синтеза цит.Р450 при поступлении в
организм
ксенобиотиков,
в
том
числе
лекарственных
препаратов,
снижает
концентрацию
лекарственного
препарата,
поэтому скорость биотрансформации препарата
учитывается при определении терапевтической
дозы препарата.
36.
Примером является опасность совместногоприменения
женщинами
орального
контрацептива и снотворного препарата фенобарбитала.
Этот
же
феномен
лежит
в
основе
несовместимости лекарственных препаратов.
Например, совместный прием снотворных из
группы
барбитуратов
и
антикоагулянта
варфарина (или его аналогов), снижает
концентрацию антикоагулянта, что может
привести к тромбообразованию.
37.
Ингибиторы цитохрома Р4501) Необратимые ингибиторы прямого
действия:
а) Ингибиторы небелковой части цит. Р450,
связывающиеся с Fe+3 гема - CN-, CO, H2S;
б) промежуточные продукты метаболизма
цитохрома Р450, которые образуют с ним
прочные комплексы:
препараты ПАСК,
прогестерон, стероидные контрацептивы,
тетурам,
аминазин,
фторурацил,
циклосерин.
38.
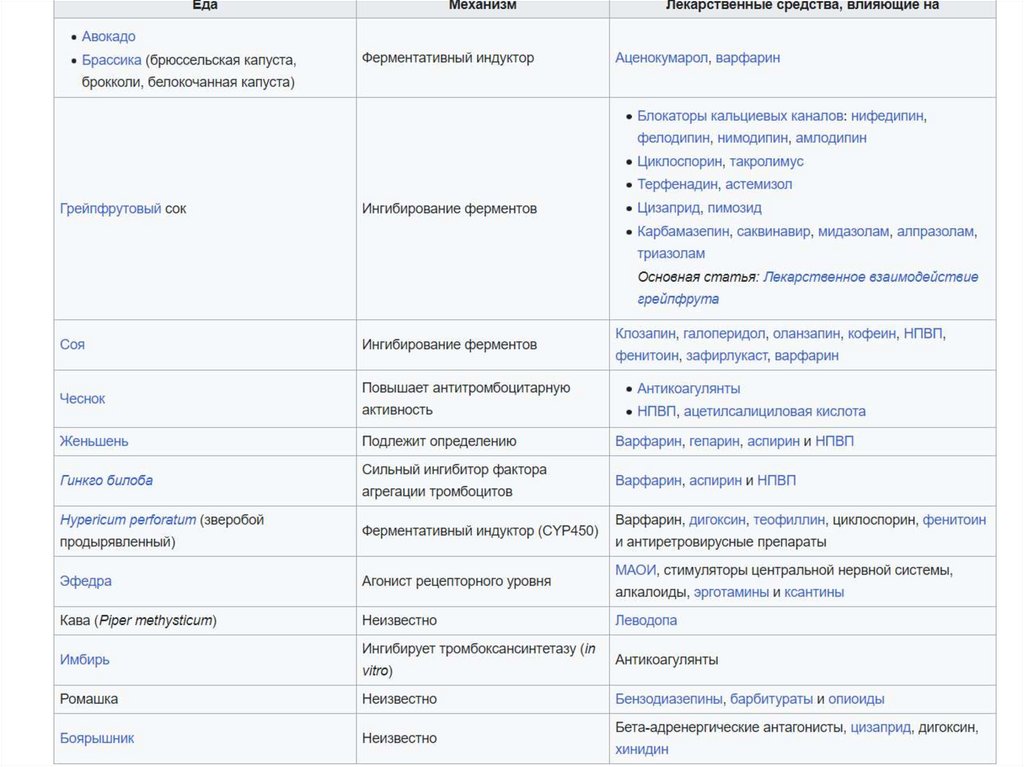
2) Ингибиторы цитохрома Р450 – флавоноиды сокагрейпфрута. Несовместимость ряда лекарственных
препаратов с соком грейпфрута.
Ингибитор цитохрома Р -450 печени эффективный
противоязвенный препарат – циметидин был
исключен.
39.
Феномен токсификацииВ процессе работы цитохрома Р450 могут
образоваваться соединения, имеющие более
высокую токсичность по сравнению с исходными
метаболитами. Такое явление называется
токсификация.
Например, при биотрансформации морфина
образуется норморфин, токсичность которого в 6
раз выше морфина.
При
биотрансформации
хлороформа,
четыреххлористого углерода, дихлорэтана и т.д.
образуются
хлорсодержащие свободные
радикалы и даже крайне токсичный фосген.
40.
Индукция цитохрома Р-4501 А1 и 1А2приводит к метаболической токсификации
бензпирена, афлатоксина В-1 и других
соединений,
являющихся
проканцерогенами и повышению их
мутагенной и канцерогенной активности.
Для их детоксикация важна активность
второй фазы детоксикации – ферментов
конъюгации.
41.
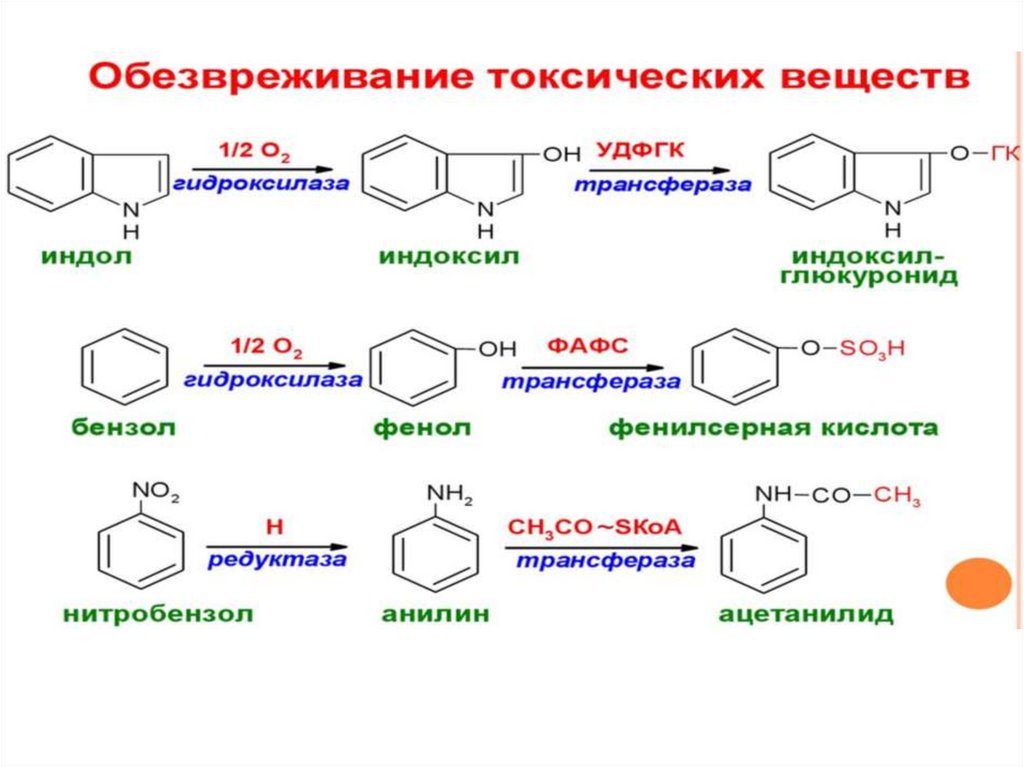
Вторая фаза детоксикации – конъюгация1. Сульфатная – присоединение
остатка серной кислоты
(детоксикация фенолов, кишечного индола и скатола) –
сульфотрансфераза (ФАФС);
2. Глюкуронидная – присоединение остатка глюкуроновой
кислоты (детоксикация фенолов, билирубина, морфина,
биотрансформация
эстрадиола)
–
УДФ
–
глюкуронилтрансфераза (УДФ-глюкуроновая к-та);
3. Глутатионовая;
4. Ацетилирование – присоединение
ацетильного остатка
(биотрансформация сульфамидных препаратов и аминов) – Nацетил трансфераза (ацетил - SКоА);
5. Метилирование – присодинение метильной группы
(норадреналин – адреналин, биосинтез лецитина) –
Mетилтрансфераза (SAM);
6. Аминокислотная – присодинение глицина к бензойной
кислоте.
































 Медицина
Медицина








