Похожие презентации:
Карбоновые кислоты. Классы кислородсодержащих веществ
1. Карбоновые кислоты
Классификация, номенклатура,изомерия, получения, химические
свойства, применение.
2. Классы кислородсодержащих веществ.
Атом кислорода входит Спиртыв состав разных
Фенолы
функциональных групп и
создаются новые классы Альдегиды и кетоны
органических веществ: Карбоновые кислоты
Сложные эфиры
Углеводы
Напримери другие
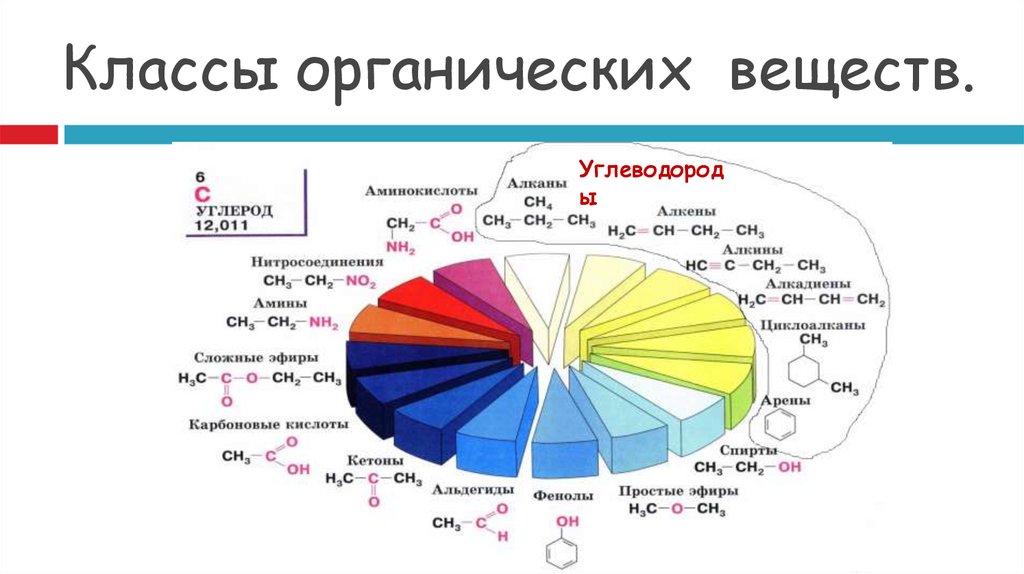
3. Классы органических веществ.
Углеводороды
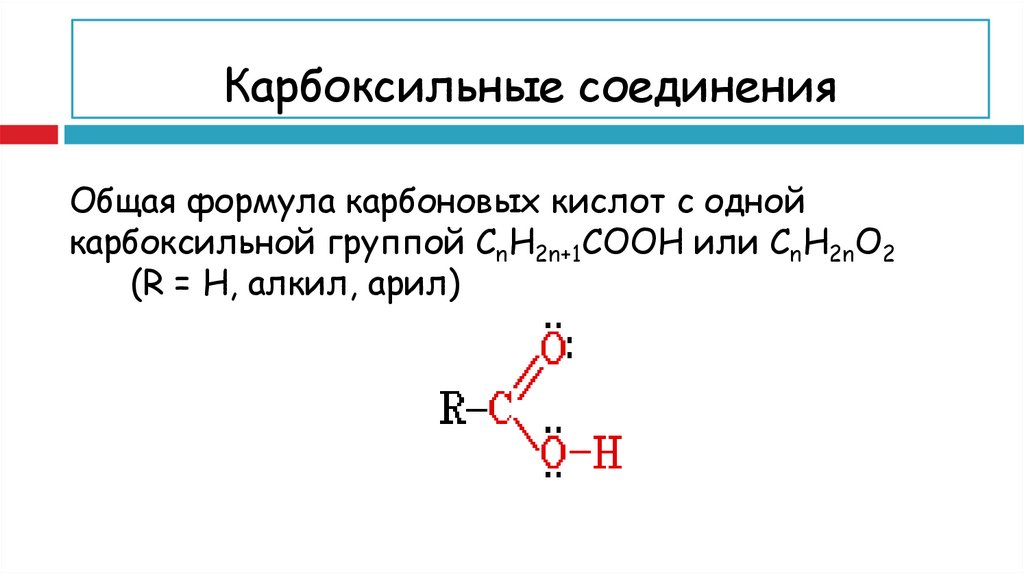
4. Карбоксильные соединения определения.
Карбоновые кислоты — органические соединения,содержащие одну или несколько карбоксильных групп –
Кислоты — это соединения, молекулы которых содержат подвижный
атом водорода и способны к его ощеплению в виде протона (катиона
водорода H+).
5.
Карбоксильные соединенияОбщая формула карбоновых кислот с одной
карбоксильной группой СnH2n+1COOH или СnH2nO2
(R = H, алкил, арил)
6. Карбоновые кислоты функциональная группа
Функциональная группа - это группа атомов, котораяопределяет характерные химические свойства
данного класса веществ.
примеры: гидроксильная, карбоксильная, альдегидная группы
(карбонильная)…
Карбоксильная группа является
функциональной группой карбоновых кислот.
7.
Карбоксильные соединенияПростейшие карбоновые кислоты
Название
Муравьиная
кислота
(метановая)
Уксусная
кислота
(этановая)
Пропионовая
кислота
(пропановая)
Формула
Модель
8.
Карбоновые кислотыКлассификация
Карбоновые
признакам.
кислоты
классифицируют
по
двум
структурным
1. По числу карбоксильных групп кислоты подразделяются на:
одноосновные или монокарбоновые R-COOH
многоосновные (дикарбоновые, трикарбоновые и т.д.)
9.
Карбоновые кислотыКлассификация
2. По характеру углеводородного радикала различают кислоты:
предельные (например, CH3CH2CH2COOH масляная кислота);
непредельные (CH2= CH–CH2COOH акриловая кислота);
• ароматические (C6H5COOH бензойная кислота)
• алициклические (например, циклопропанкарбоновая кислота)
10.
Карбоновые кислотыКлассификация
• гетероциклические (пример – никотиновая кислота)
Соединения, содержащие наряду с карбоксильной группой -СООН другие
функциональные группы (-Hal, -OH, -CH=O, >C=O, -NH2 и т.п.), относятся к
замещенным карбоновым кислотам.
По типу функциональных групп в составе радикала эти соединения
подразделяют на:
галогенкарбоновые кислоты Hal–R–COOH,
гидроксикислоты HO–R–COOH,
оксокислоты
(альдегидокислоты НС(О)–R–COOH и кетонокислоты
R'C(O)–R–COOH),
аминокислоты H2N–R–COOH и др.
11. Номенклатура карбоновых кислот.
Систематическиеназвания
кислот
даются
по
названию
соответствующего углеводорода с добавлением суффикса -овая и
слова кислота (название класса).
Нумерацию углеродной
карбоксильной группы.
цепи
начинают
от
атома
углерода
Для карбоновых кислот широко используются также тривиальные
названия, которые обычно отражают природный источник, где были
впервые обнаружены эти соединения.
12.
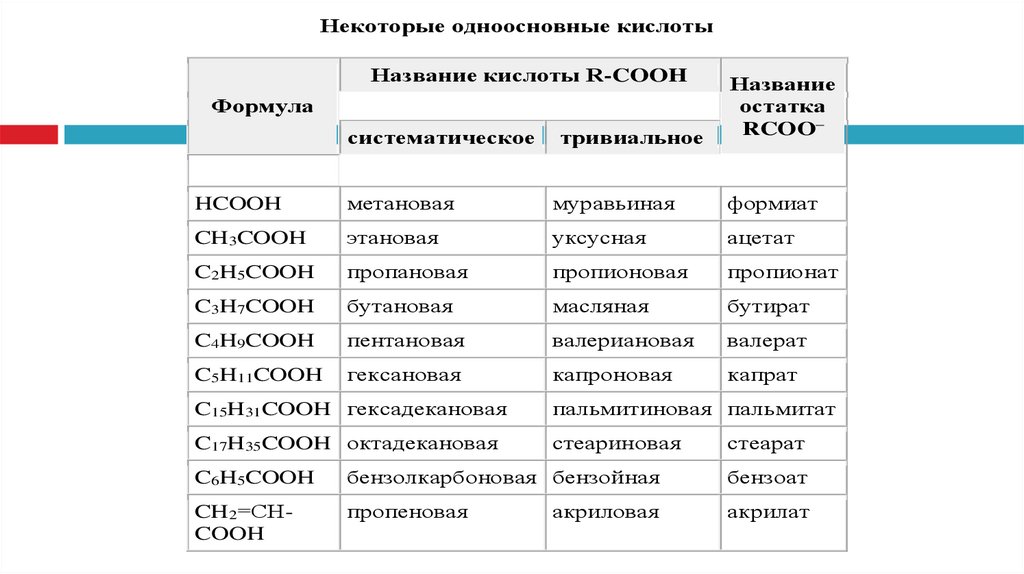
Некоторые одноосновные кислотыНазвание кислоты R-COOH
систематическое
тривиальное
Название
остатка
RCOO–
HCOOH
метановая
муравьиная
формиат
CH3COOH
этановая
уксусная
ацетат
C2H5COOH
пропановая
пропионовая
пропионат
C3H7COOH
бутановая
масляная
бутират
C4H9COOH
пентановая
валериановая
валерат
C5H11COOH
гексановая
капроновая
капрат
Формула
C15H31COOH гексадекановая
пальмитиновая пальмитат
C17H35COOH октадекановая
стеариновая
стеарат
C6H5COOH
бензолкарбоновая бензойная
бензоат
CH2=СHCOOH
пропеновая
акрилат
акриловая
13. Номенклатура карбоновых кислот.
Название группы RCOO– (карбоксилат) содержит остаток названиякарбоновой кислоты и суффикс ат. Название этой группы входит в
названия солей и сложных эфиров карбоновых кислот.
Для многоосновных кислот применяют суффиксы -диовая, -триовая и
т.д.
Например:
· HOOC–COOH – этандиовая (щавелевая) кислота;
· HOOC–CH2–COOH – пропандиовая (малоновая) кислота.
14. Номенклатура карбоновых кислот.
Если атом углерода карбоксильной группы не входит в состав главнойуглеродной цепи (например, цикла), то название кислоты строят из
названия этой цепи (цикла), суффикса -карбоновая и слова кислота.
Так, систематическое название бензойной кислоты
C6H5COOH — бензолкарбоновая кислота.
Нумерация атомов углеродной цепи (цикла)
начинается от атома углерода, связанного с группой
СООН
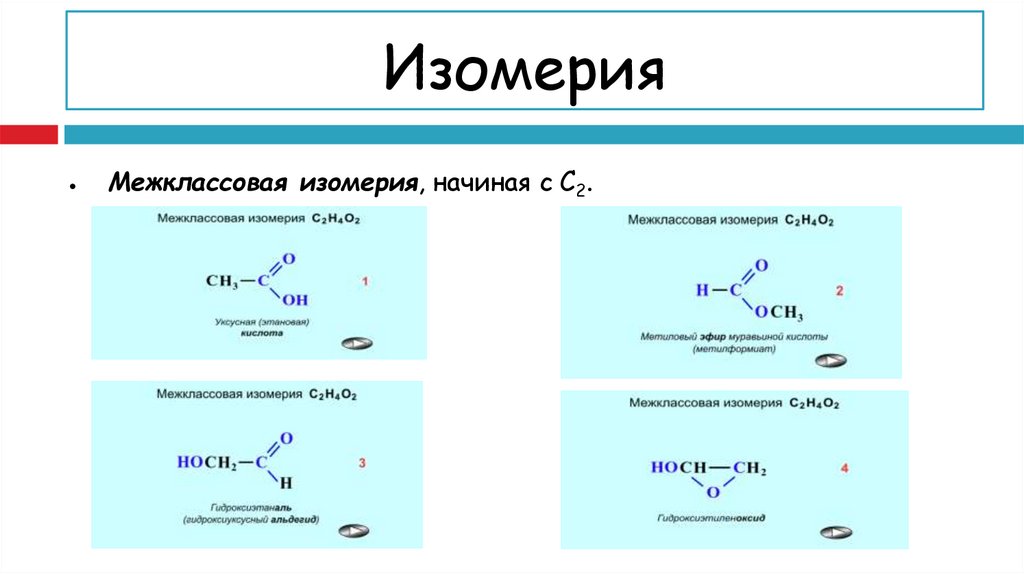
15. ВИДЫ ИЗОМЕРИИ у карбоновых кислот:
I. Cтруктурная изомерия (на примере одноосновных кислот)Изомерия скелета в углеводородном радикале (начиная с C4).
16.
ИзомерияМежклассовая изомерия, начиная с C2.
17.
ИзомерияII. Пространственная изомерия
а) цис-транс-Изомерия характерна для:
- непредельных карбоновых кислот, содержащих двойную связь с
разными заместителями, например,
Изомеры бутен-2-овой кислоты
18.
ИзомерияII. Пространственная изомерия
- замещённых алициклических кислот
Алициклические карбоновые кислоты — соединения, в молекулах которых группа
СООН связана с замкнутым кольцом из частично или полностью насыщенных
атомов углерода.
Изомеры 2-метилциклопропанкарбоновой
кислоты
19.
ИзомерияII. Пространственная изомерия
б) Оптическую изомерию проявляют:
- кислоты, в молекулах которых присутствует асимметрический
атом (Асимметрический атом — тетраэдрический sp3-атом,
связанный с четырьмя различными заместителями)
20.
ИзомерияII. Пространственная изомерия
б) Оптическую изомерию проявляют:
-транс-изомеры замещённых алициклических кислот, например,
Таким образом, 2-метилциклопропанкарбоновая кислота существует
в виде 3-х стереоизомеров (цис-изомер и 2 транс-изомера).
21. Строение карбоксильной группы -COOH
Карбоксильная группа –COOH, характер её химических связей, строениеуглеводородного радикала R и их взаимное влияние определяют
свойства карбоновых кислот R–COOH.
Группа –COOH содержит две функциональные группы —
карбонильную >С=О и гидроксильную –OH, связанные между собой.
Находясь в непосредственной связи, эти группы взаимно влияют друг
на друга и видоизменяют свои свойства.
Для атомов углерода и кислорода группы >C=O характерно состояние
sp2-гибридизации. Атом кислорода ОН-группы, связанный в составе
карбоксильной группы с sp2-атомом углерода, также имеет sp2гибридизацию.
22. Строение карбоксильной группы -COOH
Для атомов углерода и кислорода группы >C=O характерно состояниеsp2-гибридизации. Атом кислорода ОН-группы, связанный в составе
карбоксильной группы с sp2-атомом углерода, также имеет sp2гибридизацию.
Поэтому все три атома О(sp2)–С(sp2)–О(sp2) лежат в одной плоскости, а
их негибридизованные p-орбитали расположены перпендикулярно этой
плоскости.
23. Строение карбоксильной группы -COOH
При перекрывании p-орбиталей образуется система сопряжения сделокализованными связями O...C...O, по которой передаётся
взаимное влияние групп ОН и С=О.
24. Строение карбоксильной группы -COOH
Взаимное влияние атомов в молекулах карбоновых кислотхарактеризуется электронными эффектами атомных групп.
Группа
Электронный
эффект
>С=О
–I и –M
–ОН
+M и более
слабый –I
В целом группа СООН по отношению к
углеводородному
радикалу
R
является
электроноакцепторным заместителем.
–СООН –I и –M*
I - индуктивный эффект, M - мезомерный эффект
* Для группы СООН при sp2 или sp-атоме радикала R.
25. Строение карбоксильной группы -COOH
Электронное строение карбоксильной группы придаёт карбоновымкислотам характерные свойства.
1)
2)
3)
Карбоксильная группа содержит три полярные ковалентные связи: С=О, С–О и О–Н, способные к
гетеролитическому разрыву. Поэтому реакции с их участием идут в основном по ионному
механизму.
Смещение электронной плотности к карбонильному атому кислорода вызывает
дополнительную, по сравнению со спиртами и фенолами, поляризацию связи О–Н, что
определяет бо́льшую подвижность водородного атома, то есть более сильные кислотные
свойства.
Пониженная электронная плотность (δ+) на атоме углерода в СООН-группе способствует
взаимодействию карбоновых кислот с нуклеофильными реагентами. При этом +М-эффект ОНгруппы уменьшает частичный положительный заряд атома углерода в группе С=О. В отличие от
альдегидов и кетонов, вступающих с нуклеофилами в реакцию нуклеофильного
присоединения, для карбоновых кислот характерно нуклеофильное замещение группы –ОН.
26. Строение карбоксильной группы -COOH
4) Атом кислорода в группе С=О, имея неподелённую пару электронов, способен присоединятьпротон Н+ (при действии сильной кислоты). Это играет важную роль в кислотном катализе
реакций нуклеофильного замещения.
5) Группа –СООН за счёт положительного заряда на атоме углерода снижает электронную
плотность на связанном с ней углеводородном радикале R, то есть является по отношению к нему
электроноакцепторным заместителем. В случае предельных кислот карбоксильная группа
проявляет –I-эффект, а в непредельных (например, CH2=CH–COOH) и ароматических (С6Н5–
СООН) — как –I, так и –М-эффект. Выступая в качестве заместителя, карбоксильная группа влияет
на направление реакций, идущих по углеводородному радикалу.
6) Атом водорода в полярной группе Оδ– - Нδ+ одной молекулы кислоты и атом кислорода группы
Сδ+ = Оδ– другой молекулы способны к образованию межмолекулярной водородной связи
–O–H...O=C, что во многом определяет физические свойства карбоновых кислот.
27. Физические свойства карбоновых кислот
Способность веществ к образованию водородных связей во многомопределяет их физические свойства.
Для карбоновых кислот характерны ассоциирующие водородные связи,
которые возникают за счёт полярных групп О–Н и С=О, принадлежащих
разным молекулам:
Такое межмолекулярное связывание затрудняет переход вещества в газообразное
состояние, то есть повышает температуру его кипения.
Способность к ассоциации молекул увеличивается при переходе от альдегидов и
кетонов (где нет Н-связей) к спиртам и, далее, к кислотам. Поэтому для карбоновых
кислот характерны более высокие температуры кипения.
28. Физические свойства карбоновых кислот
Сравнение температур кипения альдегидов, спиртов и кислотМолекулярн
ая масса
T. кип., °C
CH3CH2CHO
58
49
Спирт
CH3CH2CH2OH
60
97
Кислота
CH3CООН
60
118
Класс
Формула
Альдегид
29. Физические свойства карбоновых кислот
При нормальных условияхкарбоновые кислоты
существуют в жидком или
твёрдом состоянии
Кислота
Формула
Т. пл., °C
T. кип., °C
Муравьиная
HCOOH
8
101
Уксусная
СН3COOH
17
118
Масляная
СН3(СН2)2COOH
–5
164
Акриловая
CH2=CHCOOH
12
141
Бензойная
C6H5COOH
122
249
Щавелевая
HOOC–COOH
189
-
30. Физические свойства карбоновых кислот
Например, простейший представитель – муравьиная кислотаНСООН – бесцветная жидкость с т. кип. 101 °С,
а чистая безводная уксусная кислота CH3COOH при охлаждении до 17 °С
превращается в прозрачные кристаллы, напоминающие лёд
(отсюда ее название ледяная кислота).
Видеоопыт "Ледяная уксусная кислота".
Простейшая ароматическая кислота – бензойная C6H5COOH (т. пл. 122,4 °С)
– легко возгоняется, то есть переходит в газообразное состояние, минуя
жидкое. При охлаждении её пары сублимирутся в кристаллы. Это свойство
используется для очистки вещества от примесей.
Видеоопыт "Возгонка бензойной кислоты".
31. Физические свойства карбоновых кислот
Растворимость карбоновых кислот в воде обусловлена образованиеммежмолекулярных водородных связей с растворителем (H2O):
Низшие гомологи С1–С3 смешиваются с водой в любых соотношениях.
С увеличением углеводородного радикала растворимость кислот в
воде уменьшается.
Высшие кислоты, например, пальмитиновая C15H31COOH и стеариновая
C17H35COOH – бесцветные твердые вещества, не растворимые в воде.
32. Методы получения карбоновых кислот:
В основе большинства методов получения карбоновых кислот лежатреакции окисления соединений других классов (углеводородов, спиртов,
альдегидов), поскольку функциональная группа кислот -СООН содержит
углеродный атом в более высокой степени окисления (+3).
1. Окисление углеводородов:
а) частичное окисление алканов с разрывом связи С–С
В промышленности этим способом получают уксусную кислоту из нбутана:
33. Методы получения карбоновых кислот:
б) окисление алкенов с разрывом связи С=Св) окисление аренов с углеводородным радикалом в боковой цепи
34. Методы получения карбоновых кичлот:
2. Окисление альдегидов:3. Окисление первичных спиртов:
4. Взаимодействие реактива Гриньяра с диоксидом углерода СО2:
35. Методы получения карбоновых кислот:
5. Щелочной гидролиз галогенозамещенных углеводородов, содержащих триатома галогена у одного атома углерода:
6. Гидролиз нитрилов (Нитрилы RC≡N получают действием цианидов калия
или натрия на галогеноуглеводороды (реакция нуклеофильного замещения
галогена на группу CN):
36. Методы получения карбоновых кислот:
✦ Для получения отдельных представителей карбоновых кислот наряду с общимиметодами применяют также специальные способы ситеза.
7. Эффективными методами промышленного синтеза муравьиной и уксусной
кислот являются реакции карбонилирования (введения карбонильной группы С=О)
под действием оксида углерода(II).
Муравьиную кислоту HCOOH получают взаимодействием СО с горячим
раствором гидроксида натрия при повышенном давлении; образовавшуюся при
этом соль (формиат натрия) обрабатывают серной кислотой для вытеснения
муравьиной кислоты
37. Методы получения карбоновых кислот:
Уксусная кислота CH3COOH образуется при реакции метанола c оксидомуглерода(II) по схеме:
CH3OH + CO → CH3COOH
(катализатор – соли родия)
38. Химические свойства карбоновых кислот
В молекулах карбоновых кислот можно выделить ряд реакционных центров,определяющих возможные реакции с участием как карбоксильной группы, так и
углеводородного радикала
Реакционные центры карбоксильной группы
39. Химические свойства карбоновых кислот
1) ОН-кислотный центр определяет кислотные свойства (способностьотщеплять протон);
2) С участием электрофильного центра (атома углерода карбоксильной
группы) происходят реакции нуклеофильного замещения группы –ОН
в карбоновых кислотах с образованием функциональных производных
(сложных эфиров, амидов, ангидридов, галогенангидридов и др.);
3) Оснóвный центр – атом кислорода карбонильной группы с
неподелённой электронной парой, способный присоединять протон H+.
Это свойство используется при кислотном катализе реакций
нуклеофильного замещения;
40. Химические свойства карбоновых кислот
4) Cвязь R—C является реакционным центром в реакциях декарбоксилирования –деструкции карбоновой кислоты с удалением карбоксильной группы в виде
диоксида углерода CO2.
Выступая в качестве заместителя, карбоксильная группа влияет на реакции,
идущие по углеводородному радикалу.
41. Химические свойства карбоновых кислот
Реакционные центры в углеводородныхрадикалах:
1) Реакционным центром в радикалах предельных кислот
является СН-кислотный центр. Под влиянием
электроноакцепторной СООН-группы соседняя α-СН-связь
радикала становится полярной Cδ––Hδ+. Это определяет
возможность реакций замещения атома водорода в α-звене
метильного, первичного или вторичного алкильного радикала.
Кислоты с третичным радикалом, например, (CH3)3C–COOH
42. Химические свойства карбоновых кислот
Реакционные центры в углеводородныхрадикалах:
2) В радикалах непредельных кислот (RCH=CH–COOH,
RC≡C–COOH), по отношению к которым карбоксильная
группа проявляет –I и –М-эффекты, реакционным
центром служит кратная связь С=С или С≡C,
вступающая в реакции присоединения. При этом атом
водорода полярного реагента Hδ+–Xδ– присоединяется к
менее гидрогенизированному атому Cδ– кратной связи
(против правила Марковникова).
43. Химические свойства карбоновых кислот
Реакционные центры в углеводородныхрадикалах:
3) Реакционным центром в радикалах ароматических кислот
(С6Н5–СООН) под влиянием –I и –М-эффектов группы СООН
является наиболее полярная связь С–Н в положении 3 (мета)
бензольного кольца, которая участвует в реакциях электрофильного
замещения. В этом случае карбоксильная группа
(электроноакцепторный заместитель) выступает как
ориентант 2-го рода.
44. Химические свойства карбоновых кислот
Реакционные центры в углеводородныхрадикалах:
4) Особое место в ряду карбоновых кислот занимает
муравьиная кислота HCOOH, которую можно
рассматривать одновременно как кислоту и как
альдегид. В отличие от других карбоновых кислот
муравьиная кислота легко окисляется (даёт реакцию
серебряного зеркала). Активным реакционным
центром при этом является связь H—C в
альдегидной группе. При окислении муравьиной
H–COOH
кислоты образуется неустойчивая угольная кислота
H2CO3, распадающаяся на оксид углерода(IV) и воду:
HO–COOH
CO2↑ + H2O
45. Химические свойства карбоновых кислот
I. Кислотные свойства карбоновых кислот. Образование солейКарбоновые кислоты значительно превосходят по кислотности спирты ROH и
фенолы ArOH. В водном растворе карбоновые кислоты диссоциируют на ионы:
R–COOH + H2O
R–COO– + H3O+
Кислая среда обнаруживается с помощью индикаторов.
46. Химические свойства карбоновых кислот
Степень диссоциации зависит от устойчивости анионов RCOO– (карбоксилатионов). Эти анионы стабильнее (и легче образуются), чем соответствующиеспиртам и фенолам анионы RO– и ArO–.
Причина большей устойчивости карбоксилат-ионов — равномерное распределение
(делокализация) отрицательного заряда между двумя атомами кислорода:
Однако карбоновые кислоты в целом – слабые кислоты: в водных растворах их
соли сильно гидролизованы.
Видеоопыт "Карбоновые кислоты – слабые электролиты".
47. Химические свойства карбоновых кислот
Сила кислот зависит от строения радикала. Электроноакцепторныезаместители в радикале усиливают кислотность. Так, в ряду
хлоруксусных кислот их сила возрастает с увеличением количества
электроотрицательных атомов хлора:
Электронодонорные заместители, напротив, уменьшают кислотные
свойства карбоксила. Поэтому пропионовая кислота CH3CH2COOH и
последующие гомологи слабее уксусной кислоты, а самой сильной в
гомологическом ряду одноосновных кислот является муравьиная
кислота H–COOH.
48. Химические свойства карбоновых кислот
Соли карбоновых кислот RCOO–Me+ (на примере монокарбоновых) получаютпри действии на кислоты:
а) активных металлов
2RCOOH + Mg → (RCOO)2Mg + H2↑
б) аммиака (без нагревания)
RCOOH + NH3 → RCOONH4
в) основных оксидов
2RCOOH + CuO → (RCOO)2Cu + H2O
г) гидроксидов металлов и аммония
RCOOH + NaOH → RCOONa + H2O
Видеоопыт
Видеоопыт
Видеоопыт
д) солей более слабых кислот
2RCOOH + Na2CO3 → 2RCOONa + H2O + CO2↑ Видеоопыт
49. Химические свойства карбоновых кислот
Названия солей составляют из названий остатка RCOO-(
50. Химические свойства карбоновых кислот
(карбоксилат-иона) и металла:CH3COONa – ацетат натрия,
(HCOO)2Ca – формиат кальция,
C17H35COOK – стеарат калия и т.п.
В названиях кислых солей многоосновных кислот используются приставки гидро,
дигидро. Например, соли лимонной кислоты (цитраты): гидроцитрат натрия или
дигидроцитрат натрия
51. Химические свойства карбоновых кислот
Более сильные кислоты вытесняют карбоновые кислоты из их солей:CH3COONa + HCl → CH3COOH + NaCl
В водном растворе соли щелочных металлов в значительной степени
гидролизованы. Поэтому такие растворы имеют щелочную реакцию.
R–COONa + H2O
R–COOH + NaOH
• Соли предельных карбоновых кислот способны к расщеплению с выделением
диоксида углерода (реакция декарбоксилирования) Реакция Дюма.
52. Химические свойства карбоновых кислот
• Соли предельных карбоновых кислот способны к расщеплению с отщеплениемдиоксида углерода (реакция декарбоксилирования)
Декарбоксилирование молей предельных карбоновых кислот, приводит к
образованию алканов.
а) Реакция Дюма - это сплавление солей карбоновых кислот с
щелочами. При этом отщепляется карбоксилатная группа (–COOMe), и
образуется карбонат:
Видеоопыт
53. Химические свойства карбоновых кислот
б) электролиз водных растворов щелочных солей карбоновыхкислот – Реакция Кольбе:
54. Химические свойства карбоновых кислот
II. Реакции кислот по углеводородному радикалуКарбоксильная группа влияет на связанный с ней углеводородный радикал,
проявляя свойства электроноакцепторного заместителя.
В зависимости от природы радикала карбоновые кислоты могут вступать в
реакции:
-замещения атома водорода в α-СН-группе алкильного радикала;
- замещения водорода в бензольном кольце ароматического радикала;
- присоединения по кратной углерод-углеродной связи непредельного радикала.
В результате этих реакций образуются замещенные карбоновые кислоты Z-RCOOH с новой функциональной группой Z (Cl, Br, OH, NO2, NH2 и др.).
55. Химические свойства карбоновых кислот
1. Замещение водорода в α-СН-звене радикала:Реакции этого типа характерны для предельных карбоновых кислот, в молекулах
которых группа -СOОH находится при sp3-атоме углерода. Под влиянием
–I-эффекта карбоксильной группы в молекуле карбоновой кислоты повышается
полярность связи С–Н в α-положении (соседнем с группой СООН). Это
увеличивает подвижность атома водорода и способствует его замещению.
56. Химические свойства карбоновых кислот
Например, замещение α-водородородного атома на галоген (Сl, Br)происходит в присутствии красного фосфора в качестве катализатора:
CH3CH2COOH + Cl2 (Pкрасн., t)
CH3CHClCOOH + HCl
(реакция Гелля-ФольгардаЗелинского
Реакция галогенирования насыщенных карбоновых кислот имеет важное значение,
так как открывает путь к синтезу гетерофункциональных кислот – α-гидрокси- и
α-аминокислот.
57. Химические свойства карбоновых кислот
2. Замещение в ароматическом радикале:Ароматические карбоновые кислоты вступают в реакции электрофильного
замещения по бензольному кольцу в соответствии с правилами ориентации. По
отношению к ароматическому радикалу карбоксильная группа ориентантам 2-го
рода. Эта группа направляет электрофильное замещение в ароматическом ядре в
мета-положение (3 или 5).
58. Химические свойства карбоновых кислот
3. Присоединение по связи С=С в непредельном радикале:Непредельные карбоновые кислоты способны к реакциям присоединения по
кратным углерод-углеродным связям в углеводородном радикале.
Наибольшее влияние на эти реакции оказывает группа –CОOН, если она находится
в сопряжении со связью С=С (например, в акриловой кислоте CH2=CH–CООH) и
проявляет по отношению к радикалу –I и –М-эффекты. В этом случае карбоновая
кислота вступает в реакцию электрофильного присоединения против правила
Марковникова:
59. Домашнее задание:
Читать § 20 учить. Презентацию разобрать.Письменное задание прикреплено к ЭЖД.
60. Функциональные производные карбоновых кислот
Карбоновыекислоты
проявляют
высокую
реакционную способность. Они вступают в реакции с
различными веществами и образуют разнообразные
соединения, среди которых важное значение имеют
функциональные производные — соединения,
полученные в результате реакций по карбоксильной
группе, а при гидролизе образующие карбоновую
кислоту.
61. Функциональные производные карбоновых кислот
62. Функциональные производные карбоновых кислот
Карбоновые кислоты и их функциональные производные находятся втесной взаимосвязи друг с другом. На схеме показаны возможные пути
их взаимопревращений:
63. Функциональные производные карбоновых кислот
В основе этих превращений лежат реакции нуклеофильного замещенияпри sp2-атоме углерода в соединениях R–CO–Z,
где Z = OH, OR', OCOR, Cl, NH2 и т.п.
Реакционная способность таких соединений увеличивается в ряду:
RCONH2 < RCOOR' < RCOOH < (RCO)2O < RCOCl
Наибольшей активностью обладают хлорангидриды RCOCl и
ангидриды (RCO)2O. Реакции с их участием практически необратимы.
Поэтому эти соединения, в особенности хлорангидриды, широко
применяются для получения других производных (сложных эфиров
спиртов и фенолов, амидов и т.п.)
64. Функциональные производные карбоновых кислот
1. Сложные эфиры RCOOR' образуются при взаимодействии спиртов скарбоновыми кислотами (реакция этерификации):
Для получения сложных эфиров спиртов и фенолов используются также
более активные производные карбоновых кислот – галогенангидриды или
ангидриды.
65. Функциональные производные карбоновых кислот
Галогенангидриды — производные кислот, в которых гидроксильныегруппы заменены атомами галогена. RCOCl
Ангидриды карбоновых кислот RCOOH — соединения (RCO)2O,
образующиеся при отщеплении одной молекулы воды от двух
молекул кислоты. (RCO)2O:
66. Функциональные производные карбоновых кислот
2. Амиды RCONH2 – функциональные производные карбоновыхкислот, в которых гидроксил OH замещён на аминогруппу NH2. Одним
из способов получения амидов является действие аммиака на
карбоновые кислоты с нагреванием образующейся аммониевой соли:
67. Функциональные производные карбоновых кислот
3. Нитрилы R–С≡N – органические соединения, в которых углеводородныйрадикал связан с группой -C≡N (циан).
Простейший представитель – нитрил уксусной кислоты CH3–C≡N - Ацетонитрил
Тривиальные названия нитрилов формируют, заменяя суффикс ил в тривиальном названии ацильного
радикала R-CO на суффикс онитрил:
CH –C≡N – ацетонитрил (нитрил уксусной кислоты),
CH CH –C≡N – пропионитрил (нитрил пропионовой кислоты),
CH =CH–C≡N – акрилонитрил (нитрил акриловой кислоты).
Систематические названия составляют добавлением суффикса онитрил к названию родоначального
углеводорода:
CH (CH ) –CN – гептанонитрил.
3
3
2
2
3
2
5
68. Функциональные производные карбоновых кислот
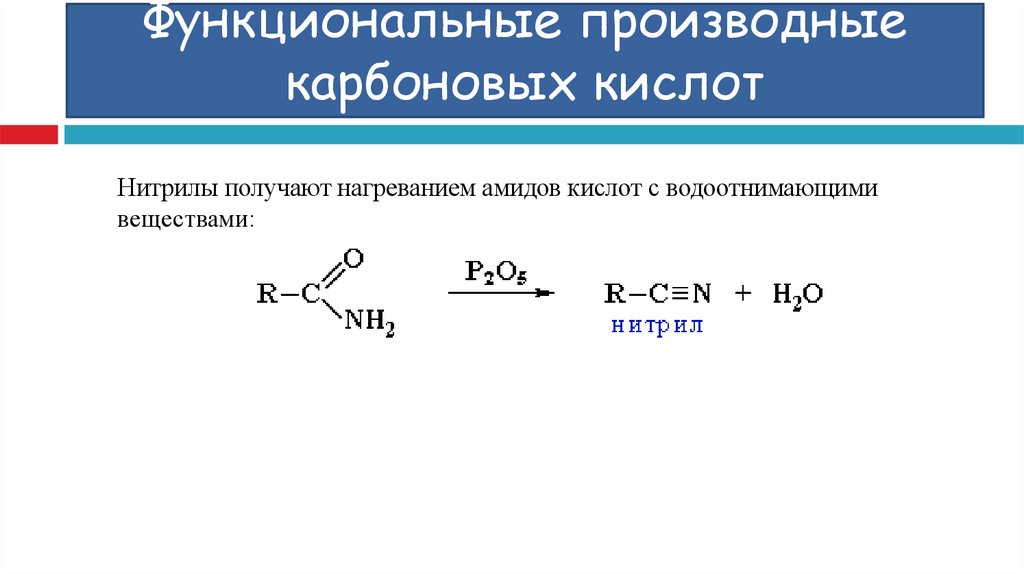
Нитрилы получают нагреванием амидов кислот с водоотнимающимивеществами:
69. Функциональные производные карбоновых кислот
4. Галогенангидриды (ацилгалогениды) R-CO-Hal – функциональныепроизводные карбоновых кислот, в которых гидроксильная группа заменена на
галоген (Hal).
Названия галогенангидридов состоят из названия группы ацил R-CO и
суффикса галогенид (хлорид, бромид и т.п.).
Например, CH3COCl – ацетилхлорид.
Часто используются систематические названия ацилов, состоящие из
названия соответствующего углеводорода и суффикса оил:
C3H7COCl – бутаноилхлорид,
(CH3)2CHCOBr – 2-метилпропаноилбромид.
70. Функциональные производные карбоновых кислот
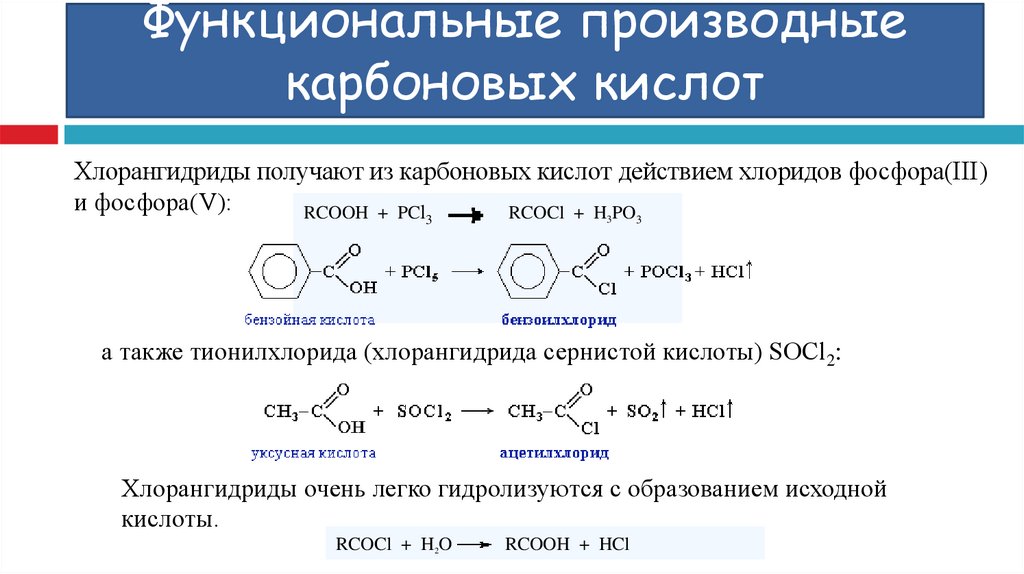
Хлорангидриды получают из карбоновых кислот действием хлоридов фосфора(III)и фосфора(V):
RCOOH + PCl
RCOCl + H3PO
3
3
а также тионилхлорида (хлорангидрида сернистой кислоты) SOCl2:
Хлорангидриды очень легко гидролизуются с образованием исходной
кислоты.
RCOCl + H2O
RCOOH + HCl
71. Функциональные производные карбоновых кислот
5. Ангидриды (R-CO)2О – функциональные производные карбоновыхкислот, в которых гидроксильная группа -ОН заменена на группу -OCO-R (карбоксилат).
Названия ангидридам даются по названию соответствующей кислоты (с
заменой слова кислота на ангидрид):
(CH3CO)2O – уксусный ангидрид,
(C6H5CO)2O – бензойный ангидрид,
(CH3CH2CH2CH2CH2CO)2O – гексановый ангидрид.
72. Функциональные производные карбоновых кислот
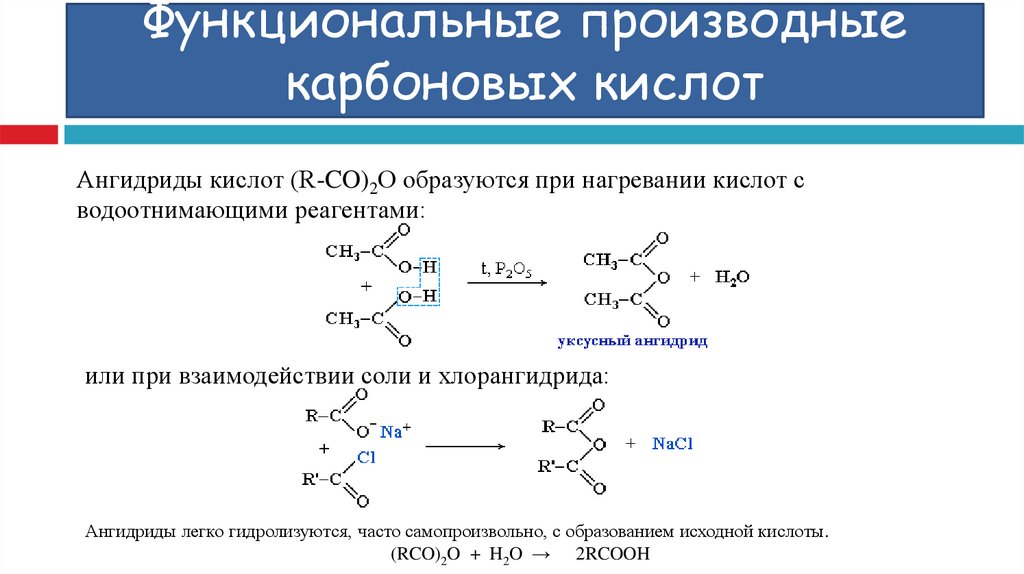
Ангидриды кислот (R-CO)2О образуются при нагревании кислот сводоотнимающими реагентами:
или при взаимодействии соли и хлорангидрида:
Ангидриды легко гидролизуются, часто самопроизвольно, с образованием исходной кислоты.
(RCO)2O + H2O → 2RCOOH

































































 Химия
Химия








