Похожие презентации:
Буферные системы. Буферные растворы
1.
ЛекцияБуферные системы
1
2.
Буферные системы (БС)-это растворы, обладающие свойством достаточно стойко
сохранять постоянство рН при добавлении небольшого
коли-чества сильной кислоты, щелочи, а также при
разбавлении или концентрировании.
2
3.
Сама эта способность называется буферным действием (БД).БС обычно состоят из двух компонентов, по природе которых
БС делят на 4 типа:
1 тип- БС: состоящие из слабой кислоты и соли этой
кислоты с сильным основанием, например:
CH3COOH
CH3COONa
ацетатный
НСООН
НСООN
формиатный
Н2СО3
NаНСО3
гидрокарбонат
ный
ННb
КНb
ННbО2
КНbО2
гемоглоби
Оксигемогло
новый
биновый
3
4.
АЦЕТАТНЫЙ БУФЕРCH3COOH + H2O
CH3COO‾ +
CH3COONa
H 3 O+
CH3COO‾ +
Na+
одноименный ацетат ион подавляет диссоциацию
уксусной кислоты и можно считать ,что БД оказывает
кислотно-основная (К/О) пара:
CH3COOH
слабая кислота
кислотный резерв
/
и
CH3COO‾
ее сильное сопр.
основание
щелочной резерв
4
5.
БД заключается в том что:а) при действии на БС небольшого количества
сильной кислоты H+ (HCl, HNO3, H2SO4...) идет реакция
H+
сильная
кислота
+
CH3COO‾
→
CH3COOH
щелочной резерв
кислотный резерв
уменьшается
увеличивается
при этом pH практически не изменяется, так как сильная
кислота замещается эквивалентным количеством слабой
(CH3COOH) кислоты.
5
6.
б) при действии на БС небольшого количестващелочи OH‾ (NaOH, KOH...) идет реакция
OH‾ +
щелочь
CH3COOH
→
CH3COO‾
+ H2O
кислотный резерв
щелочной резерв
уменьшается
увеличивается
при этом pH практически не изменяется, так как сильное
основание OH‾ замещается эквивалентным количеством
слабого электролита H2O.
Для поддержания постоянства pH необходимы оба
компонента. Если один из компонентов будет полностью
исчерпан, то БС перестанет действовать.
6
7.
В ацетатном буферном растворе устанавливается равновесие:СH3COOH ↔ H+ + СH3COOМожно схематически представить, что буферная способность данной
системы обусловлена наличием двух больших резервуаров, в одном из
которых находится кислота СH3COOH, а в другом — основание СH3COO- :
Когда в буферный раствор приливают небольшое количество
сильного основания (ОН–), из левого резервуара поступает кислота,
нейтрализуя
добавленное
основание.
Правый
резервуар
срабатывает при добавлении кислот (Н+).
7
7
8.
Значение pH БС рассчитывают поуравнению Гендерсона-Гессельбаха: pH = pKк+ lg
Если Ссоли = Скислоты, то pH = pKk+ lg
буфферное
соотношение
Если
=
lg Vc / Vk ≈
1/9 …
-1...
2/8 ...
5/5 ... 8/2 … 9/1
0...
+1
Тогда интервал pH, в котором БС будет оказывать БД, т.е.
∆pH = pKк ± 1
Для ацетатного буфера ∆pH = 4,75 ± 1, т.е. интервал рН в котором
будет действовать данный буфер от 3,75 до 5,75.
8
9.
При разбавлении и концентрировании БС буферноесоотношение не изменяется, т.к. оба компонента одинаково
разбавляются или концентрируются.
Например: Vc / Vк = 3 / 7, если разбавить в 2 раза
Vc / Vк = 3 • 2 / 7 • 2
Это используется в клинических лабораториях.
Например: моча это буферный раствор, поэтому ее можно
разбавить водой до исчезновения цвета и потом определить pH
колориметрическим методом.
9
10.
Мерой БД является буферная емкость (БЁ) - величина,характеризующая способность БС противодействовать
изменению pH при добавлении сильной кислоты или щелочи.
БЁ показывает число молей сильной кислоты или щелочи,
которые нужно добавить к 1 л БС, чтобы изменить pH на 1
единицу:
Буферная ёмкость (В)
В по кислоте:
В по щелочи:
CкVк
CщVщ
Bk= VБС · ∆pH
Bщ = VБС · ∆pH
10
11.
Водородокарбонатная буферная система:HCO3
H 2CO3
K 4,37·10
7
pK 6,37
С учётом растворенного СО2 (37oС)
HCO3
CO2 H 2CO3
K 7,76·10 7
pK 6,11
11
11
12.
Уравнение Гендерсона-Гассельбаха(для расчета рН крови)
[HCO3 ]
pH 6,11 lg
pСO2
рСО2 – альвеолярное давление
(парциальное давление СО2 воздуха, находящегося
в равновесии с кровью)
12
12
13.
20pH крови 6,11 lg
7,4
1
Поскольку [НСО3–]:[СО2] = 20 : 1, а HCO3¯ работает
против кислоты, то водородокарбонатная система имеет
буферную емкость по кислоте значительно больше буферной
емкости по основанию. Это отвечает особенностям
метаболизма организма.
13
13
14.
Механизм действия водородокарбонатной буферной системыПри увеличении в крови концентрации ионов Н+
происходит выделение СO2, который выводится из организма в
процессе дыхания через легкие:
H+ + HCO3¯ H2CO3 CO2 + H2O
При поступлении в кровь оснований, они связываются
угольной кислотой, и равновесие смещается в сторону
образования НСО3 ¯ : OH ¯ + H2CO3 HCO3 ¯ + H2O
Нарушение кислотно-основного равновесия в организме
компенсируется водороднокарбонатной буферной системы
за 10-15 мин.
Соотношение [НСО3¯ ]/[Н2СО3] изменяется и приходит в
норму за счет легочной вентиляции в течение 10-18 часов.
Водородокарбонатный буфер – является основной
буферной системой плазмы крови и содержится также в
эритроцитах, межклеточной жидкости и в почечной ткани. 1414
15.
БС 2-го типа - например, аммиачный буфер:состав NH4OH + NH4Cl по правилу протолиза записывают:
NH3+ H2O
NH4Cl
→
NH4+ + OH ‾ ионизация слабого основания
NH4+ + Cl‾
диссоциация соли
Кислотно- основное равновесие устанавливается
при
pK(NH3) = 4.75
Одноименный ион NH4+
подавляет ионизацию NH3 и можно считать, что БД оказывает
кислотно-основная пара
NH4+
/
сопр.сильная к-та
NH3
слабое основание
кислотный
щелочной
резервы
15
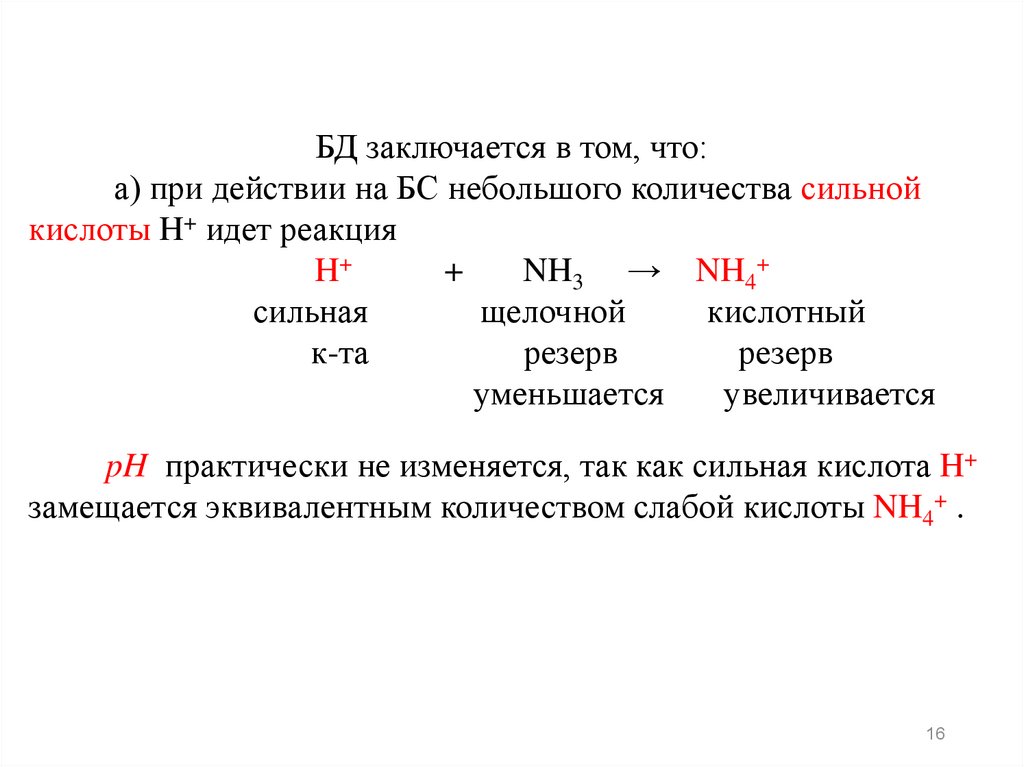
16.
БД заключается в том, что:а) при действии на БС небольшого количества сильной
кислоты H+ идет реакция
H+
+
NH3 → NH4+
сильная
щелочной
кислотный
к-та
резерв
резерв
уменьшается
увеличивается
pH практически не изменяется, так как сильная кислота H+
замещается эквивалентным количеством слабой кислоты NH4+ .
16
17.
б) при действии щелочи на БС идет реакцияOH‾ +
NH4+ →
NH3 + H2O
сильное
кислотный
щелочной
основание
резерв
резерв
уменьшается увеличивается
при этом pH практически не изменяется, так как OH‾
замещается эквивалентным
количеством H2O.
17
18.
Значение pH БС 2-го типа определяют по уравнениюГендерсона -Гассельбаха: pOH = pKосн+ lg
т.к. pH + pOH = 14, то
и можно записать
pH=14- pKoсн - lg
рН = 14 - рОН
, если же
Сс = Сосн, то
pH=14- pKoсн - lg
Зона буф. действия ∆pOH = pKосн ± 1 или
pH =14 - (pKoсн ± 1)
В организме этот тип БС представлен аминами и их солями
18
19.
БС 3-го типа- например фосфатный буфер: состоит из двухкислых солей фосфорной кислоты, одна из которых проявляет
свойства кислоты, а другая - свойства ее сопряженного
основания. По правилам протолиза
NaH2PO4
→ Na+ + H2PO4‾
H2PO4‾ + H2O
HPO42- + H3O+
Na2HPO4→ HPO42- + 2Na+
БД оказывает К-О пара
К-О равновесие
pK H2PO4¯ = 7,2
H2PO4‾ / HPO42кислотный и щелочной
резервы
а) при действии сильной кислоты идет реакция:
H+
+ HPO42- → H2PO4‾
б) при действии щелочи на БС идет реакция
OH‾ + H2PO4‾ → HPO42- + H2O
19
20.
В отличие от гидрокарбонатной, фосфатная системаболее «консервативна».
Избыточные продукты нейтрализации выводятся через
почки и полное восстановление отношения [НРО42–] / [H2PO4–]
происходит только через 2-3 суток.
Выведение тех или иных компонентов фосфатной
буферной системы с мочой, в зависимости от перерабатываемой пищи, объясняет широкий интервал значений рН мочи
( 4,8 до 7,5. )
20
21. БС 4-го типа - амфолиты. Например: это аминокислотные и белковые буферные системы: NH2-Pt-COOH NH2 -Pt-COONa
COOH+ H+
COOH
Рt-CH
катион.форма
NH3+ белок- к-та
COO‾
+H2O
NH2
Pt-CH
Z= +
Pt-CH
ионизация
Z=0
альбумины
и глобулины
NH3+
COO‾
+OH‾
Pt-CH
Z= анион. форма
NH2 белок-основание
В плазме крови участвуют в
поддержании рН крови
21
22.
Гемоглобиновая буферная система:Гемоглобиновая
H-Hb
K-Hb
венозная кровь
рН = 7.32 – 7.36
Оксигемоглобиновая
HHbО2
К-HbО2
артериальная кровь
рН = 7.42 – 7.46
~ 35 % общего буферного
действия крови
~ 63-75 % общего буферного
действия в эритроцитах
22
22
23.
Белки составляют 20% массы клетоки тканей, поэтому белковая буферная
система является одной из мощных
буферных систем организма.
Белковая буферная система
поддерживает постоянство рН в клетках и
тканях.
В крови работает анионный белковый
буфер.
Попадающие на кожу человека небольшие количества
кислоты или щелочи довольно быстро нейтрализуются
белковой буферной системой
23
23
24.
Зона буферного действияСc
pH pК д кисл lg
Ск
1
pH pК д кисл lg
10
10
pH pК д кисл lg
1
pH pK 1
ацетатный
4,75
7
фосфатный
7,21
6,37
бикарбонатный
рН
9,25
амиачный 2424
25.
Буферные системы крови:водородокарбонатная, фосфатная, белковая,
гемоглобиновая.
Из кишечника и тканей в кровь при обмене веществ
постоянно поступают различные кислоты: угольная,
молочная, масляная… и, в меньшей степени, основания:
аммиак, креатин.
Благодаря наличию буферных систем, рН крови
остается постоянным 7.4 ± 0.04
В организме человека в спокойном
ежесуточно
образуется
количество
эквивалентное ≈ 30 л 1 н НСI !!!!
состоянии
кислоты,
25
25
26.
Значение буферных систем для организма.Организм человека обладает тонким механизмом
координации физиологических и биологических процессов
назваемых гомеостазом.
Они осуществляются путем гуморальной регуляции,
т.е. регуляции посредством жидких систем организма:
кровью, лимфой, тканевой жидкостью...
Примером гомеостаза является поддержание
постоянства pH для каждой жидкости организма, например, в
плазме pH = 7,4 ± 0,05 , у внутриклеточной жидкости
эритроцитов pH =7,25, в моче pH = 4,8-7,5, в желудочном соке
pH = 0,9-1,1.
Достигается это постоянство с помощью регуляторных
механизмов, из которых важная роль принадлежит Б.С.
26
27.
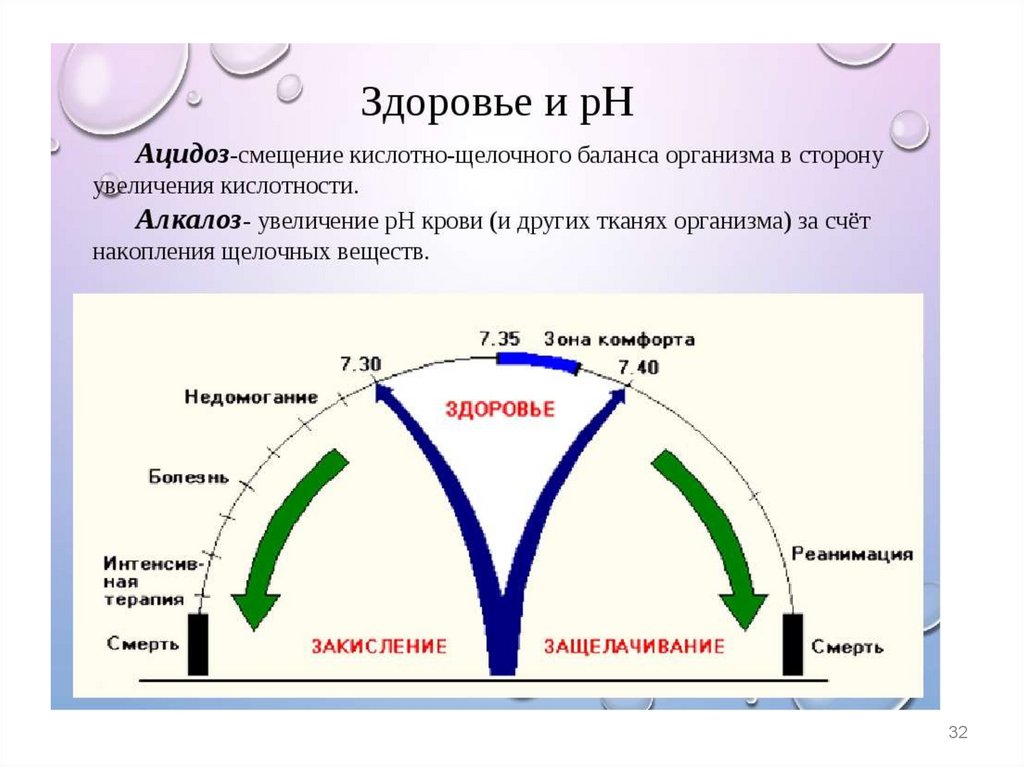
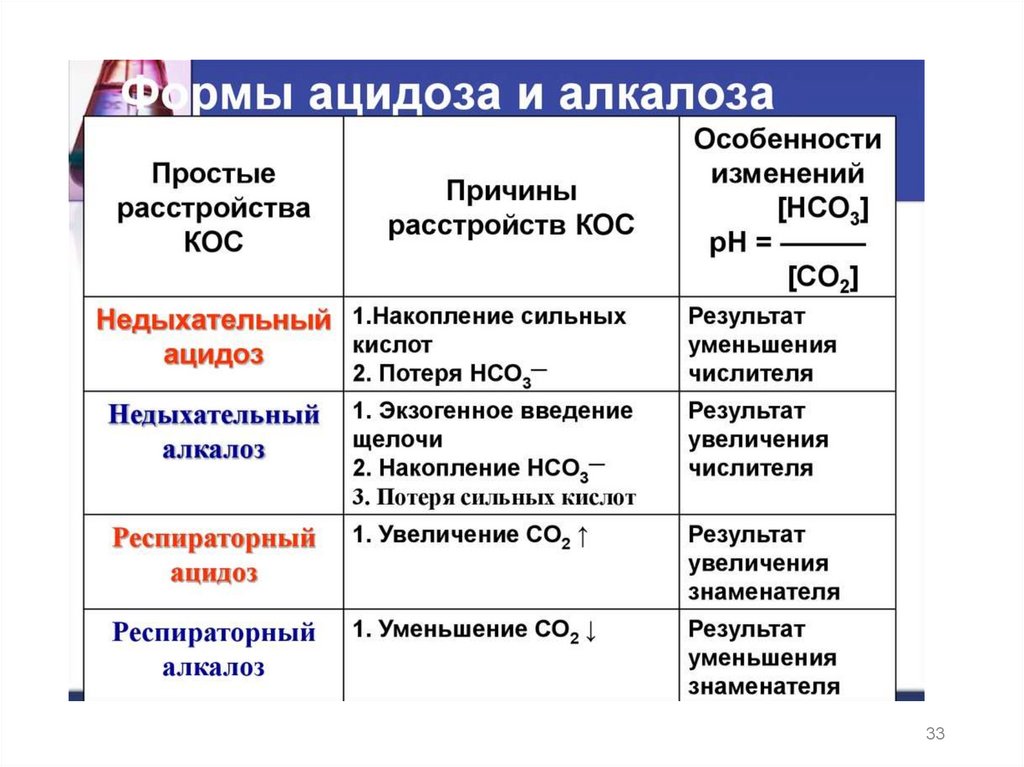
Постоянство pH крови называется изогидрией, анарушение этого постоянства ацидозом и алкалозом.
Нарушения кислотно- основного равновесия в
организме могут быть :
1) респираторными (газовыми) связанными с нарушением
работы легких,
2) клиническими они легко выявляются(одышка)
27
28.
Например, в организме осуществляется следующееравновесие:
I
II
CO2 + H2O ↔ H2CO3 ↔ H+ + HCO3‾
a) при воспалении легких из-за плохой вентиляции в легких
накапливается CO2, т.е. увеличивается концентрация CO2,
увеличивается скорость реакции I и равновесие сместится
вправо, у человека наблюдается одышка.
б) при поступлении в организм питьевой соды:
NaHCO3→ Na++HCO3‾
увеличивается концентрация HCO3‾ и соответственно
скорость реакции II, а образующийся CO2 выводится через
легкие
28
29.
2) метаболические нарушения связанные с работойпочек, могут протекать бессимптомно, и для их
выявления необходим лабораторный контроль;
метаболический ацидоз наблюдается, например, при
диабете, при голодании
метаболический алкалоз наблюдается при
недостатке НСО3¯ или избытке нелетучих кислот в
межклеточной жидкости, а также при рвоте
29
30.
Все буферные системы организма обладают большей буферной емкостью по кислоте, чем по основанию,( поскольку характеризуются соотношением):
1 : 4 < [акцептор протона]/[донор протона] < 1 : 20
Это соотношение находится в соответствии с
особенностями метаболизма человеческого организма,
образующего больше кислотных продуктов, чем сновных.
Именно поэтому очень важным показателем для
физиологических сред является буферная емкость Вк по
кислоте.
При заболеваниях органов дыхания, кровообращения, печени, желудка, почек, при отравлениях, голодании,
диабете, ожоговой болезни может наблюдаться уменьшение или увеличение Вк по сравнению с нормой.
Возникают патологические явления: ацидоз и алкалоз.
30
30
31.
Ацидоз– накопление в организме кислых продуктов
уменьшение рН крови в сравнении с нормой
(уменьшение кислотной буферной емкости в
сравнении с нормой)
Алкалоз
– накопление в организме щелочных продуктов
увеличение рН крови в сравнении с нормой
(увеличение кислотной буферной емкости в
сравнении с нормой)
31






























 Химия
Химия








