Похожие презентации:
Аминокислоты. Строение. Классификация
1.
Презентация к уроку«Аминокислоты»
План:
строение
классификация
изомерия
номенклатура
химические свойства
получение аминокислот
значение аминокислот в жизни человека.
2.
Аминокислоты — главный материал для строениямышечных тканей. Так считали медики до
недавнего времени.
Последние исследования роли аминокислот
заставили дополнить традиционный взгляд.
Оказывается, аминокислоты являются активными
участниками важнейших процессов в организме.
От них зависит не только рост силы и массы мышц,
но и восстановление физического и психического
тонуса после тренировок, катаболизм
подкожного жира и даже интеллектуальная
деятельность мозга.
3.
АминокислотыN H2 – C H – C O O H
R
Производные карбоновых кислот,
содержащие в своем составе одну или
несколько аминогрупп.
4.
АминокислотыПриродные
Их около 150, они были
обнаружены в живых
организмах, около 20 из
них входят в состав
белков. Половина этих
аминокислот –
незаменимые
(не синтезируются
в организме человека,
они поступают с
пищей.)
Синтетические
Получают кислотным
гидролизом белков
либо из карбоновых
кислот, воздействуя на
них галогеном
и, далее, аммиаком.
5.
Все природные аминокислотыимеют тривиальные названия
6.
Все природные аминокислотыимеют тривиальные названия
7.
НоменклатураПо систематической номенклатуре названия
аминокислот образуются из названий соответствующих
кислот прибавлением приставки амино- и указанием
места расположения аминогруппы по отношению
к карбоксильной группе.
8.
НоменклатураЧасто используется другой способ построения названий
аминокислот- рациональная номенклатура, согласно
которой к тривиальному названию карбоновой кислоты
добавляется приставка амино- с указанием положения
аминогруппы буквой греческого алфавита (α, β, γ, δ, ε и
т.д.)
9.
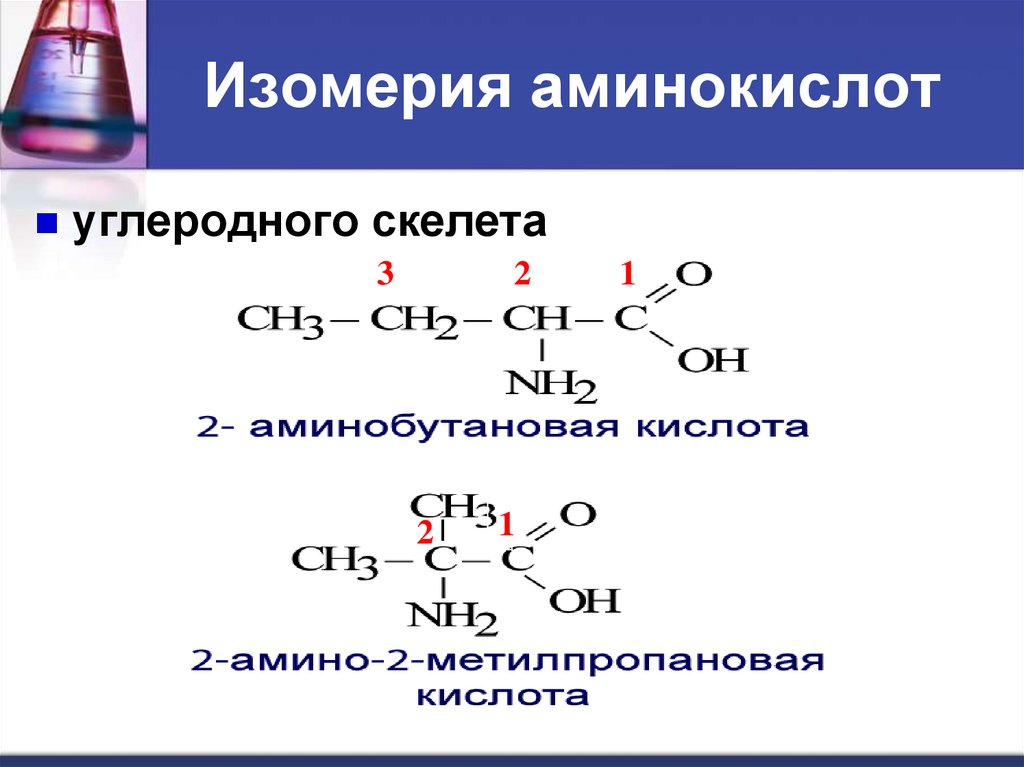
Изомерия аминокислотуглеродного
скелета ;
положения функциональных групп ;
межклассовая (нитросоединения,
нитроэфиры);
оптическая.
10.
Изомерия аминокислотуглеродного скелета
3
2
2
1
1
11.
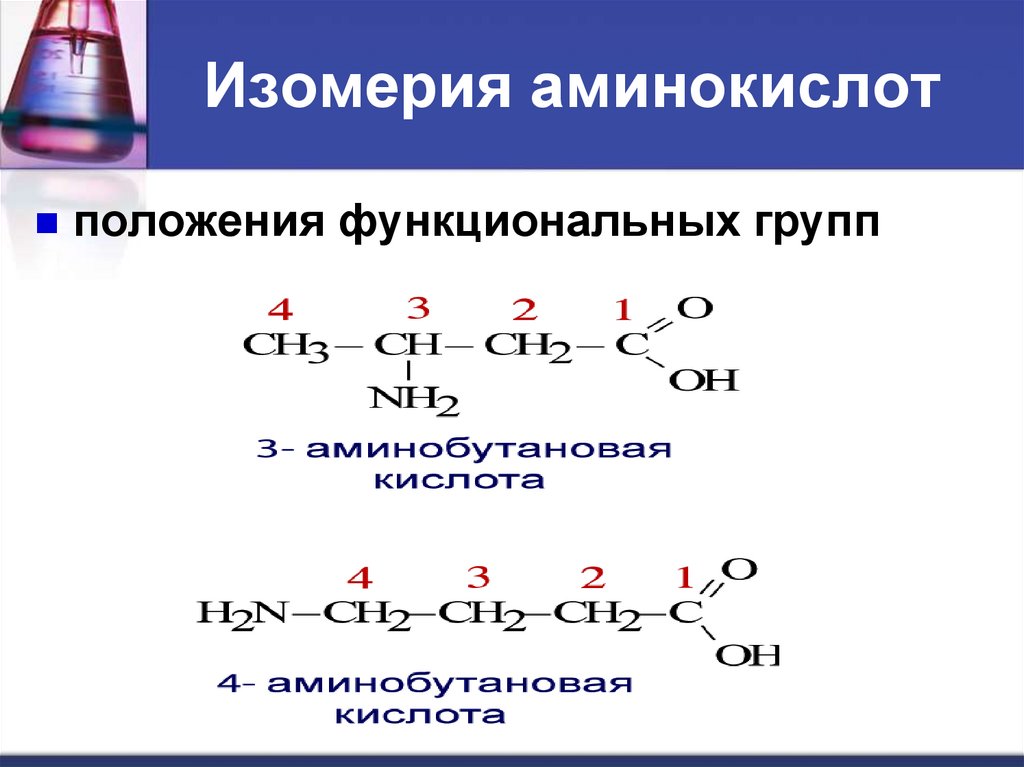
Изомерия аминокислотположения функциональных групп
12.
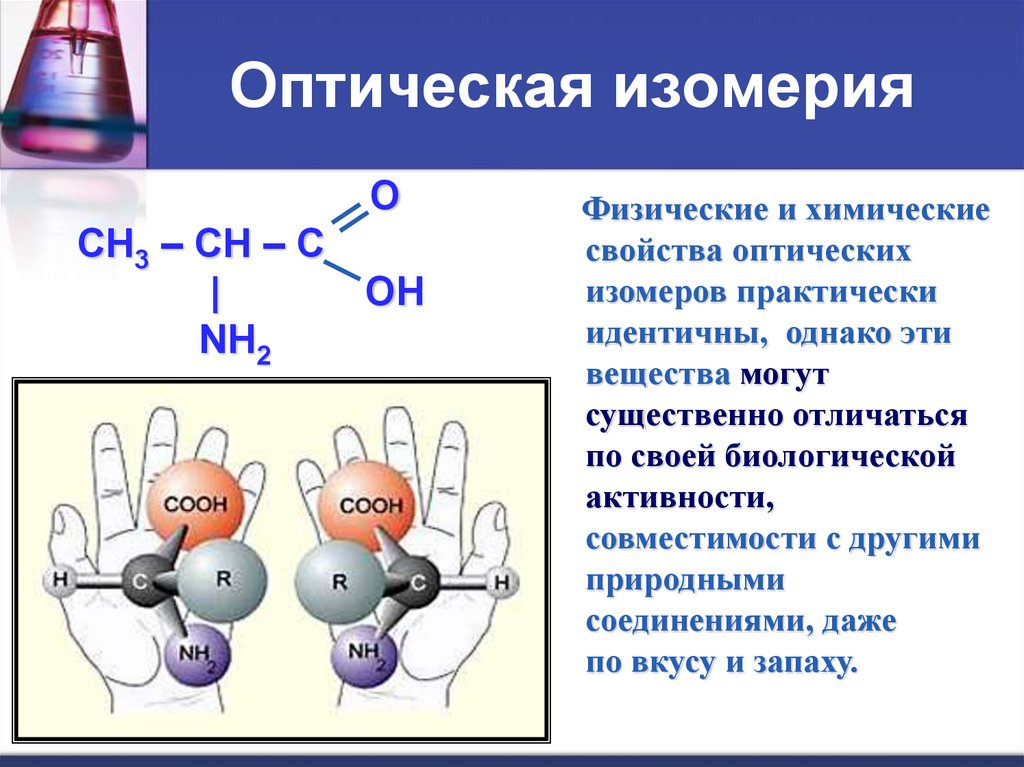
Оптическая изомерияO
CH3 – CH – C
|
OH
NH2
2- аминопропановая кислота
Физические и химические
свойства оптических
изомеров практически
идентичны, однако эти
вещества могут
существенно отличаться
по своей биологической
активности,
совместимости с другими
природными
соединениями, даже
по вкусу и запаху.
13.
Физические свойстваАминокислоты
бесцветные;
кристаллические;
хорошо растворимы в воде, но малорастворимы
в органических растворителях;
в зависимости от R могут быть сладкими,
горькими или безвкусными;
обладают оптической активностью;
плавятся с разложением при температуре выше
200º.
14.
Химические свойстваНаличие аминои карбоксильной групп
определяет двойственность
химических свойств
аминокислот.
Амфотерность (от греч.
amphуteros – «и тот и другой») –
способность некоторых веществ
в зависимости от условий
проявлять либо кислотные,
либо основные свойства;
амфотерные вещества иногда
называют амфолитами.
15.
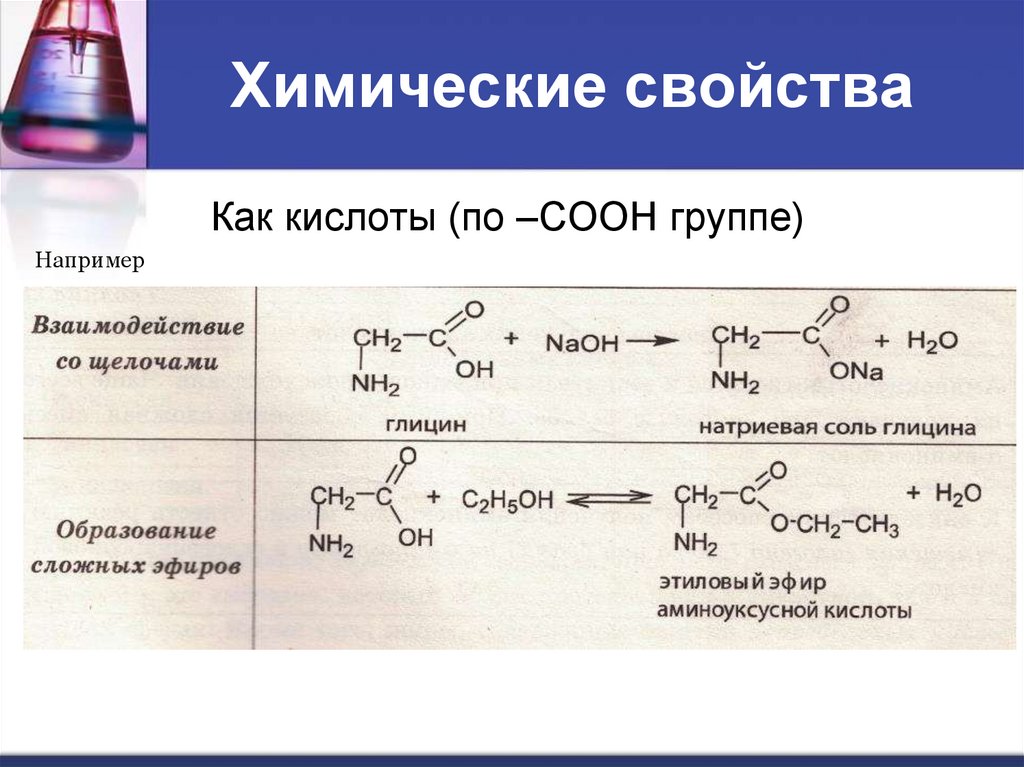
Химические свойствапо гр. –СООН
со щелочами
с металлами
с оксидами и
гидроксидами
металлов
с солями более
слабых или
летучих кислот
со спиртами
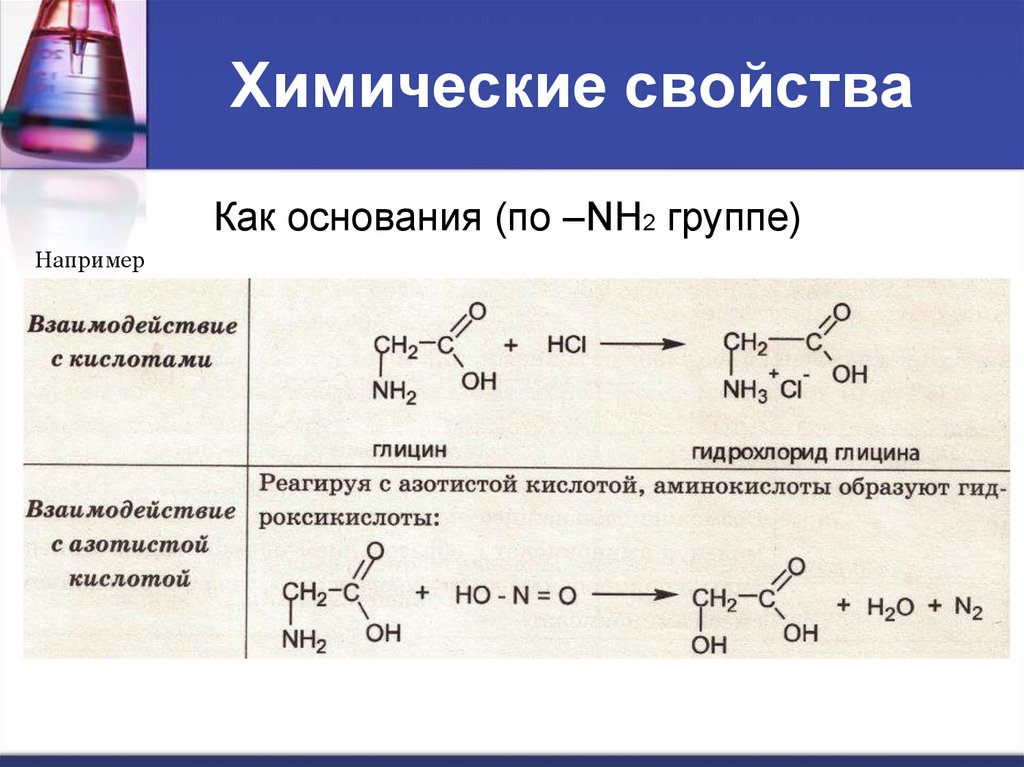
По гр. –NH2
с сильными
кислотами
с галогеноводородами
ВЗАИМОДЕЙСТВИЕ
ФУНКЦИОНАЛЬНЫХ
ГРУПП
Образование
внутренних
солей
Образование
молекул белков
16.
Химические свойстваКак кислоты (по –СООН группе)
Например
17.
Химические свойстваКак основания (по –NН2 группе)
Например
18.
Химические свойстваВодные растворы аминокислот имеют
нейтральную, щелочную или кислую среду в
зависимости от количества функциональных
групп.
Так, глутаминовая кислота образует кислый
раствор (две группы –COOH, одна -NH2 (см.
таблицу выше), а лизин – щелочной раствор ( одна
группа –COOH, две -NH2 )
19.
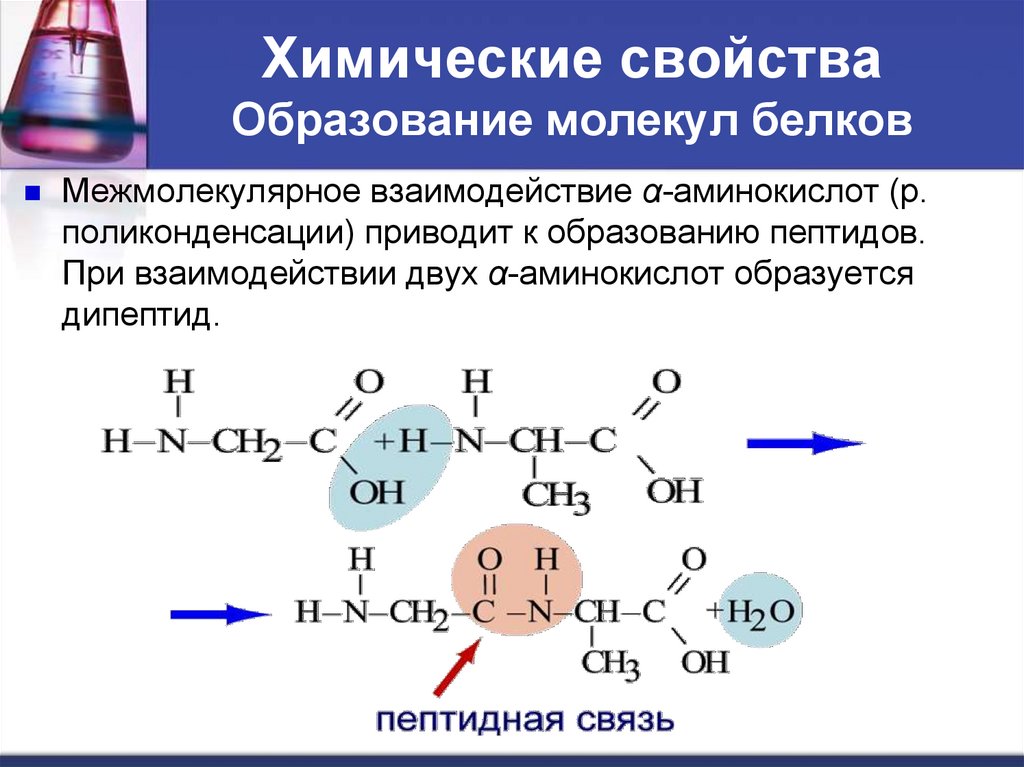
Химические свойстваОбразование молекул белков
Межмолекулярное взаимодействие α-аминокислот (р.
поликонденсации) приводит к образованию пептидов.
При взаимодействии двух α-аминокислот образуется
дипептид.
20.
Химические свойстваОбразование биполярного иона
Молекулы аминокислот в твердом состоянии и в
водных растворах существуют в виде биполярных
ионов (внутренних солей), которые образуются за счет
переноса протона от карбоксильной группы к
аминогруппе.
21.
Химические свойстваКомплексообразование
O
2 NH2CH2-COOH + Cu(OH)2 C- O
NH2 CH2
Cu – O - C + 2H2O
CH2- NH2
O
синий раствор
Аминокислоты образуют комплексное соединение синего цвета с
Cu(OH)2. Это качественная реакция на аминокислоты.
Для проведения реакции часто используют основный карбонат
меди – (CuOH)2CO3, который постепенно растворяется в растворе
аминокислоты, при этом заметно выделение пузырьков
углекислого газа, т.к. кислоты, содержащие карбоксильную группу,
более сильные, чем угольная, и вытесняют ее их солей.
22.
Химические свойства- При нагревании аминоуксусная кислота может отщеплять
углекислый газ
t
H2N–CH2–COOH
H2N–CH3 + CO2↑
- Аминокислоты, имеющие в своем составе бензольное
кольцо, реагируют с концентрированной азотной
кислотой, образуя нитропроизводные желтого цвета. Эта
реакция называется ксантопротеиновой.
23.
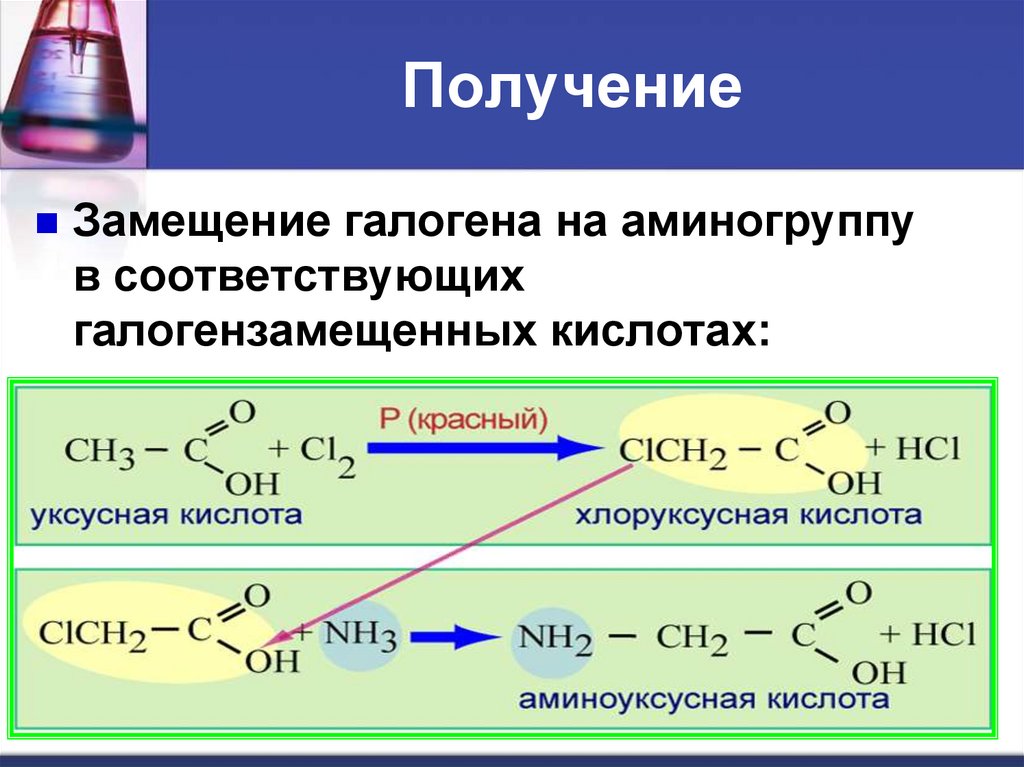
ПолучениеЗамещение галогена на аминогруппу
в соответствующих
галогензамещенных кислотах:
24.
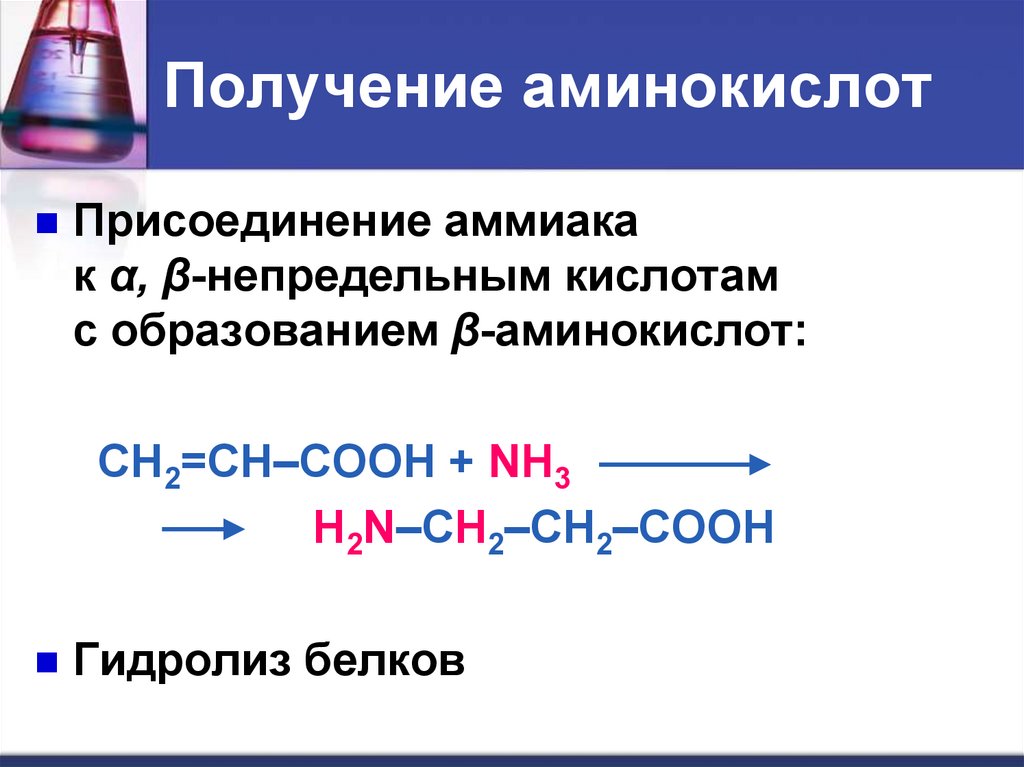
Получение аминокислотПрисоединение аммиака
к α, β-непредельным кислотам
с образованием β-аминокислот:
CH2=CH–COOH + NH3
H2N–CH2–CH2–COOH
Гидролиз белков
25.
Значение аминокислот в жизничеловека. Применение
-
-
Аминокислоты входят в состав белков и являются необходимым
элементом питания;
Используются для получения лекарственных препаратов;
ε-аминокапроновая кислота используется для получения волокна
капрон.
26.
Значение аминокислот в жизничеловека. Применение
27.
Значение аминокислот в жизничеловека. Применение



















 Химия
Химия