Похожие презентации:
20220216_ammiak
1.
Подготовила урок учительхимии Медведева О.В.
2.
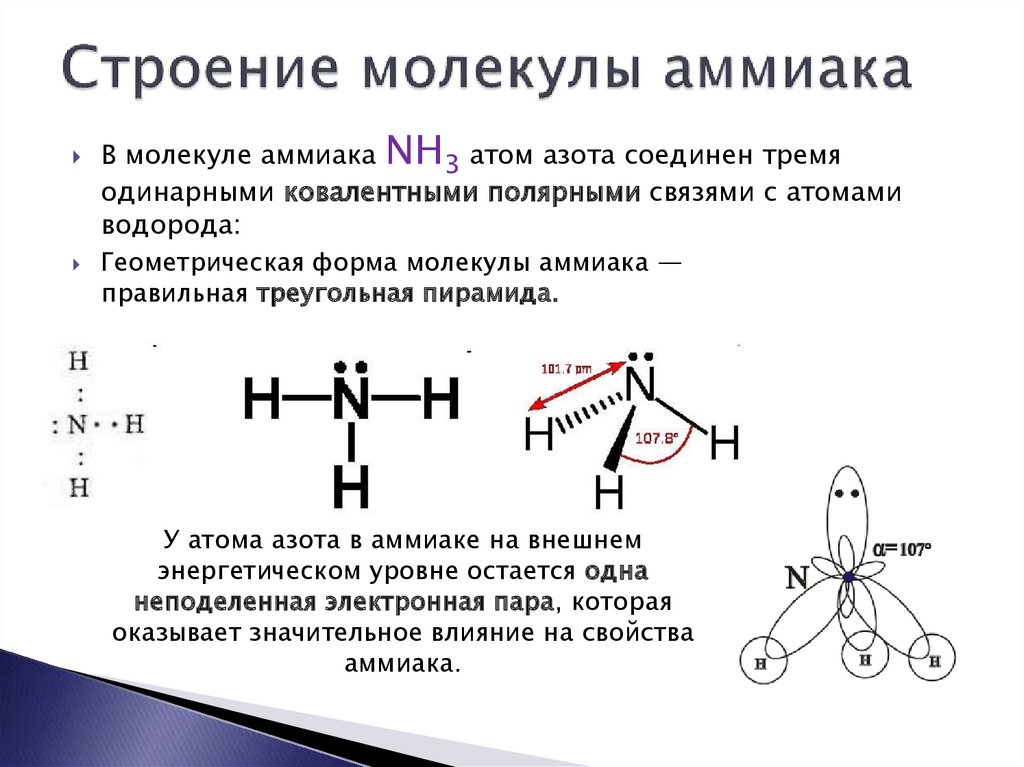
В молекуле аммиака NH3 атом азота соединен тремяодинарными ковалентными полярными связями с атомами
водорода:
Геометрическая форма молекулы аммиака —
правильная треугольная пирамида.
У атома азота в аммиаке на внешнем
энергетическом уровне остается одна
неподеленная электронная пара, которая
оказывает значительное влияние на свойства
аммиака.
3.
Аммиак – бесцветный газ с резкимхарактерным запахом. Ядовит. Весит меньше
воздуха. Связь N-H — сильно полярная,
поэтому между молекулами аммиака в
жидкой фазе возникают водородные связи.
При этом аммиак очень хорошо растворим в
воде, т.к. молекулы аммиака образуют
водородные связи с молекулами воды.
4.
В лаборатории аммиак получают привзаимодействии солей аммония с щелочами.
2NH4Cl + Са(OH)2 → CaCl2 + 2NH3 + 2Н2O
Гидролиз нитридов:
Ca3N2 + 6H2O → ЗСа(OH)2 + 2NH3
В промышленности аммиак получают с
помощью процесса Габера: прямым синтезом
из водорода и азота.
N2 + 3Н2 ⇄ 2NH3
5.
В водном растворе аммиак проявляетосновные свойства.
Как основание, аммиак взаимодействует с
кислотами:
NH3 + H2SO4 → NH4HSO4 (при изб. кислоты)
2NH3 + H2SO4 → (NH4)2SO4 (при изб. аммиака)
NH3 + HCl → NH4Cl
6.
В качестве основания, водный раствораммиака реагирует с растворами солей
тяжелых металлов, образуя нерастворимые
гидроксиды.
FeSO4 + 2NH3 + 2H2O → Fe(OH)2 + (NH4)2SO4
Соли и гидроксиды меди, никеля,
серебра растворяются в избытке аммиака,
образуя комплексные соединения –
аминокомплексы.
4NH3 + CuCl2 → [Cu(NH3)4]Cl2
7.
Аммиак горит на воздухе, образуя азот иводу:
NH3 + O2 →N2 + H2O
Если реакцию проводить в присутствии
катализатора (Pt), то азот окисляется до NO:
NH3 + O2 → NO + H2O
Задание : уравнять данные реакции методом
электронного баланса.
8.
Используя параграф 29 составьте схемуприменения аммиака
9.
Параграф 29.№8, 9
Составить задачу, используя химические
свойства аммиака. И представить её
решение.








 Химия
Химия