Похожие презентации:
20220412_struktura_pshe
1. ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И.МЕНДЕЛЕЕВА.
АВТОР: КОСТЫЧЕВ АНДРЕЙУЧ-СЯ 9 КЛАССА МАОУ СОШ№4
п. НОВООРСК.
РУКОВОДИТЕЛЬ: ШУРЫГИНА ГАЛИНА
АЛЕКСАНДРОВНА
УЧИТЕЛЬ ХИМИИ.
2. ЦЕЛЬ:
ПОПЫТАТЬСЯ ПРЕДСКАЗАТЬ БУДУЩЕЕ ПЕРИОДИЧЕСКОЙСИСТЕМЫ НА ОСНОВЕ ИМЕЮЩИХСЯ ФАКТОВ.
• ОБЪЕКТ ИССЛЕДОВАНИЯ:
• ПЕРИОДИЧЕСКИЙ ЗАКОНИ ПЕРИОДИЧЕСКАЯ
СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Д.И.МЕНДЕЛЕЕВА.
3. ЗАДАЧИ:
1. ИЗУЧИТЬ ИСТОРИЮ ОТКРЫТИЯ ПЕРИОДИЧЕСКОГО ЗАКОНА,А
ТАКЖЕ ПРЕДПОСЫЛКИ ЕГО ОТКРЫТИЯ.
2. ИССЛЕДОВАТЬ ФАКТЫ, ЯВЛЯЮЩИЕСЯ ЭКСПЕРИМЕНТАЛЬНЫМ
ПОДТВЕРЖДЕНИЕМ СПРАВЕДЛИВОСТИ ЗАКОНА,ЕГО
ИСТОРИЧЕСКОЙ ВАЖНОСТИ.
3. СРАВНИТЬ СВОЙСТВА ЭЛЕМЕНТОВ ПРЕДСКАЗАННЫЕ
УЧЕНЫМИ В XX ВЕКЕ,СО СВОЙСТВАМИ
ЭЛЕМЕНТОВ,СИНТЕЗИРОВАННЫХ В КОНЦЕ XX ВЕКА.
4. НА ОСНОВЕ ИЗУЧЕННОГО МАТЕРИАЛА ПОПЫТАТЬСЯ
ПРЕДСКАЗАТЬ БУДУЩЕЕ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ.
4. УЧЕНИЕ О СТРОЕНИИ АТОМОВ ВСКРЫЛО ГЛУБОКИЙ ФИЗИЧЕСКИЙ СМЫСЛ ПЕРИОДИЧЕСКОГО ЗАКОНА. ГЛАВНОЙ ХАРАКТЕРИСТИКОЙ АТОМА ЯВЛЯЕТСЯ
ПОЛОЖИТЕЛЬНЫЙ ЗАРЯД, РАСПОЛОЖЕННЫЙ В ЦЕНТРЕ АТОМА,А ЗНАЧИТ, И ЭЛЕМЕНТА.
ЗАРЯД ЯДРА ОПРЕДЕЛЯЕТ ЧИСЛО ЭЛЕКТРОНОВ В ЭЛЕКТРОННОЙ
ОБОЛОЧКЕ АТОМА , ЕЁ СТРОЕНИЕ, А ТЕМ САМЫМ ВСЕ
СВОЙСТВА ЭЛЕМЕНТА И ЕГО ПОЛОЖЕНИЕ В ПЕРИОДИЧЕСКОЙ
СИСТЕМЕ.
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Д.И.МЕНДЕЛЕЕВА ЯВЛЯЕТСЯ ГРАФИЧЕСКИМ ОТОБРА ЖЕНИЕМ
ПЕРИОДИЧЕСКОГО ЗАКОНА.
5.
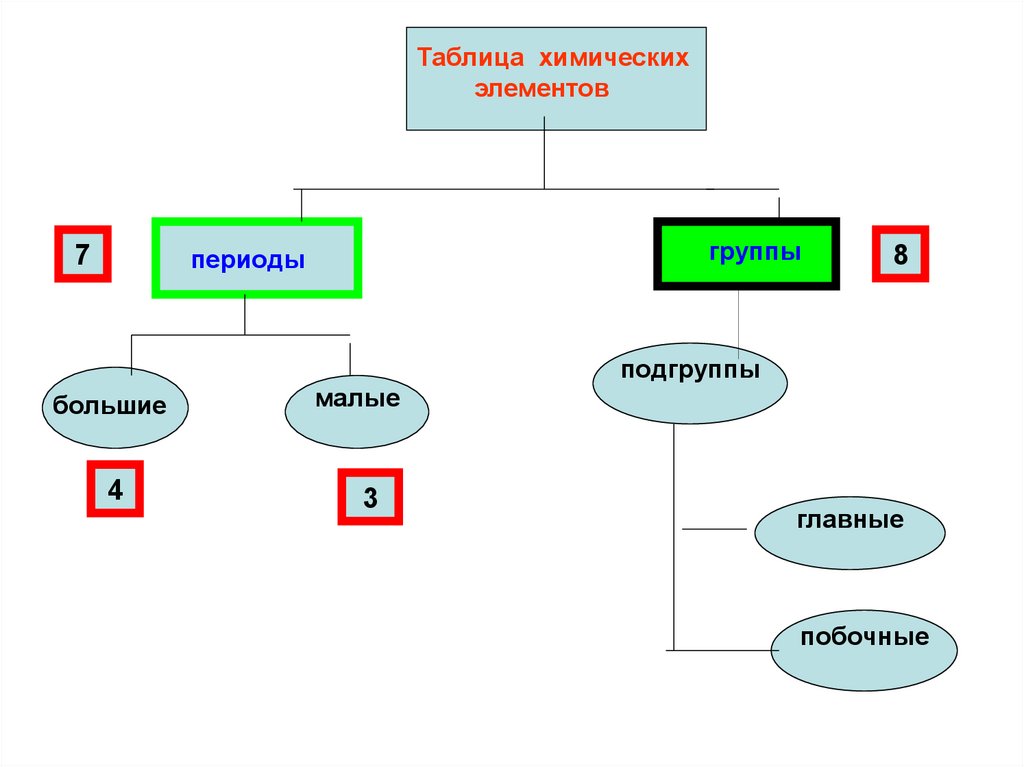
Таблица химическихэлементов
7
группы
периоды
большие
4
малые
3
8
подгруппы
главные
побочные
6. Структура периодической системы:
• Периодическая система химическихэлементов Д.И. Менделеева имеет:
• 7 периодов (большой и малый);
• 10 рядов (чётный и нечётный);
• 8 групп (главная и побочная)
7. Периодом называется ряд элементов, расположенных в порядке возрастания атомных масс, начинающийся со щелочного металла (за
исключением первого периода;он начинается с водорода) и
заканчивающийся инертным газом. В
первый период входят только два элемента,
во второй и третий — по восемь (эти
периоды называются малыми). Четвертый
период образован восемнадцатью
элементами, а пятый и шестой — еще
большим числом элементов. Их называют
большими периодами.
8. Чётный и нечетный ряд:
• В системе 10 рядов. Каждый малый период состоит из одногоряда; чётного (верхнего) и нечётного (нижнего). В чётных рядах
больших периодов ( 4; 6; 8 и 10) находятся одни металлы, и
свойства элементов в ряду слева направо изменяются слабо.
• В нечётных рядах больших периодов ( 5; 7 и 9) свойства
элементов в ряду слева направо изменяются как у типических
элементов.
• Основным признаком, по которому элементы разделены на два
ряда, является степень окисления (во времена Менделеева –
валентность)
9. Группы элементов.
Группа – это вертикальный ряд элементов, имеющиходинаковое количество электронов на внешнем
энергетическом уровне.
Номер группы связан со степенью окисления элементов,
проявляемой ими в соединениях. Как правило, высшая
Положительная степень окисления равна номеру группы.
Каждая группа делится на две подгруппы –
главная и побочная.
10.
Главная и побочная подгруппы подчёркиваются смещением однихэлементов влево, а других вправо.
Главную подгруппу составляют типические элементы (свойства которых
изменяются закономерно от типического металла до благородного газа)
-это элементы II и III периодов и сходные с ними по химическим
свойствам элементы больших периодов.
Побочную подгруппу составляют только металлы – элементы больших
периодов.
Химические свойства элементов главных и побочных подгрупп
значительно различаются. Например:
в VII группе главную подгруппу составляют неметаллы F, Cl, Br ,I ,At
а побочную – металлы Mn , Tc , Re.
Таким образом, подгруппы объединяют наиболее сходные между
собой элементы.
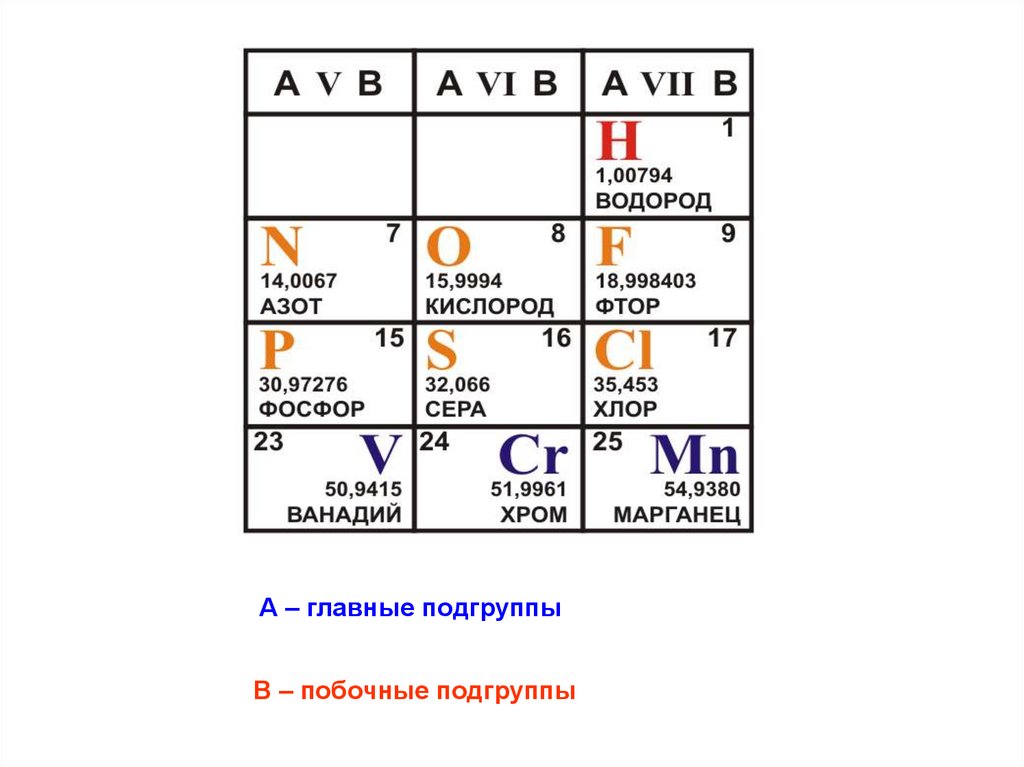
11.
А – главные подгруппыВ – побочные подгруппы
12. Актиноиды и лантаноиды.
• В VI периоде вслед за лантаном располагаются 14 элементов спорядковыми номерами 58-71 по свойствам похожие на лантан
– поэтому их назвали – лантаноидами.
• Такая же ситуация наблюдается в VII периоде у элементов с
порядковыми номерами 90 – 103. Их свойства похожи на
актиний, и называются они актиноидами.
13. Чтобы определить, какая подгруппа — главная, а какая — побочная, важно помнить, что в состав главных подгрупп входят элементы
как малых, таки больших периодов.
• Побочные подгруппы образованы только элементами
больших периодов. Например, в состав главной подгруппы
II группы входят элементы второго и третьего периодов —
бериллий Be и магний Mg. Побочная подгруппа начинается
с элемента четвертого (большого) периода — цинка Zn. И
еще одно отличие: главная подгруппа, как правило, состоит
из большего числа элементов, чем побочная (в VIII группе
наоборот).
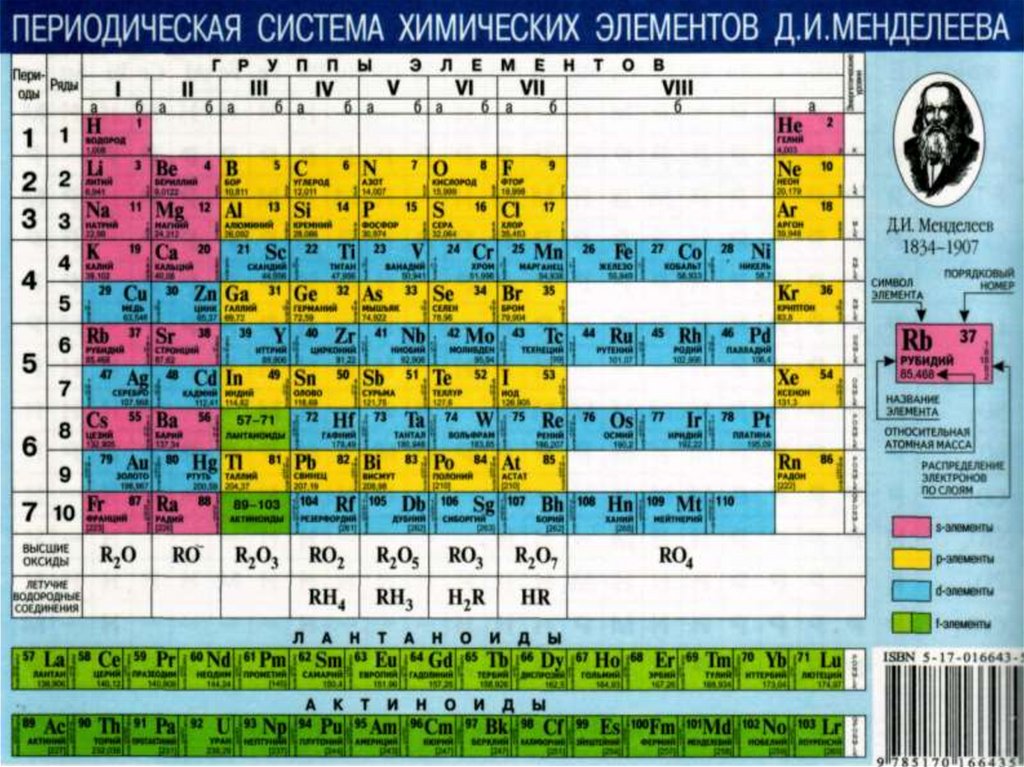
14. Периодическая система химических элементов существует в двух вариантах: длинный и короткий.
• Первым Д.И. Менделеев предложил вариант длиннойформы, в котором все периоды располагались одной
строкой.
• Основной недостаток этой этого варианта –
растянутость, некомпактность, т.к. часть клеток
системы пустует.
15. Форма периодической таблицы элементов, рекомендованная ИЮПАК
16. Вариант короткой формы:
• ЭТОТ ВАРИАНТ БОЛЕЕ КОМПАКТНЫЙ, ОДНАКОЕГО СУЩЕСТВЕННЫЙ НЕДОСТАТОК –
СОЧЕТАНИЕ В ОДНОЙ ГРУППЕ НЕСХОДНЫХ
ЭЛЕМЕНТОВ, Т.Е. СИЛЬНОЕ РАЗЛИЧИЕ СВОЙСТВ
ЭЛЕМЕНТОВ ГЛАВНЫХ И ПОБОЧНЫХ
ПОДГРУПП. ЭТО В КАКОЙ -ТО МЕРЕ
«ЗАТУШЁВЫВАЕТ» ПЕРИОДИЧНОСТЬ СВОЙСТВ
ЭЛЕМЕНТОВ И ЗАТРУДНЯЕТ ПОЛЬЗОВАНИЕ
СИСТЕМОЙ.
17.
18. ВЫВОД:
ТАКИМ ОБРАЗОМ, из всего сказанного следует, то, чтоПЕРИОДИЧЕСКАЯ СИСТЕМА химических элементов и
ПЕРИОДИЧЕСКИЙ ЗАКОН – БРАТЬЯ – БЛИЗНЕЦЫ;
Мы говорим «ПЕРИОДИЧЕСКИЙ ЗАКОН» –
подразумеваем ПЕРИОДИЧЕСКАЯ СИСТЕМА,
мы говорим «ПЕРИОДИЧЕСКАЯ СИСТЕМА» подразумеваем «ПЕРИОДИЧЕСКИЙ ЗАКОН»!
19. Литература:
• Агафошин Н.П. Периодический закон ипериодическая система элементов Д.И.
Менделеева. — М.: Просвещение, 1973. —
208 с.
• Макареня А.А., Рысев Ю.В. Д.И. Менделеев.
— М.: Просвещение, 1983. — 128 с.
• Макареня А.А., Трифонов Д.Н.
Периодический закон Д.И. Менделеева. — М.:
Просвещение, 1969. — 160 с.
















 Химия
Химия








