Похожие презентации:
Металлы (1)
1. ГБПОУ КСУ №32
МЕТАЛЛЫ
2.
МеталлыМеталлы – это элементы, атомы которых
легко отдают электроны внешнего
(а
некоторые
и
предвнешнего)
электронного
слоя,
превращаясь
в
положительные ионы.
3.
Группы элементовПери –
оды
1
2
3
I
II
Н
Li
Литий
Натрий
4
30
VIII
Ag 48 Сd In
47
Кадмий
49
Индий
55 Ва
Цезий
56 57
Барий
*
Fr
Ртуть
87
Rа
81
Таллий
88 89
**
Цирконий
Sn
Олово
Радий
Актиний
R2О
RO
R2O3
51 Тe
Та
73
82 Вi
Свинец
75
W
Сиборгий
Никель
36
44
Ru 45 Rh 46 Pd
Рутений
Родий
Палладий
Xe
54
Ксенон
Re
Рений
84 At
Полоний
Ni
Кr
53
74
105 Db 106 Sg
Резерфордий Дубний
Кобальт
28
Криптон
Технеций
Йод
Вольфрам
Висмут
Со
35
52 I
83 Ро
Железо
27
Бром
Теллур
18
Аргон
34 Br
Молибден
Тантал
Ас 104 Rf
Франций
Ниобий
Ar
17
Nb 42 Мо 43 Тс
41
10
Неон
Марганец
Селен
Сурьма
Гафний
Pb
Хром
Мышьяк
Фтор
Cr 25 Мn 26 Fe
33 Se
50 Sb
La 72 Hf
Лантан
Аu 80 Hg ТI
79
2
Nе
9
Хлор
V 24
32 As
F
17 Cl
Сера
Ванадий
Y 40 Zr
8
15 S
Ti 23
Германий
О
Кислород
Фосфор
Титан
Иттрий
7
Азот
Кремний
31 Ge
38 39
N
14 P
Sc 22
Галлий
Стронций
6
13 Si
Zn Ga
37 Sr
С
Углерод
Скандий
Цинк
Рубидий
Бор
20 21
Кальций
Сu
29
5
Алюминий
19 Сa
Калий
В
12 Al
Магний
Золото
ЛВС
Ве
11 Мg
Na
Cs
Высшие
оксиды
VII
Не
Бериллий
Серебро
7
VI
Гелий
3
Rb
6
V
Водород
Медь
5
IV
1
К
4
III
76
Оs
Осмий
77
Ir
Иридий
107 Bh 108 Hs 109 Мt
R2O5
RO3
R2O7
RH4
RH3
RH2
RH
Платина
Радон
Астат
RO2
Рt
Rn
85
Борий
78
Хассий
Мейтнерий
RO4
86
4.
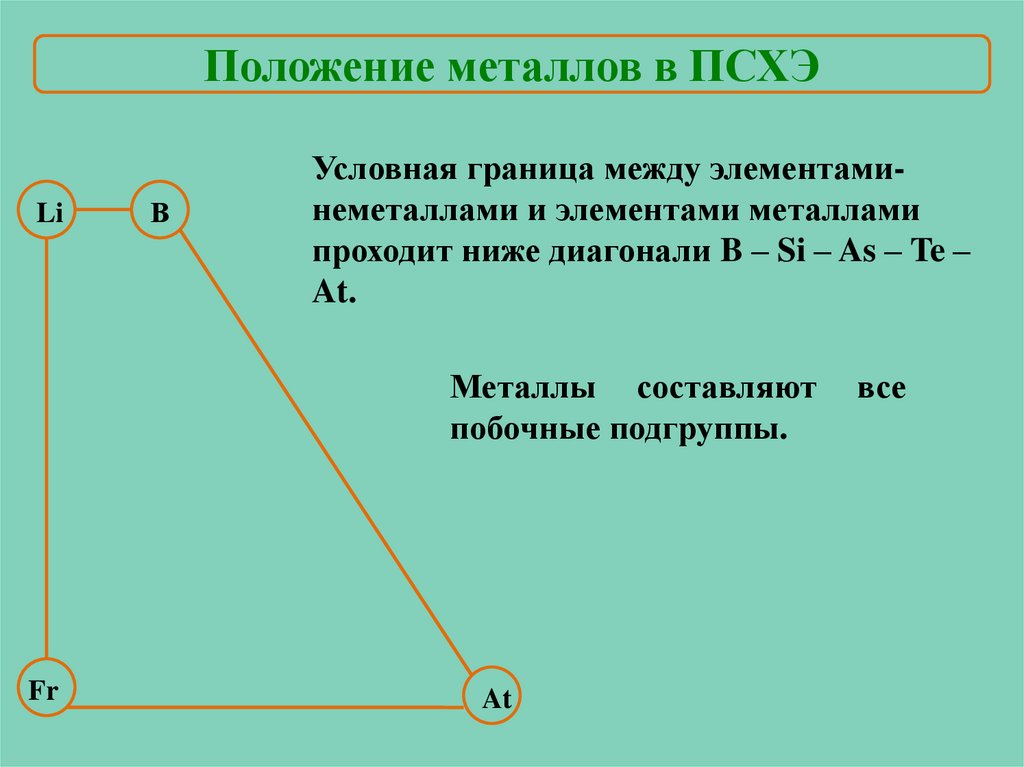
Положение металлов в ПСХЭLi
В
Условная граница между элементаминеметаллами и элементами металлами
проходит ниже диагонали B – Si – As – Te –
At.
Металлы составляют
побочные подгруппы.
Fr
At
все
5.
Мы знаем, что…- В атомах металлов на внешнем электронном слое
небольшое число электронов
- Атомы
металлов
отдают
валентные
электроны,
превращаясь в катионы
- Атомы
металлов
соединяются
друг
с
другом
металлической связью
- Атомы
металлов,
соединенные
друг
с
другом
металлической связью, образуют простые вещества с
металлической кристаллической решеткой
М0 ─ nе ↔ Мn+
атом
катион
6.
Металлическийблеск
Электропроводность
Физические свойства
металлов
Твердость
Теплопроводность
Ковкость
Пластичность
Плотность
Температура
плавления
7.
Химические свойства металловнеМе
О2
Н 2О
Ме
+
Оксиды металлов
Кислоты
Соли
2Na + Cl2 → 2NaCl
Cl20 +Na0→ ?
4Al + 3O2 → 2Al2O3
О2 +Al → ?
2Na+2Н2О→2NaOH+H2
H2O +Na→ ?
Al + Fe2O3 → Al2O3 + Fe
Al + Fe2O3 → ?
Zn + HCL → ZnCl2 + H2
Zn+HCl → ?
Fe + CuCl2→ FeCl2 + Cu
Fe+CuCl2→
?
8.
Особенности химических реакций металлов:При взаимодействии с кислородом
металлы могут образовать
различные по составу продукты: оксиды (основные и амфотерные), а
также пероксиды:
Например, 2Na + O2 = Na2O2 (пероксид натрия)
Взаимодействие металлов с водой, если металл – щелочной,
щелочно-земельный или алюминий:
M + H2O → M(OH)n + H2↑
Взаимодействие металлов с водой, если металл находится в
электрохимическом ряду напряжений от марганца до свинца (вкл.):
t
M + H2O → MxOy + H2↑
Взаимодействие металлов с водой, если металл находится в
электрохимическом ряду напряжений после водорода:
M + H 2O →
9.
Взаимодействие металлов с кислотамиM + HmAc → MxAcy + H2↑
1) Металл должен находиться в электрохимическом ряду
напряжений левее водорода.
2) Для реакций не рекомендуется использовать щелочные
металлы, т.к. они сначала взаимодействуют с водой.
3) В результате реакции должна образоваться растворимая
соль, т.к. в противном случае она покроет металл осадком и
доступ кислоты к металлу прекратится.
4) По-особому взаимодействуют с металлами азотная и
концентрированная серная кислоты.
10.
Взаимодействие металлов с растворами солейM + M/xAcy → MxAcy + М/
1) Металл должен находиться в электрохимическом ряду
напряжений левее металла, образующего соль.
2) Для реакций не рекомендуется использовать щелочные
металлы, т.к. они сначала взаимодействуют с водой.
3) В результате реакции должна образоваться растворимая
соль, т.к. в противном случае она покроет металл осадком и
доступ раствора соли к металлу прекратится.
11.
Общие способы получения металлов- Пирометаллургия
– получение металлов и сплавов под
действием высоких температур.
- Гидрометаллургия – получение металлов из водных
растворов.
- Электрометаллургия – получение
действием электрического тока.
металлов
под
12.
Общие способы получения металловПирометаллургия
- Восстановление углем (угарным газом):
2PbO + C = CO2 + 2Pb
- Восстановление алюминием (кальцием):
2Al + Fe2O3 = Al2O3 + 2Fe
- Восстановление водородом:
СuO + H2 = Cu + H2O
13.
Общие способы получения металловГидрометаллургия
1 стадия: растворение в кислоте
минералов, содержащих металлы:
нерастворимых
CuS + 2HCl = CuCl2 + H2S
2 стадия: вытеснение металлов из растворов их солей более
активными металлами:
CuCl2 + Fe = FeCl2 + Cu
14.
Общие способы получения металловЭлектрометаллургия
Электролиз расплавов:
KCl → K+ + Cl─
катод (─) K+ +1e → K0
анод (+) 2Cl─ ─ 2e → Cl20
эл.ток
2KCl
→
2K + Cl2↑
Этим способом в промышленности получают металлы,
стоящие в ряду напряжений металлов до Al.
15.
Коррозия металловСамопроизвольное
разрушение
металлических
материалов, происходящее под воздействием окружающей
среды, называется коррозией.
Химическая
4Fe + 6H2O + 3O2 = 4Fe(OH)3
Коррозия железа и
образование ржавчины
Электрохимическая
Коррозия железа в контакте с
медью и в растворе соляной
кислоты:
Катод 2Н+ + 2е = Н2
Анод Fe2+ - 2e = Fe0
16.
Способы защиты металлов от коррозии• Защита более активным металлом;
• Отделение металла от агрессивной среды;
• Использование замедлителей коррозии;
• Электрозащита;
• Пассивация металлов;
• Изготовление сплавов, стойких к коррозии.
17.
СПЛАВЫНержавеющая сталь состоит из основного
компонента – железа, а также добавок хрома (обычно 1030%), никеля (обычно 0-20%), молибдена (обычно 2-3%) и
других элементов: медь, титан, алюминий.
Бронза- 88% из меди и на 12% из олова
Латунь- 66% меди и 34% цинка
Мельхиор-медь — 65%,никель и кобальт — 5—30%
• Дюралюмины– алюминий (90-94%);Медь 3,5-5,5%;
• Магний 0,5-0,8%;Марганец 0,6%;
• Дюраль отличается:Повышенной прочностью; Высокой
термоустойчивостью.















 Химия
Химия








