Похожие презентации:
Определение массы уксусной кислоты в растворе. Лабораторная работа № 1
1.
2.
Лабораторная работа № 1ОПРЕДЕЛЕНИЕ МАССЫ УКСУСНОЙ КИСЛОТЫ В РАСТВОРЕ
3.
Лабораторная работа № 1ОПРЕДЕЛЕНИЕ МАССЫ УКСУСНОЙ КИСЛОТЫ В РАСТВОРЕ
Цель работы: проверить освоение техники титрования на
примере методики определения массы
уксусной кислоты кислот в растворе
методом алкалиметрии.
4.
ДатаШкола
Фамилия, имя
5.
Посуда и реактивыБюретка вместимостью 25 или 50 см3.
Пипетка Мора вместимостью 10 см3.
Мерная колба вместимостью 100 см3.
Коническая колба для титрования вместимостью 100 см3.
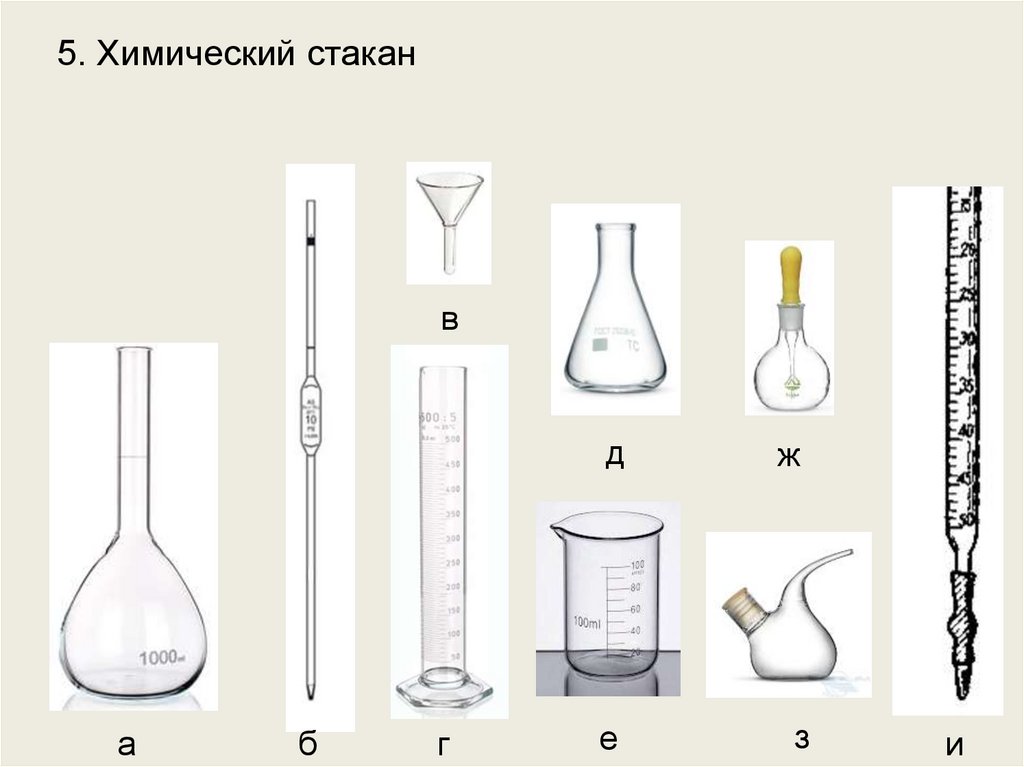
Химический стакан вместимостью 100 см3.
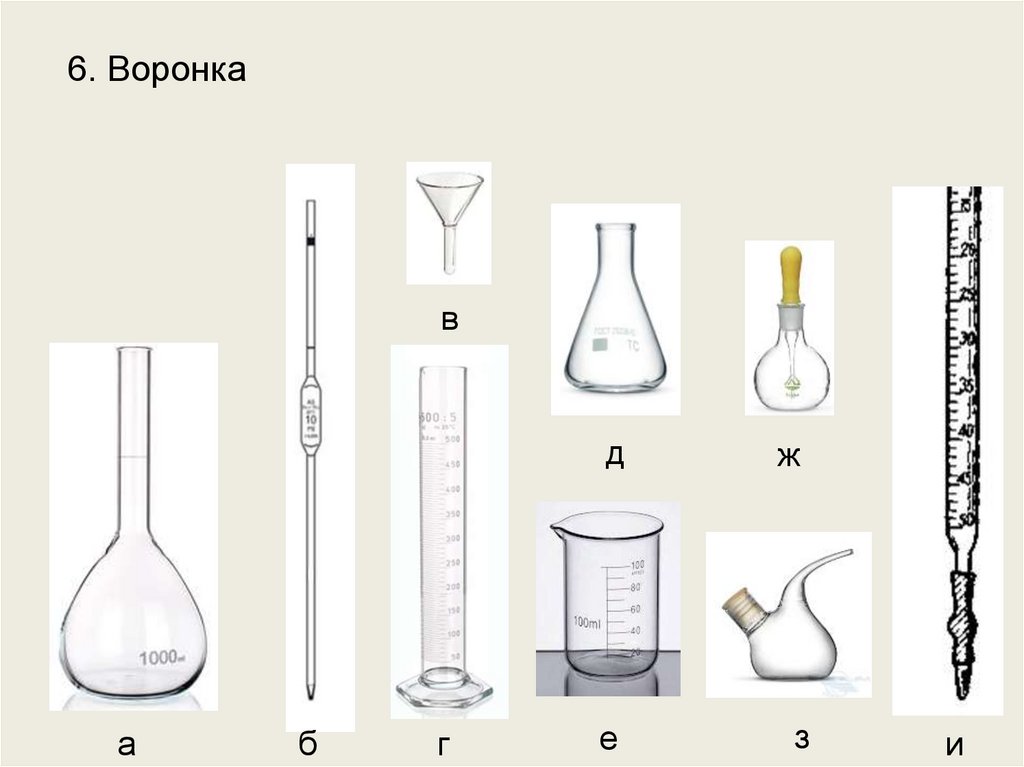
Воронка диаметром 3 см.
Экран для титрования.
Рабочий раствор гидроксида натрия с приблизительной
концентрацией 0,1 моль/дм3.
Стандартный раствор щавелевой кислоты с молярной
концентрацией эквивалента 0,1000 моль/дм3.
Спиртовой раствор фенолфталеина с массовой долей 1,0 %.
6.
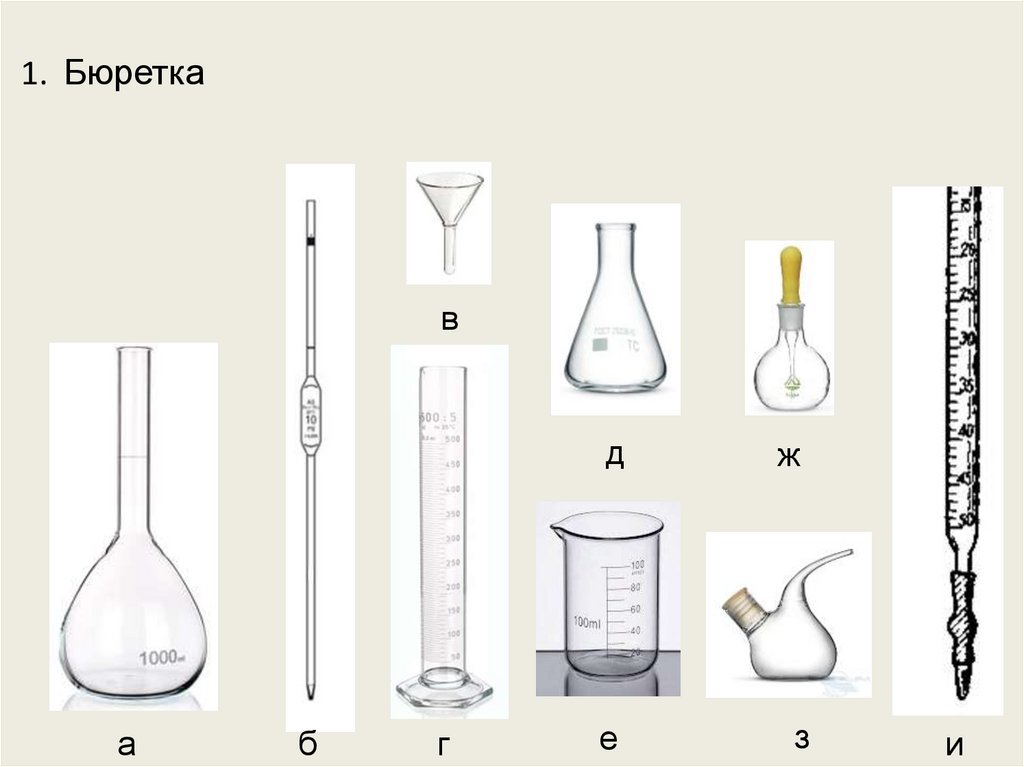
1. Бюреткав
а
б
г
д
ж
е
з
и
7.
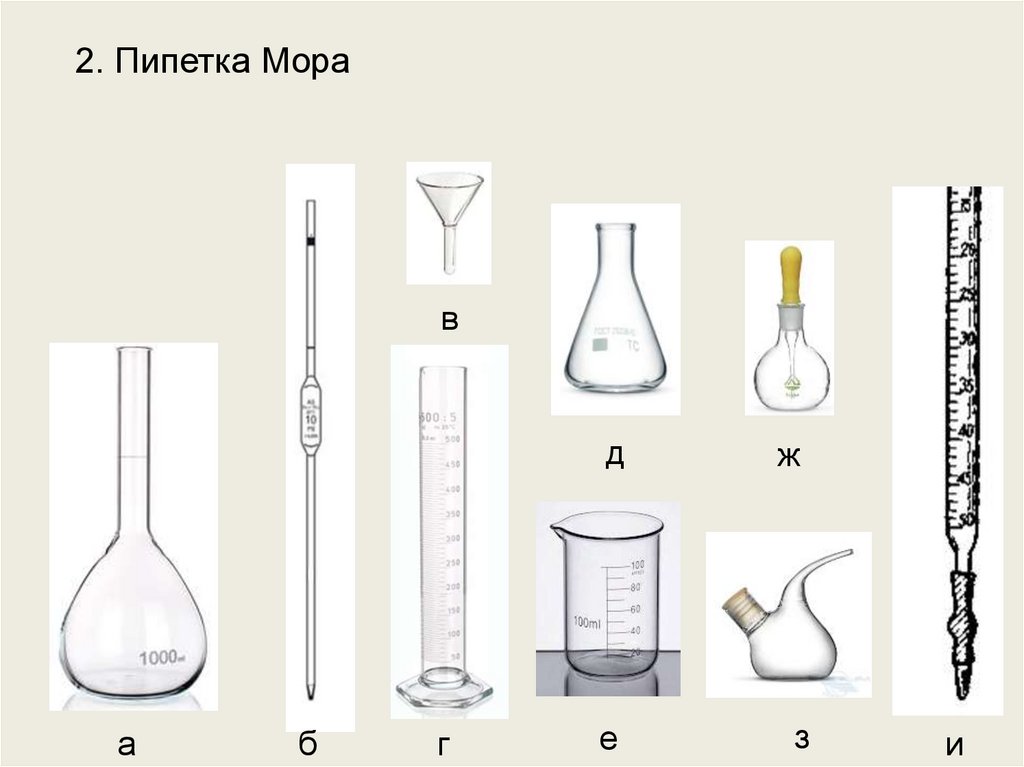
2. Пипетка Морав
а
б
г
д
ж
е
з
и
8.
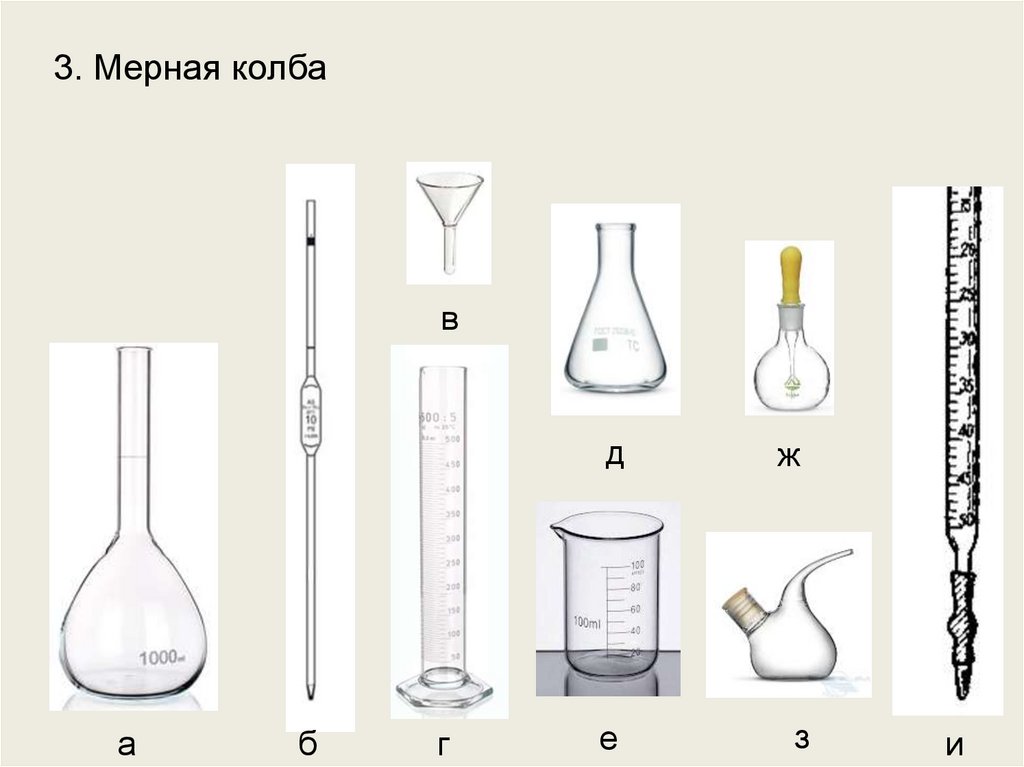
3. Мерная колбав
а
б
г
д
ж
е
з
и
9.
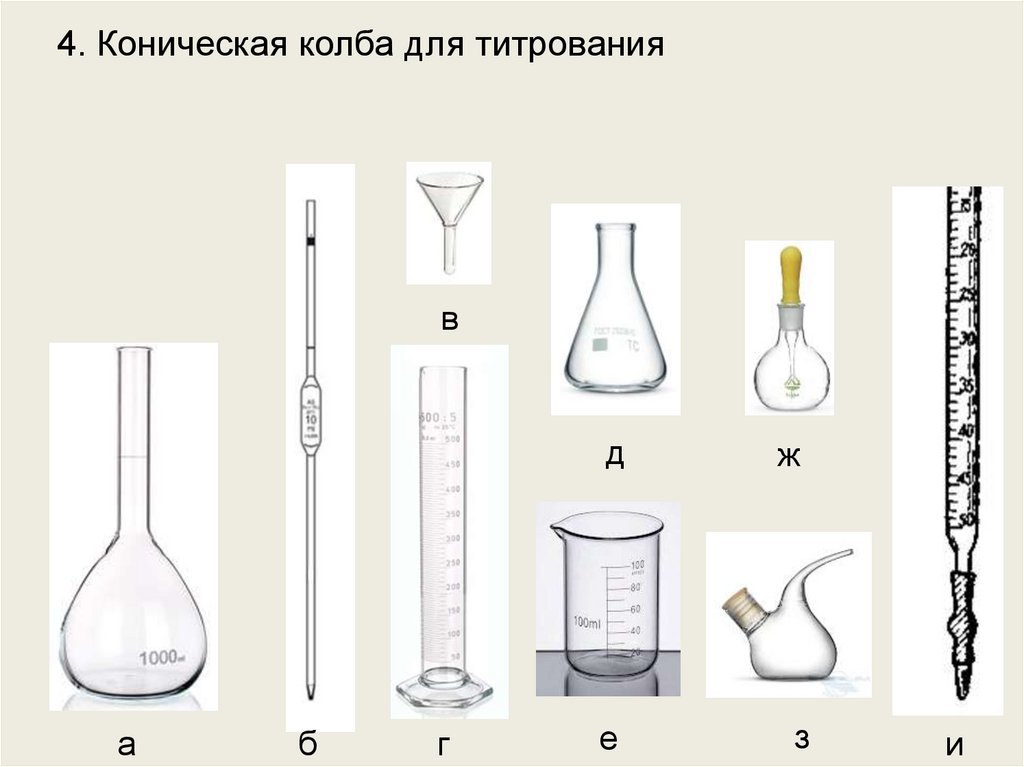
4. Коническая колба для титрованияв
а
б
г
д
ж
е
з
и
10.
5. Химический стаканв
а
б
г
д
ж
е
з
и
11.
6. Воронкав
а
б
г
д
ж
е
з
и
12.
7. Экран для титрования – …….13.
Порядок выполнения работыУстановка титра (стандартизация)
рабочего раствора гидроксида натрия
Гидроксид натрия – рабочий раствор, следовательно, в
день проведения анализа необходимо установить
(уточнить) его концентрацию.
Бюретку в соответствии с правилами заполняют
титрантом (раствором NaOH). Корректируют положение
бюретки в штативе, закрепляя ее так, чтобы "носик"
погружался в колбу для титрования на 2–3 см. На стол
штатива, в котором закреплена бюретка, помещают белый
экран для титрования.
14.
8. Опишите Ваши действия при заполнениибюретки раствором NaOH
15.
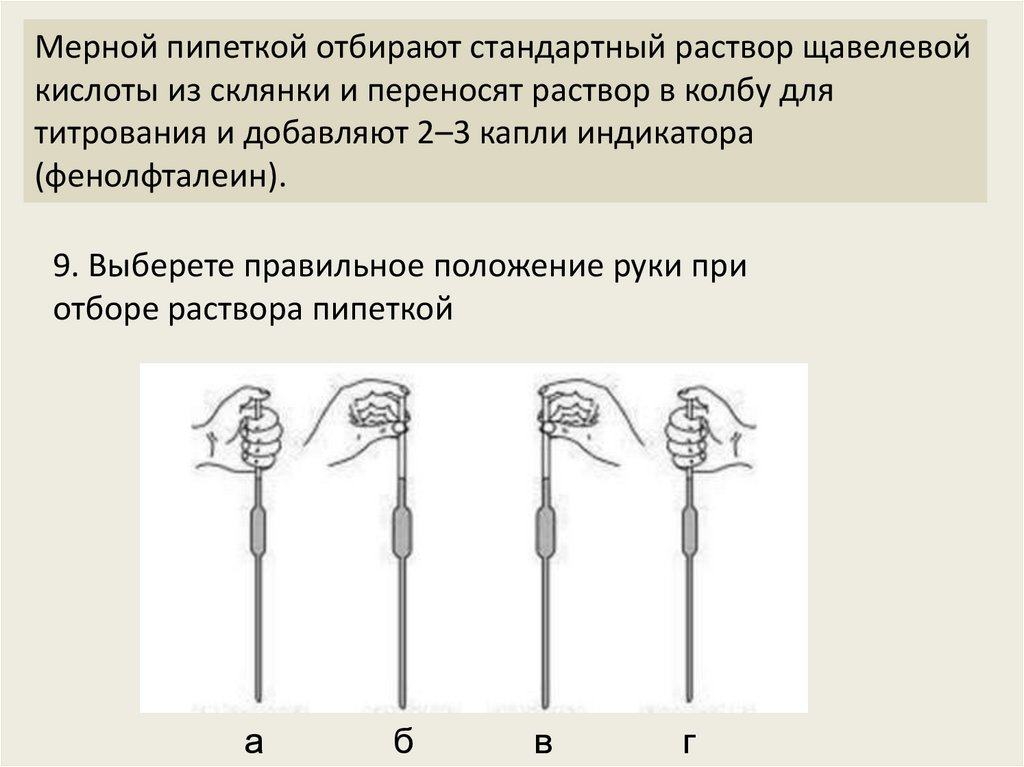
Мерной пипеткой отбирают стандартный раствор щавелевойкислоты из склянки и переносят раствор в колбу для
титрования и добавляют 2–3 капли индикатора
(фенолфталеин).
16.
Мерной пипеткой отбирают стандартный раствор щавелевойкислоты из склянки и переносят раствор в колбу для
титрования и добавляют 2–3 капли индикатора
(фенолфталеин).
9. Выберете правильное положение руки при
отборе раствора пипеткой
а
б
в
г
17.
10. Есть ли особые требования при отбореопределенного объема титруемого раствора
пипеткой Мора. Если есть, то какие?
18.
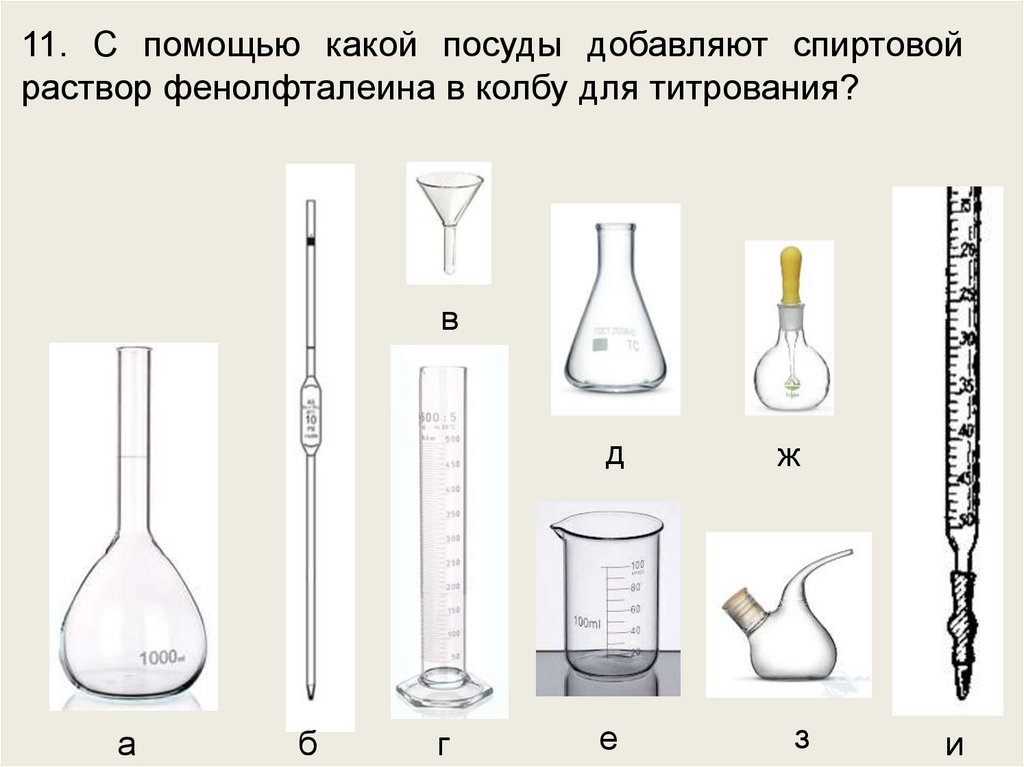
11. С помощью какой посуды добавляют спиртовойраствор фенолфталеина в колбу для титрования?
в
а
б
г
д
ж
е
з
и
19.
Колбу со стандартным раствором помещают под "носик" бюретки ипроводят ориентировочное* титрование: приливают раствор титранта
порциями по 1 см3, постоянно перемешивая содержимое колбы круговыми
движениями. После перемешивания наблюдают окраску раствора в колбе.
Выявляют интервал объема раствора щелочи с точностью до 1,0 см3, при
котором происходит резкое изменение цвета титруемого раствора от
бесцветного до малинового. Этот интервал объема соответствует скачку на
кривой титрования, внутри находится точка эквивалентности.
Последующие титрования проводят точно, сразу приливая к новой порции
титруемого раствора объем гидроксида натрия, соответствующий объему
начала скачка, потом добавляют титрант по 1 капле, постоянно перемешивая
содержимое колбы круговыми движениями. Титрование прекращают, когда
титруемый раствор окрасится в розовый цвет от одной капли раствора NaOH.
Окраска раствора должна быть устойчивой в течение 30 с. После каждого
титрования уровень титранта в бюретке устанавливают на нулевое деление.
Расхождение между параллельными результатами титрования не должно
превышать 0,10 см3 (сходимые объемы).
______________________________
*Ориентировочное титрование не является обязательной стадией анализа, при работе в
производственных лабораториях по нормативным документам не проводится, так увеличивает расход
титруемого образца. Но на стадии обучения рекомендуется, как стадия облегчающая последующее
установление точки эквивалентности.
20.
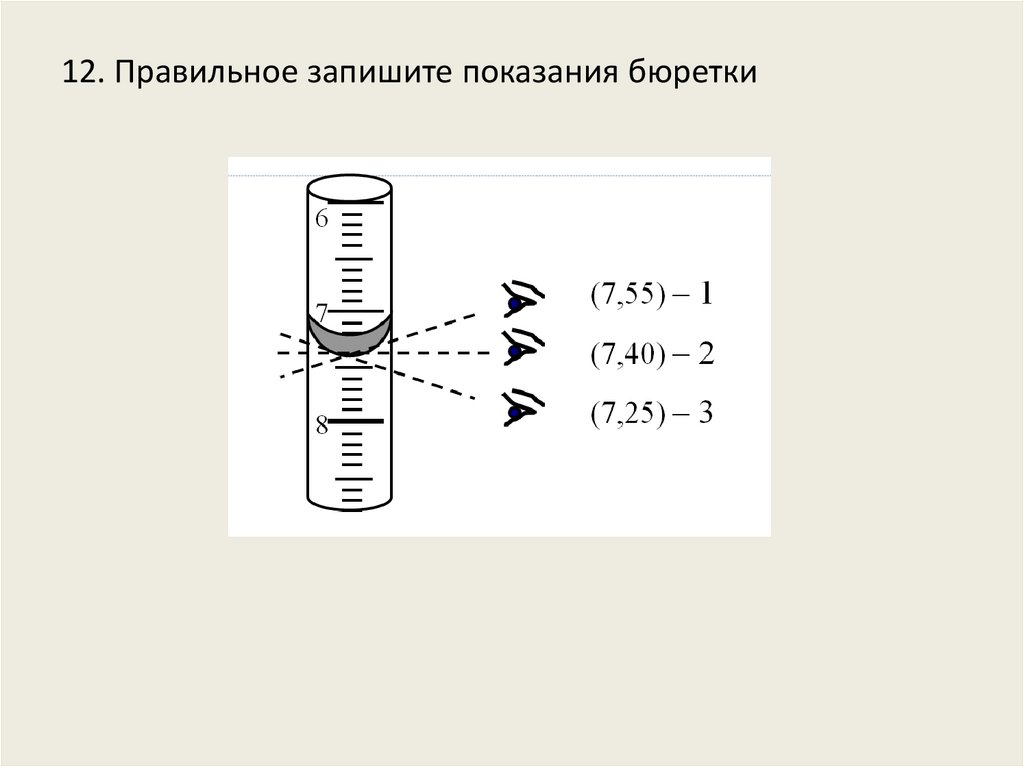
12. Правильное запишите показания бюретки21.
Результаты титрования помещают в таблицу.Номер
V(Н2С2О4), см3
V(NaOH), см3
опыта
Vср., см3
Зная точную концентрацию стандартного раствора, его объем
и объем титранта, измеренный по бюретке, по закону
эквивалентов вычисляют молярную концентрацию эквивалента
(моль/дм3) и титр (г/см3) рабочего раствора NaOH:
с(1/1NaOH)
c(1/2H 2 C 2 O 4 ) V (H 2 C 2 O 4 )
;
V (NaOH)
c(1/1NaOH) M (1/1NaOH)
T (NaOH)
.
1000
22.
Результаты титрования помещают в таблицу.Номер
V(Н2С2О4), см3
V(NaOH), см3
опыта
Vср., см3
Зная точную концентрацию стандартного раствора, его
объем и объем титранта, измеренный по бюретке, по закону
эквивалентов вычисляют молярную концентрацию эквивалента
(моль/дм3) и титр (г/см3) рабочего раствора NaOH:
c(1/2H 2 C 2 O 4 ) V (H 2 C 2 O 4 )
с(1/1NaOH)
;
V (NaOH)
c(1/1NaOH) M (1/1NaOH)
T (NaOH)
.
1000
23.
Результаты титрования помещают в таблицу.Номер
V(Н2С2О4), см3
V(NaOH), см3
опыта
Vср., см3
Зная точную концентрацию стандартного раствора, его
объем и объем титранта, измеренный по бюретке, по закону
эквивалентов вычисляют молярную концентрацию эквивалента
(моль/дм3) и титр (г/см3) рабочего раствора NaOH:
с(1/1NaOH)
c(1/2H 2 C 2 O 4 ) V (H 2 C 2 O 4 )
;
V (NaOH)
c(1/1NaOH) M (1/1NaOH)
T (NaOH)
.
1000
24.
Посуда и реактивыБюретка вместимостью 25 или 50 см3.
Пипетка Мора вместимостью 10 см3.
Мерная колба вместимостью 100 см3.
Коническая колба для титрования вместимостью 100 см3.
Химический стакан вместимостью 100 см3.
Воронка диаметром 3 см.
Экран для титрования.
Рабочий раствор гидроксида натрия с приблизительной
концентрацией 0,1 моль/дм3.
Стандартный раствор щавелевой кислоты с молярной
концентрацией эквивалента 0,1000 моль/дм3.
Спиртовой раствор фенолфталеина с массовой долей 1,0 %.
25.
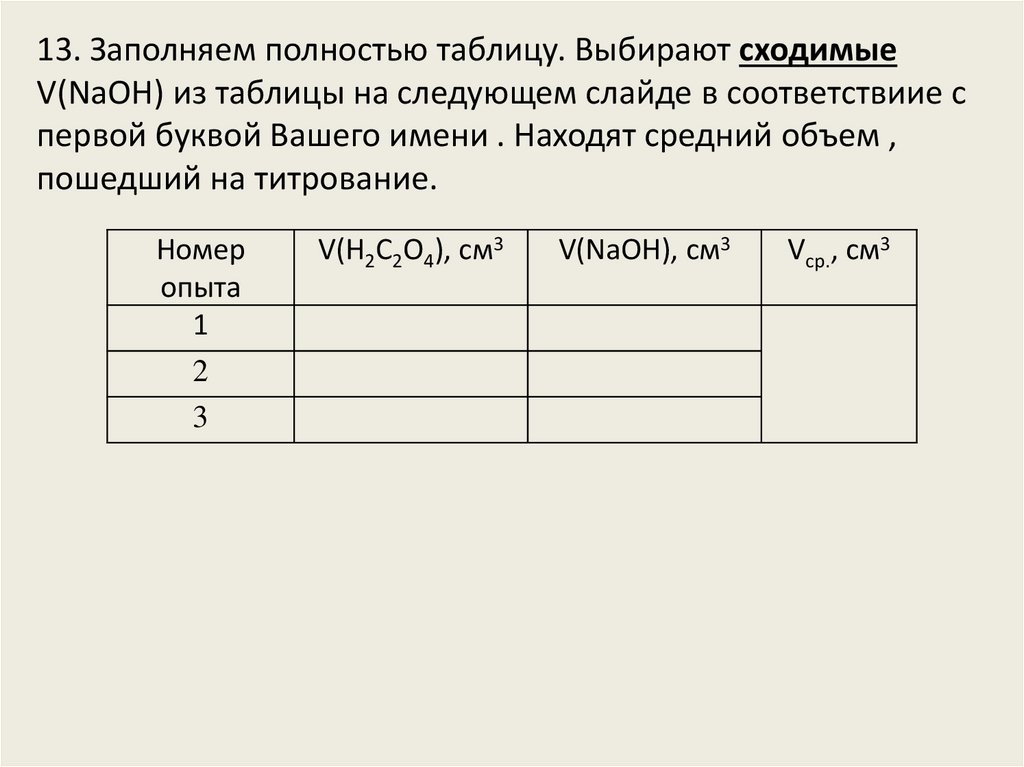
13. Заполняем полностью таблицу. Выбирают сходимыеV(NaOH) из таблицы на следующем слайде в соответствиие с
первой буквой Вашего имени . Находят средний объем ,
пошедший на титрование.
Номер
опыта
1
2
3
V(Н2С2О4), см3
V(NaOH), см3
Vср., см3
26.
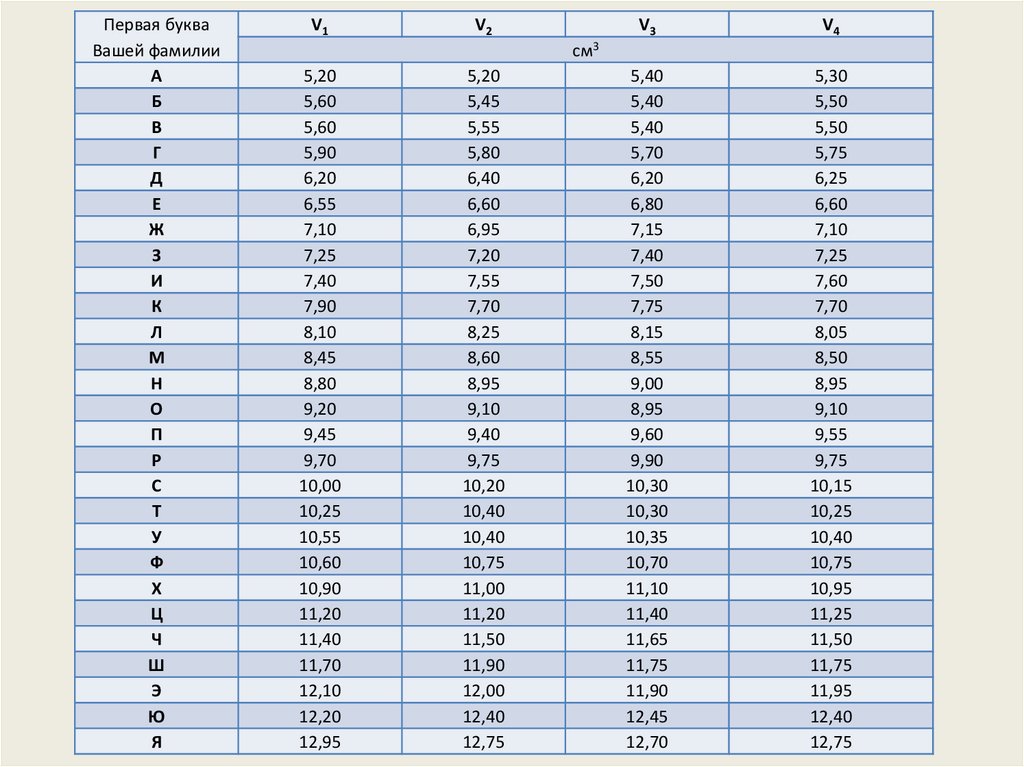
Первая букваВашего имени
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Э
Ю
Я
V1
V2
V3
V4
5,40
5,40
5,40
5,70
6,20
6,80
7,15
7,40
7,50
7,75
8,15
8,55
9,00
8,95
9,60
9,90
10,30
10,30
10,35
10,70
11,10
11,40
11,65
11,75
11,90
12,45
12,70
5,30
5,50
5,50
5,75
6,25
6,60
7,10
7,25
7,60
7,70
8,05
8,50
8,95
9,10
9,55
9,75
10,15
10,25
10,40
10,75
10,95
11,25
11,50
11,75
11,95
12,40
12,75
см3
5,20
5,60
5,60
5,90
6,20
6,55
7,10
7,25
7,40
7,90
8,10
8,45
8,80
9,20
9,45
9,70
10,00
10,25
10,55
10,60
10,90
11,20
11,40
11,70
12,10
12,20
12,95
5,20
5,45
5,55
5,80
6,40
6,60
6,95
7,20
7,55
7,70
8,25
8,60
8,95
9,10
9,40
9,75
10,20
10,40
10,40
10,75
11,00
11,20
11,50
11,90
12,00
12,40
12,75
27.
14. Рассчитать молярную концентрацию эквивалента титранта.c(1/2H 2 C 2 O 4 ) V (H 2 C 2 O 4 )
с(1/1NaOH)
;
V (NaOH)
15. Рассчитать титр титранта.
T (NaOH)
c(1/1NaOH) M (1/1NaOH)
.
1000
28.
Определение массы уксусной кислоты в раствореВ мерную колбу получают у преподавателя контрольный
раствор
уксусной
кислоты,
доводят
до
метки
дистиллированной водой и тщательно перемешивают.
Промытой мерной пипеткой отбирают 10,00 см3
приготовленного раствора уксусной кислоты в колбу для
титрования, добавляют 2 – 3 капли раствора индикатора.
Уровень раствора гидроксида натрия в бюретке устанавливают
на нулевое деление.
Титруют до получения трех сходимых результатов:
расхождение между параллельными опытами не должно
превышать 0,10 см3.
29.
16. Есть ли особые требования при доведениираствора до метки при приготовлении его в мерной
колбе. Если есть, то какие?
30.
16. Есть ли особые требования при доведениираствора до метки при приготовлении его в мерной
колбе. Если есть, то какие?
17. Схематично изобразите установку для
титрования, пометив в какой посуде какой раствор
(смесь растворов) находится.
31.
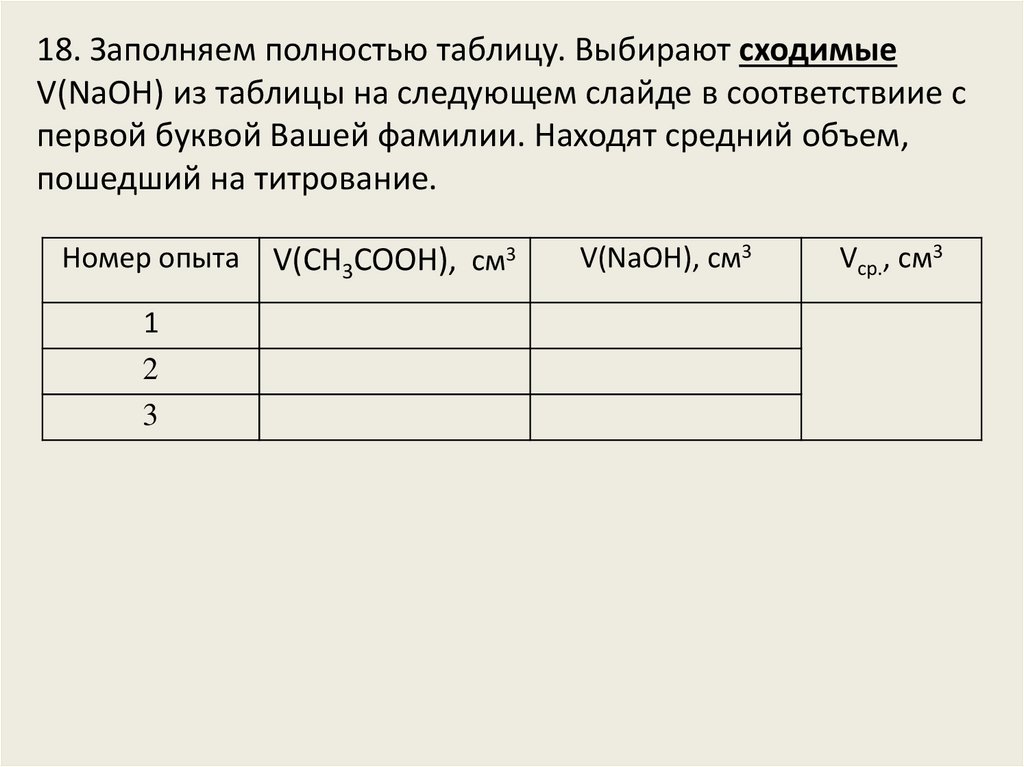
18. Заполняем полностью таблицу. Выбирают сходимыеV(NaOH) из таблицы на следующем слайде в соответствиие с
первой буквой Вашей фамилии. Находят средний объем,
пошедший на титрование.
Номер опыта
1
2
3
V(СН3СООН), см3
V(NaOH), см3
Vср., см3
32.
Первая букваВашей фамилии
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Э
Ю
Я
V1
V2
V3
V4
5,40
5,40
5,40
5,70
6,20
6,80
7,15
7,40
7,50
7,75
8,15
8,55
9,00
8,95
9,60
9,90
10,30
10,30
10,35
10,70
11,10
11,40
11,65
11,75
11,90
12,45
12,70
5,30
5,50
5,50
5,75
6,25
6,60
7,10
7,25
7,60
7,70
8,05
8,50
8,95
9,10
9,55
9,75
10,15
10,25
10,40
10,75
10,95
11,25
11,50
11,75
11,95
12,40
12,75
см3
5,20
5,60
5,60
5,90
6,20
6,55
7,10
7,25
7,40
7,90
8,10
8,45
8,80
9,20
9,45
9,70
10,00
10,25
10,55
10,60
10,90
11,20
11,40
11,70
12,10
12,20
12,95
5,20
5,45
5,55
5,80
6,40
6,60
6,95
7,20
7,55
7,70
8,25
8,60
8,95
9,10
9,40
9,75
10,20
10,40
10,40
10,75
11,00
11,20
11,50
11,90
12,00
12,40
12,75
33.
Массу уксусной кислоты в контрольном растворе (вмерной колбе) находят по закону эквивалентов с учетом
того, что титровали только часть раствора, отобраную
пипеткой:
c(1/1NaOH) V (NaOH) M(1/1CH 3COOH) Vк
m(CH3COOH)
1000 Vп
где
с(1/1NaOH) – уточненная молярная концентрация
эквивалента раствора гидроксида натрия;
V(NaOH) – средний объем титранта, пошедший на
титрование;
Vк – вместимость мерной колбы, см3;
Vп – объем пробы (пипетки), см3;
М(1/1СН3СООН) – молярная масса эквивалента
уксусной кислоты.
34.
19. Рассчитать массу уксусной кислоты в контрольном растворе .35.
Н+ОН-
36.
Н+ОН-
рН = - lg с (Н+)
рН = 1 = -lg 10-1 = - lg 0,1
с (Н+) = 0,1 моль/дм3
рН = 2 = -lg 10-2 =- lg 0,01
с (Н+) = 0,01 моль/дм3
рН = 3
с (Н+) = 0,001 моль/дм3
37.
Н+рН = - lg с (Н+)
рН + рОН = 14
ОНрОН = - lg c(ОH-)
38.
Н+рН = - lg с (Н+)
рН + рОН = 14
ОН-
с (ОН-) = 0,1 моль/дм3
рОН = - lg 0,1 = -lg 10-1 = - (-1) = 1
рН = 14 – 1 = 13
39.
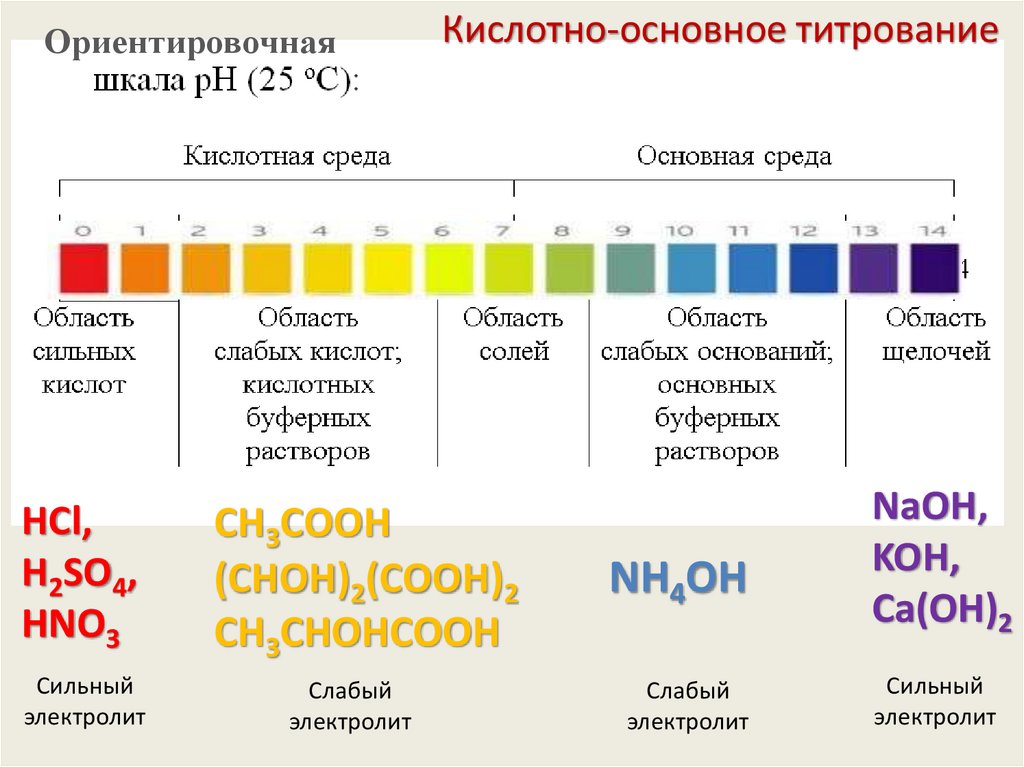
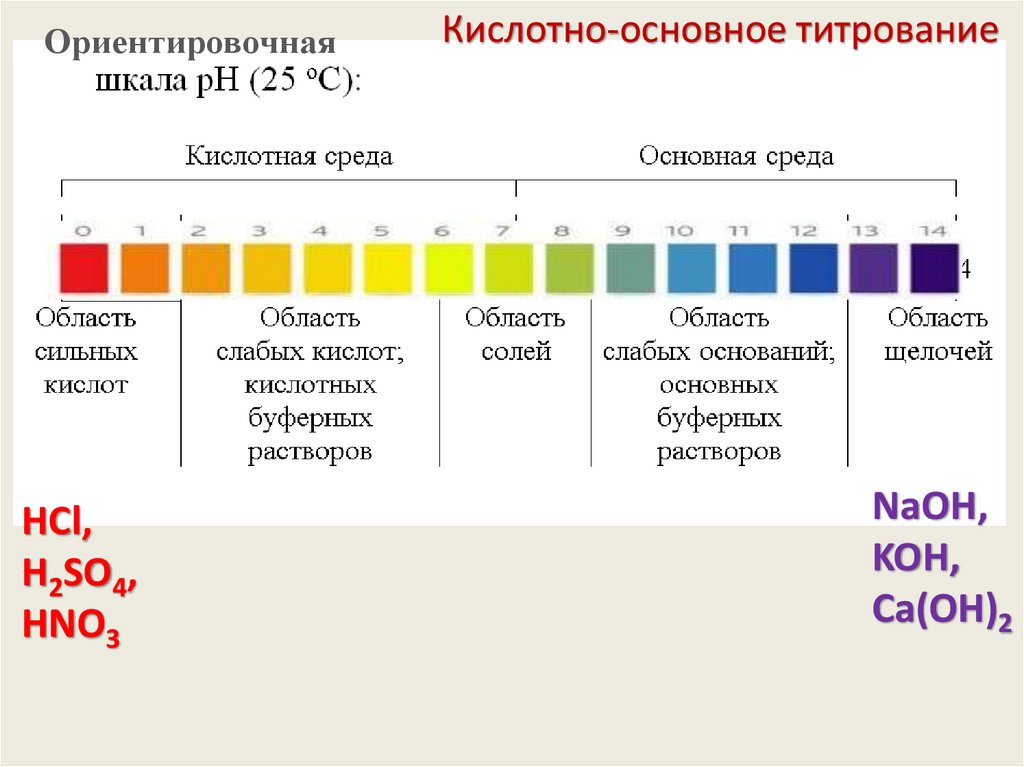
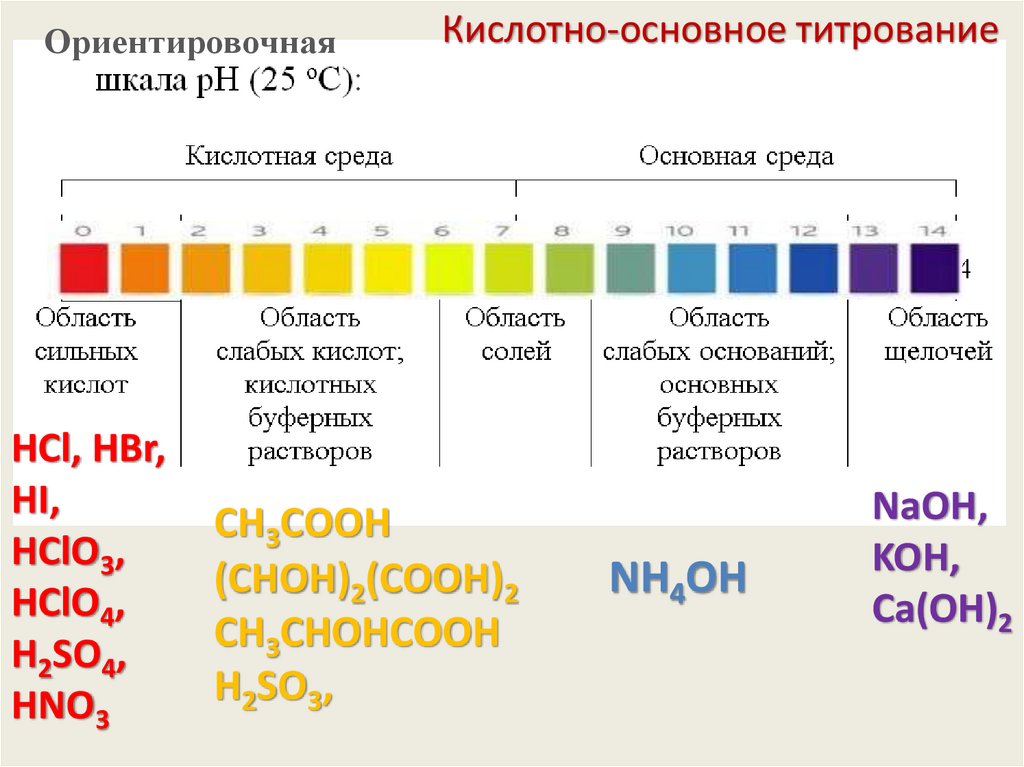
ОриентировочнаяКислотно-основное титрование
HCl,
H2SO4,
HNO3
CН3СООH
(СHОH)2(СООH)2
CН3СHОHСООH
NH4OH
Сильный
электролит
Слабый
электролит
Слабый
электролит
NaOH,
KOH,
Сa(OH)2
Сильный
электролит
40.
ГИДРОЛИЗ СОЛЕЙСоль, образованная сильной кислотой и слабым основанием
NH4Cl + H2O
41.
ГИДРОЛИЗ СОЛЕЙСоль, образованная сильной кислотой и слабым основанием
NH4Cl + HOН
42.
ГИДРОЛИЗ СОЛЕЙСоль, образованная сильной кислотой и слабым основанием
NH4+ + Cl– + H2O NH4OH + HCl
43.
ГИДРОЛИЗ СОЛЕЙСоль, образованная сильной кислотой и слабым основанием
NH4+ + Cl– + H2O NH4OH + H+ + Cl–
44.
ГИДРОЛИЗ СОЛЕЙСоль, образованная сильной кислотой и слабым основанием
NH4+ + Cl– + H2O NH4OH + H+ + Cl–
При гидролизе данной соли образуется определенное количество
свободных ионов Н+, следовательно рН 7
45.
ГИДРОЛИЗ СОЛЕЙСоль, образованная сильной кислотой и слабым основанием
NH4+ + Cl– + H2O NH4OH + H+ + Cl–
При гидролизе данной соли образуется определенное количество
свободных ионов Н+, следовательно рН 7
46.
ГИДРОЛИЗ СОЛЕЙСоль, образованная сильной кислотой и слабым основанием
(гидролизуется по катиону)
NH4+ + Cl– + H2O NH4OH + H+ + Cl–
При гидролизе данной соли образуется определенное количество
свободных ионов Н+, следовательно рН 7
47.
ГИДРОЛИЗ СОЛЕЙСоль, образованная сильной кислотой и слабым основанием
(гидролизуется по катиону)
NH4+ + Cl– + H2O NH4OH + H+ + Cl–
При гидролизе данной соли образуется определенное количество свободных ионов
Н+, следовательно рН 7
Соль, образованная слабой кислотой и сильным основанием
(гидролизуется по аниону)
CН3СОО– + Nа+ + H2O CН3СООН + Nа+ + OH–
При гидролизе данной соли образуется определенное количество свободных ионов
ОН–, следовательно рН 7
Соль, образованная слабой кислотой и слабым основанием
(гидролизуется по катиону и аниону; гидролизуется полностью)
CН3СОО– + NН4+ + H2O CН3СООН + NН4OH
При гидролизе не образуются свободные ионы Н+ и ОН–, следовательно рН 7
Соль, образованная сильной кислотой и сильным основанием
(не гидролизуется)
NaCl, KCl, Na2SO4, K2SO4, NaNO3, KNO3
рН = 7
48.
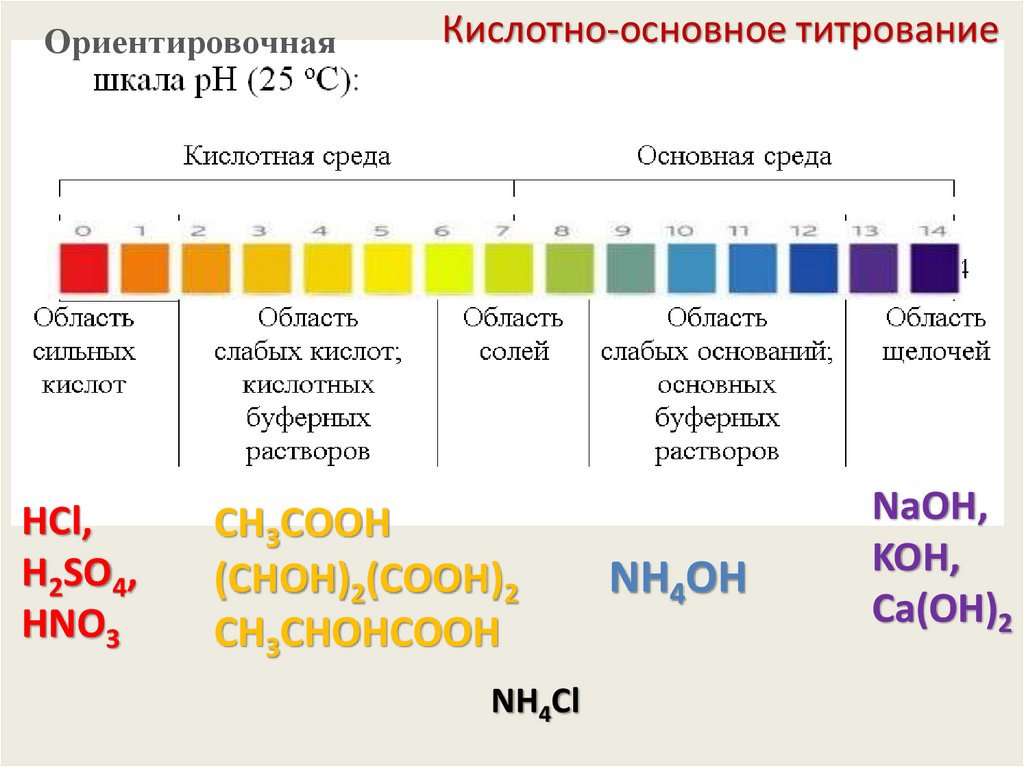
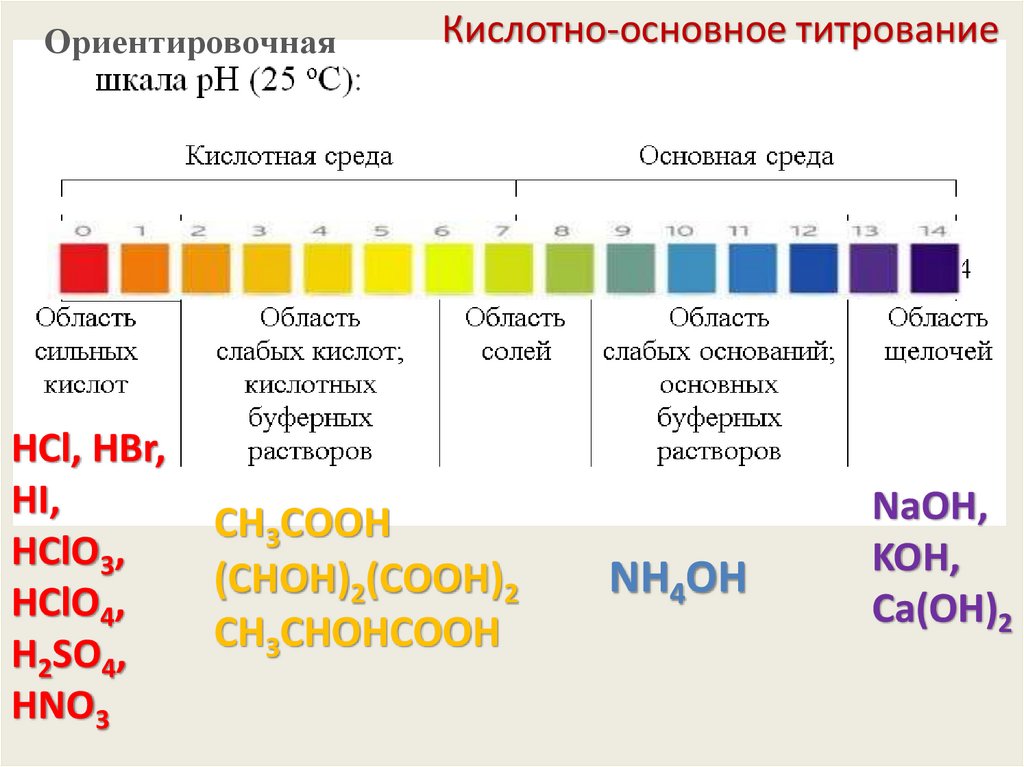
ОриентировочнаяHCl,
H2SO4,
HNO3
Кислотно-основное титрование
CН3СООH
(СHОH)2(СООH)2
CН3СHОHСООH
NH4Cl
NH4OH
NaOH,
KOH,
Сa(OH)2
49.
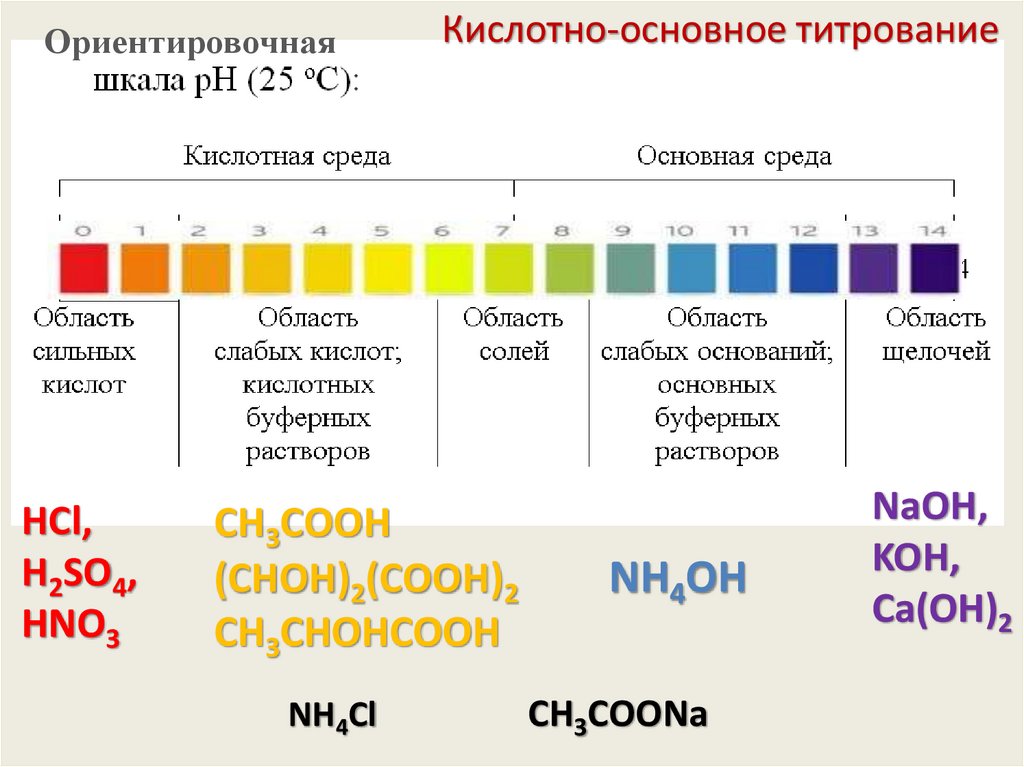
ОриентировочнаяHCl,
H2SO4,
HNO3
Кислотно-основное титрование
CН3СООH
(СHОH)2(СООH)2
CН3СHОHСООH
NH4Cl
NH4OH
CН3СOОNa
NaOH,
KOH,
Сa(OH)2
50.
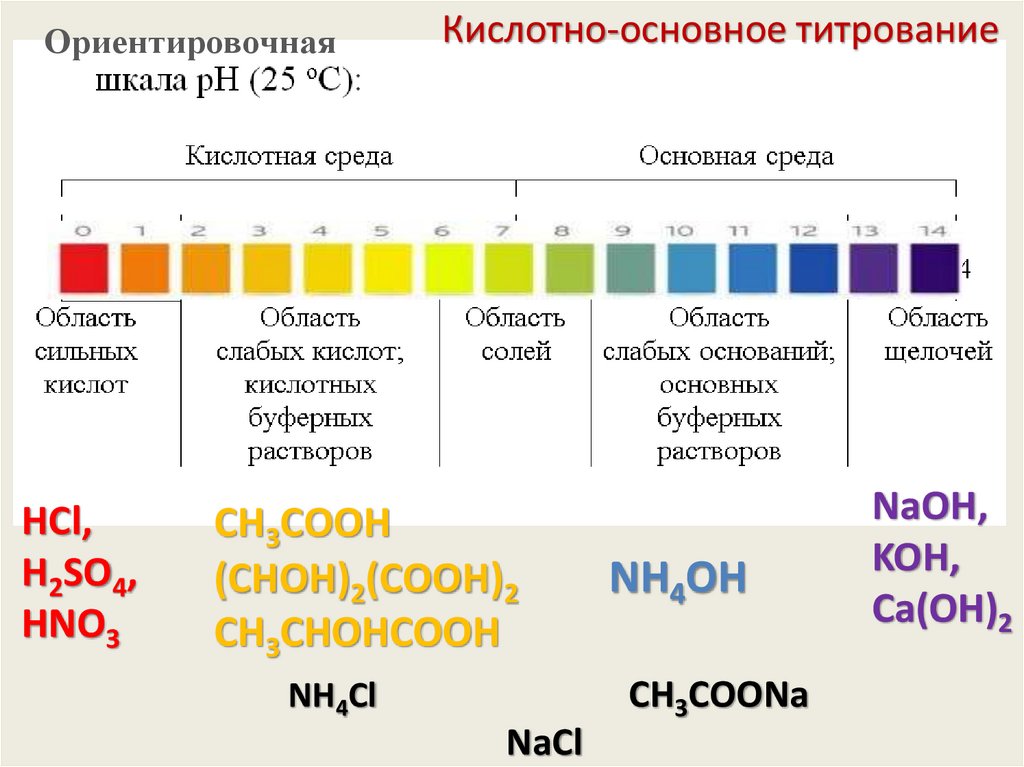
ОриентировочнаяHCl,
H2SO4,
HNO3
Кислотно-основное титрование
CН3СООH
(СHОH)2(СООH)2
CН3СHОHСООH
NH4OH
CН3СOОNa
NH4Cl
NaCl
NaOH,
KOH,
Сa(OH)2
51.
ОриентировочнаяHCl,
H2SO4,
HNO3
Кислотно-основное титрование
NaOH,
KOH,
Сa(OH)2
52.
ОриентировочнаяHCl, HBr,
HI,
HClO3,
HClO4,
H2SO4,
HNO3
Кислотно-основное титрование
NaOH,
KOH,
Сa(OH)2
53.
54.
55.
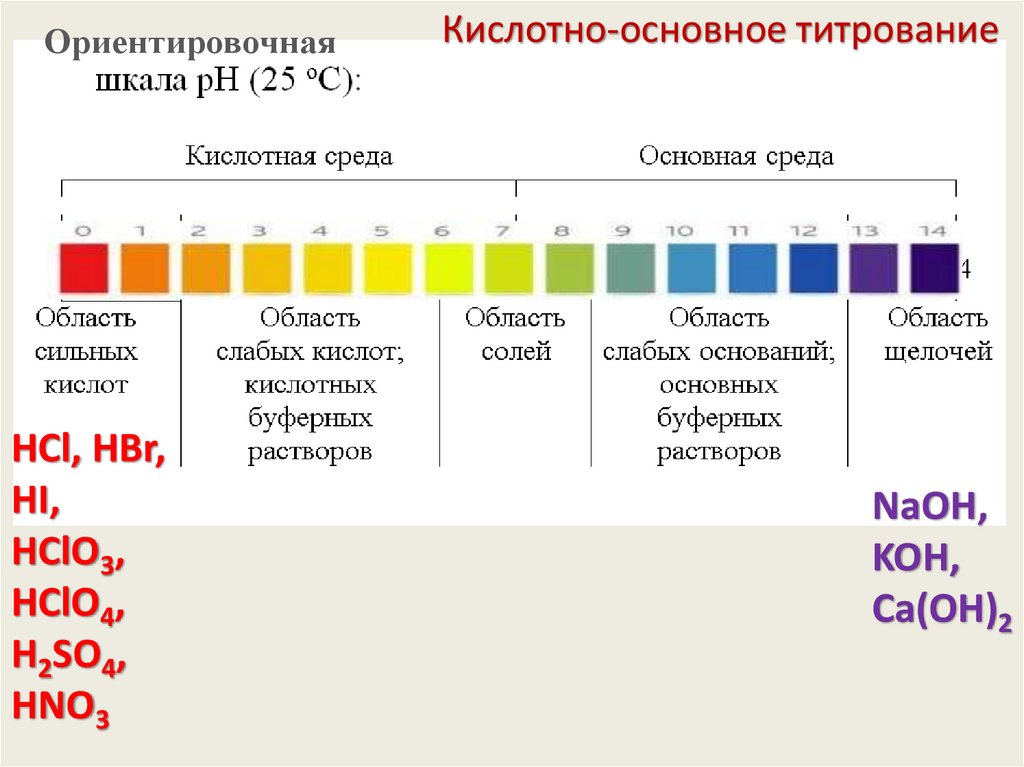
ОриентировочнаяHCl, HBr,
HI,
HClO3,
HClO4,
H2SO4,
HNO3
Кислотно-основное титрование
CН3СООH
(СHОH)2(СООH)2
CН3СHОHСООH
H2SO3,
NH4OH
NaOH,
KOH,
Сa(OH)2
56.
ОриентировочнаяHCl, HBr,
HI,
HClO3,
HClO4,
H2SO4,
HNO3
Кислотно-основное титрование
CН3СООH
(СHОH)2(СООH)2
CН3СHОHСООH
NH4OH
NaOH,
KOH,
Сa(OH)2
57.
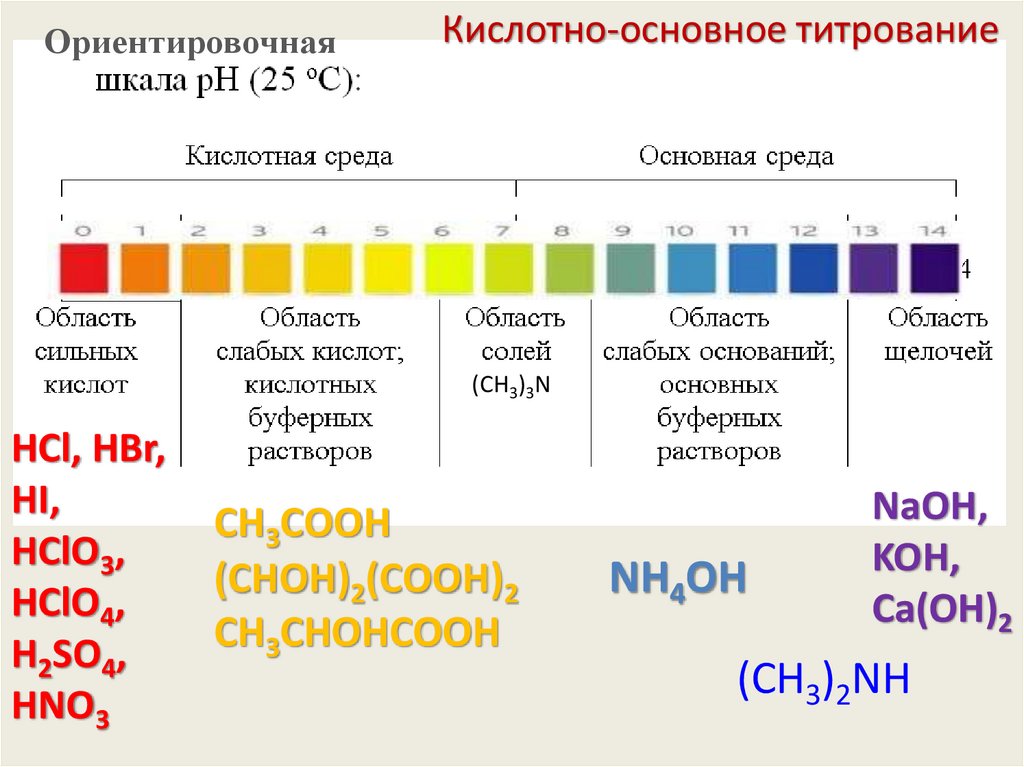
ОриентировочнаяКислотно-основное титрование
(CH3)3N
HCl, HBr,
HI,
HClO3,
HClO4,
H2SO4,
HNO3
CН3СООH
(СHОH)2(СООH)2
CН3СHОHСООH
NH4OH
NaOH,
KOH,
Сa(OH)2
(CH3)2NH
58.
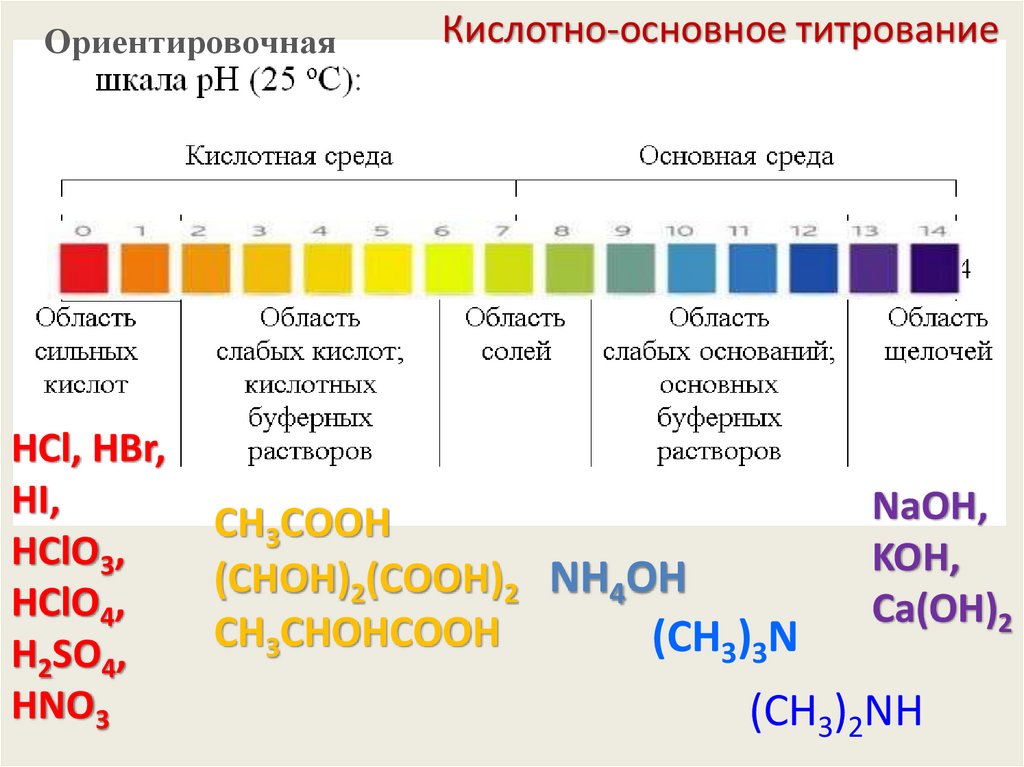
ОриентировочнаяHCl, HBr,
HI,
HClO3,
HClO4,
H2SO4,
HNO3
Кислотно-основное титрование
CН3СООH
(СHОH)2(СООH)2 NH4OH
CН3СHОHСООH
(CH3)3N
NaOH,
KOH,
Сa(OH)2
(CH3)2NH
59.
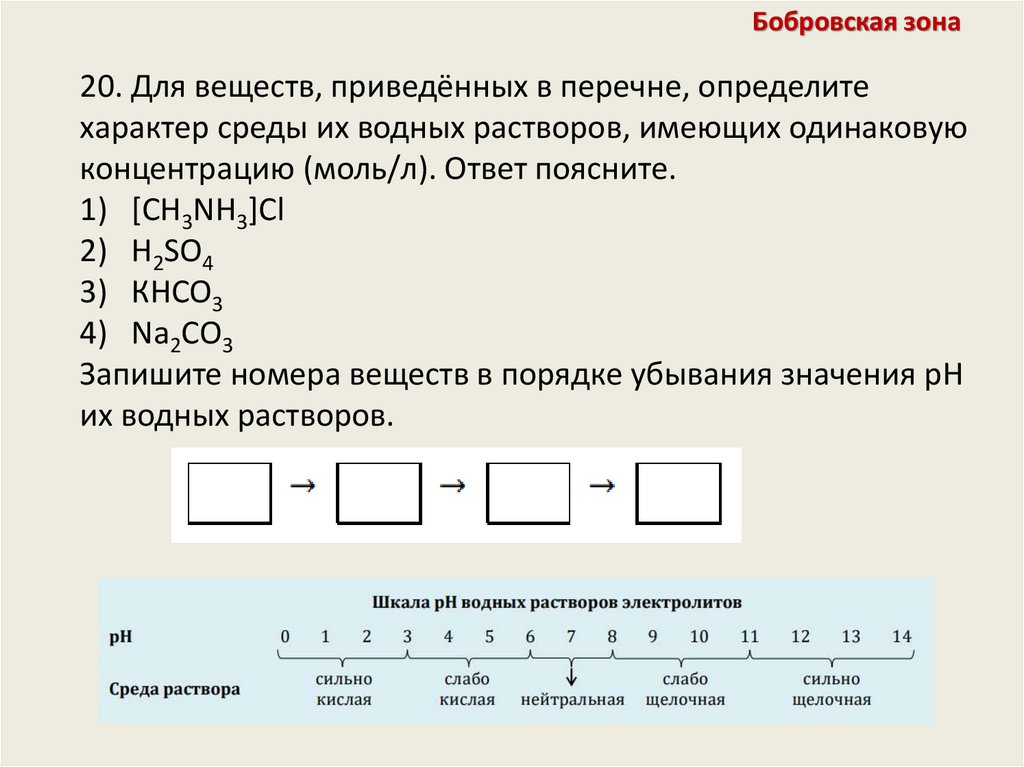
Бобровская зона20. Для веществ, приведённых в перечне, определите
характер среды их водных растворов, имеющих одинаковую
концентрацию (моль/л). Ответ поясните.
1) [CH3NH3]Cl
2) H2SO4
3) КHCO3
4) Na2CO3
Запишите номера веществ в порядке убывания значения pH
их водных растворов.
60.
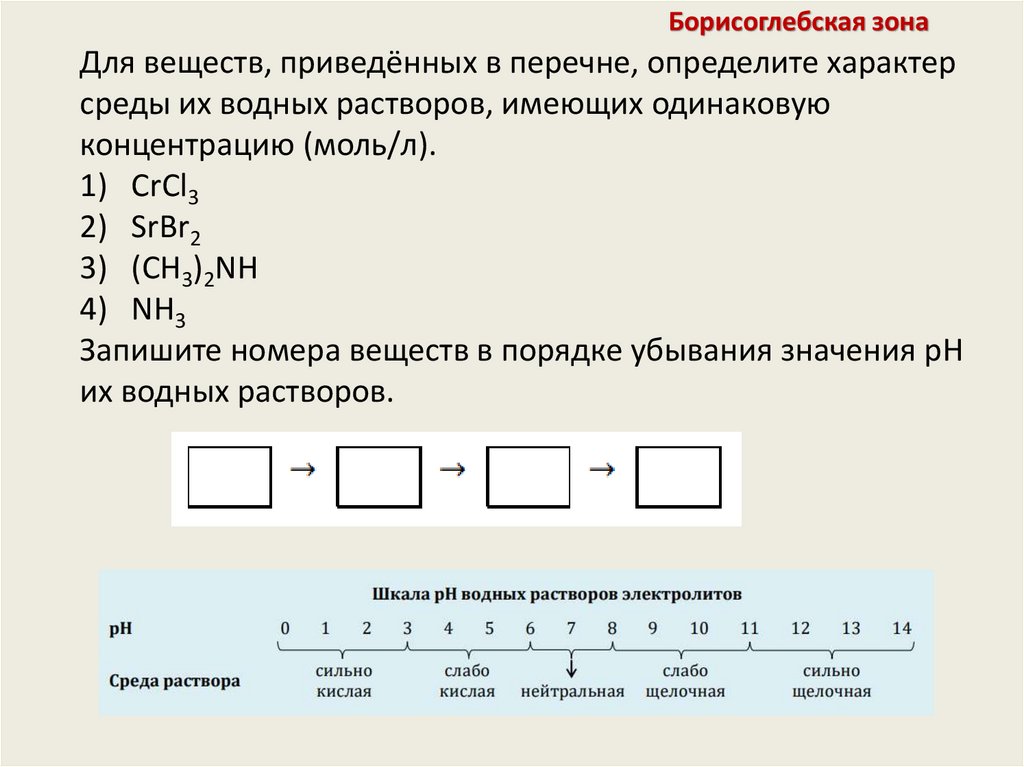
Борисоглебская зонаДля веществ, приведённых в перечне, определите характер
среды их водных растворов, имеющих одинаковую
концентрацию (моль/л).
1) CrCl3
2) SrBr2
3) (CH3)2NH
4) NH3
Запишите номера веществ в порядке убывания значения pH
их водных растворов.
61.
Богучарская зонаДля веществ, приведённых в перечне, определите характер
среды их водных растворов, имеющих одинаковую
концентрацию (моль/л).
1) Na2SO4
2) (NH4)2SO4
3) LiS
4) HClO3
Запишите номера веществ в порядке уменьшения значения
pH их водных растворов.
62.
Воронежская зона20. Для веществ, приведённых в перечне, определите
характер среды их водных растворов, имеющих одинаковую
концентрацию (моль/л). Ответ поясните.
1) FeBr2
2) C17H35COONa
3) CsOH
4) HClO3
Запишите номера веществ в порядке убывания значения pH
их водных растворов.
63.
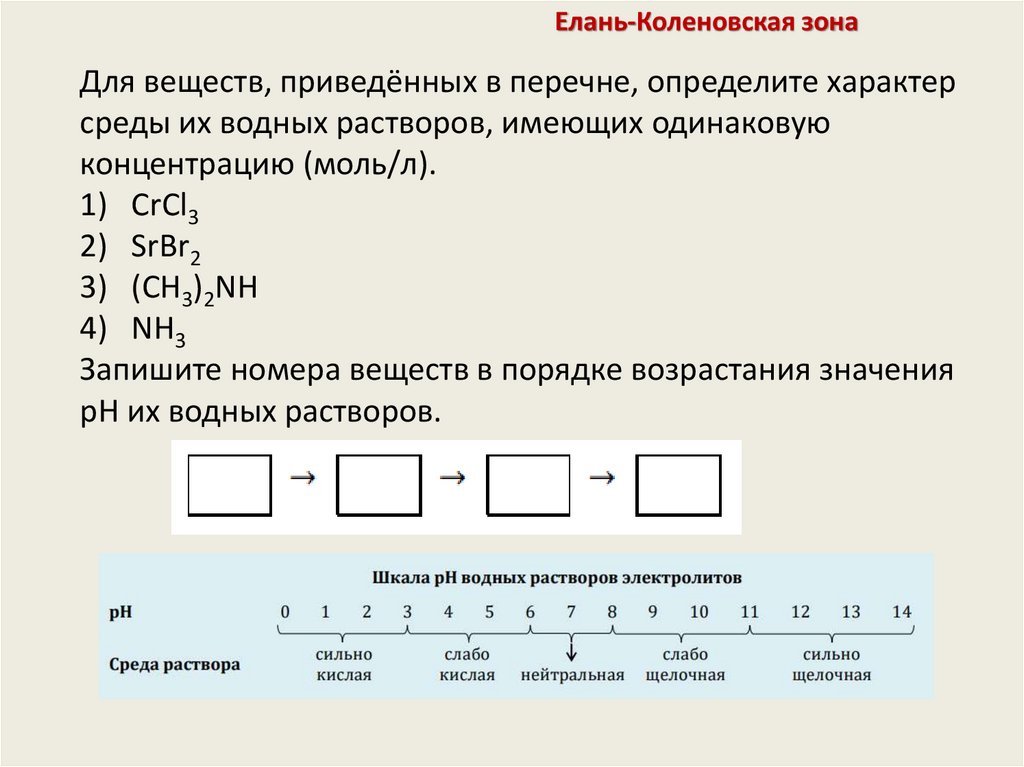
Елань-Коленовская зонаДля веществ, приведённых в перечне, определите характер
среды их водных растворов, имеющих одинаковую
концентрацию (моль/л).
1) CrCl3
2) SrBr2
3) (CH3)2NH
4) NH3
Запишите номера веществ в порядке возрастания значения
pH их водных растворов.
64.
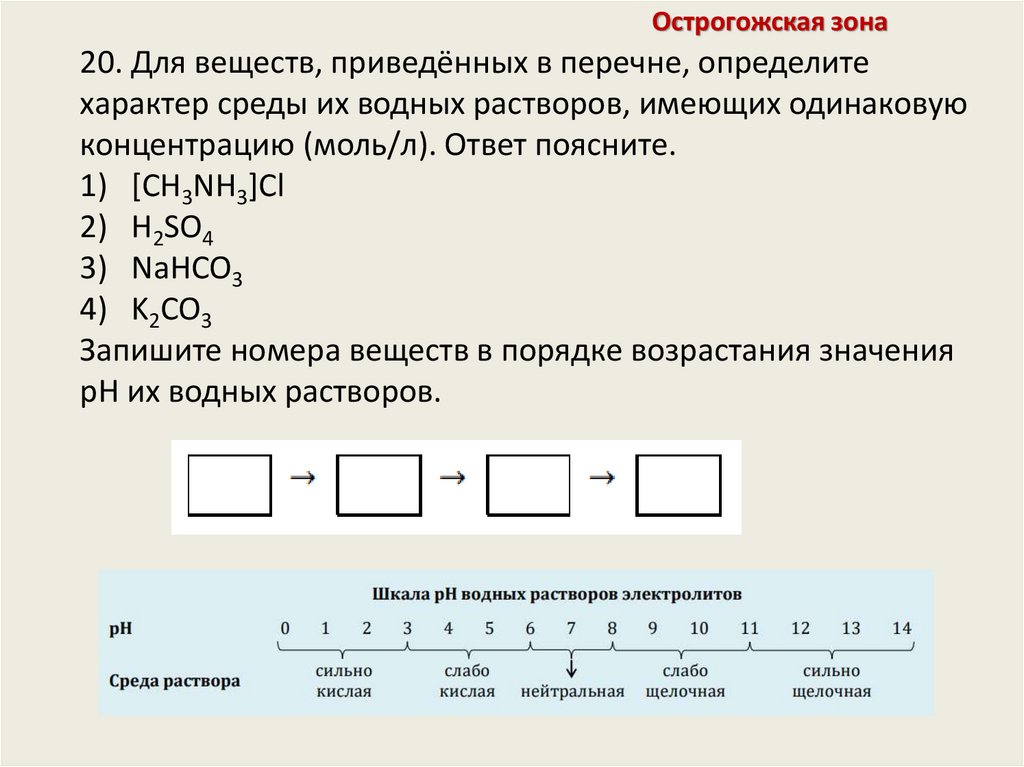
Острогожская зона20. Для веществ, приведённых в перечне, определите
характер среды их водных растворов, имеющих одинаковую
концентрацию (моль/л). Ответ поясните.
1) [CH3NH3]Cl
2) H2SO4
3) NaHCO3
4) K2CO3
Запишите номера веществ в порядке возрастания значения
pH их водных растворов.
65.
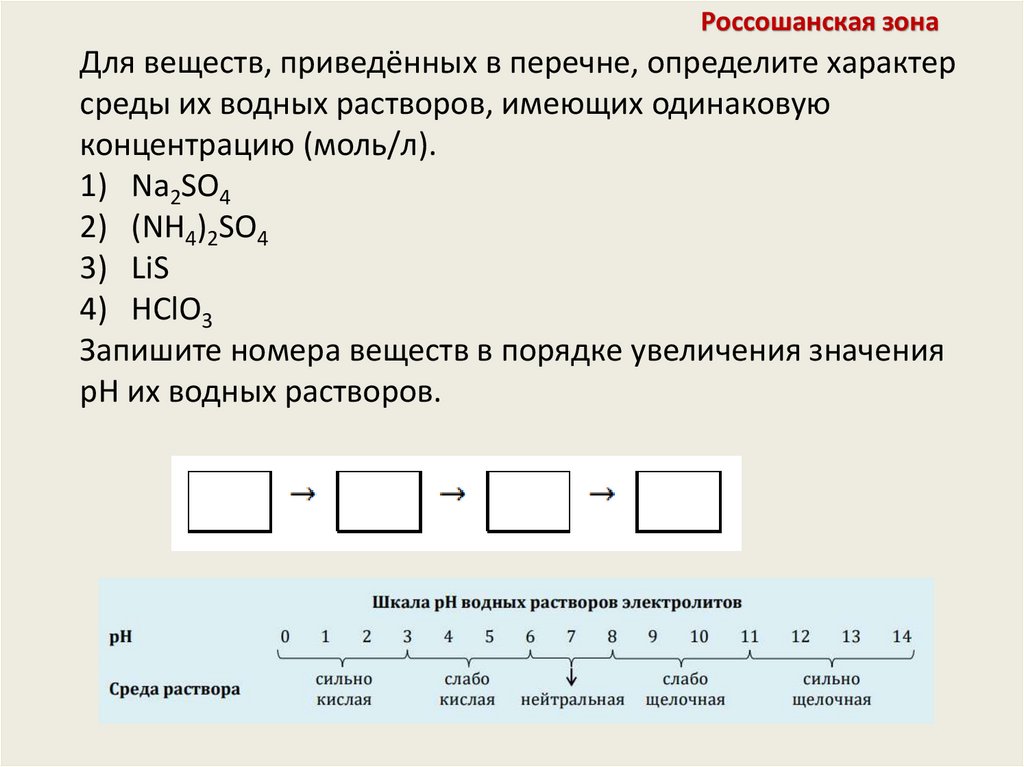
Россошанская зонаДля веществ, приведённых в перечне, определите характер
среды их водных растворов, имеющих одинаковую
концентрацию (моль/л).
1) Na2SO4
2) (NH4)2SO4
3) LiS
4) HClO3
Запишите номера веществ в порядке увеличения значения
pH их водных растворов.




































 Химия
Химия








