Похожие презентации:
Альдегиды и кетоны
1.
АЛЬДЕГИДЫ И КЕТОНЫАльдегиды и кетоны – органические соединения, молекулы которых
содержат карбонильную группу (оксогруппу) >С=О.
По наличию этой функциональной группы альдегиды и кетоны относят к
карбонильным или оксосоединениям.
Альдегиды органические соединения, в молекулах которых атом
углерода карбонильной группы (карбонильный углерод) связан с атомом
водорода.
Общая формула: R–CН=O или
R
H
C O
(R = H, алкил, арил)
Функциональная группа –СН=О называется альдегидной.
Кетоны органические вещества, молекулы которых содержат
карбонильную группу, соединенную с двумя углеводородными
радикалами.
Общие формулы: R2C=O, R–CO–R' или
R
(R, R' = алкил, арил)
C O
R'
2.
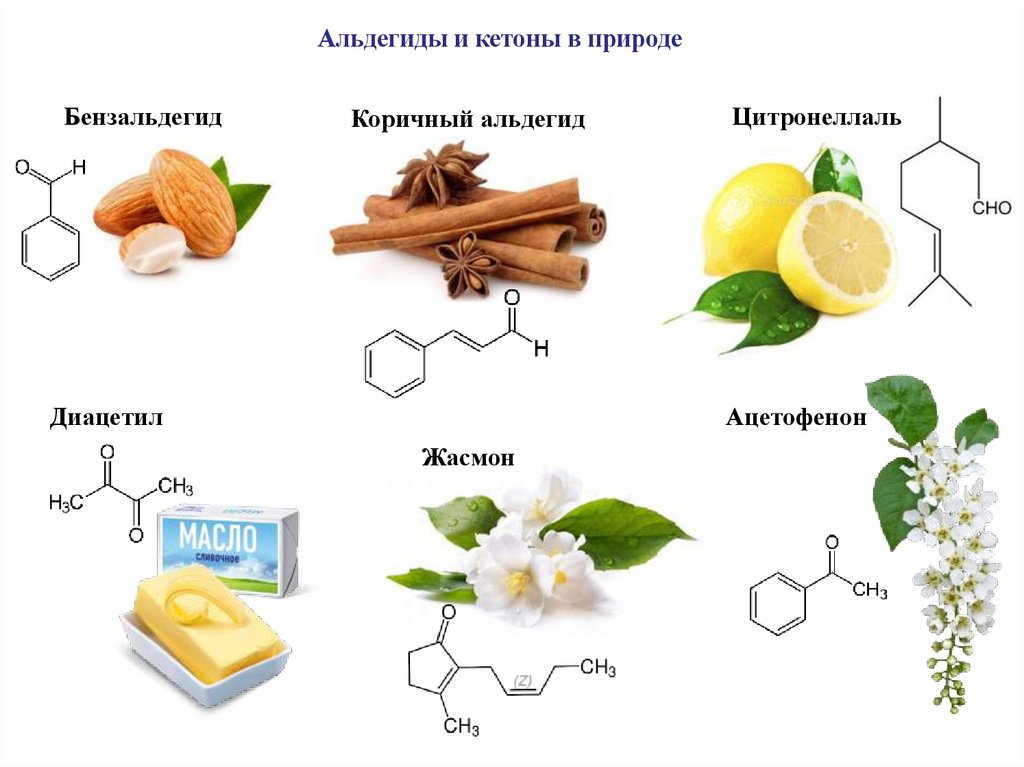
Альдегиды и кетоны в природеБензальдегид
Коричный альдегид
Диацетил
Цитронеллаль
Ацетофенон
Жасмон
3.
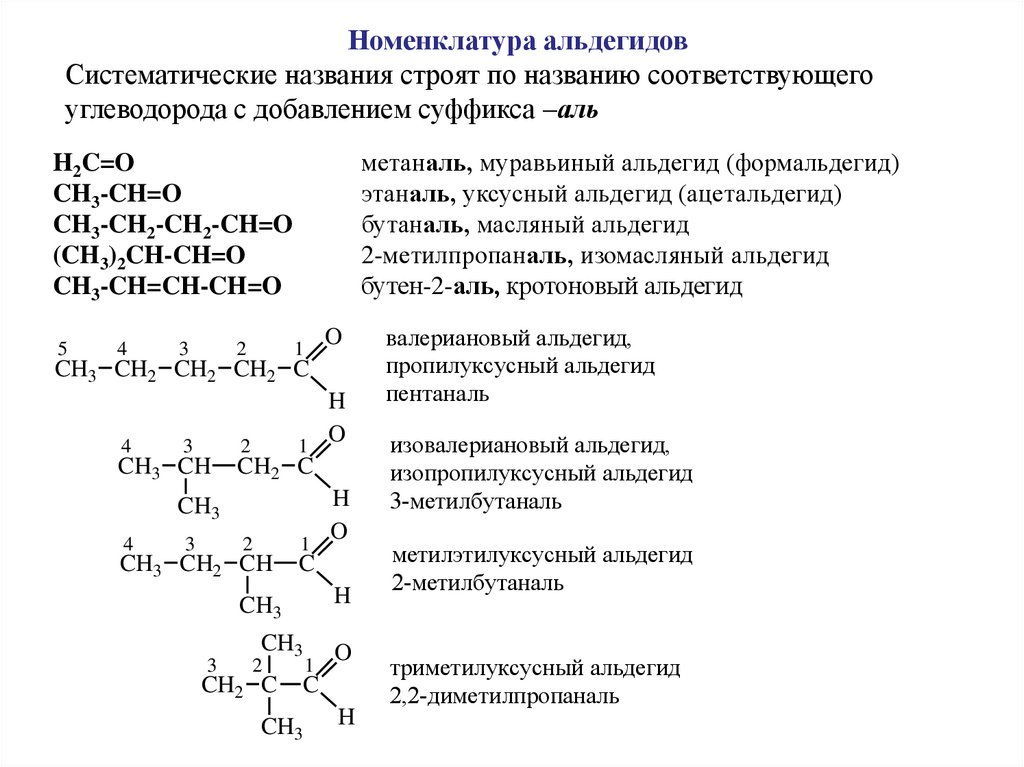
Номенклатура альдегидовСистематические названия строят по названию соответствующего
углеводорода с добавлением суффикса –аль
метаналь, муравьиный альдегид (формальдегид)
этаналь, уксусный альдегид (ацетальдегид)
бутаналь, масляный альдегид
2-метилпропаналь, изомасляный альдегид
бутен-2-аль, кротоновый альдегид
H2C=O
CH3-CH=O
CH3-CH2-CH2-CH=O
(CH3)2CH-CH=O
CH3-CH=CH-CH=O
5
4
3
2
1
O
CH3 CH2 CH2 CH2 C
4
3
2
CH3 CH
CH2
CH3
4
3
2
CH3 CH2 CH
CH3
3
H
O
1
C
H
O
1
C
H
CH3
2
CH2 C
1
O
C
CH3
H
валериановый альдегид,
пропилуксусный альдегид
пентаналь
изовалериановый альдегид,
изопропилуксусный альдегид
3-метилбутаналь
метилэтилуксусный альдегид
2-метилбутаналь
триметилуксусный альдегид
2,2-диметилпропаналь
4.
В префиксе альдегидную группу называют формил-:O
O
C CH2 C
H
OH
формилуксусная кислота
(в свободном состоянии неизвестна)
Номенклатура кетонов
Заместительная номенклатура ИЮПАК:
• название кетона строится по названию соответствующего углеводорода и
суффикса -он; нумерацию цепи начинают от конца, ближайшего к карбонильной
группе:
1 2 3
ацетон, диметилкетон
2-пропанон
H3C C CH3
1
O
2
3
4
H3C C CH2 CH3
O
метилэтилкетон
2-бутанон
Названия кетонов несложного строения производят от названий радикалов (в
алфавитном порядке) с добавлением слова кетон. Для симметричных кетонов
перед названием радикала употребляется приставка ди.
В префиксе кетогруппу называют оксо-
5.
Изомерия альдегидов и кетоновСтруктурная изомерия альдегидов:
- изомерия углеродного скелета, начиная с С4
CH3 CH2 CH2 C
бутаналь
CH3
O
CH3 CH C
H
- межклассовая изомерия:
а) с кетонами, начиная с С3
O
H
2-метилпропаналь
CH3 CH2 C
O
CH3 C CH3
O
пропанон
(ацетон)
H
пропаналь
б) с циклическими оксидами (с С2)
CH3 C
O
CH2
H
O
этиленоксид
(эпоксид)
этаналь
(ацетальдегид)
в) с непредельными спиртами и простыми эфирами (с С3)
CH3 CH2 C
пропаналь
O
H
CH2
CH2 CH CH2 OH
CH2 CH O CH3
аллиловый спирт
винилметиловый эфир
6.
Структурная изомерия кетонов:- изомерия углеродного скелета (c C5)
CH3 CH2 CH2 C CH3
O
пентанон-2
CH3 CH
C CH3
CH3 O
3-метилбутанон-2
- изомерия положения карбонильной группы (c C5)
CH3 CH2 CH2 C CH3
CH3 CH2 C CH2 CH3
O
пентанон-2
O
пентанон-3
-межклассовая изомерия (аналогично альдегидам).
Пространственная изомерия:
• Оптическая (если углеводородный радикал содержит асимметрический
углеродный атом)
• цис-транс-изомерия (если углеводородный радикал содержит двойную связь)
7.
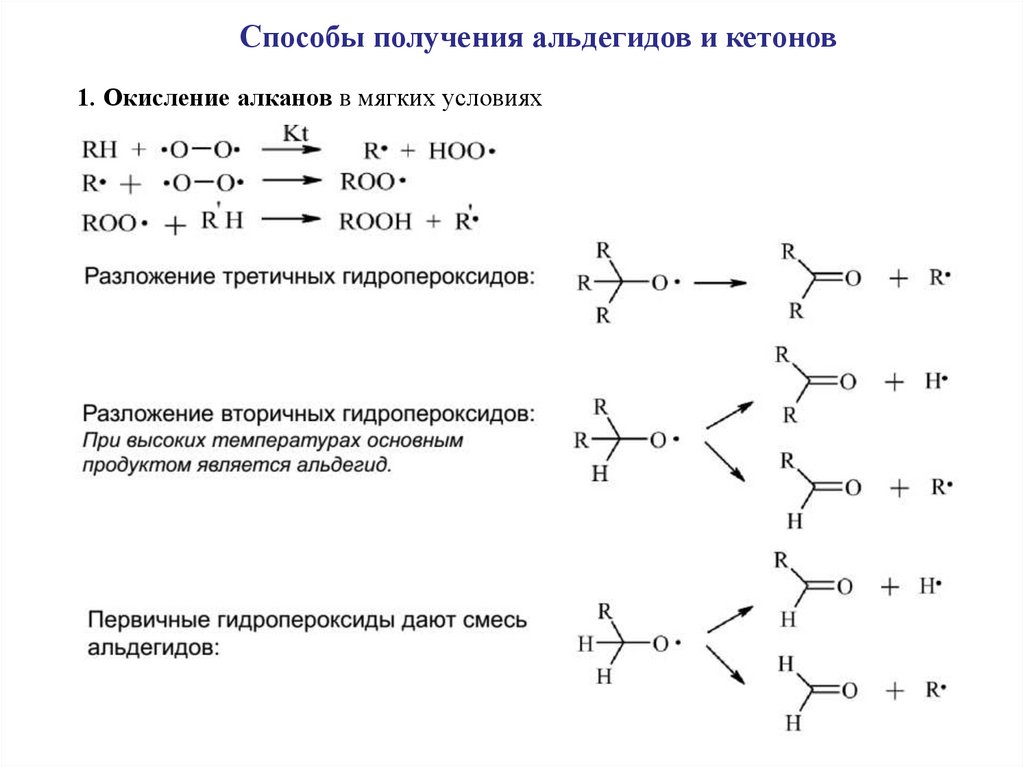
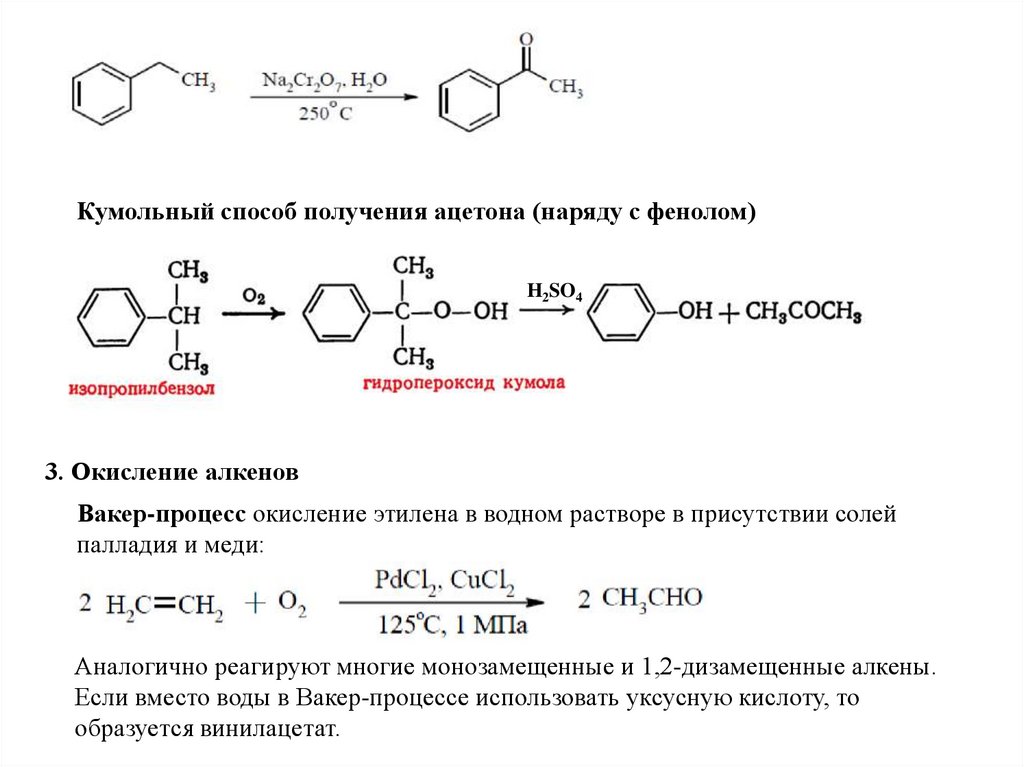
Способы получения альдегидов и кетонов1. Окисление алканов в мягких условиях
8.
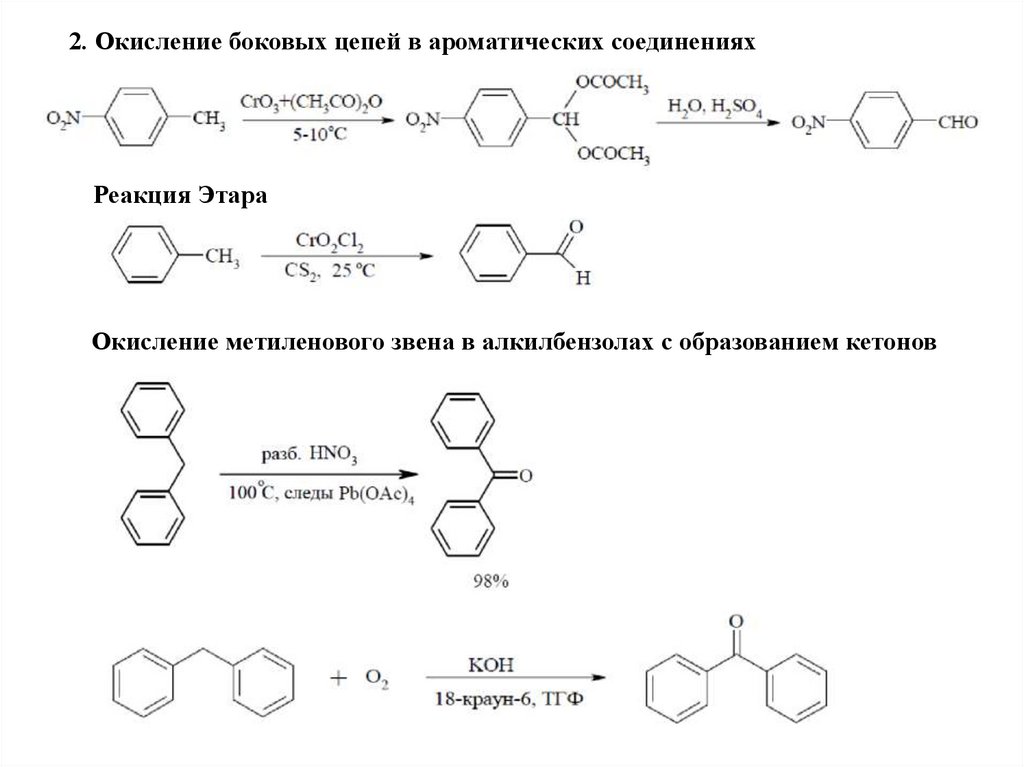
2. Окисление боковых цепей в ароматических соединенияхРеакция Этара
Окисление метиленового звена в алкилбензолах с образованием кетонов
9.
Кумольный способ получения ацетона (наряду с фенолом)H2SO4
3. Окисление алкенов
Вакер-процесс окисление этилена в водном растворе в присутствии солей
палладия и меди:
Аналогично реагируют многие монозамещенные и 1,2-дизамещенные алкены.
Если вместо воды в Вакер-процессе использовать уксусную кислоту, то
образуется винилацетат.
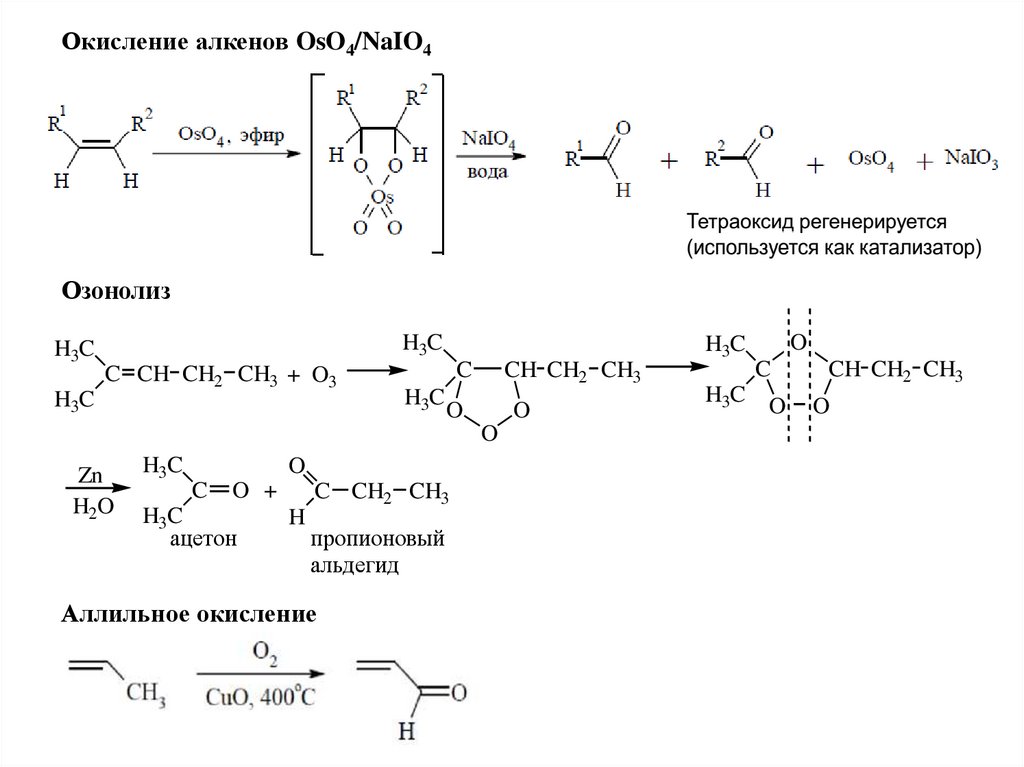
10.
Окисление алкенов OsO4/NaIO4Озонолиз
H3C
H3C
H3C
C CH CH2 CH3 + O3
H3C
C
CH CH2 CH3
O
O
O
Zn
H2O
H3C
O
C
O +
H3C
ацетон
C CH2 CH3
H
пропионовый
альдегид
Аллильное окисление
O
H3C
H3C
C
CH CH2 CH3
O
O
11.
4. Гидроформилирование алкенов (оксосинтез)CH3 CH
CH2 + CO + H2
[Co(CO)4]2
t C
O
CH3 CH2 CH2 C
+
H
бутаналь
(основной продукт)
CH3 CH CH3
C
H
O
2-метилпропаналь
Количество изомерного разветвленного альдегида можно свести к минимуму, если
в качестве катализатора в гораздо более мягких условиях использовать гомогенные
комплексы Pt(II) с органическими лигандами или гидрохлорид
дициклопентадиенилциркония (C5H5)2ZrHCl
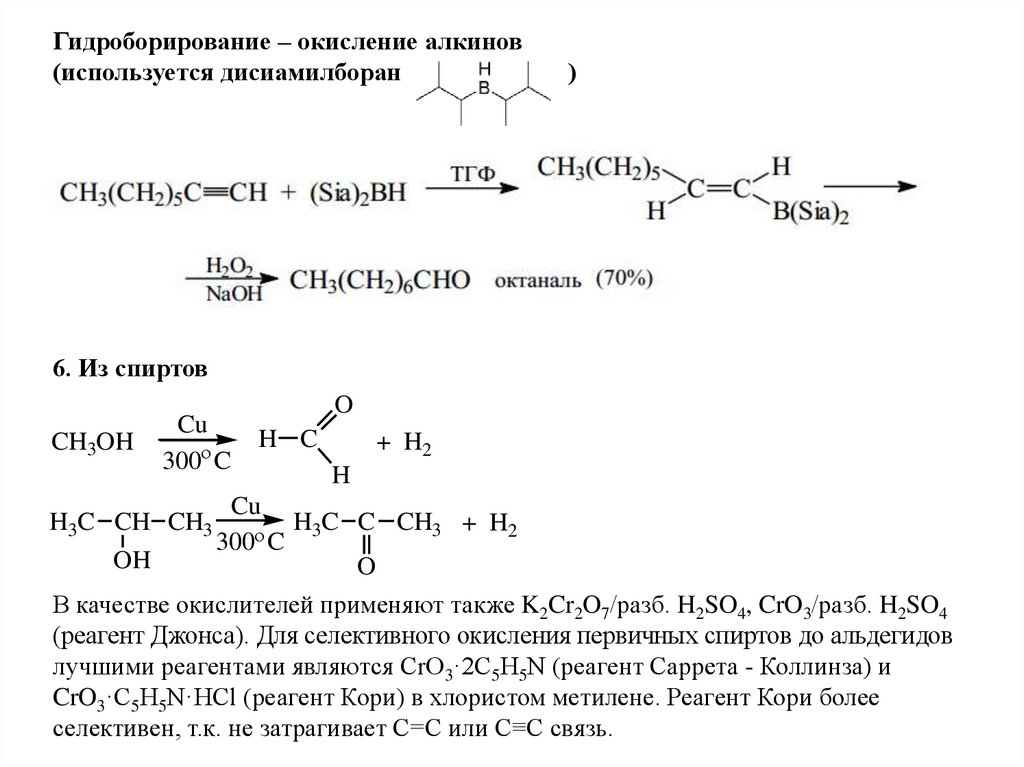
5. Из алкинов
Реакция Кучерова
12.
Гидроборирование – окисление алкинов(используется дисиамилборан
)
6. Из спиртов
CH3OH
Cu
300 C
O
H C
+ H2
H
Cu
H3C CH CH3
H3C C CH3 + H2
300 C
OH
O
В качестве окислителей применяют также K2Cr2O7/разб. H2SO4, CrO3/разб. H2SO4
(реагент Джонса). Для селективного окисления первичных спиртов до альдегидов
лучшими реагентами являются CrO3·2С5Н5N (реагент Саррета - Коллинза) и
CrO3·С5Н5N·HCl (реагент Кори) в хлористом метилене. Реагент Кори более
селективен, т.к. не затрагивает C=C или С≡С связь.
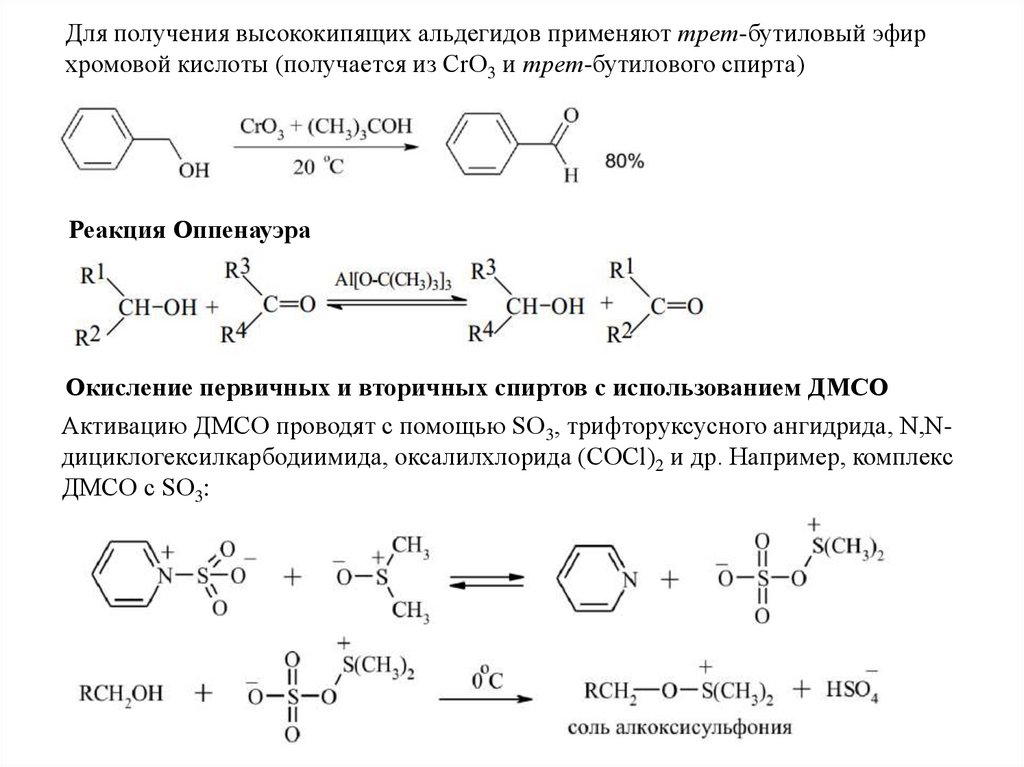
13.
Для получения высококипящих альдегидов применяют трет-бутиловый эфирхромовой кислоты (получается из CrO3 и трет-бутилового спирта)
Реакция Оппенауэра
Окисление первичных и вторичных спиртов с использованием ДМСО
Активацию ДМСО проводят с помощью SO3, трифторуксусного ангидрида, N,Nдициклогексилкарбодиимида, оксалилхлорида (COCl)2 и др. Например, комплекс
ДМСО с SО3:
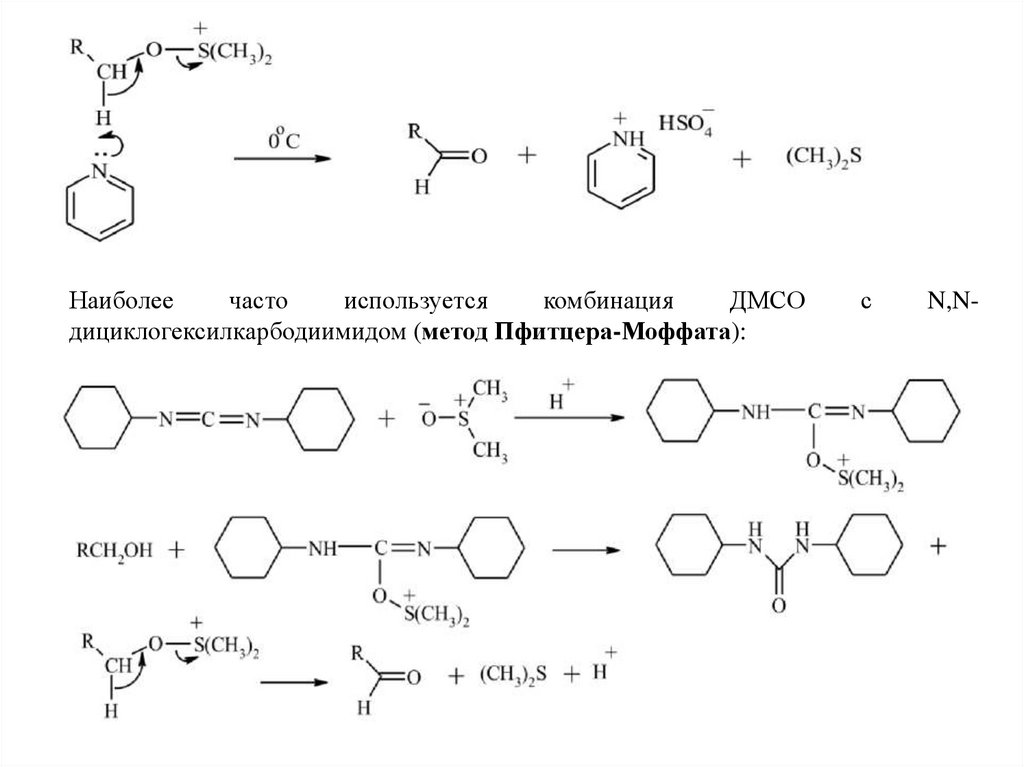
14.
Наиболеечасто
используется
комбинация
ДМСО
дициклогексилкарбодиимидом (метод Пфитцера-Моффата):
с
N,N-
15.
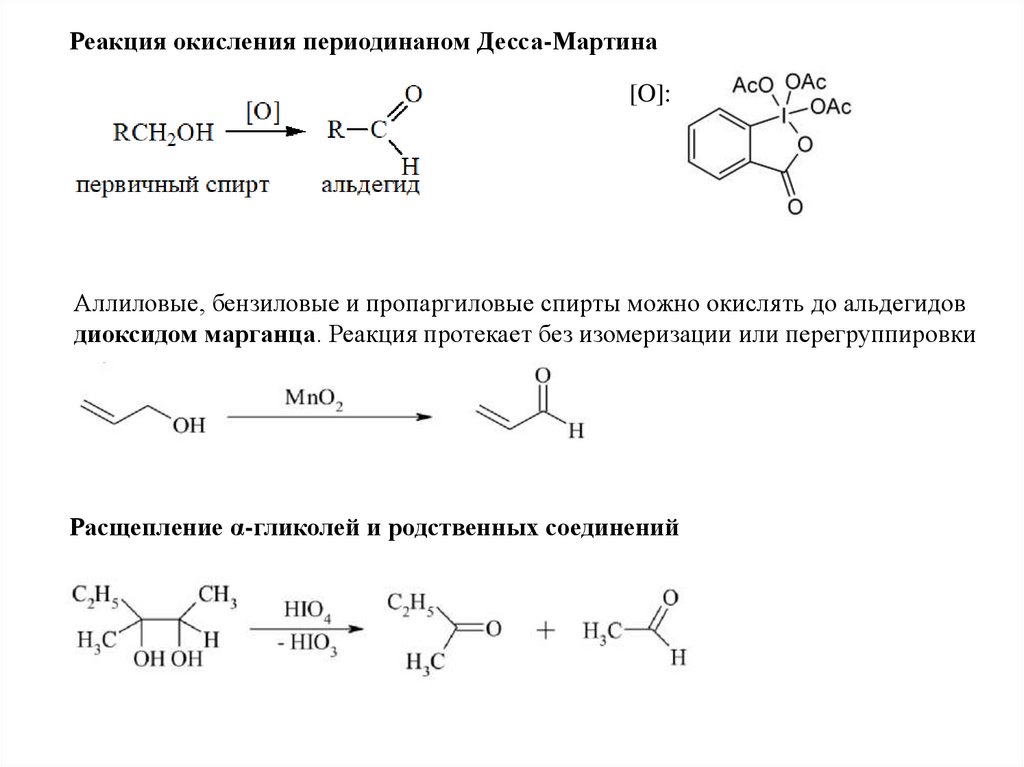
Реакция окисления периодинаном Десса-Мартина[O]:
Аллиловые, бензиловые и пропаргиловые спирты можно окислять до альдегидов
диоксидом марганца. Реакция протекает без изомеризации или перегруппировки
Расщепление α-гликолей и родственных соединений
16.
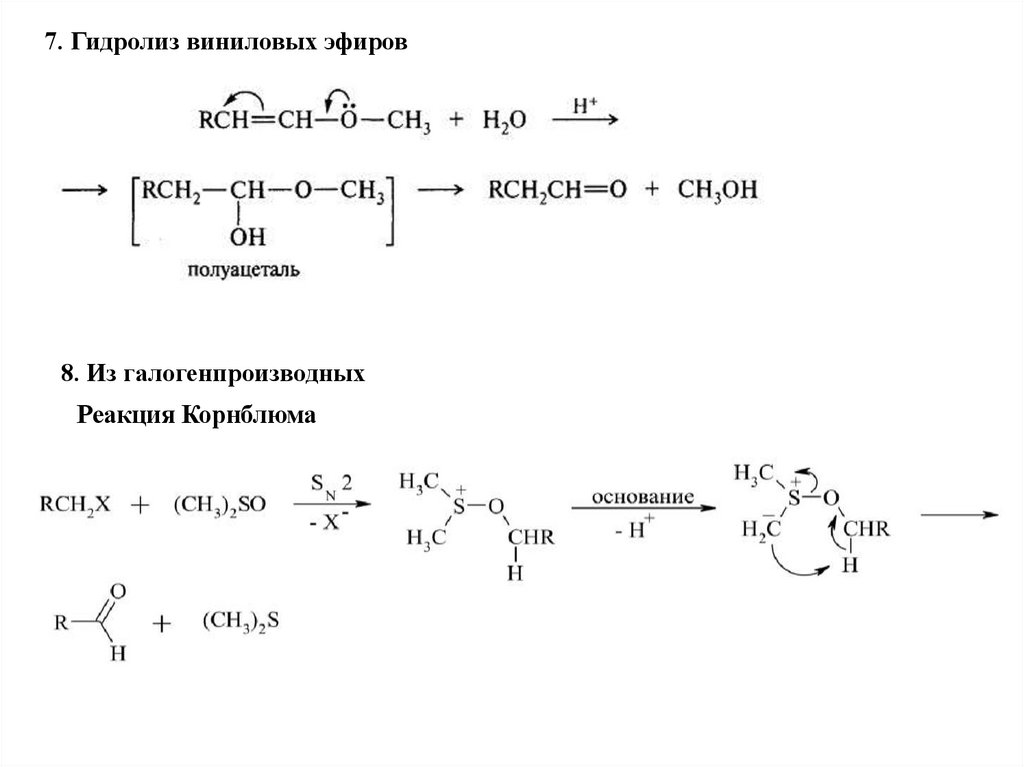
7. Гидролиз виниловых эфиров8. Из галогенпроизводных
Реакция Корнблюма
17.
Окисление бензилгалогенидовРеакция Соммле
С помощью солей 2-нитропропана
18.
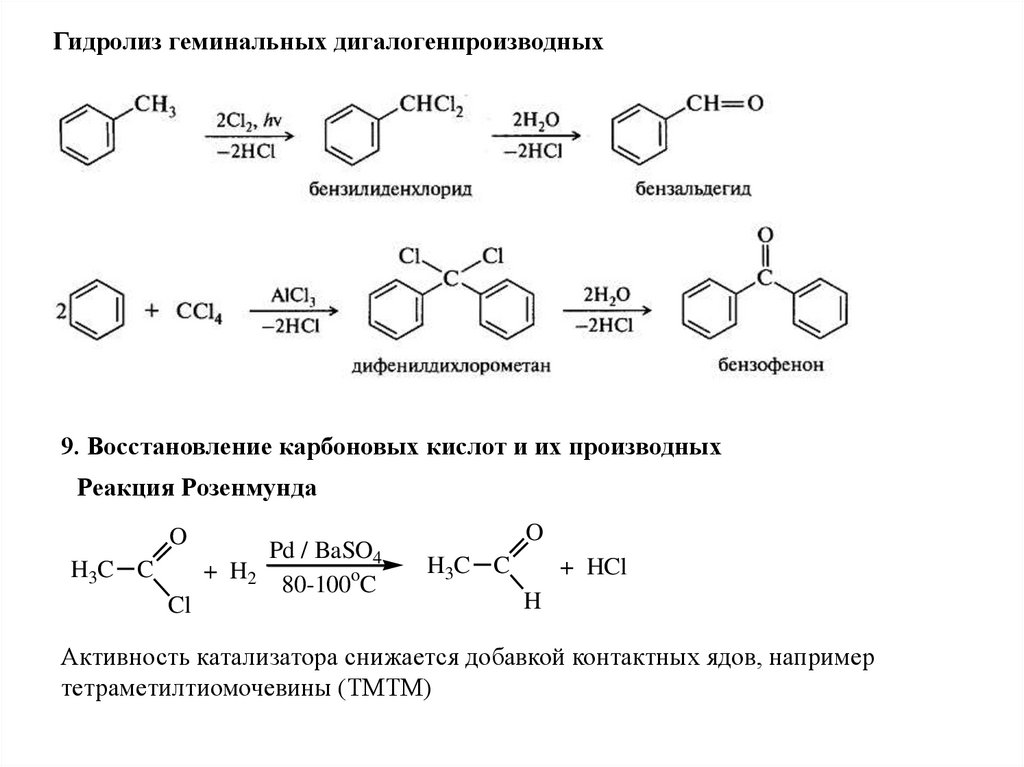
Гидролиз геминальных дигалогенпроизводных9. Восстановление карбоновых кислот и их производных
Реакция Розенмунда
O
H3C C
+ H2
Cl
Pd / BaSO4
80-100oC
O
H3C C
+ HCl
H
Активность катализатора снижается добавкой контактных ядов, например
тетраметилтиомочевины (ТМТМ)
19.
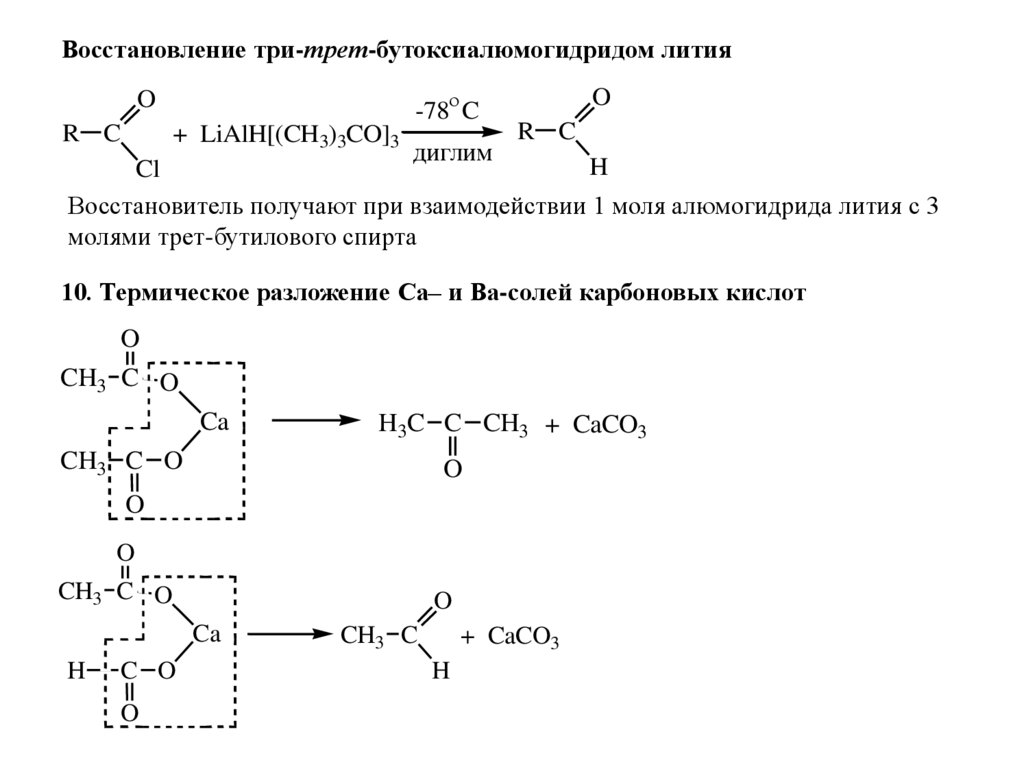
Восстановление три-трет-бутоксиалюмогидридом лития-78 C
O
R C
+ LiAlH[(CH3)3CO]3
O
R C
диглим
H
Cl
Восстановитель получают при взаимодействии 1 моля алюмогидрида лития с 3
молями трет-бутилового спирта
10. Термическое разложение Са– и Ва-солей карбоновых кислот
O
CH3 C O
Ca
H3C C CH3 + CaCO3
CH3 C O
O
O
O
CH3 C O
O
Ca
H
C O
O
CH3 C
+ CaCO3
H
20.
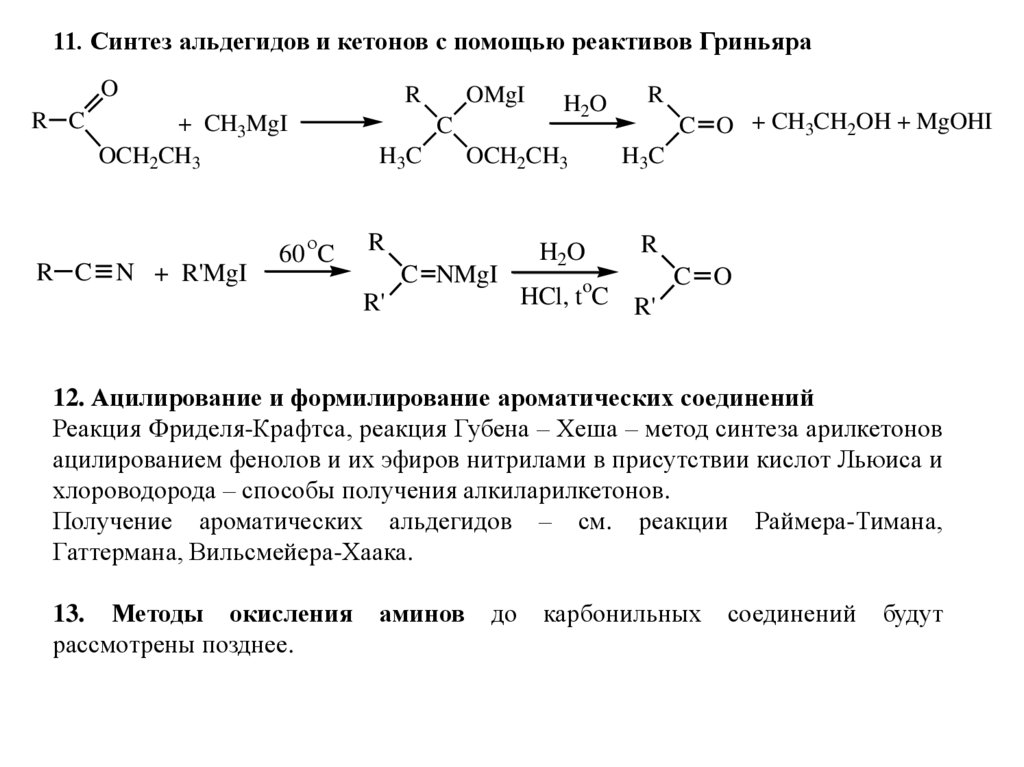
11. Синтез альдегидов и кетонов с помощью реактивов ГриньяраO
R C
R
+ CH3MgI
OCH2CH3
C
H3C
R C N + R'MgI
OMgI
60 C
H2O
OCH2CH3
R
C NMgI
R'
H2O
R
C O + CH3CH2OH + MgOHI
H3C
R
HCl, toC R'
C O
12. Ацилирование и формилирование ароматических соединений
Реакция Фриделя-Крафтса, реакция Губена – Хеша – метод синтеза арилкетонов
ацилированием фенолов и их эфиров нитрилами в присутствии кислот Льюиса и
хлороводорода – способы получения алкиларилкетонов.
Получение ароматических альдегидов – см. реакции Раймера-Тимана,
Гаттермана, Вильсмейера-Хаака.
13. Методы окисления
рассмотрены позднее.
аминов
до
карбонильных
соединений
будут
21.
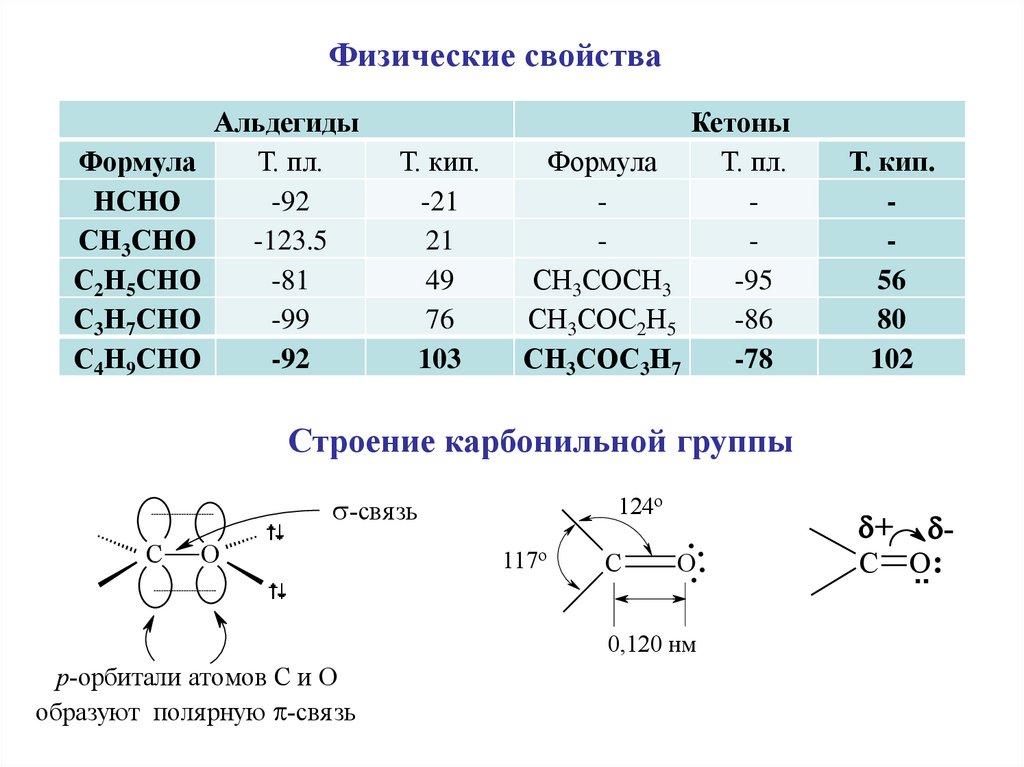
Физические свойстваАльдегиды
Формула
Т. пл.
НСНО
-92
СН3СНО
-123.5
С2Н5СНО
-81
С3Н7СНО
-99
С4Н9СНО
-92
Т. кип.
-21
21
49
76
103
Кетоны
Формула
Т. пл.
СН3СОСН3
-95
СН3СОС2Н5
-86
СН3СОС3Н7
-78
Т. кип.
56
80
102
Строение карбонильной группы
124o
-свя зь
C
O
117o
C
..
O..
0,120 нм
p-орбитали атомов C и О
образуют поля рную -свя зь
+
C
-
O
.. :
22.
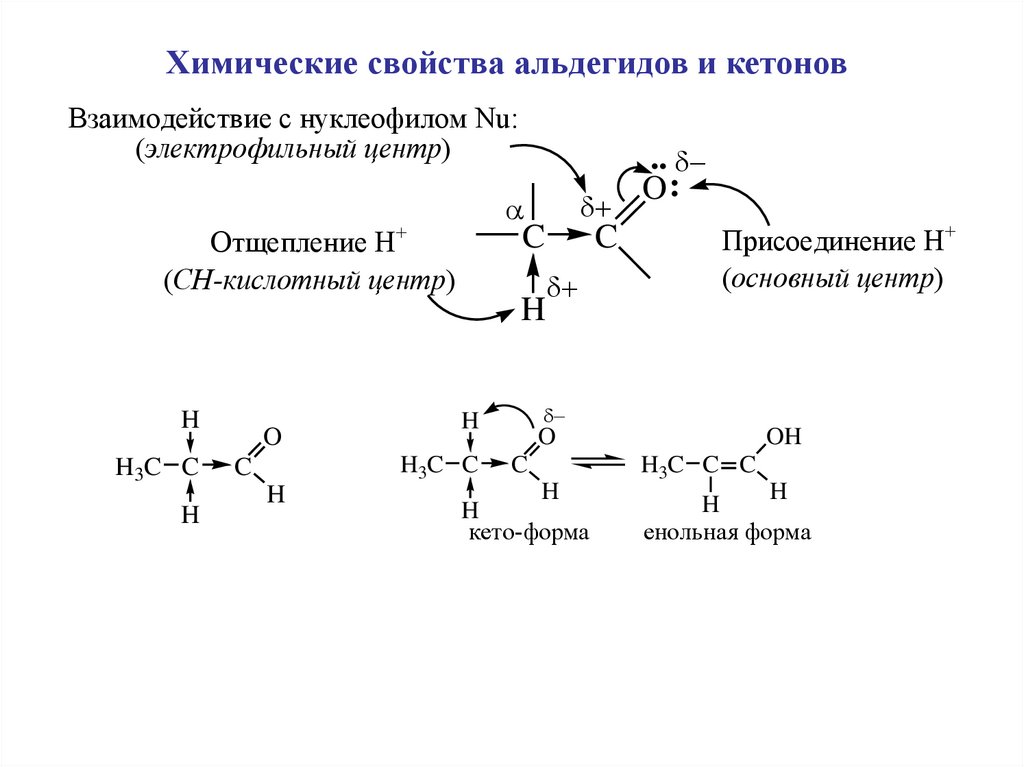
Химические свойства альдегидов и кетоновВзаимодействие с нуклеофилом Nu:
(электрофильный центр)
Отщепление Н+
(CH-кислотный центр)
C
H
H
H 3C C
H
O
H
Присоединение Н+
(основный центр)
H
H3C C
C
C
..
O:
O
C
OH
H3C C C
H
H
кето-форма
H
H
енольная форма
23.
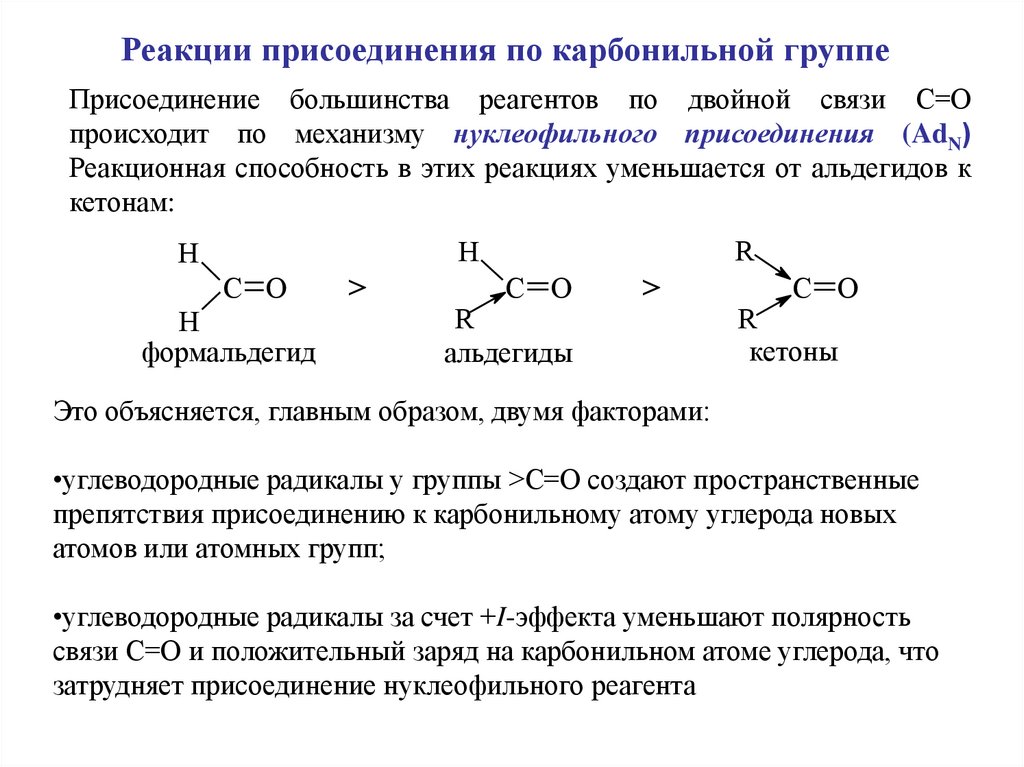
Реакции присоединения по карбонильной группеПрисоединение большинства реагентов по двойной связи С=О
происходит по механизму нуклеофильного присоединения (AdN)
Реакционная способность в этих реакциях уменьшается от альдегидов к
кетонам:
R
H
H
C O
H
формальдегид
>
C O
R
альдегиды
>
C O
R
кетоны
Это объясняется, главным образом, двумя факторами:
•углеводородные радикалы у группы >С=О создают пространственные
препятствия присоединению к карбонильному атому углерода новых
атомов или атомных групп;
•углеводородные радикалы за счет +I-эффекта уменьшают полярность
связи С=О и положительный заряд на карбонильном атоме углерода, что
затрудняет присоединение нуклеофильного реагента
24.
Реакции с О-нуклеофилами1. Присоединение воды
Вода присоединяется к альдегидам и кетонам, образуя неустойчивые
гем-диолы:
R
R'
C O + H2O
Cl3CCHO + H2O
хлораль
R
R' C OH
OH
Cl3CCH(OH)2
хлоральгидрат (устойчивый гем-диол)
Содержание карбонильной формы и гем-диола
в водных растворах альдегидов и кетонов
Соединение
Н2С=О
СН3СН=О
СН3С(О)СН3
СlСН2СН=О
Карбонильная форма, %
0.05
43
99.8
3
Гем-диол, %
99.95
57
0.2
97
25.
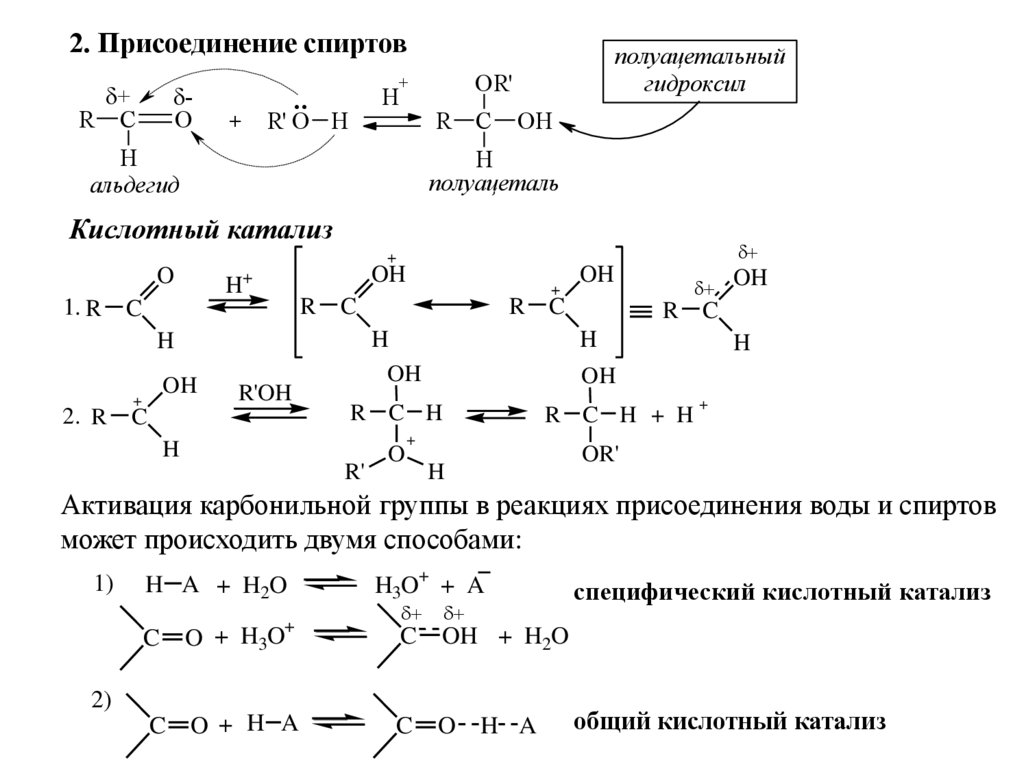
2. Присоединение спиртов+
R C
O
+
OR'
+
H
..
R' O H
R
H
альдегид
полуацетальный
гидроксил
C
OH
H
полуацеталь
Кислотный катализ
+
O
1. R
OH
H+
R
C
C
2. R
+
R'OH
C
R'
O
OH
R
C
H
H
OH
R C H
H
OH
C
H
OH
H
OH
R
+
R C H + H
+
H
+
OR'
Активация карбонильной группы в реакциях присоединения воды и спиртов
может происходить двумя способами:
1)
H A + H2O
H3O+ + A
C
O + H3O
+
C
OH + H2O
C
O + H A
C
O H A
2)
специфический кислотный катализ
общий кислотный катализ
26.
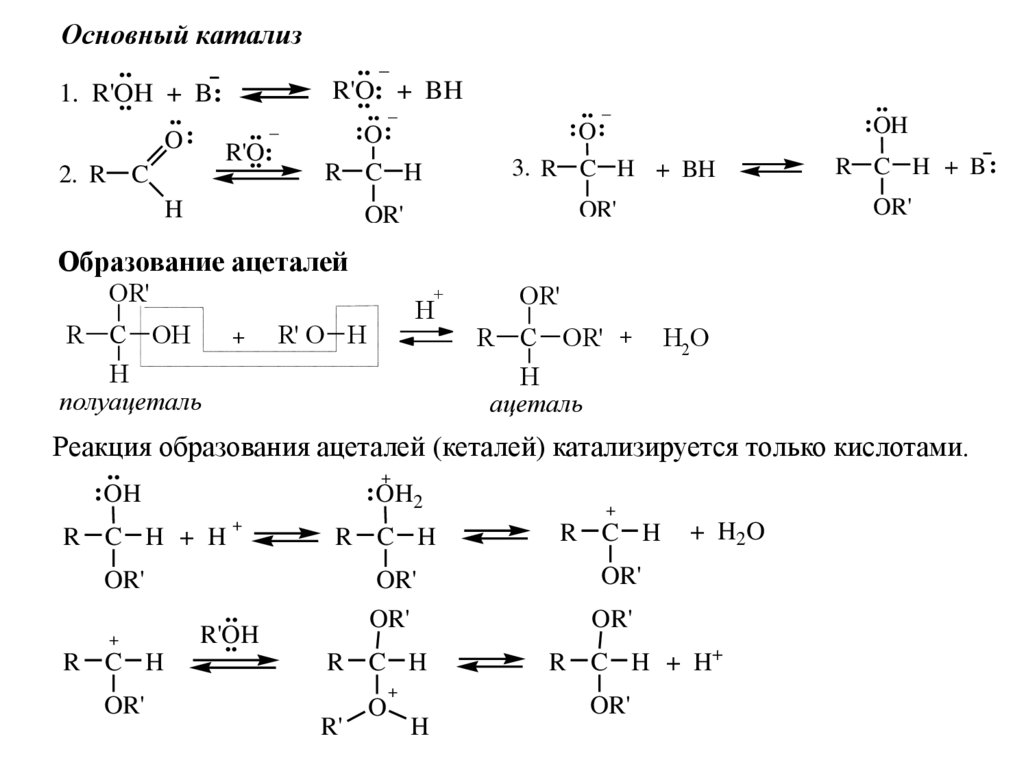
Основный катализ..
1. R'OH
.. + B:
..
.. _
O : R'O:
..
2. R C
H
.. _
R'O:
.... _+ BH
:O :
R C H
3. R C H + BH
OR'
OR'
..
: OH
.. _
:O :
R C H + B:
OR'
Образование ацеталей
OR'
+
R C OH
H
полуацеталь
+
H
R' O H
OR'
R C OR' +
H
ацеталь
H2O
Реакция образования ацеталей (кеталей) катализируется только кислотами.
..
: OH
+
R C H + H
+
: OH2
+
R C H
R C H
OR'
OR'
OR'
OR'
OR'
+
R C H
OR'
..
R'OH
..
R C H
R'
O
+
H
+ H2 O
R C H + H+
OR'
27.
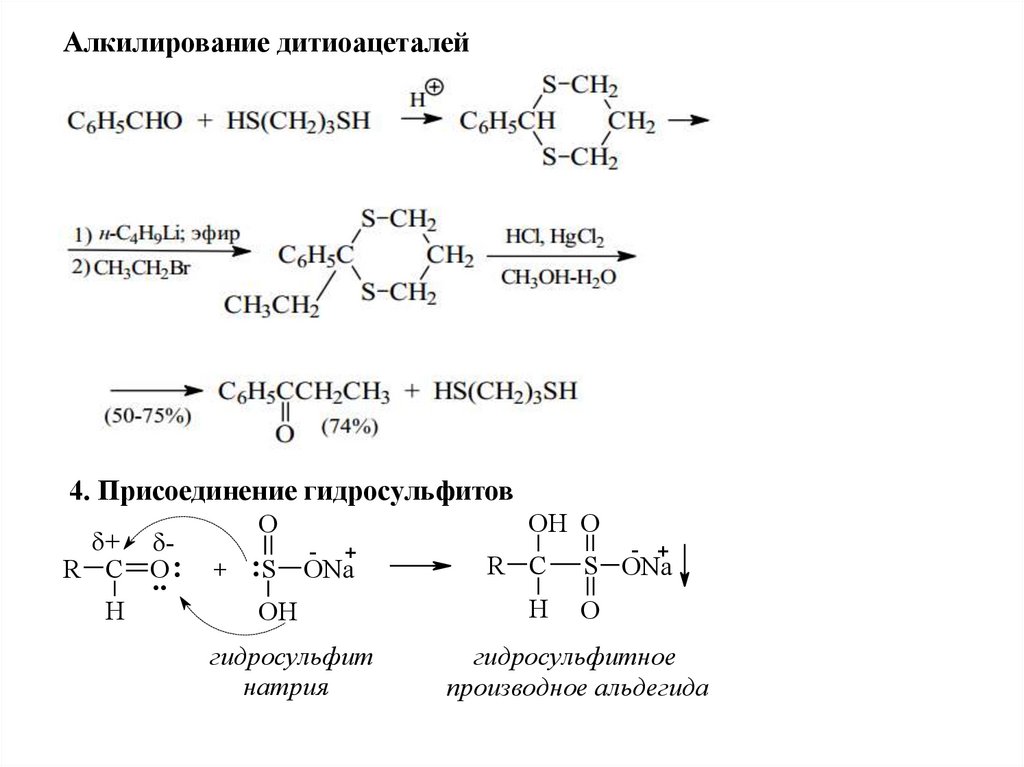
Реакции с S-нуклеофилами3. Реакция с тиолами
Дитиоацетали устойчивы к действию оснований и довольно трудно
гидролизуются в кислой среде.
Для их расщепления используют соединения ртути и кадмия.
Образование дитиоацеталей используют для защиты карбонильной
группы.
28.
Алкилирование дитиоацеталей4. Присоединение гидросульфитов
+ R C O
.. :
H
OH O
O
+
-
+
:S ONa
OH
гидросульфит
натрия
R C
H
- +
S ONa
O
гидросульфитное
производное альдегида
29.
Реакции с С-нуклеофилами5. Присоединение циановодородной (синильной) кислоты HCN
+ R C O
..:
+
CN
+ H CN
R C OH
H
-гидроксинитрил
(циангидрин)
H
альдегид
Механизм реакции (AdN):
Стадия 1 – образование цианид-иона:
HCN + OH
:CN + H2O
Стадия 2 – медленное присоединение цианид-иона к карбонильной группе:
:O:
..
:O :
H3C C CH3
H3C C CH3
: CN
CN
Стадия
.. 3 – быстрое присоединение
.. протона к алкоксид-иону:
:O:
H3C C CH3 + H2O
CN
: OH
H3C C CH3 + OH
CN
ацетоциангидрин
30.
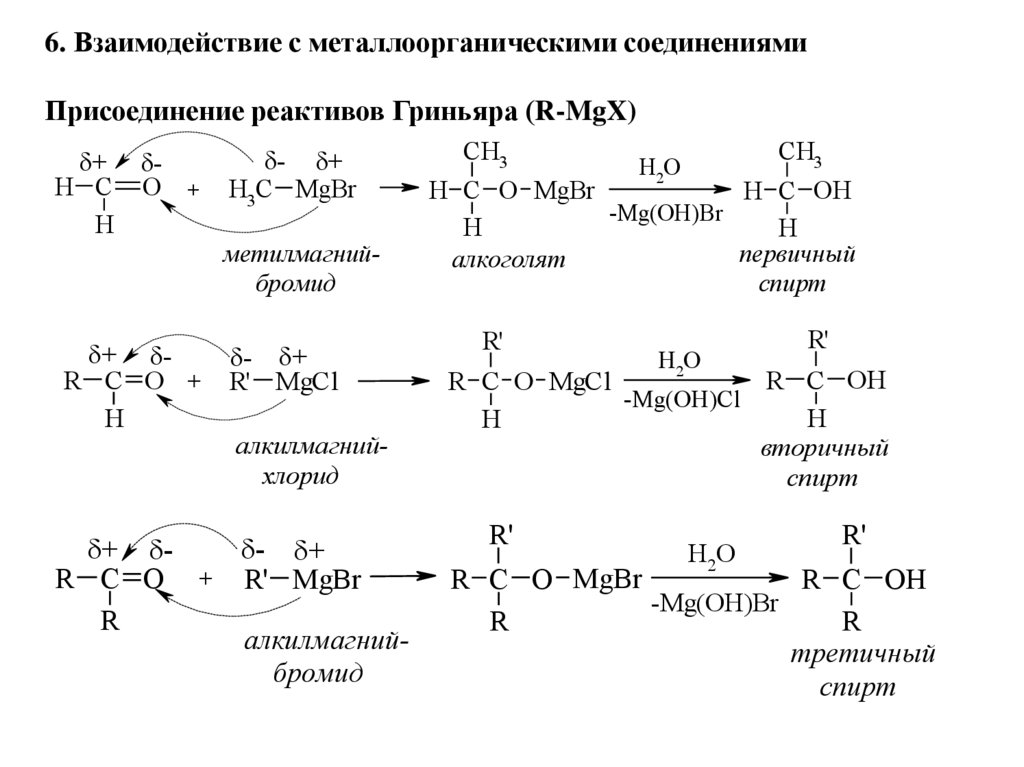
6. Взаимодействие с металлоорганическими соединениямиПрисоединение реактивов Гриньяра (R-MgX)
+
H C
H
O +
- +
H3C MgBr
метилмагнийбромид
+ R C O +
H
- +
R' MgCl
алкилмагнийхлорид
+ - +
R C O + R' MgBr
R
алкилмагнийбромид
CH3
CH3
H2O
H C O MgBr
H C OH
-Mg(OH)Br
H
H
первичный
алкоголя т
спирт
R'
H2O
R'
R C OH
R C O MgCl
-Mg(OH)Cl
H
H
вторичный
спирт
R'
H2O
R'
R C O MgBr
R C OH
-Mg(OH)Br
R
R
третичный
спирт
31.
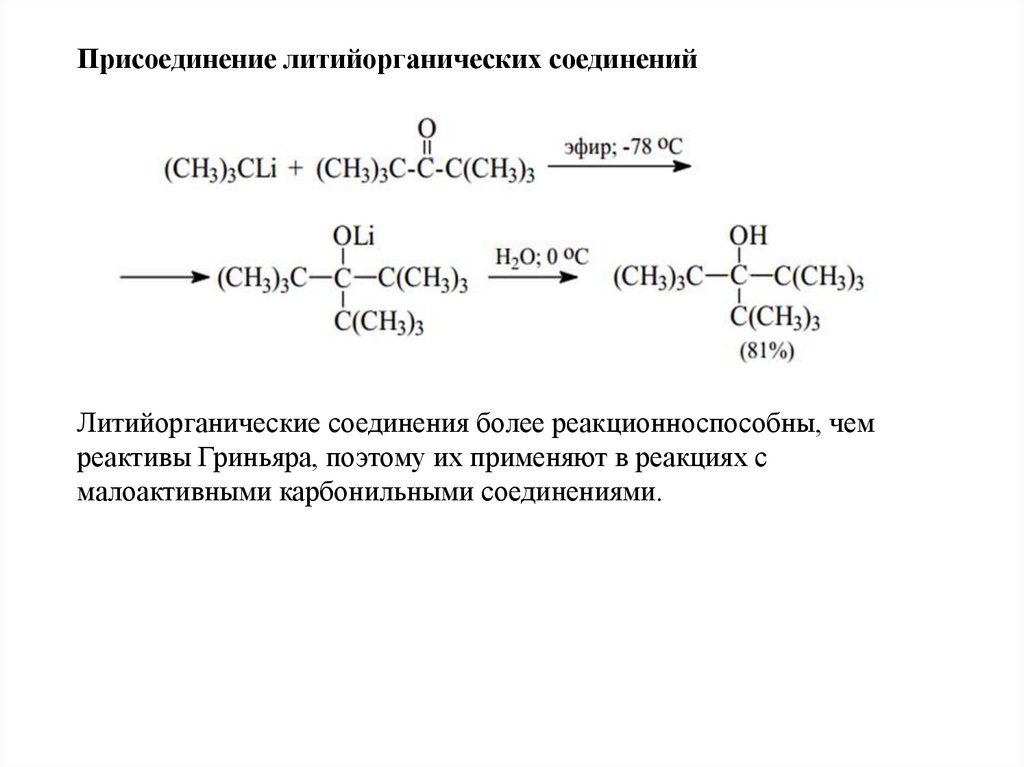
Присоединение литийорганических соединенийЛитийорганические соединения более реакционноспособны, чем
реактивы Гриньяра, поэтому их применяют в реакциях с
малоактивными карбонильными соединениями.
32.
7. Реакции с N-нуклеофиламиРеакции присоединения – отщепления
К N-нуклеофилам относят аммиак и его производные:
R-NH2
где R = H, Alk, Ar, OH, NH2, NHC6H5, NHCONH2, NHCSNH2
Стадия 1 – медленное присоединение N-нуклеофила по карбонильной связи:
C
..
: O: H
..
O + H2N R
C
N R
H
Стадия 2 – быстрый перенос протона с атома азота на атом кислорода:
..
: O: H
..
: OH
C
C
N R
..
N R
H
H
Стадия 3 – отщепление воды (1,2-отщепление):
..
: OH
C
..
N R
C
H
имин или основание Шиффа
N R + H2O
33.
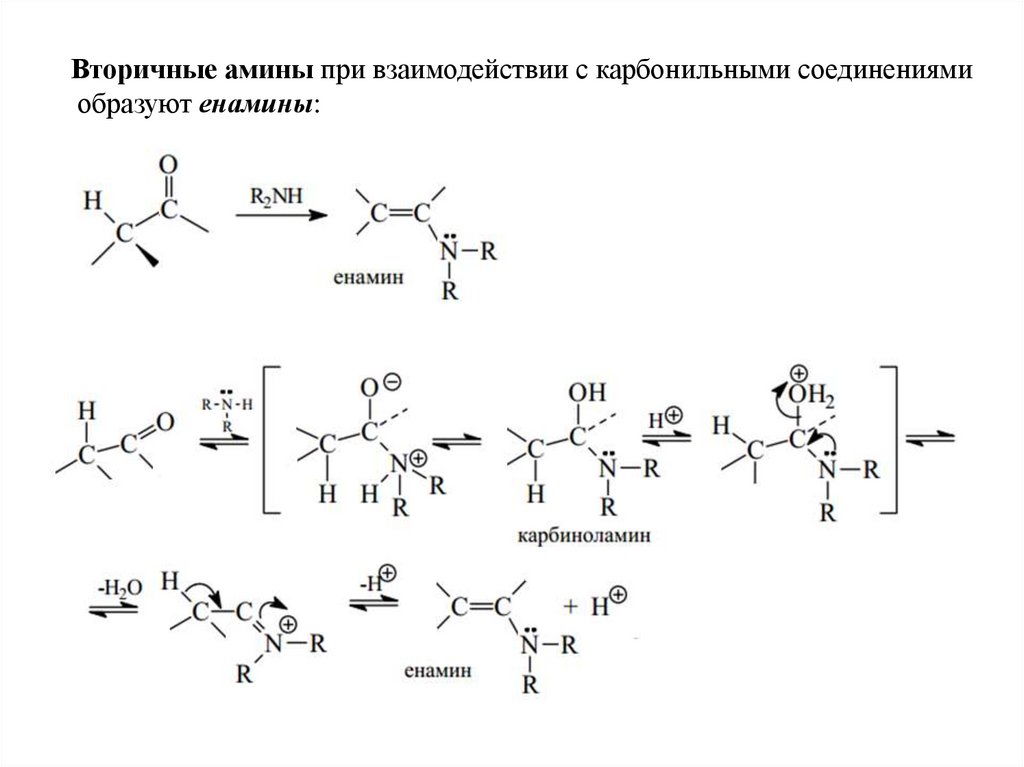
Вторичные амины при взаимодействии с карбонильными соединениямиобразуют енамины:
34.
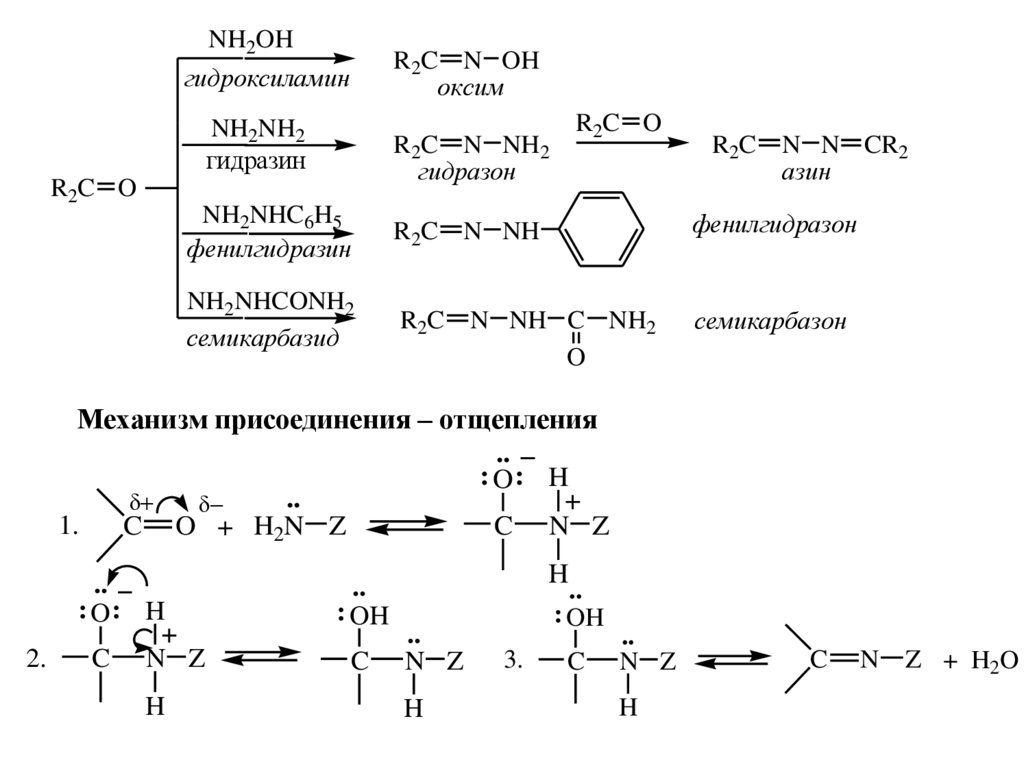
NH2OHR2C N OH
оксим
гидроксиламин
NH2NH2
гидразин
R2C O
R2C O
R2C N NH2
гидразон
NH2NHC6H5
фенилгидразин
NH2NHCONH2
семикарбазид
R2C N N CR2
азин
R2C N NH
фенилгидразон
R2C N NH C NH2
O
семикарбазон
Механизм присоединения – отщепления
..
: O: H
..
1.
C N Z
C O + H2N Z
2.
..
: O: H
..
: OH
C
C
N Z
H
H
..
N Z
H
..
: OH
3.
C
..
N Z
H
C
N
Z + H2O
35.
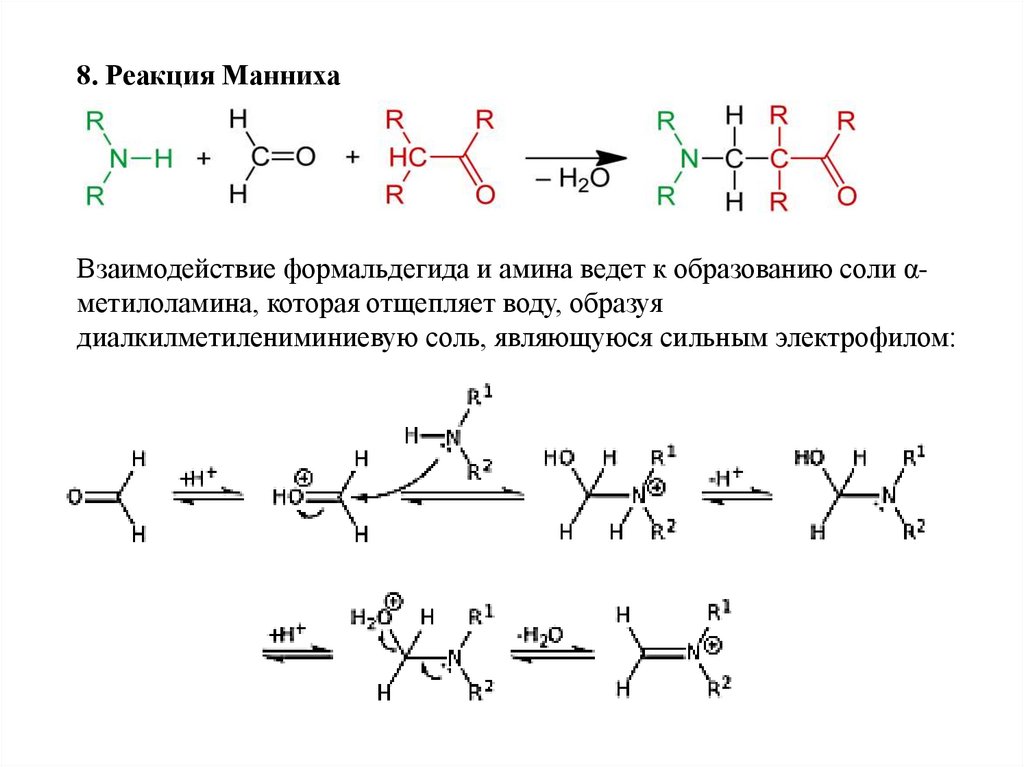
8. Реакция МаннихаВзаимодействие формальдегида и амина ведет к образованию соли αметилоламина, которая отщепляет воду, образуя
диалкилметилениминиевую соль, являющуюся сильным электрофилом:
36.
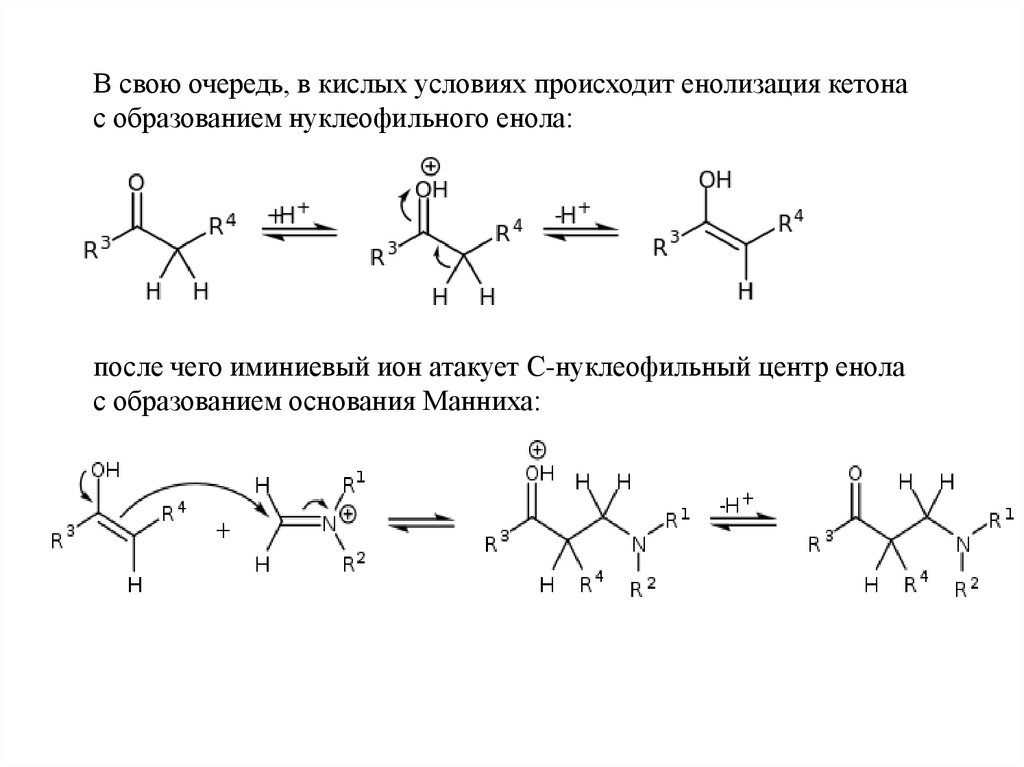
В свою очередь, в кислых условиях происходит енолизация кетонас образованием нуклеофильного енола:
после чего иминиевый ион атакует C-нуклеофильный центр енола
с образованием основания Манниха:
37.
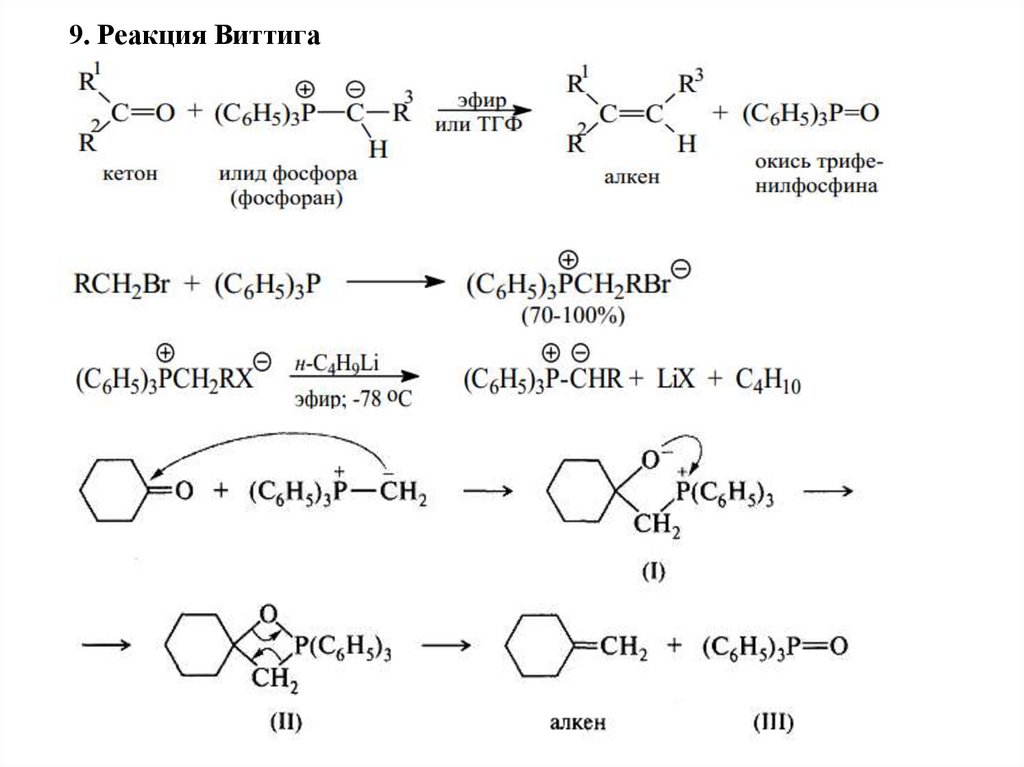
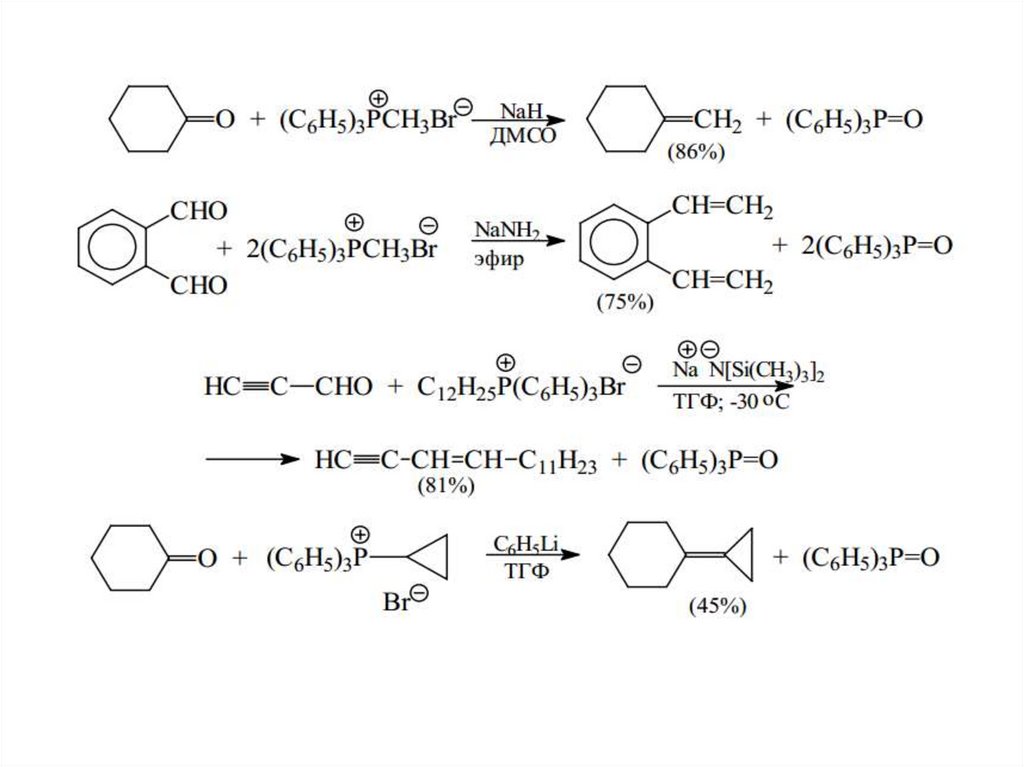
9. Реакция Виттига38.
39.
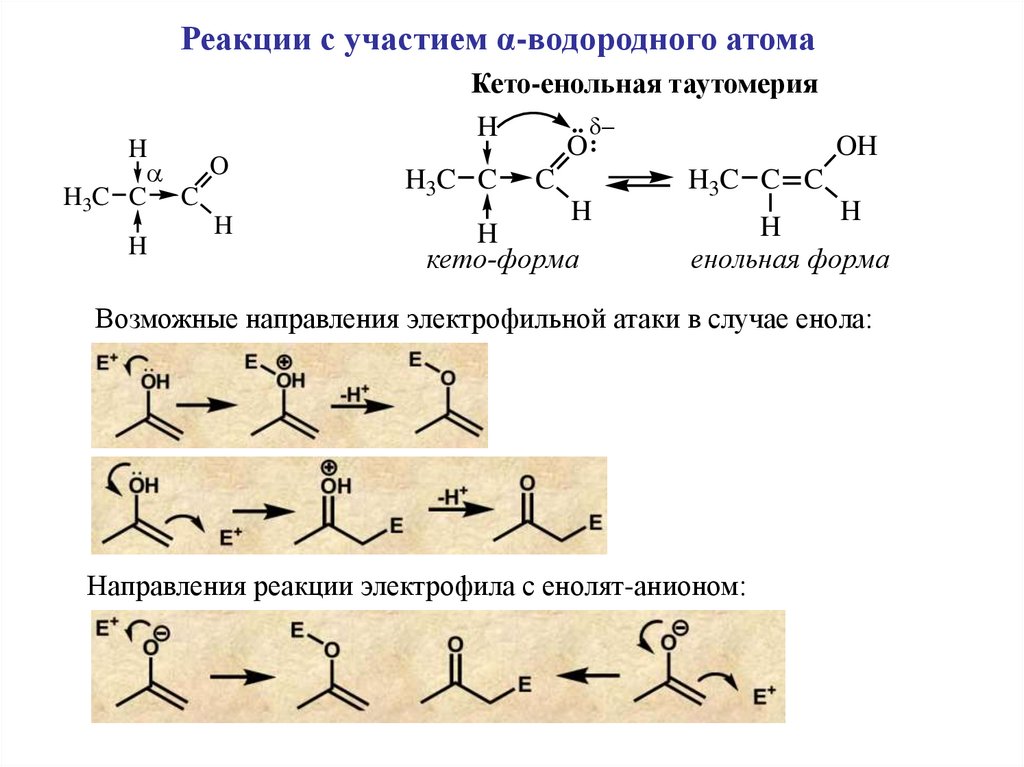
Реакции с участием α-водородного атомаКето-енольная таутомерия
H
O
H3C C C
H
H
..
O:
H
H3C C
C
OH
H3C C C
H
H
кето-форма
H
H
енольная форма
Возможные направления электрофильной атаки в случае енола:
Направления реакции электрофила с енолят-анионом:
40.
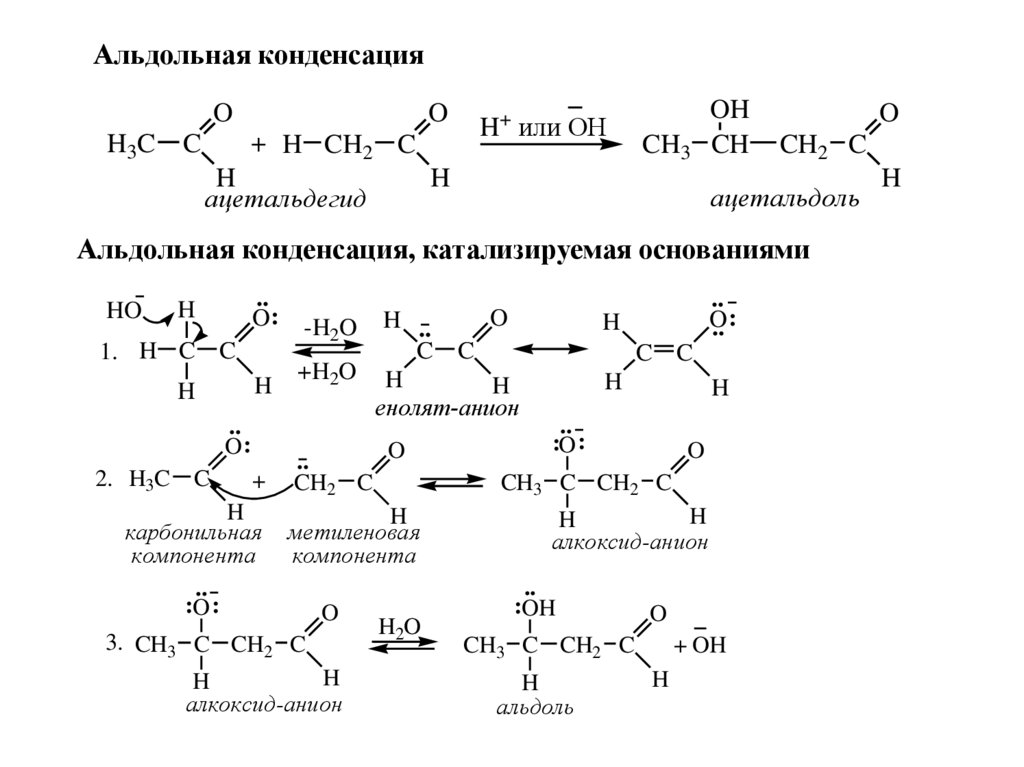
Альдольная конденсацияO
H3 C
O
+ H CH2 C
C
H
ацетальдегид
H+ или OH
CH3
H
OH
CH
O
CH2 C
ацетальдоль
Альдольная конденсация, катализируемая основаниями
HO
..
O:
H
1. H C C
H
H
..
O:
O
-H2O H ..
C C
+H2O H
H
енолят-анион
O
..
2. H3C C
+ CH2 C
H
H
карбонильная метиленовая
компонента
компонента
..
:O :
O
H2O
3. CH3 C CH2 C
H
H
алкоксид-анион
..
O
.. :
H
C C
H
H
..
:O :
O
CH3 C CH2 C
H
H
алкоксид-анион
..
:OH
O
CH3 C CH2 C
H
альдоль
+ OH
H
H
41.
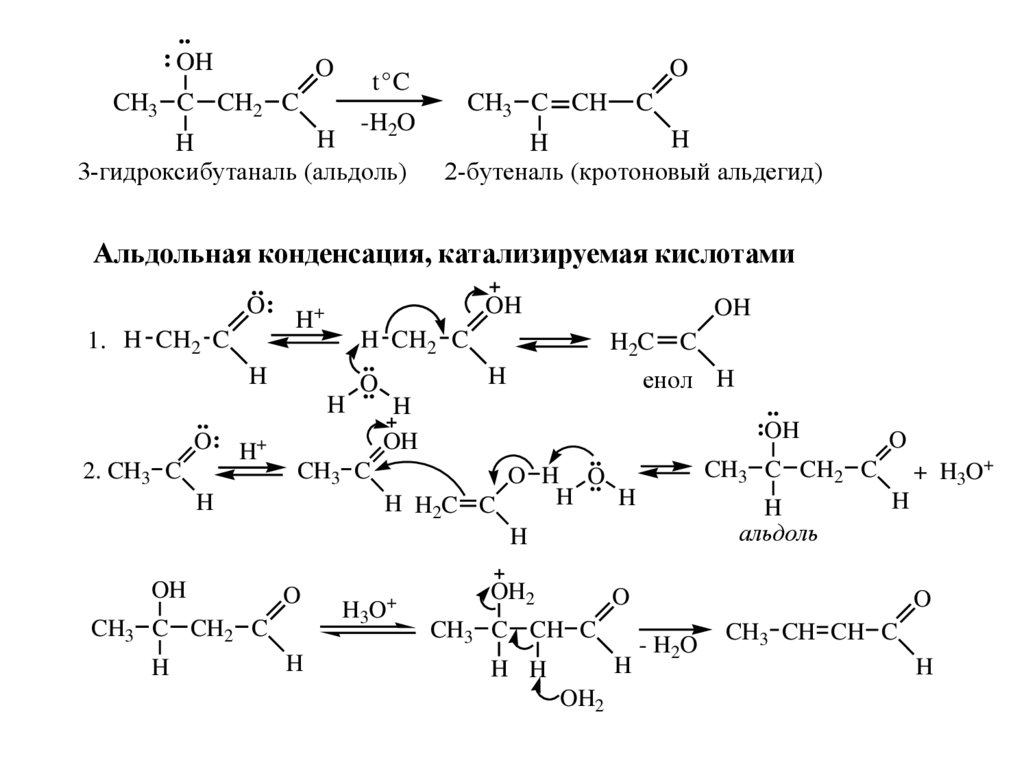
..: OH
O
CH3 C CH2 C
t°C
-H2O
H
H
3-гидроксибутаналь (альдоль)
O
CH3 C CH
C
H
H
2-бутеналь (кротоновый альдегид)
Альдольная конденсация, катализируемая кислотами
..
O:
1. H CH2 C
H
2. CH3 C
..
O : H+
H
OH
OH
H CH2 C
H 2C C
..
H
енол H
O
..
H
H
..
:OH
O
OH
..
+
CH3 C CH2 C
CH3 C
+
H
O
O H O
3
..
H
H
H
H H2C C
H
альдоль
H
O
CH3 C CH2 C
H
OH
H+
H
H3O+
OH2
O
CH3 C CH C
H
H H
OH2
O
- H2O
CH3 CH CH C
H
42.
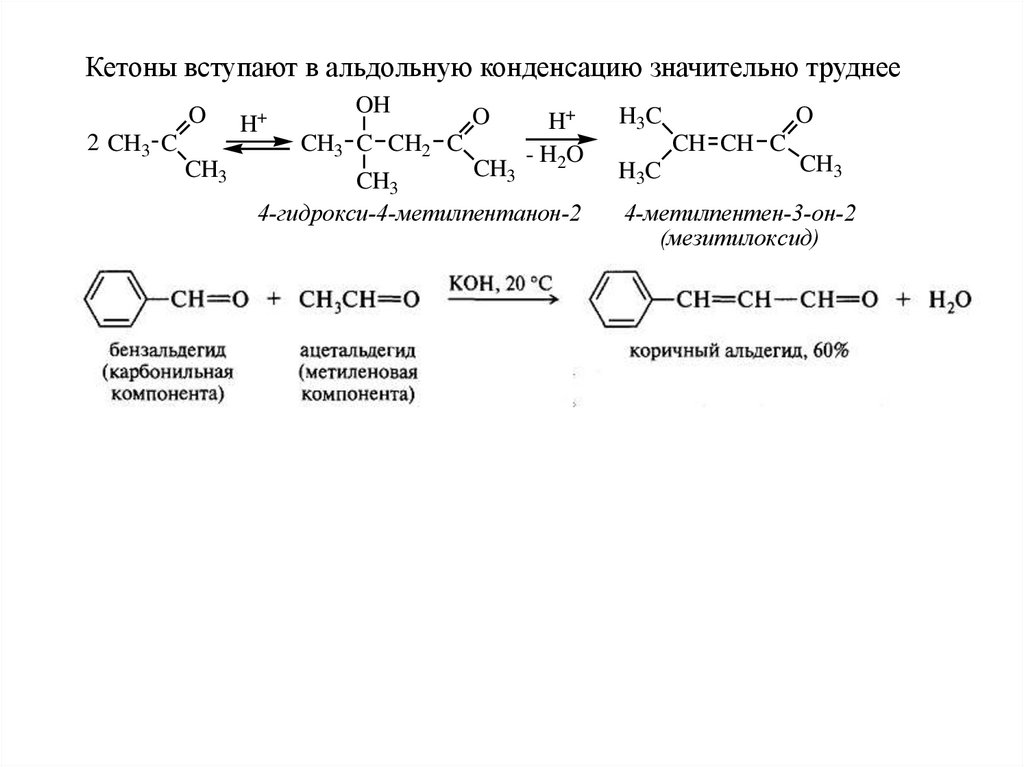
Кетоны вступают в альдольную конденсацию значительно труднееO
2 CH3 C
CH3
H+
OH
CH3 C CH2 C
O
H+
- H2O
CH3
CH3
4-гидрокси-4-метилпентанон-2
O
H3C
CH CH C
H3C
CH3
4-метилпентен-3-он-2
(мезитилоксид)
43.
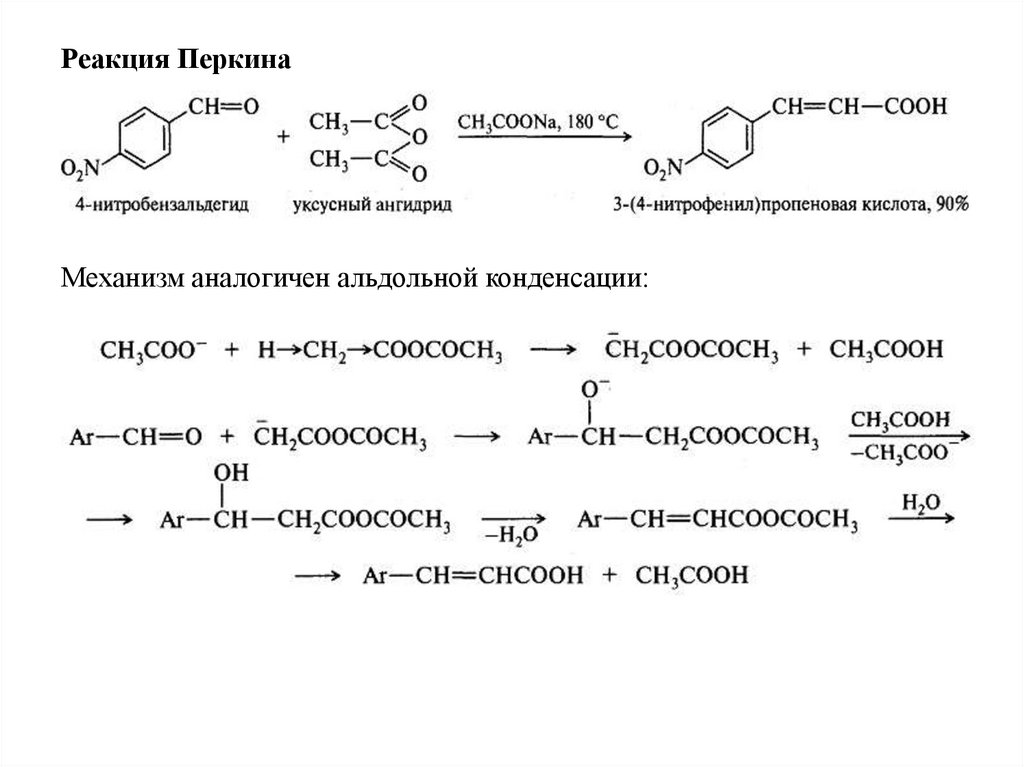
Реакция ПеркинаМеханизм аналогичен альдольной конденсации:
44.
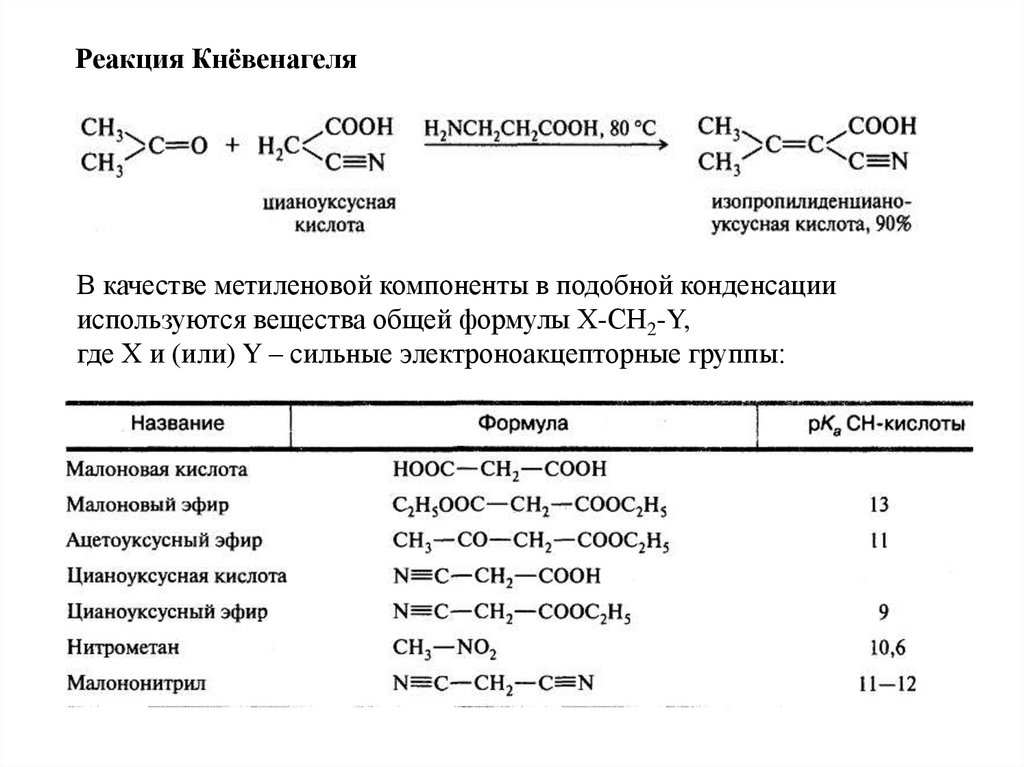
Реакция КнёвенагеляВ качестве метиленовой компоненты в подобной конденсации
используются вещества общей формулы Х-СН2-Y,
где Х и (или) Y – сильные электроноакцепторные группы:
45.
Реакции с другими электрофилами:46.
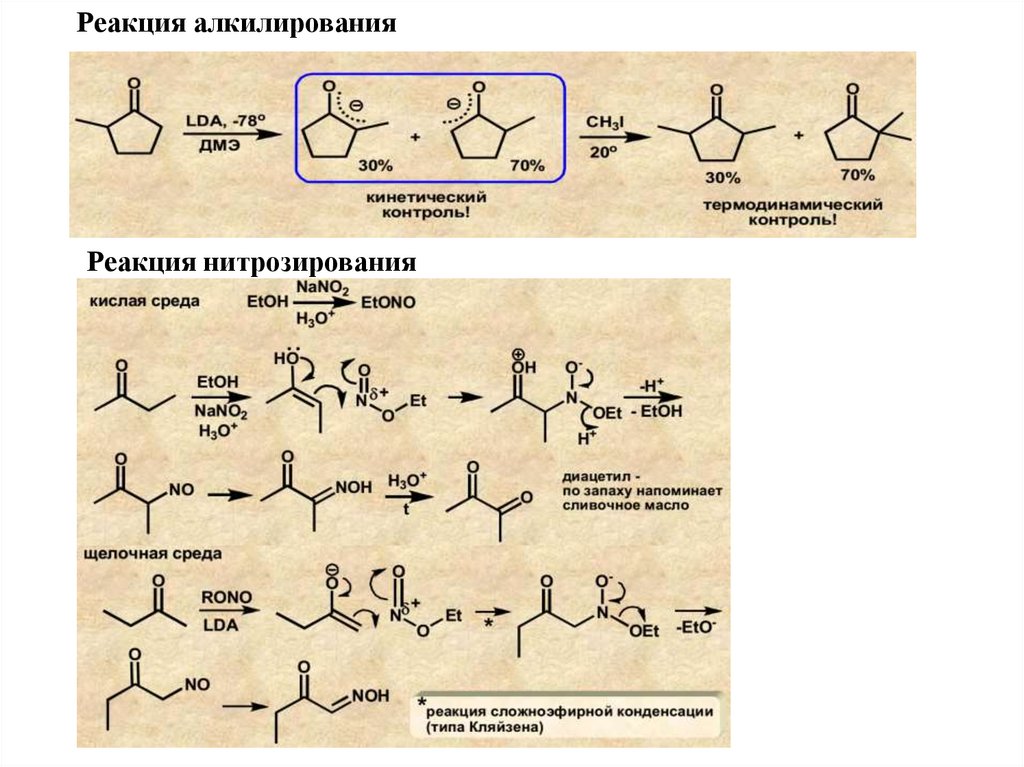
Реакция алкилированияРеакция нитрозирования
47.
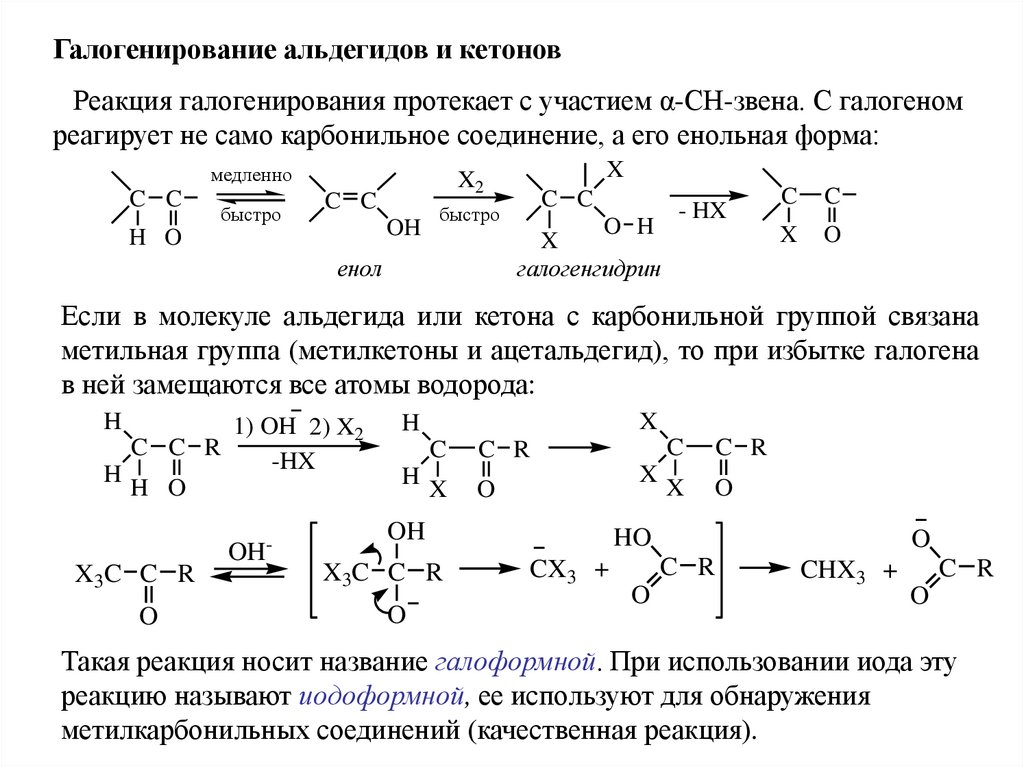
Галогенирование альдегидов и кетоновРеакция галогенирования протекает с участием α-СН-звена. С галогеном
реагирует не само карбонильное соединение, а его енольная форма:
медленно
C C
быстро
C C
OH
H O
X
X2
быстро
енол
C C
O H
X
галогенгидрин
- HX
C
C
X
O
Если в молекуле альдегида или кетона с карбонильной группой связана
метильная группа (метилкетоны и ацетальдегид), то при избытке галогена
в ней замещаются все атомы водорода:
H
1) OH 2) X2
C C R
-HX
H
H O
X3 C C R
O
OH
-
X
H
H
C
C R
X
O
X
OH
X3C C R
O
C
C R
X
O
HO
CX3 +
O
C R
O
CHX3 +
C R
O
Такая реакция носит название галоформной. При использовании иода эту
реакцию называют иодоформной, ее используют для обнаружения
метилкарбонильных соединений (качественная реакция).
48.
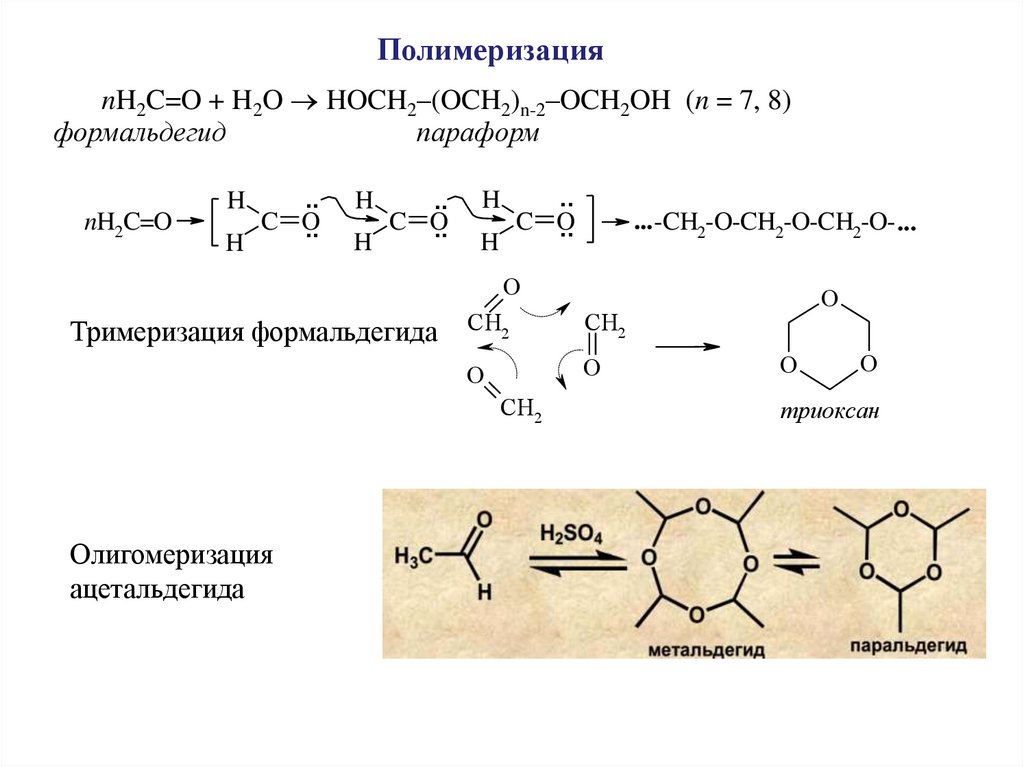
ПолимеризацияnH2C=O + H2O HOCH2–(OCH2)n-2–OCH2OH (n = 7, 8)
формальдегид
параформ
nH2C=O
H
H
..
C O
..
H
H
..
C O
..
..
C O
..
H
H
... -CH2-O-CH2-O-CH2-O- ...
O
Тримеризация формальдегида
CH2
CH2
O
O
CH2
Олигомеризация
ацетальдегида
O
O
O
триоксан
49.
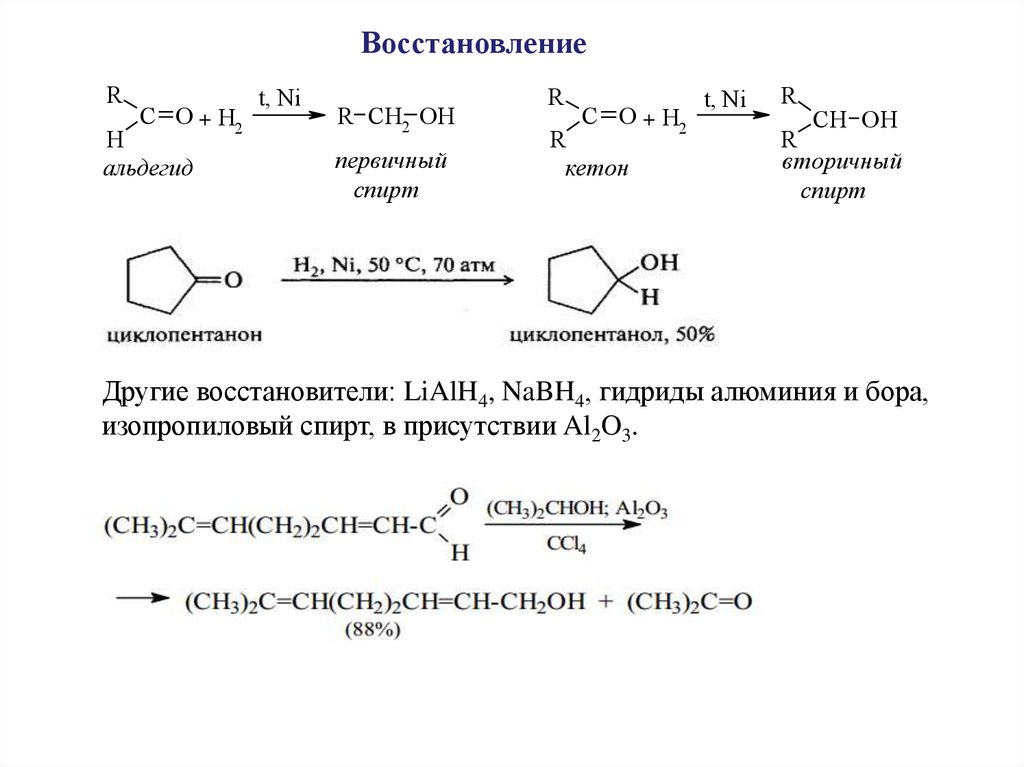
ВосстановлениеR
C O + H2
H
альдегид
t, Ni
R CH2 OH
первичный
спирт
R
C O + H2
R
кетон
t, Ni
R
CH OH
R
вторичный
спирт
Другие восстановители: LiAlH4, NaBH4, гидриды алюминия и бора,
изопропиловый спирт, в присутствии Al2O3.
50.
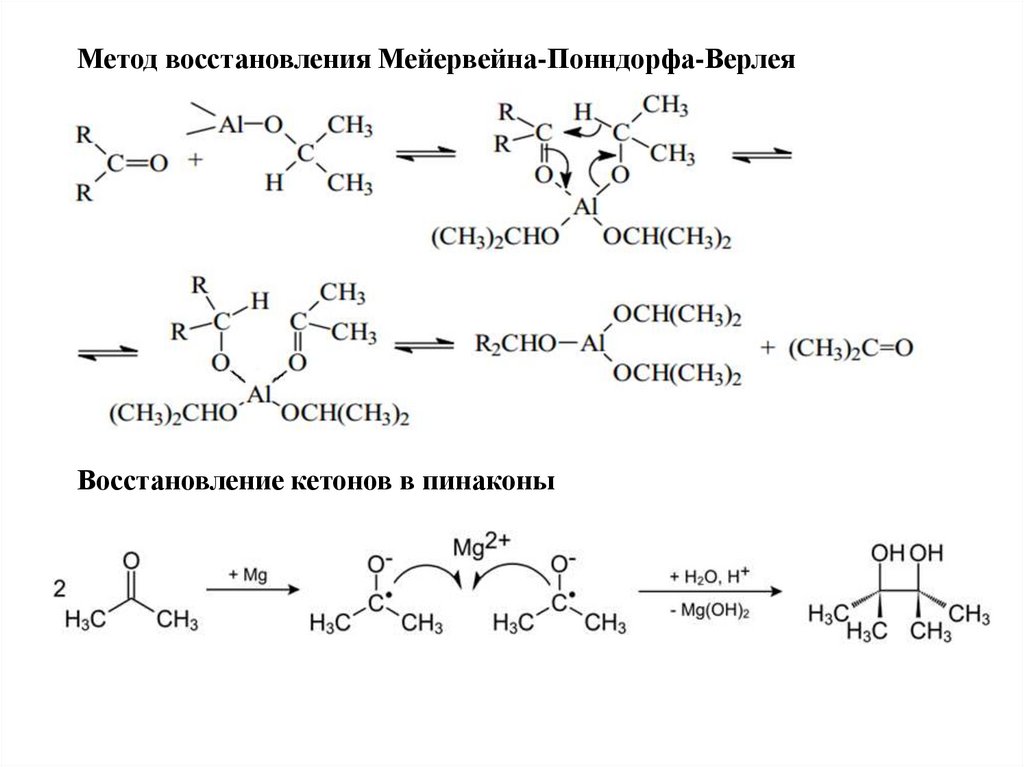
Метод восстановления Мейервейна-Понндорфа-ВерлеяВосстановление кетонов в пинаконы
51.
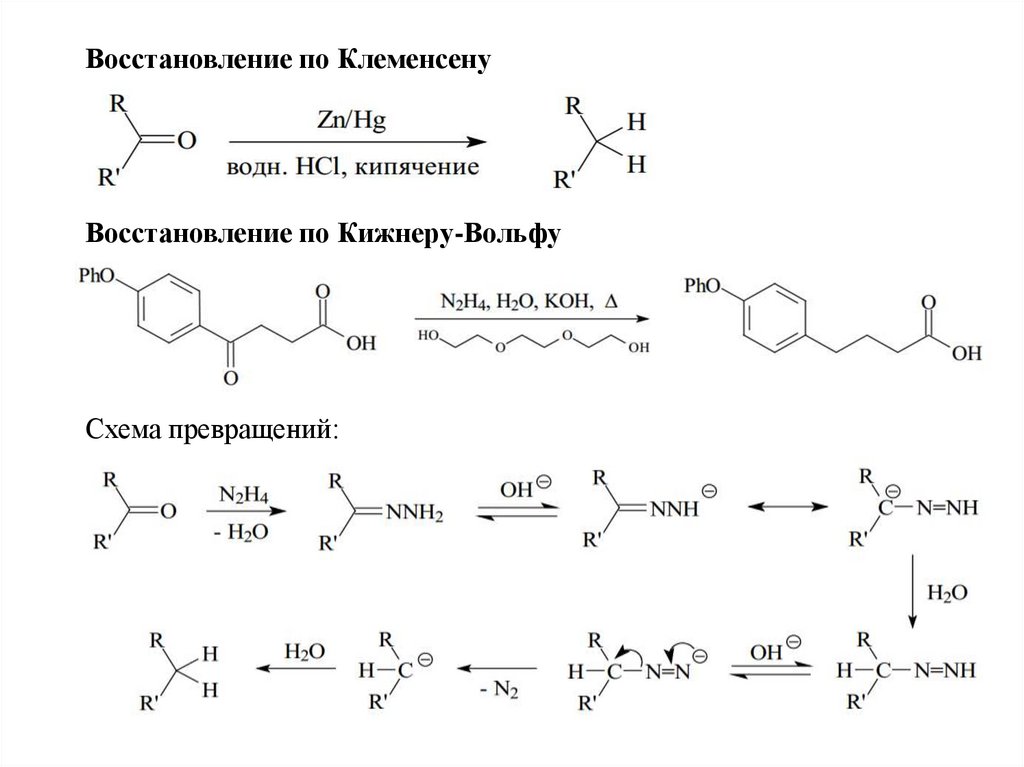
Восстановление по КлеменсенуВосстановление по Кижнеру-Вольфу
Схема превращений:
52.
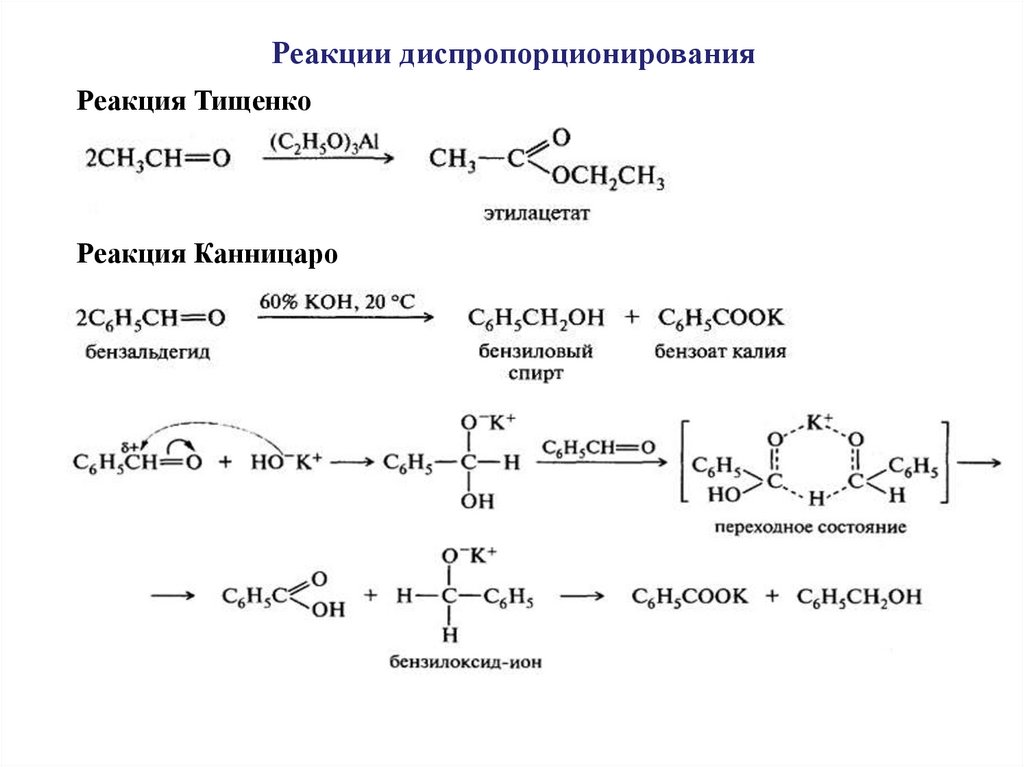
Реакции диспропорционированияРеакция Тищенко
Реакция Канницаро
53.
Окисление альдегидовРеакция "серебряного зеркала" окисление аммиачным раствором
оксида серебра (реакция Толленса):
R–CH=O + 2[Ag(NH3)2]OH RCOOH + 2Ag + 4NH3 + H2O
Окисление гидроксидом меди (II) в присутствии винной кислоты
(реактив Феллинга):
R–CH=O + 2Cu(OH)2 RCOOH + Cu2O + 2H2O
Эти реакции являются качественными на альдегидную группу.
Кроме альдегидов, в указанных условиях окисляется и муравьиная кислота:
Альдегидная
группа
O
H
C
O
H
НСООН + Ag2O 2Ag + CO2 + H2O
H2SO4
HCOOH
CO + H2O
Карбоксильная
группа
54.
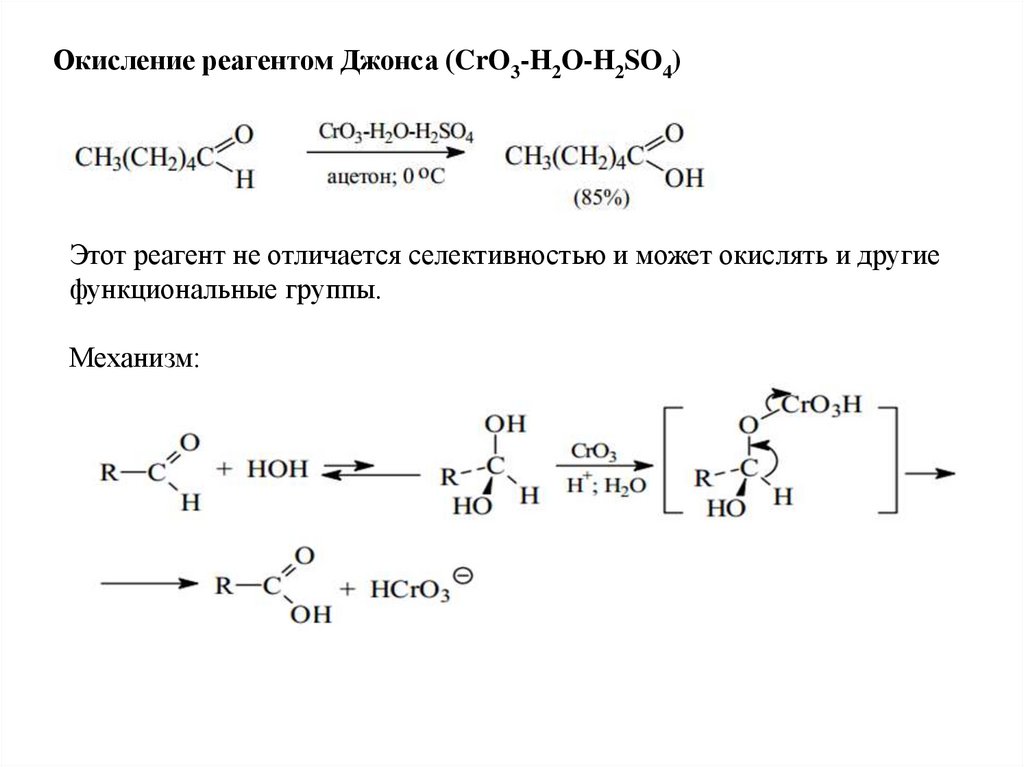
Окисление реагентом Джонса (CrO3-H2O-H2SO4)Этот реагент не отличается селективностью и может окислять и другие
функциональные группы.
Механизм:
55.
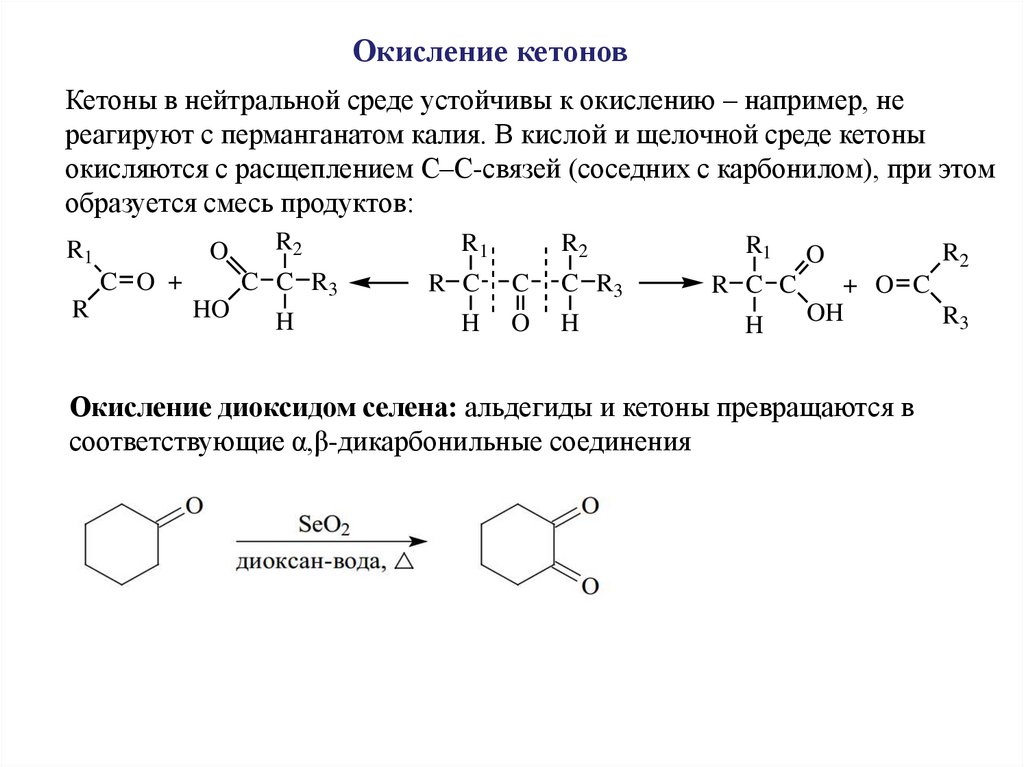
Окисление кетоновКетоны в нейтральной среде устойчивы к окислению – например, не
реагируют с перманганатом калия. В кислой и щелочной среде кетоны
окисляются с расщеплением С–С-связей (соседних с карбонилом), при этом
образуется смесь продуктов:
R1
O
C O +
R
HO
R2
R1
R2
R1
R C C
C C R3
R C
C
C R3
H
H
O
H
H
O
R2
+ O C
OH
R3
Окисление диоксидом селена: альдегиды и кетоны превращаются в
соответствующие α,β-дикарбонильные соединения
56.
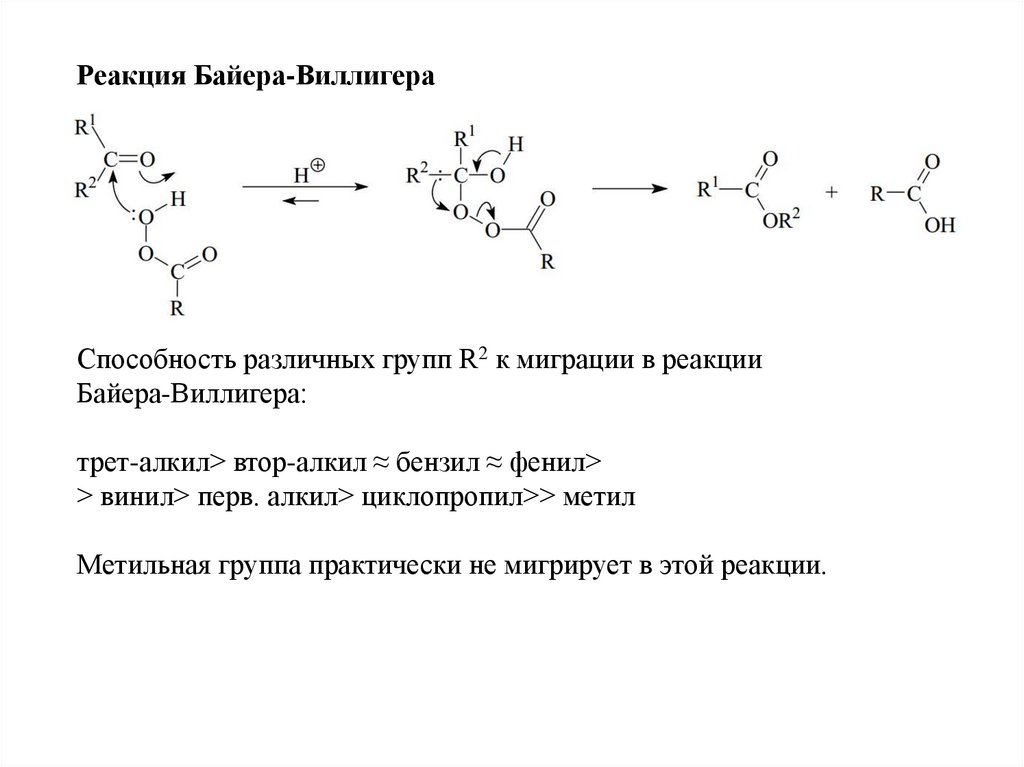
Реакция Байера-ВиллигераСпособность различных групп R2 к миграции в реакции
Байера-Виллигера:
трет-алкил> втор-алкил ≈ бензил ≈ фенил>
> винил> перв. алкил> циклопропил>> метил
Метильная группа практически не мигрирует в этой реакции.
57.
НЕНАСЫЩЕННЫЕ АЛЬДЕГИДЫ И КЕТОНЫС кумулированными кратными связями
кетены CH2=C=O
С сопряженными кратными связями
метилвинилкетон (3-бутен-2-он),
С изолированными кратными связями
CH2=CHCH2CH2CH2COCH3
акролеин (пропеналь)
58.
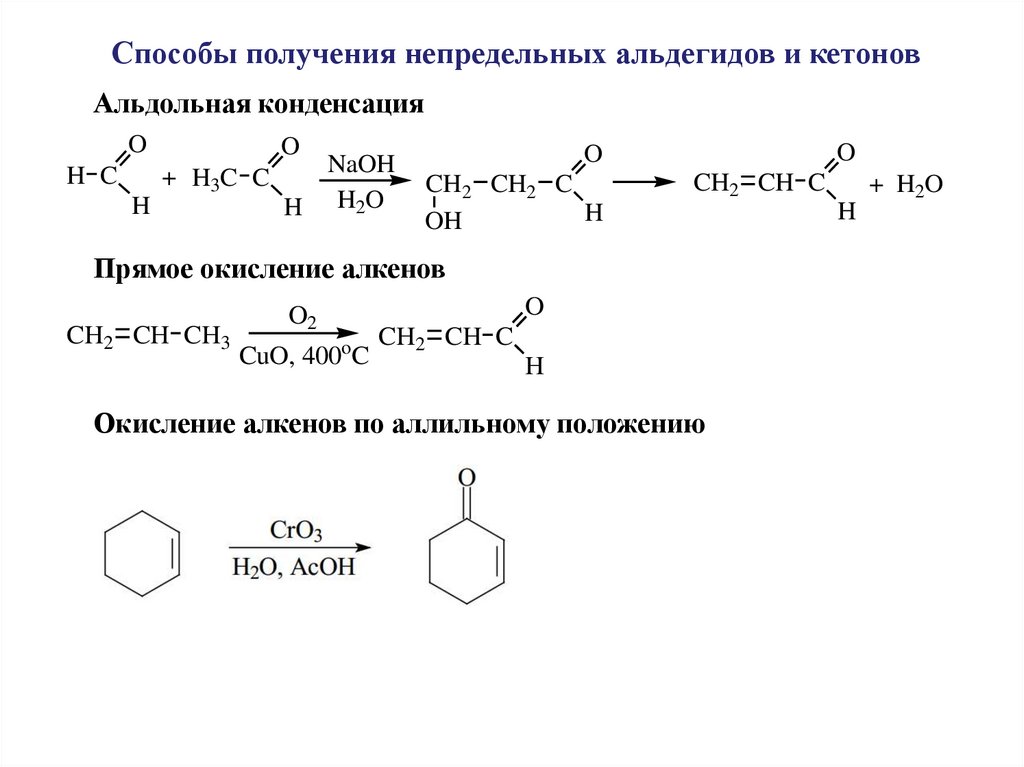
Способы получения непредельных альдегидов и кетоновАльдольная конденсация
O
O
NaOH
H C
+ H3C C
H
H H2O
O
O
CH2 CH2 C
H
OH
CH2 CH C
Прямое окисление алкенов
CH2 CH CH3
O
O2
o
CuO, 400 C
CH2 CH C
H
Окисление алкенов по аллильному положению
+ H2O
H
59.
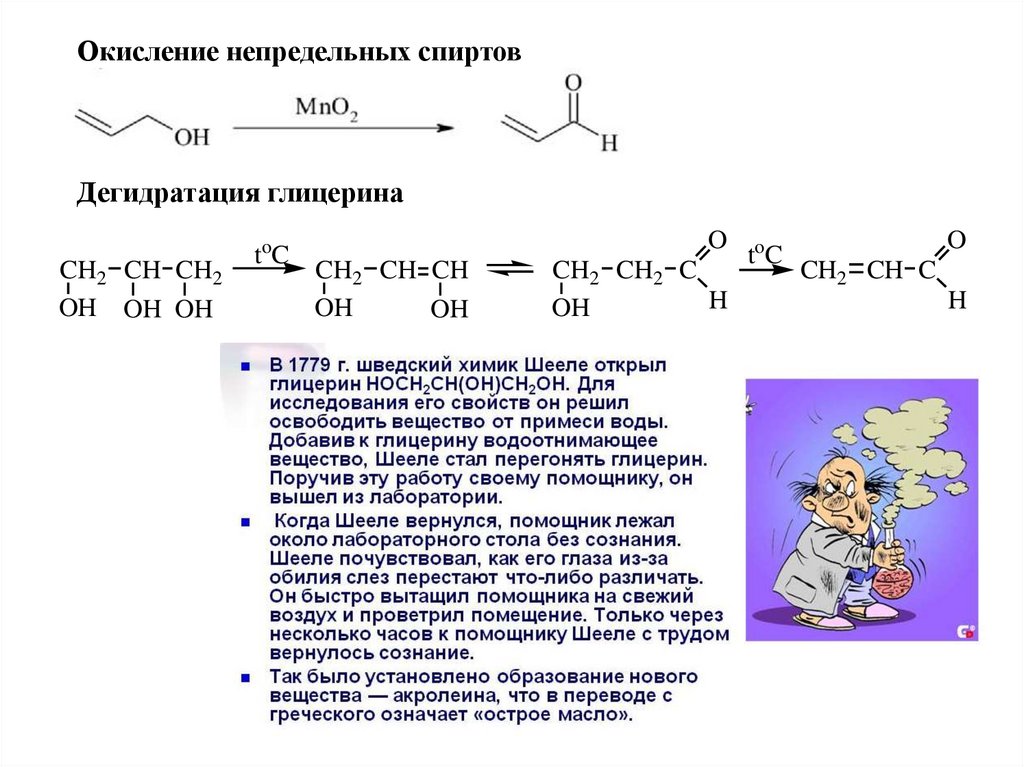
Окисление непредельных спиртовДегидратация глицерина
CH2 CH CH2
OH OH OH
t oC
O
CH2 CH CH
OH
OH
CH2 CH2 C
H
OH
to C
O
CH2 CH C
H
60.
Получение метилвинилкетона :Гидратация винилацетилена
HC C CH CH2 + H2O
H3C C CH CH2
O
Конденсация формальдегида с ацетоном
H
C O + H3C C CH3
H
O
H3C C CH2 CH2
O
OH
H3C C CH CH2
O
61.
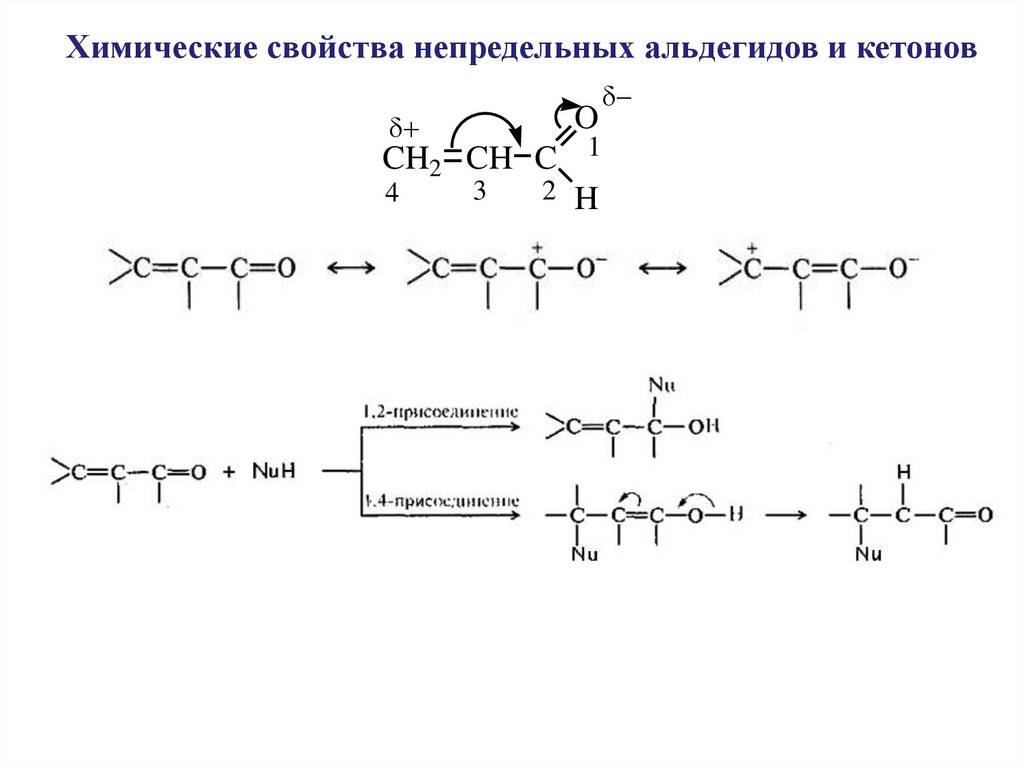
Химические свойства непредельных альдегидов и кетоновO
CH2 CH C 1
3
2 H
4
62.
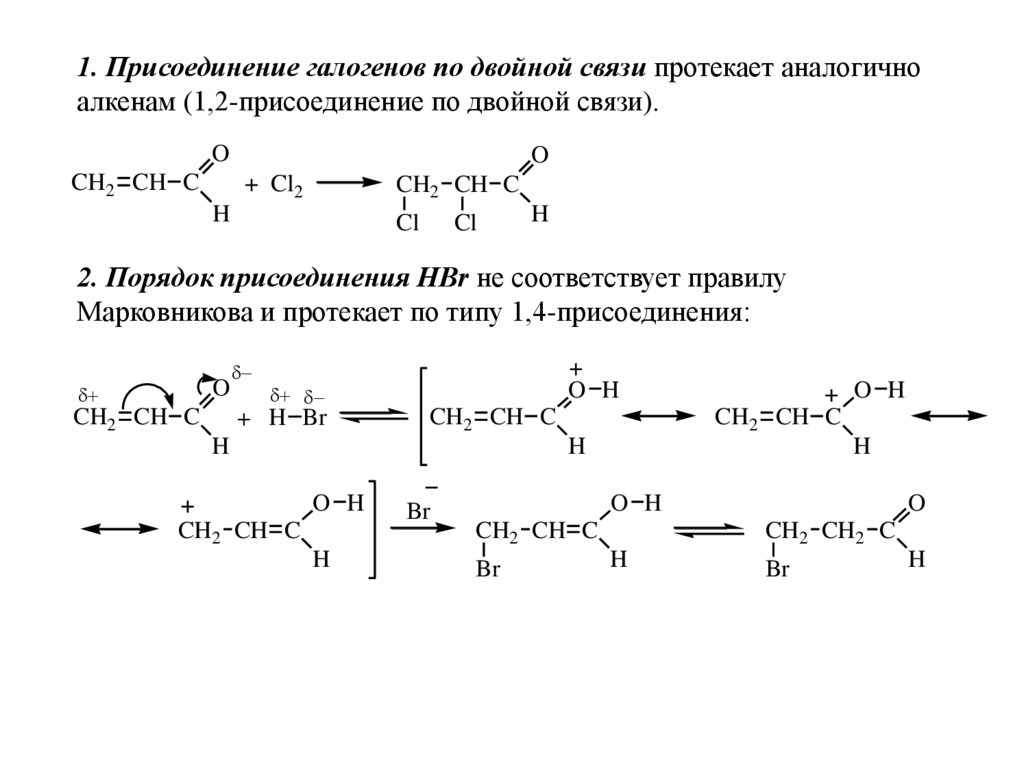
1. Присоединение галогенов по двойной связи протекает аналогичноалкенам (1,2-присоединение по двойной связи).
O
CH2 CH C
O
+ Cl2
CH2 CH C
H
Cl
Cl
H
2. Порядок присоединения HBr не соответствует правилу
Марковникова и протекает по типу 1,4-присоединения:
O
CH2 CH C
O H
+ H Br
CH2 CH C
H
O H
CH2 CH C
H
O H
CH2 CH C
H
Br
H
O H
CH2 CH C
Br
O
CH2 CH2 C
H
Br
H
63.
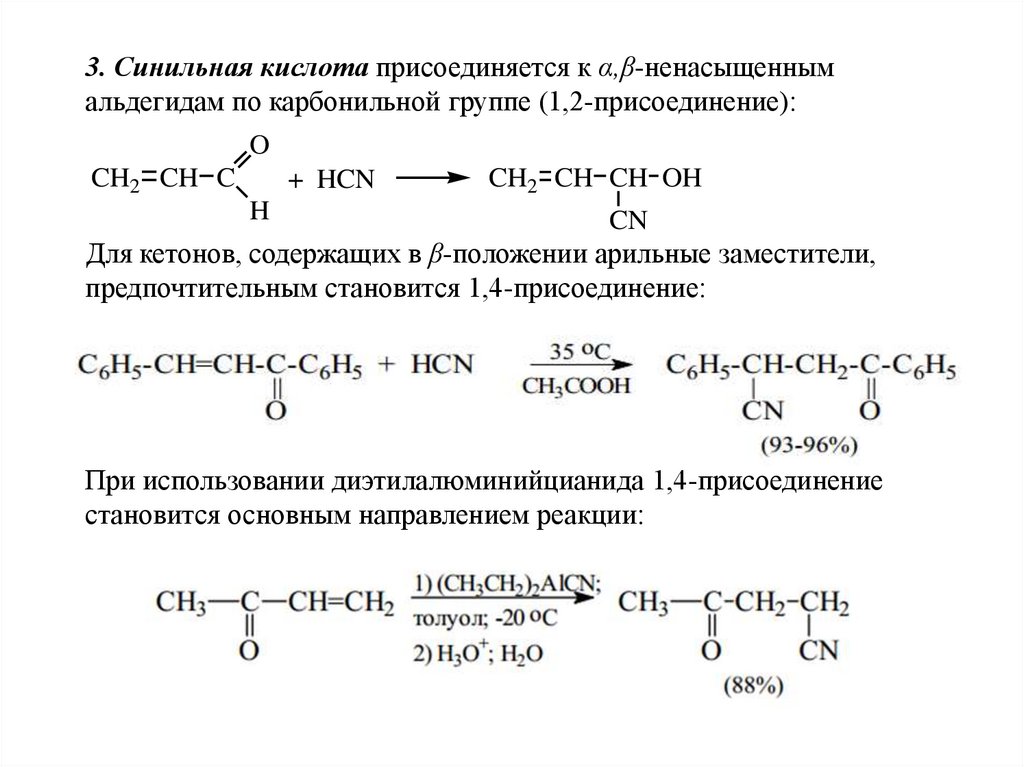
3. Синильная кислота присоединяется к α,β-ненасыщеннымальдегидам по карбонильной группе (1,2-присоединение):
O
CH2 CH C
+ HCN
CH2 CH CH OH
H
CN
Для кетонов, содержащих в β-положении арильные заместители,
предпочтительным становится 1,4-присоединение:
При использовании диэтилалюминийцианида 1,4-присоединение
становится основным направлением реакции:
64.
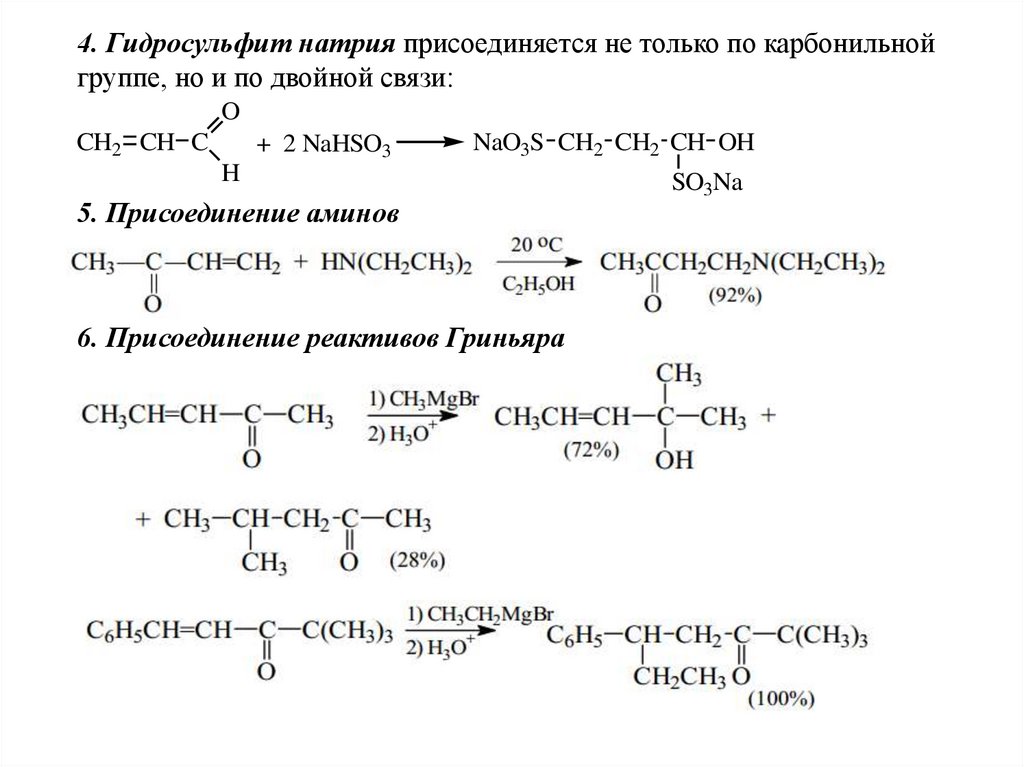
4. Гидросульфит натрия присоединяется не только по карбонильнойгруппе, но и по двойной связи:
O
CH2 CH C
+ 2 NaHSO3
NaO3S CH2 CH2 CH OH
H
5. Присоединение аминов
6. Присоединение реактивов Гриньяра
SO3Na
65.
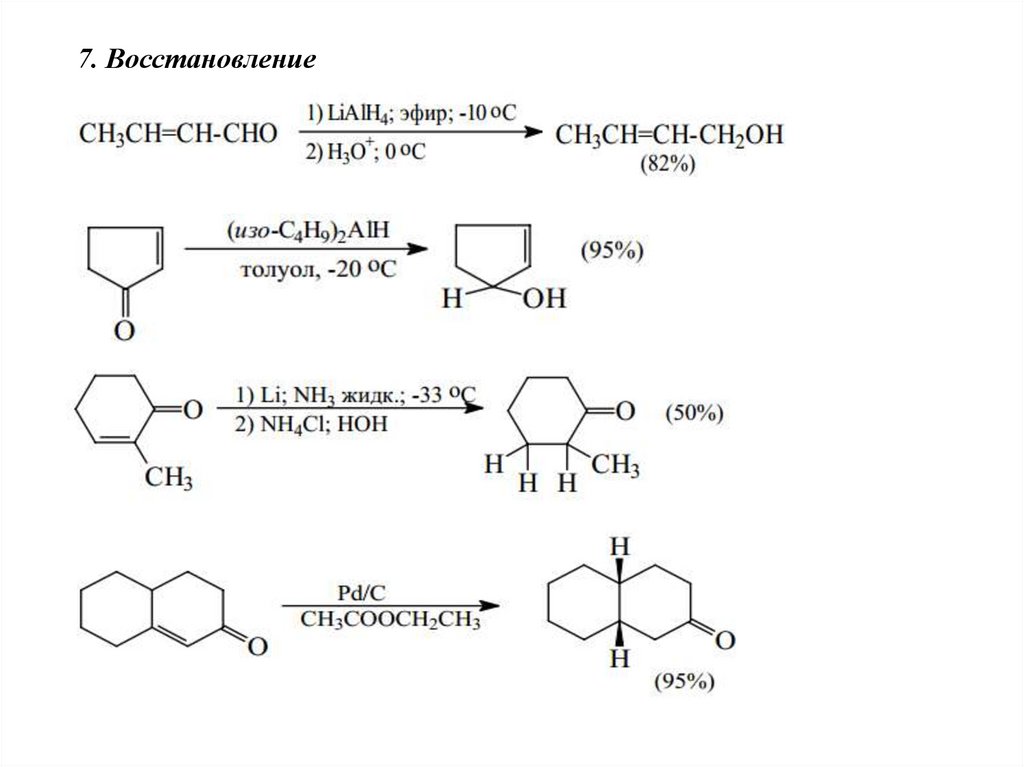
7. Восстановление66.
8. ОкислениеНепредельные альдегиды легко окисляются кислородом воздуха до
соответствующих непредельных кислот. В более жестких условиях
образуется смесь продуктов.
9. СН-активность и эффект винилогии
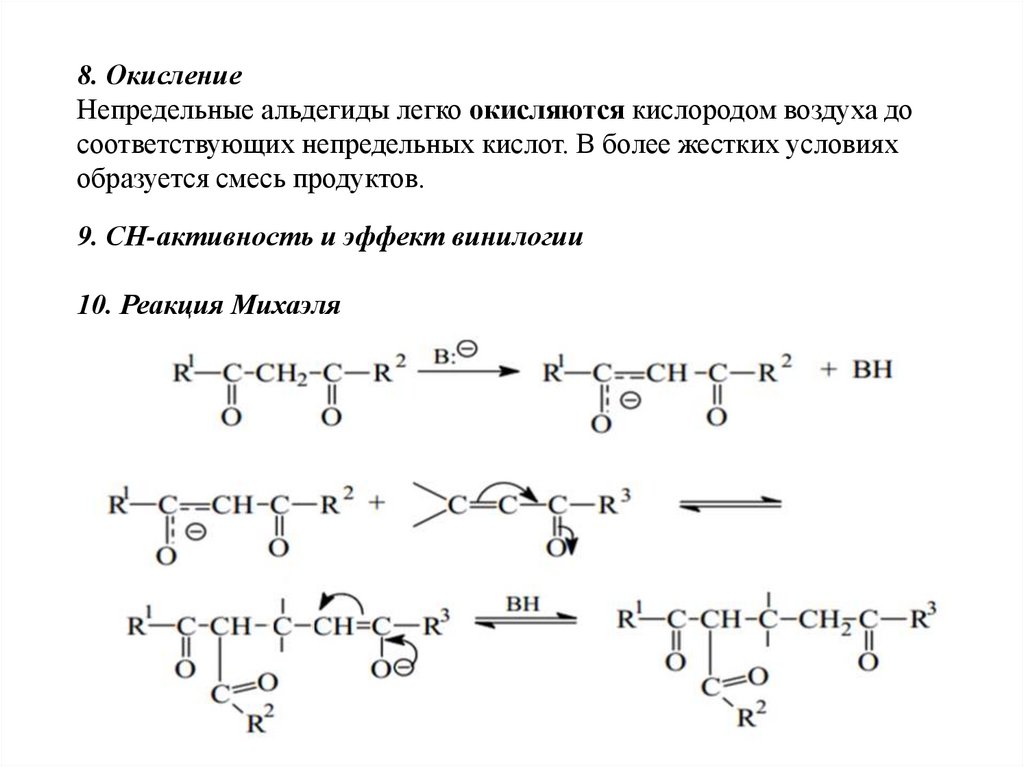
10. Реакция Михаэля
67.
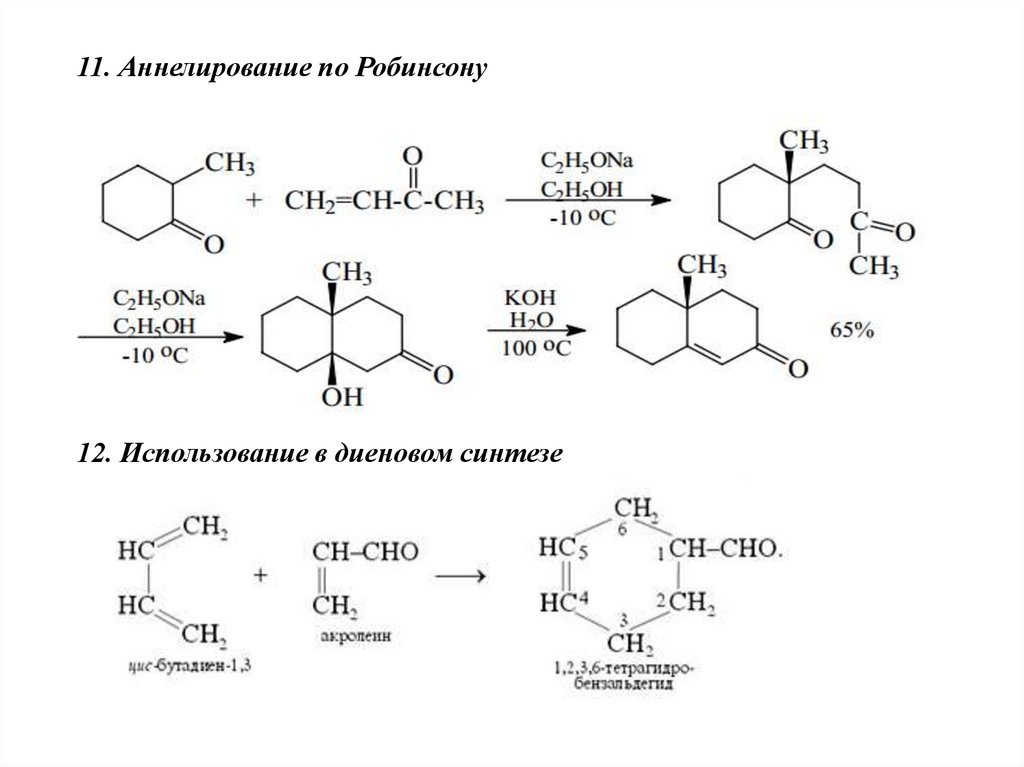
11. Аннелирование по Робинсону12. Использование в диеновом синтезе
68.
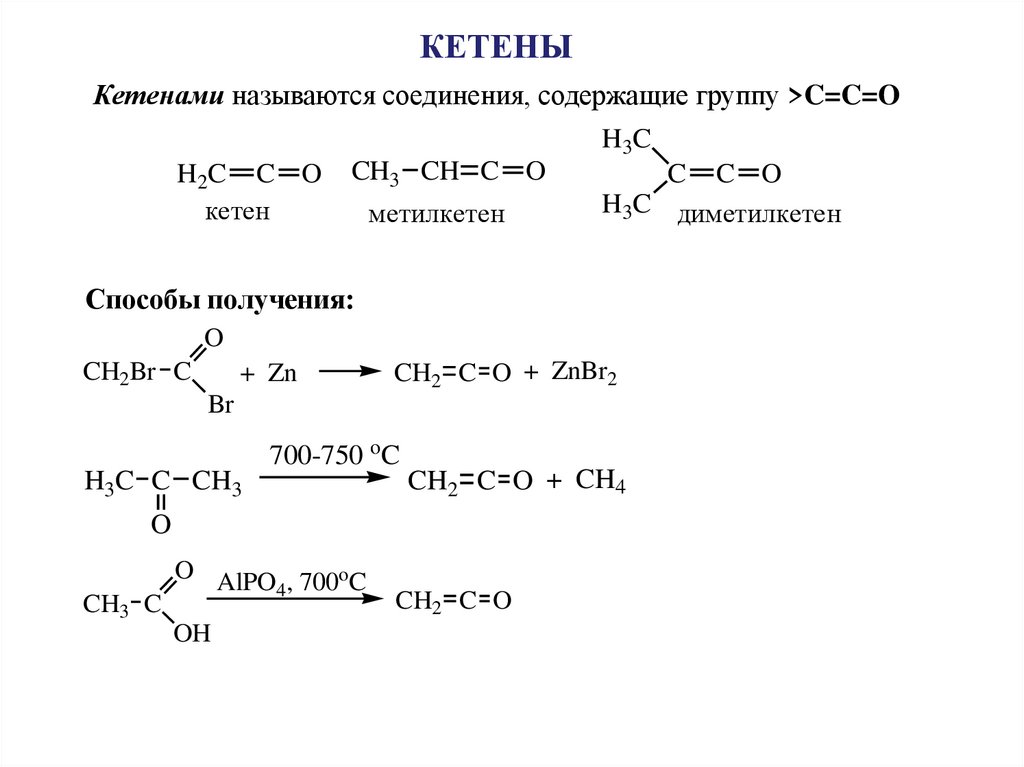
КЕТЕНЫКетенами называются соединения, содержащие группу >C=C=O
H3C
H2C C O
кетен
CH3 CH C O
метилкетен
C C O
H3C диметилкетен
Способы получения:
O
CH2Br C
+ Zn
CH2 C O + ZnBr2
Br
700-750 oC
H3C C CH3
CH2 C O + CH4
O
CH3 C
O AlPO , 700oC
4
OH
CH2 C O
69.
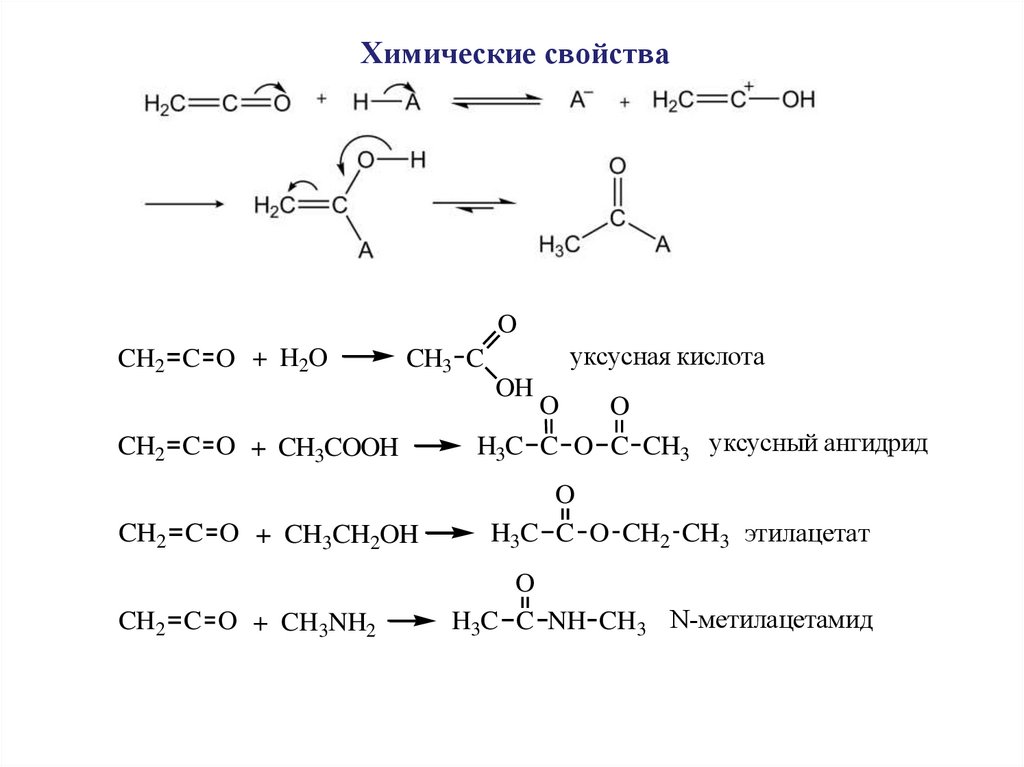
Химические свойстваO
CH2 C O + H2O
уксусная кислота
CH3 C
OH
O
CH2 C O + CH3COOH
O
H3C C O C CH3 уксусный ангидрид
CH2 C O + CH3CH2OH
O
H3C C O CH2 CH3 этилацетат
CH2 C O + CH3NH2
O
H3C C NH CH3 N-метилацетамид
70.
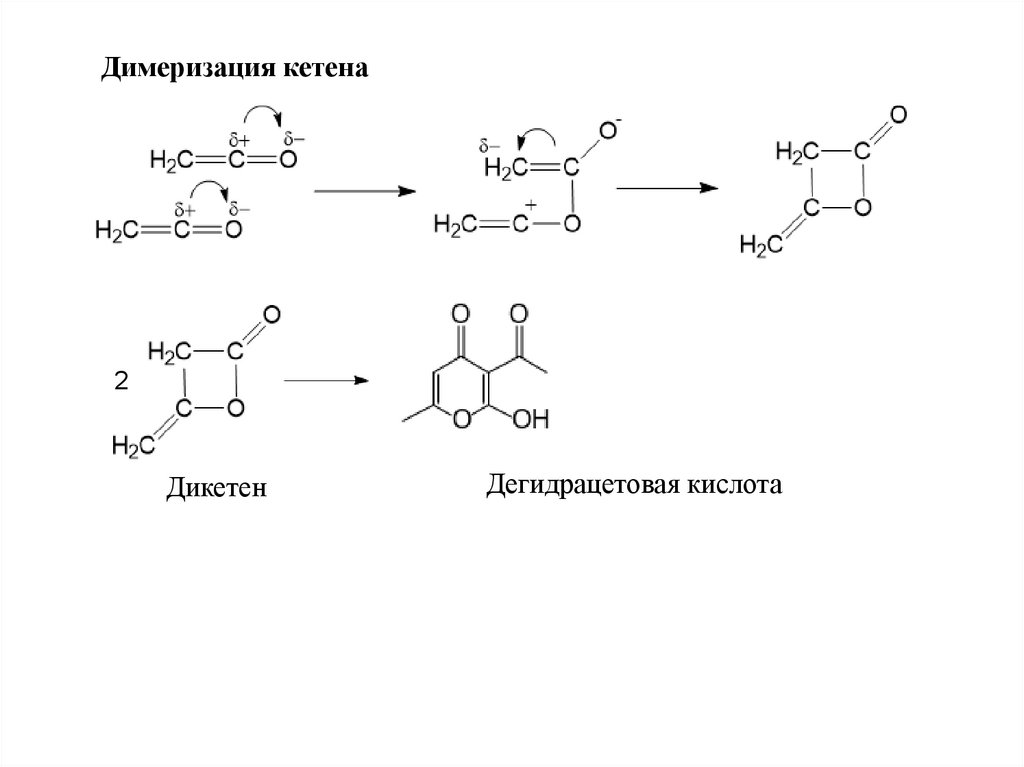
Димеризация кетена2
Дикетен
Дегидрацетовая кислота
71.
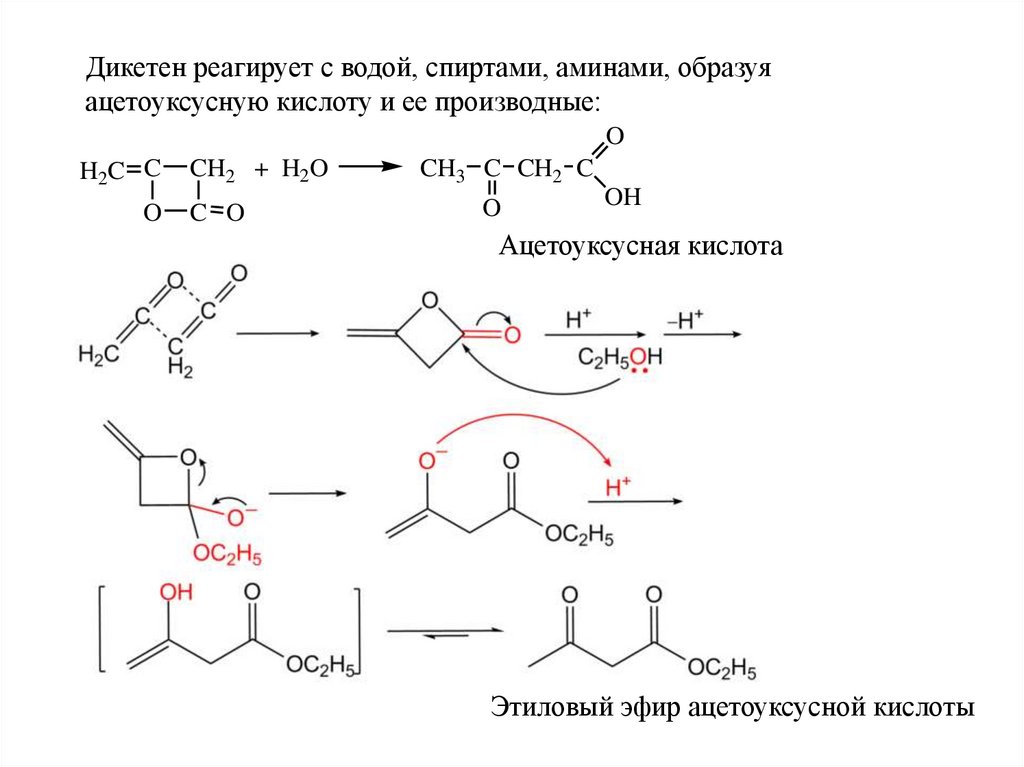
Дикетен реагирует с водой, спиртами, аминами, образуяацетоуксусную кислоту и ее производные:
O
H2C C
O
CH2 + H2O
C O
CH3 C CH2 C
O
OH
Ацетоуксусная кислота
Этиловый эфир ацетоуксусной кислоты
72.
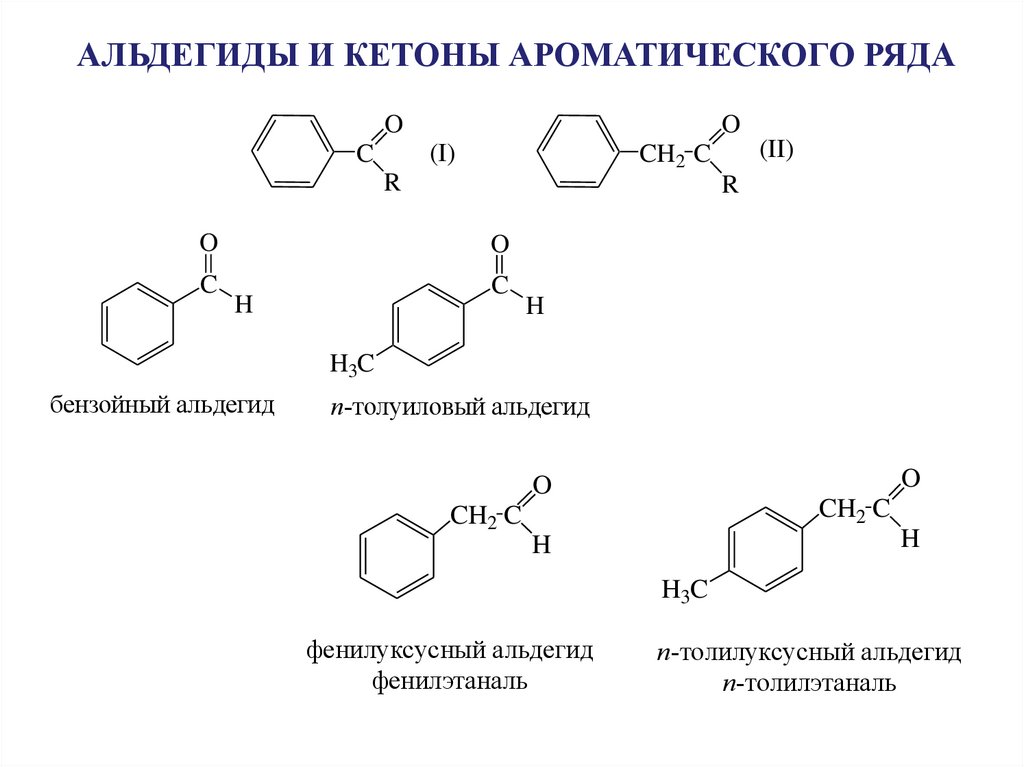
АЛЬДЕГИДЫ И КЕТОНЫ АРОМАТИЧЕСКОГО РЯДАO
O
(I)
C
R
R
O
O
C
C
H
(II)
CH2 C
H
H3C
бензойный альдегид
п-толуиловый альдегид
O
O
CH2 C
CH2 C
H
H
H3C
фенилуксусный альдегид
фенилэтаналь
п-толилуксусный альдегид
п-толилэтаналь
73.
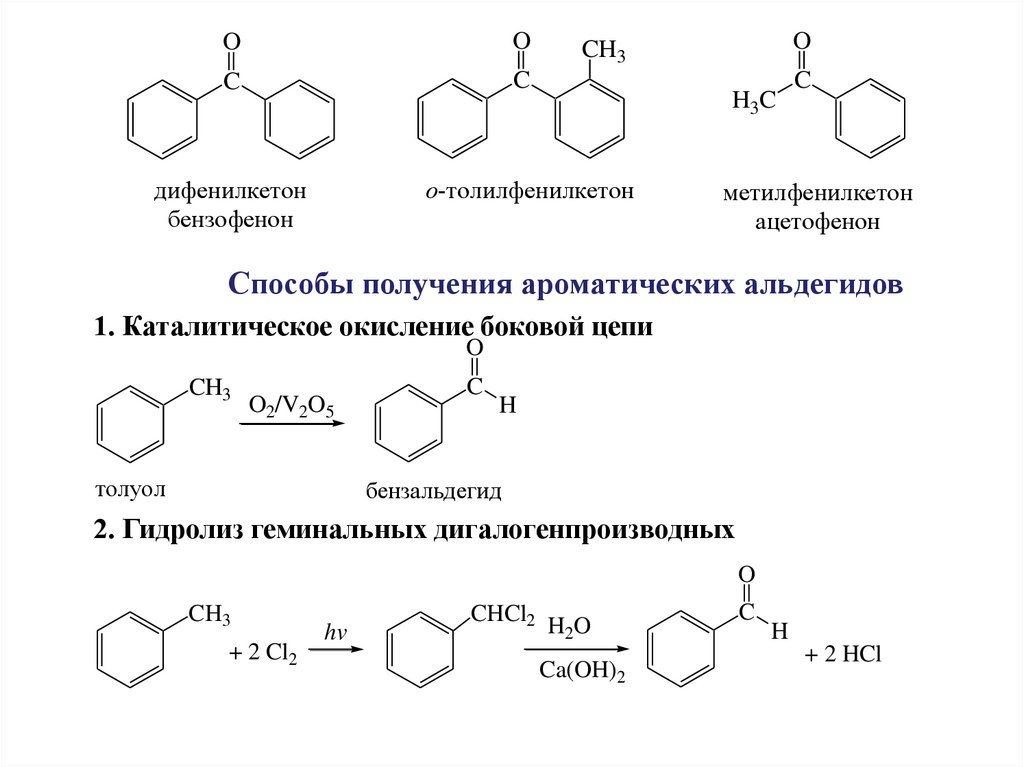
OO
C
C
дифенилкетон
бензофенон
о-толилфенилкетон
O
CH3
H3C
C
метилфенилкетон
ацетофенон
Способы получения ароматических альдегидов
1. Каталитическое окисление боковой цепи
O
CH3
O2/V2O5
толуол
C
H
бензальдегид
2. Гидролиз геминальных дигалогенпроизводных
O
CH3
+ 2 Cl2
hv
CHCl2
H2O
Ca(OH)2
C
H
+ 2 HCl
74.
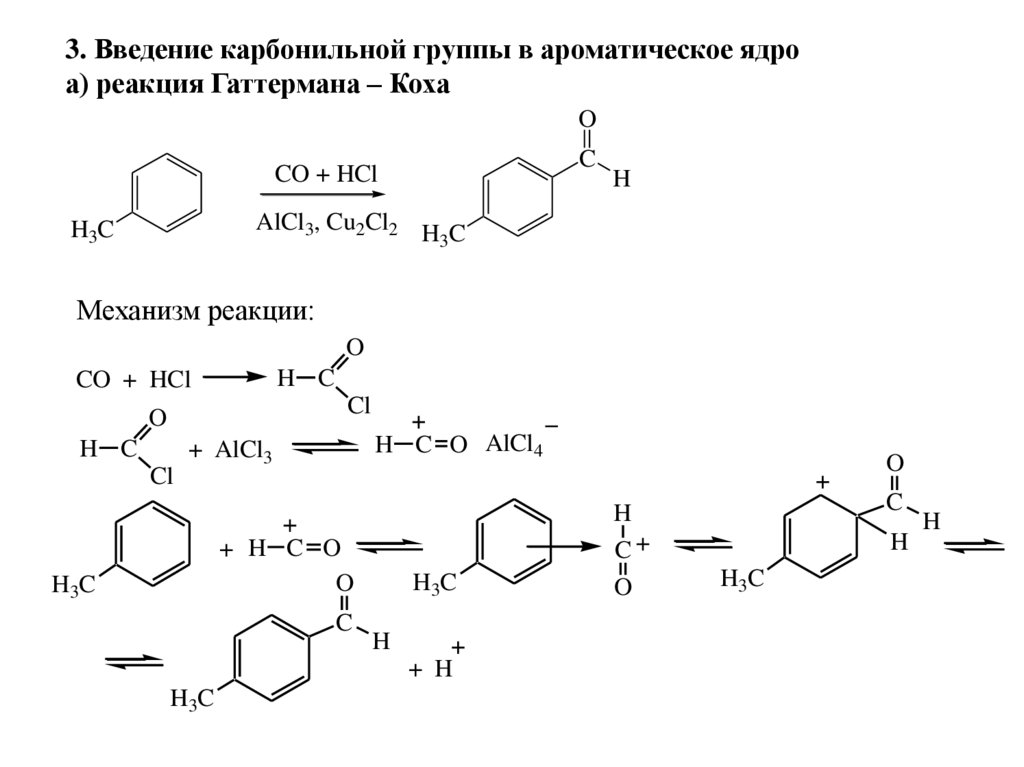
3. Введение карбонильной группы в ароматическое ядроа) реакция Гаттермана – Коха
O
C
CO + HCl
H
AlCl3, Cu2Cl2 H C
3
H3C
Механизм реакции:
O
H C
CO + HCl
Cl
O
H C
Cl
H C O AlCl4
+ AlCl3
+ H C O
O
H3C
C
H3C
H
+ H
H3C
O
H
C
O
C
H
H3C
H
75.
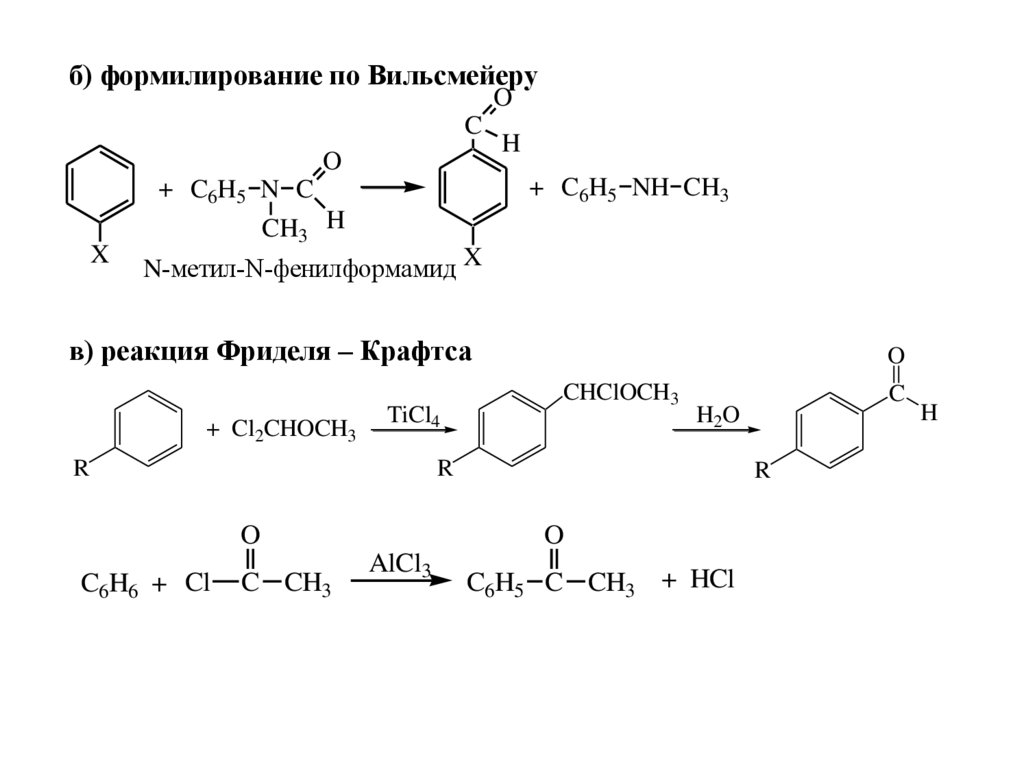
б) формилирование по ВильсмейеруO
C
O
+ C6H5 NH CH3
+ C6H5 N C
X
H
CH3 H
N-метил-N-фенилформамид X
в) реакция Фриделя – Крафтса
+ Cl2CHOCH3
TiCl4
R
CHClOCH3
C CH3
R
O
AlCl3
C
H2O
R
O
C6H6 + Cl
O
C6H5 C CH3 + HCl
H
76.
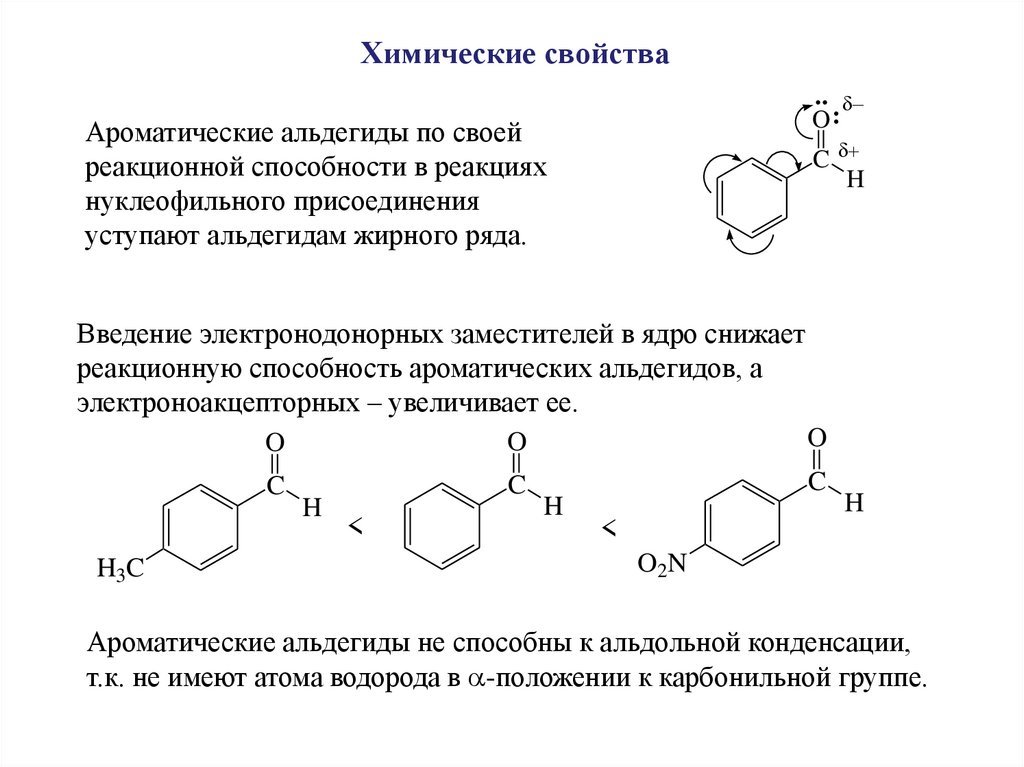
Химические свойства..
O:
Ароматические альдегиды по своей
реакционной способности в реакциях
нуклеофильного присоединения
уступают альдегидам жирного ряда.
C
H
Введение электронодонорных заместителей в ядро снижает
реакционную способность ароматических альдегидов, а
электроноакцепторных – увеличивает ее.
H3C
O
O
O
C
C
C
H
<
H
<
H
O2N
Ароматические альдегиды не способны к альдольной конденсации,
т.к. не имеют атома водорода в -положении к карбонильной группе.
77.
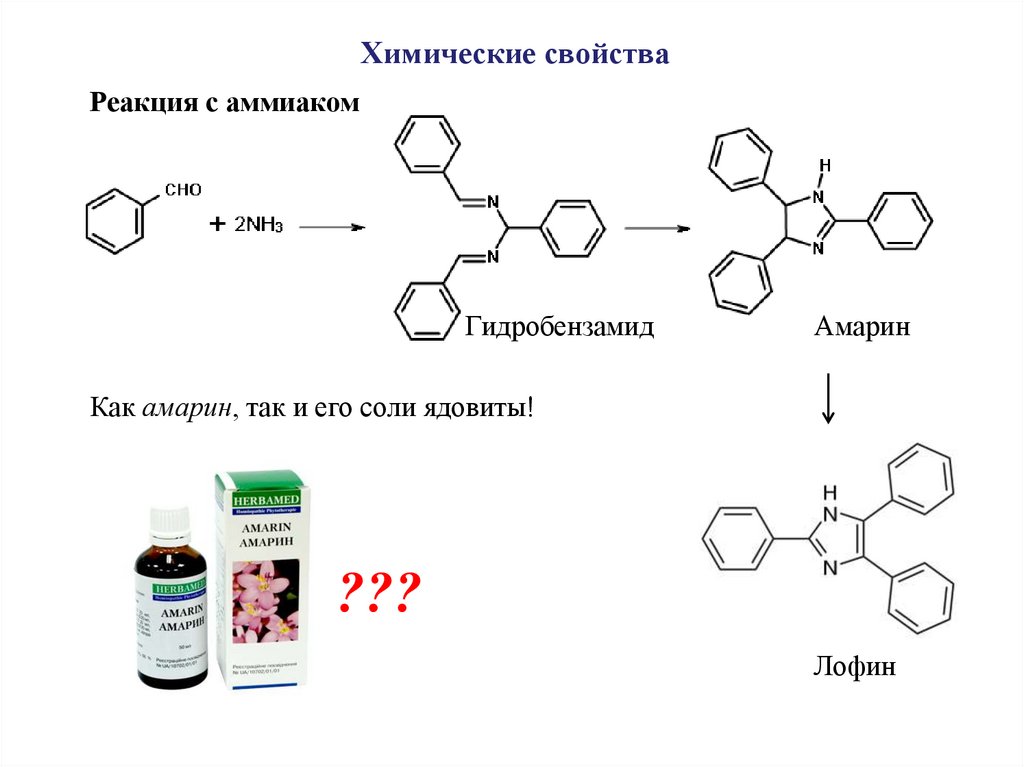
Химические свойстваРеакция с аммиаком
Гидробензамид
Амарин
Как амарин, так и его соли ядовиты!
???
Лофин
78.
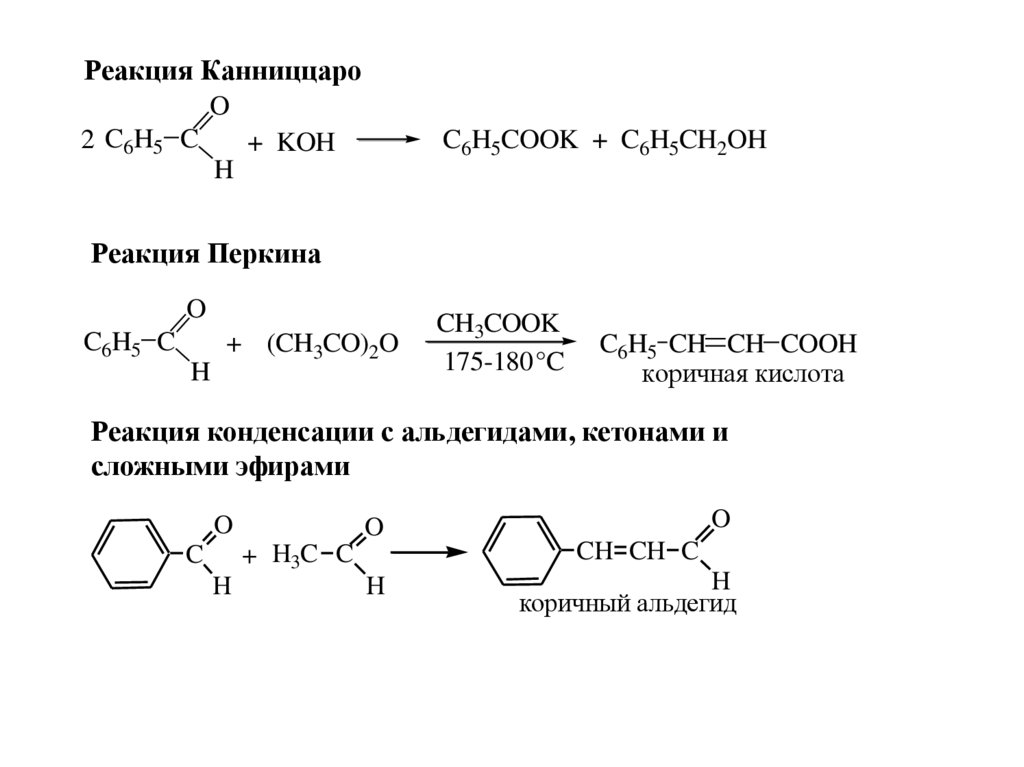
Реакция КанниццароO
2 C6H5 C
+ KOH
H
C6H5COOK + C6H5CH2OH
Реакция Перкина
O
C6H5 C
H
+ (CH3CO)2O
CH3COOK
175-180 °C
C6H5 CH CH COOH
коричная кислота
Реакция конденсации с альдегидами, кетонами и
сложными эфирами
O
O
+ H3C C
C
H
H
O
CH CH C
H
коричный альдегид
79.
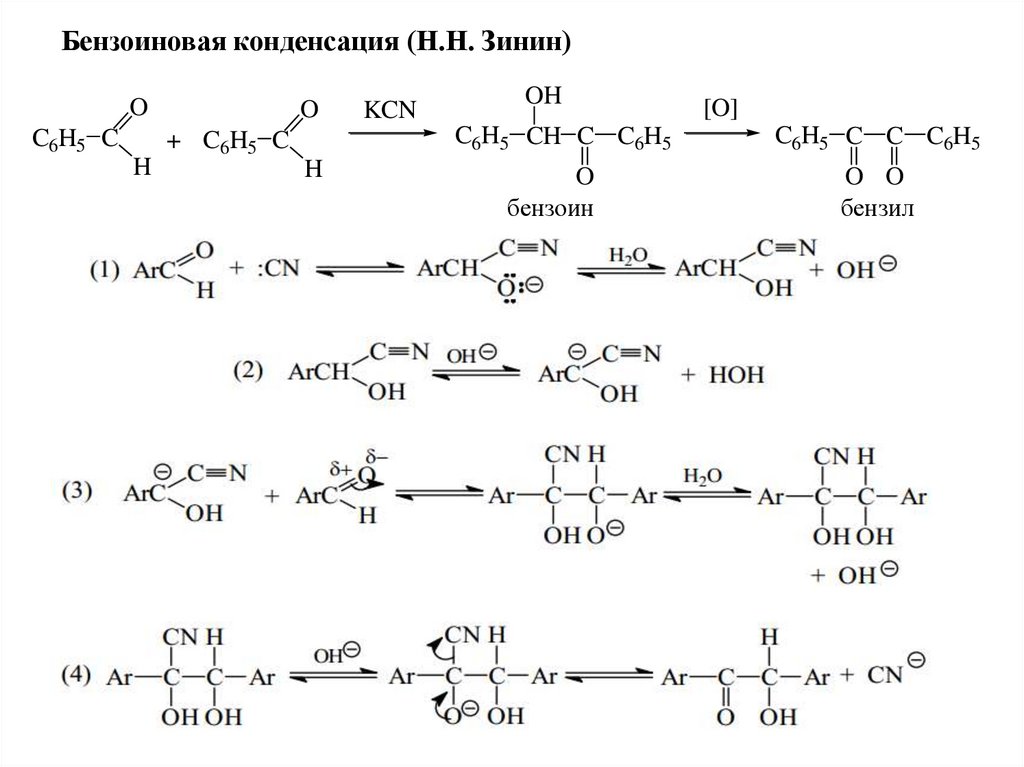
Бензоиновая конденсация (Н.Н. Зинин)O
C6H5 C
H
O
+ C6H5 C
H
KCN
OH
[O]
C6H5 CH C C6H5
C6H5 C C C6H5
O
бензоин
O O
бензил
80.
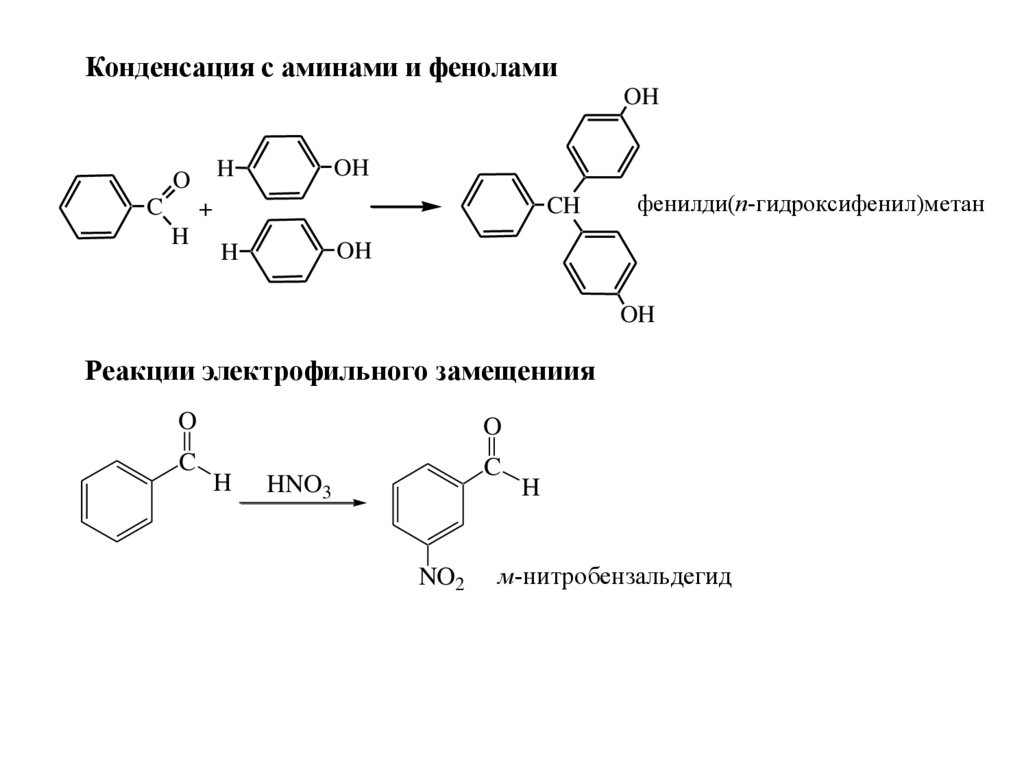
Конденсация с аминами и феноламиOH
C
OH
H
O
CH
+
H
фенилди(п-гидроксифенил)метан
OH
H
OH
Реакции электрофильного замещениия
O
C
O
H
C
HNO3
NO2
H
м-нитробензальдегид













 Химия
Химия








