Похожие презентации:
Биоматериаловедение. Введение (лекция 1)
1.
БиоматериаловедениеВведение
2.
Биоматериаловедение - что это?Материаловедение – это наука, изучающая связь между составом,строением и свойствами материалов, а
также их изменения при различных внешних воздействиях (тепловом, механическом, химическом,
биологическом и т.д.). Основная практическая задача материаловедения – изыскание оптимального
состава и способа обработки материалов для придания им заданных свойств.
Биосовместимые материалы
Биосовместимость – способность материала вызывать соответствующий отклик ткани хозяина в конкретной
ситуации, основанной на принципах:
• биоматериалы не должны вызывать местной воспалительной реакции;
• биоматериалы не должны оказывать токсического и аллергического действия на организм;
• биоматериалы не должны обладать канцерогенным действием;
• биоматериалы не должны провоцировать развитие инфекции;
• биоматериалы должны сохранять функциональные свойства в течение предусмотренного срока
эксплуатации;
• биосовместимые материалы и устройства действуют или функционируют гармонично и согласованно при
нахождении в организме или контакте с биологическими жидкостями, не вызывая заболевания или
болезненных реакций.
3.
Ретроспективаанестезия
трепанация
Ампутация
голени
Набор хирурга
4.
Новые материалы и технологииИскусственный
сердечный клапан
диагностика
кардиостимулятор
малоинвазивная
хирургия
Искусственное
сердце
Инкубатор и монитор состояния
ИФА для
диагностики
5.
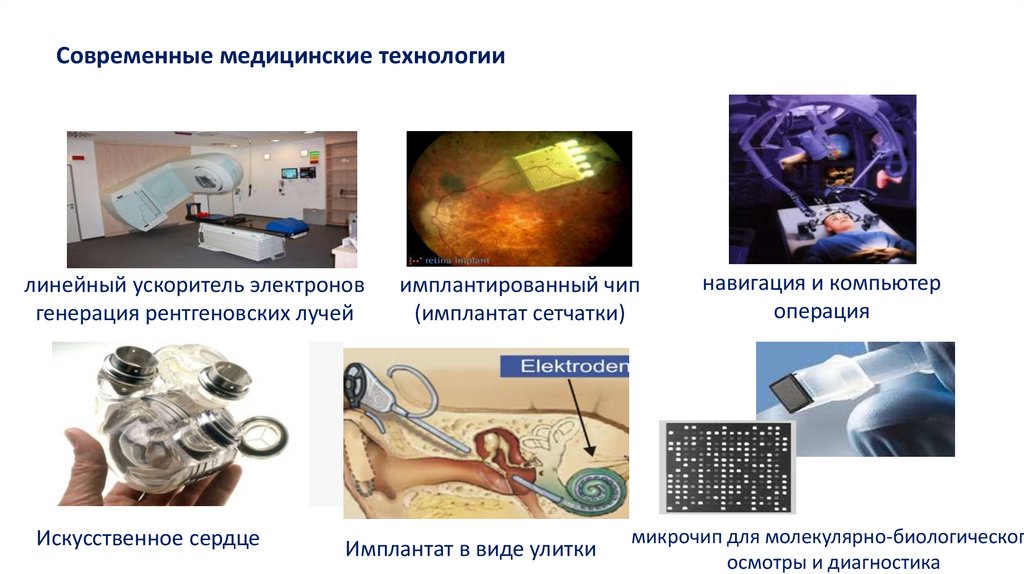
Современные медицинские технологиилинейный ускоритель электронов
генерация рентгеновских лучей
Искусственное сердце
имплантированный чип
(имплантат сетчатки)
Имплантат в виде улитки
навигация и компьютер
операция
микрочип для молекулярно-биологического
осмотры и диагностика
6.
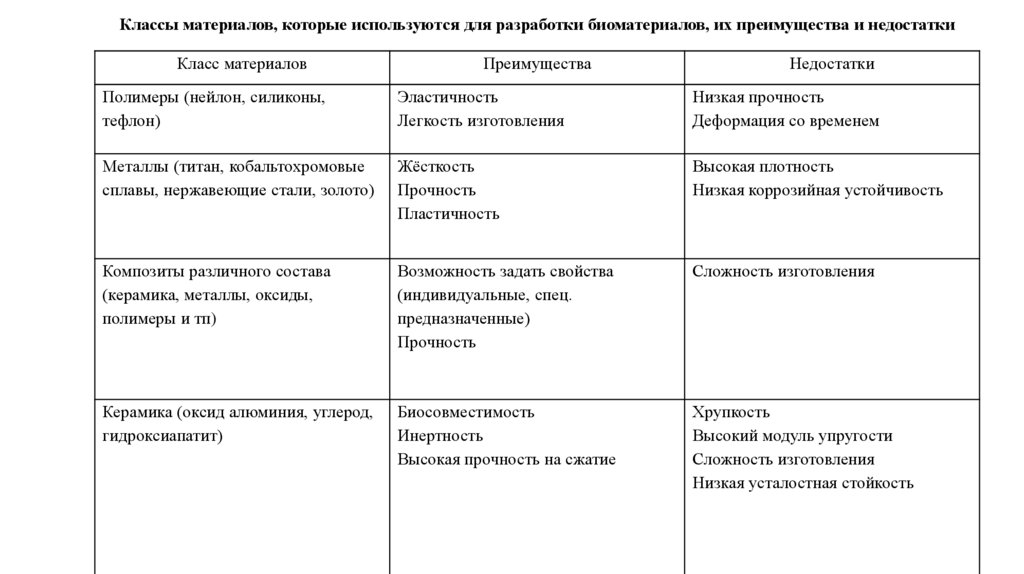
Классы материалов, которые используются для разработки биоматериалов, их преимущества и недостаткиКласс материалов
Преимущества
Недостатки
Полимеры (нейлон, силиконы,
тефлон)
Эластичность
Легкость изготовления
Низкая прочность
Деформация со временем
Металлы (титан, кобальтохромовые
сплавы, нержавеющие стали, золото)
Жёсткость
Прочность
Пластичность
Высокая плотность
Низкая коррозийная устойчивость
Композиты различного состава
(керамика, металлы, оксиды,
полимеры и тп)
Возможность задать свойства
(индивидуальные, спец.
предназначенные)
Прочность
Сложность изготовления
Керамика (оксид алюминия, углерод,
гидроксиапатит)
Биосовместимость
Инертность
Высокая прочность на сжатие
Хрупкость
Высокий модуль упругости
Сложность изготовления
Низкая усталостная стойкость
7.
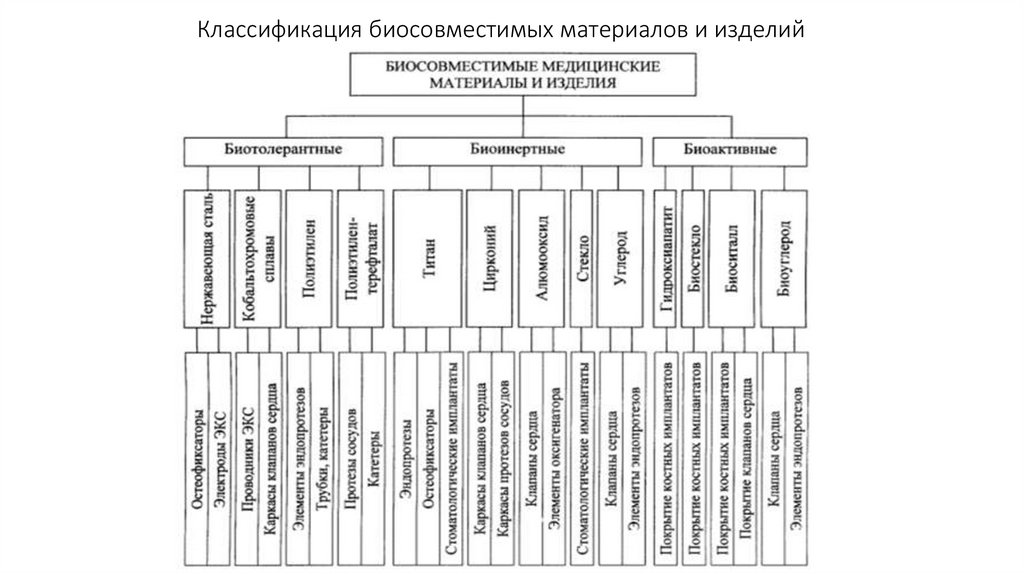
Классификация биосовместимых материалов и изделий8.
Основные понятияТвердое тело (твердофазное состояние вещества)
агрегатно
состояние вещества, отличительными признаками которого при
нормальных условиях являются устойчивость формы и характер
теплового движения структурных единиц (атомов, ионов, молекул),
совершающих малые колебания относительно некоторых
фиксированных положений равновесия.
Твердое вещество
это вся совокупность твердых фаз,
образующих единую, находящуюся в твердом состоянии,
химическую систему.
9.
Основные понятияНельзя отождествлять понятия твердое тело и фаза. Все
гомогенные части гетерогенной системы (тела), одинаковые по
химическому составу, строению и агрегатному состоянию,
ограниченные поверхностью раздела, составляют одну фазу.
Фаза является формой существования химического вещества в
твердом агрегатном состоянии.
Твердая фаза
агрегатное состояние вещества, характеризуемо
жесткой структурой. В этом состоянии частицы составляющие
вещество совершают малые колебания около фиксированных
положений
равновесия.
Их
характеризует
ограниченная
подвижность частиц и предопределенное расположение частиц в
пространстве
10.
Основные понятияАбсолютно твердое тело – система (или континиум – лат. continuum непрерывн
сплошное) материальных точек, расстояние между которыми не меняются в дан
задаче.
Абсолютно твердое тело обладает только поступательными и вращательны
степенями свободы.
Твердое тело в механике = неопределенный количественный и качественный со
+ неопределенное геометрическое строение
«Твёрдость» означает, что тело не может быть деформировано, то есть телу не
передать никакой другой энергии, кроме кинетической энергии поступательно
или вращательного движения.
Конфигурация абсолютно твёрдого тела определяется положением жёс
связанной с
ним
декартовой системы
координат.
В трёхмерном
пространстве свободное абсолютно твёрдое тело (т. е. твёрдое тело, на которо
наложены внешние связи) в общем случае имеет 6 степеней свободы:
поступательных и три вращательных.
11.
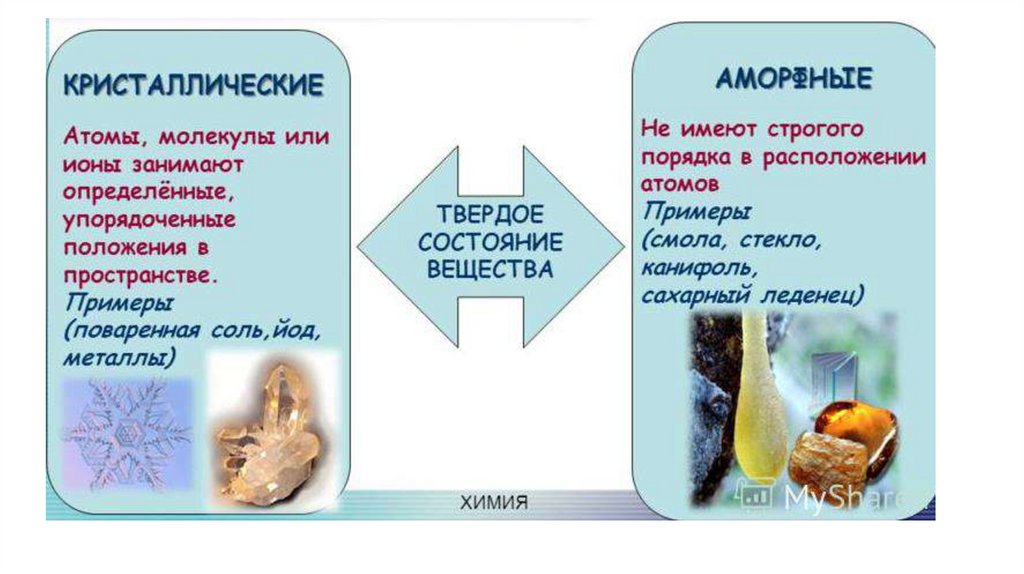
Классификация твердых тел (веществ)По фазовому составу твердые тела разделяются на: однофазные
многофазные.
По внутреннему строению твердые вещества можно разделить на
две большие группы: кристаллические и некристаллические.
По сингонии кристаллографической (гр. syn - вместе + gonia - угол)
= подразделение кристаллов по признаку симметрии элементарной
ячейки. Характеризуется соотношениями между осями а, b, с и
углами a, b, g ячейки: Существует 7 кристаллографических
сингоний.
По типу химической связи: ионные, молекулярные и т.д.
12.
Кристаллические и некристаллическиеДеление
твердых
веществ
на
кристаллические и
некристаллические основано на существовании двух типов
упорядочения структурных элементов
ближнего и дальнего
порядка.
Ближний порядок это единая по всему твердому телу
конфигурация ближайшего окружения всех атомов данного типа.
Дальний порядок-это трехмерное периодическое расположение
структурных элементов в масштабах этого твердого вещества. Вид
вещества зависит от условий получения.
К некристаллическим относят аморфные, стеклообразные и
полимерные вещества.
Ультрадисперсное, наноструктурное, тонкопленочное можно
выделить как промежуточные состояния.
13.
14.
Кристаллическое состояниехарактеризуется наличием дальнего порядка в расположении частиц,
симметрией кристаллической решетки (свойством отдельных узлов
решетки совмещаться при трансляционном перемещении).
Совокупность отдельных узлов решетки образует так называемую
решетку
Бравэ.
Кристаллическая
структура
–
конкретное
пространственное расположение атомов (ионов, молекул) в кристаллах.
Идеальный кристалл
однородная анизотропная симметричная
конденсированная среда, обладающая трансляционно упорядоченным
атомным строением и способную самоограняться в процессе роста (Е.В.
Чупрунов)
Монокристалл –
Поликристалл –
15.
Идеальный кристаллСостоит из ансамбля большого числа одинаковых частиц
(атомов, молекул, ионов и др.), упакованных в регулярную
решетку (двух- или трехмерную), заполняющую всё
пространство (объем или поверхность).
Микроскопические характеристики произвольной точки
внутри кристалла точно воспроизводятся во всех точках,
координаты которых инвариантны при операциях
трансляции
16.
Монокристаллы твёрдые тела, имеющие ввсём объёме единую кристаллическую решёт
Характерной особенностью монокристаллов является их анизотропия, т.
зависимость физических свойств(механических, тепловых, электрических,
оптических) от направления внутри кристалла. Анизотропия монокристалло
обусловлена различием в плотности расположения частиц в кристаллической решё
по разным направлениям.
17.
Поликристаллы — твёрдые тела, состоящиеиз большого числа сросшихся между собой
маленьких кристаллов
В отличие от монокристаллов поликристаллы изотропны, т. е. их
свойства одинаковы по всем направлениям. Это следствие того, что
поликристалл состоит из большого количества беспорядочно
ориентированных маленьких монокристаллов.
18.
7 кристаллографических сингонийкубическая (а = b = с, a = b = g = 90°),
тетрагональная (а = b ¹ с, a = b = g = 90°),
гексагональная (а = b ¹ с, a = b = 90°, g = 120°),
тригональная (а = b = с, a = b = g ¹ 90°),
ромбическая (а ¹ b ¹ с, a = b = g = 90°),
моноклинная (а ¹ b ¹ с, a = g = 90°, b ¹ 90°),
триклинная (a ¹ b ¹ c, a ¹ b ¹ g ¹ 90°).
• каждая сингония включает в себя несколько точечных групп
симметрий и решёток Браве.
19.
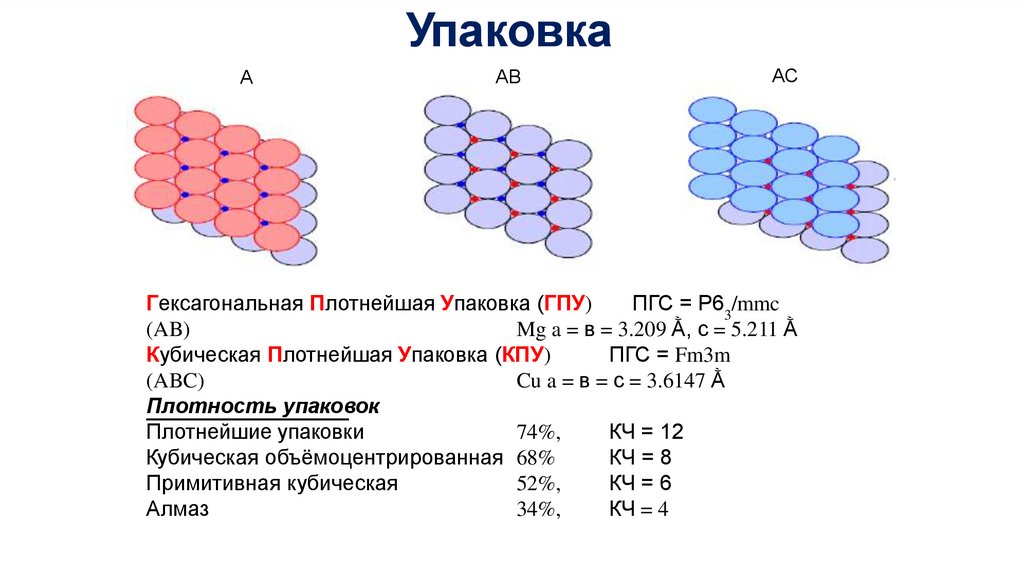
УпаковкаА
АВ
АС
Гексагональная Плотнейшая Упаковка (ГПУ)
ПГС = P63/mmc
(AB)
Mg a = в = 3.209 Ằ, c = 5.211 Ằ
Кубическая Плотнейшая Упаковка (КПУ)
ПГС = Fm3m
(ABC)
Cu a = в = с = 3.6147 Ằ
Плотность упаковок
Плотнейшие упаковки
74%,
КЧ = 12
Кубическая объёмоцентрированная 68%
КЧ = 8
Примитивная кубическая
52%,
КЧ = 6
Алмаз
34%,
КЧ = 4
20.
Некристаллическое состояние вещества• Основные формы: аморфная, полимерная, стеклообразная
аморфно-стеклообразная.
• Термином "некристаллическое твердое вещество" констатируется
факт отсутствия дальнего порядка.
• Аморфная форма - жидкоподобная, т.е. имеющие ближний
порядок, аналогичный их жидкофазному состоянию, и
решеткоподобная, для которых ближний порядок аналогичен
кристаллическому состоянию.
• Если термин "жидкоподобное" имеет определенный смысл, т.е.
отражает некристаллическую
природу вещества, то
"решеткоподобный" дает мало информации о ближнем порядке
аморфного вещества.
21.
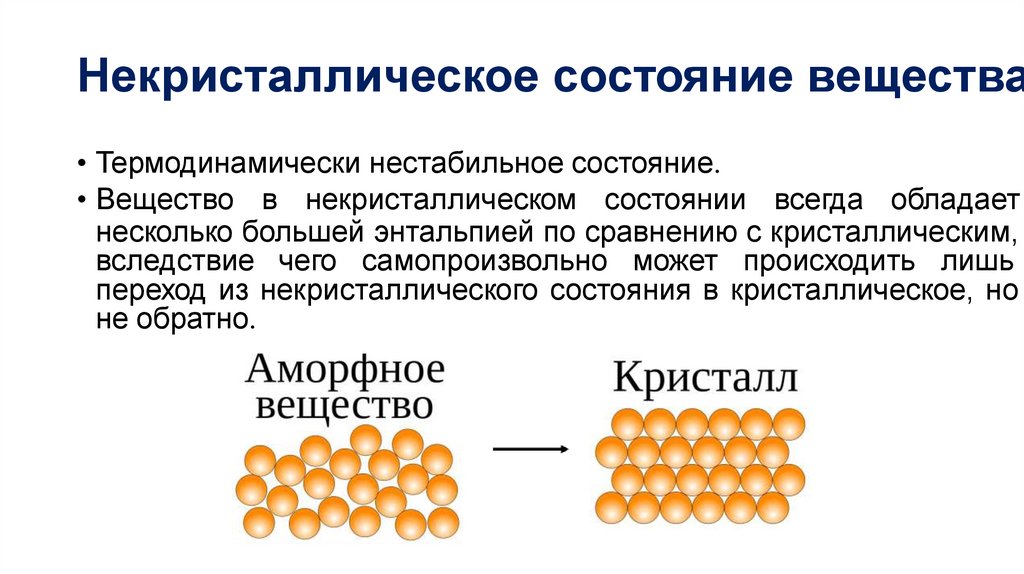
Некристаллическое состояние вещества• Термодинамически нестабильное состояние.
• Вещество в некристаллическом состоянии всегда обладает
несколько большей энтальпией по сравнению с кристаллическим,
вследствие чего самопроизвольно может происходить лишь
переход из некристаллического состояния в кристаллическое, но
не обратно.
22.
ОпределенияАморфная форма некристаллического состояния является
Аналогичной состоянию переохлажденной жидкости с
очень большой вязкостью.
Аморфные вещества не имеют строго периодического строен
ия в
трехмерном пространстве и находятся в неупорядочен
ном
состоянии. Преимущественно неупорядоченными могут б
ыть
частицы, обладающие большой протяженностью. Это связа
но с
тем, что большим молекулам очень трудно расположитьс
я в
пространстве. Представителями подобного типа аморфны
х тел
являются полимеры, смолы.
Б.Ф.Ормонту, аморфным называют такое состояние, котора
х
В.В.Алесковский:
Аморфное вещество можно представить себе как
я
в высшей степени сложную совокупность многоатомных молекул
храктеризуется
структуры твердого тела и ве
или
макромолекулобрывками
.
23.
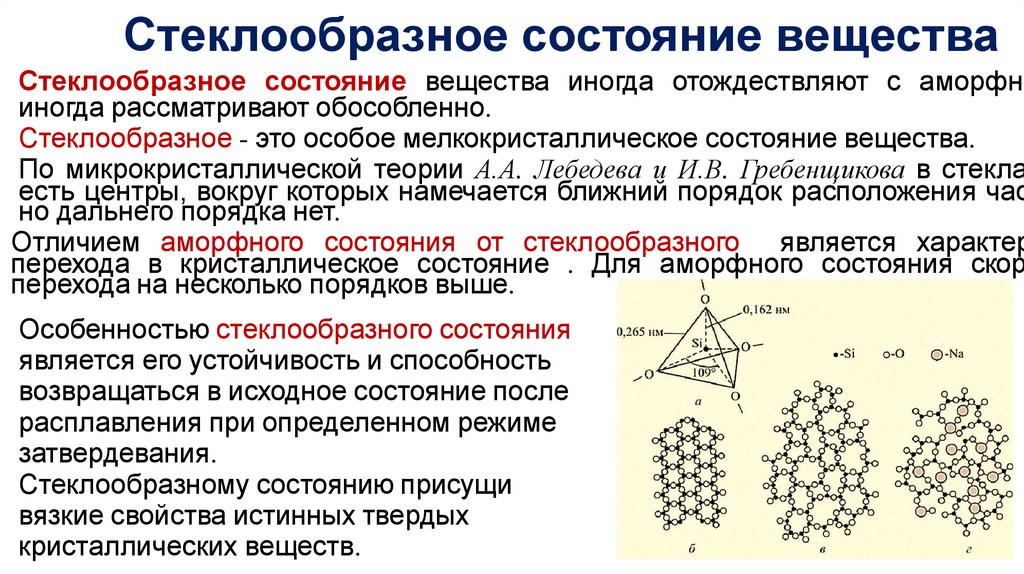
Стеклообразное состояние веществаСтеклообразное состояние вещества иногда отождествляют с аморфны
иногда рассматривают обособленно.
Стеклообразное - это особое мелкокристаллическое состояние вещества.
По микрокристаллической теории А.А. Лебедева и И.В. Гребенщикова в стекла
есть центры, вокруг которых намечается ближний порядок расположения час
но дальнего порядка нет.
Отличием аморфного состояния от стеклообразного является характер
перехода в кристаллическое состояние . Для аморфного состояния скор
перехода на несколько порядков выше.
Особенностью стеклообразного состояния
является его устойчивость и способность
возвращаться в исходное состояние после
расплавления при определенном режиме
затвердевания.
Стеклообразному состоянию присущи
вязкие свойства истинных твердых
кристаллических веществ.
24.
Промежуточные формы твердого состоянияСиталлы, керамика, ультрадисперсные и наноразмерные
вещества
Ситаллы - это закристаллизованные стекла, которые получают
введением в расплавленное стекло каталитических затравок.
Наличие затравок приводит к возникновению центров
кристаллизации, на которых растут кристаллы основной фазы.
По структуре ситаллы занимают промежуточное положение между
стеклом и керамикой. От стекла их отличает кристаллическое
строение, а от керамики и других кристаллов - наличие более
тонкой и однородной микрокристаллической структуры.
Ситаллы обладают высокой механической прочностью, твердостью
и хорошей термостойкостью.
25.
Для аморфного состояния твердых тел характерно наличие толькоближнего порядка; оно термодинамически неустойчиво, однако
при обычных температурах переход в кристаллическое состояние
обычно не реализуется и может осуществляться лишь при
нагревании.
Аморфные твердые тела, в отличие от большинства
кристаллических, изотропны
26.
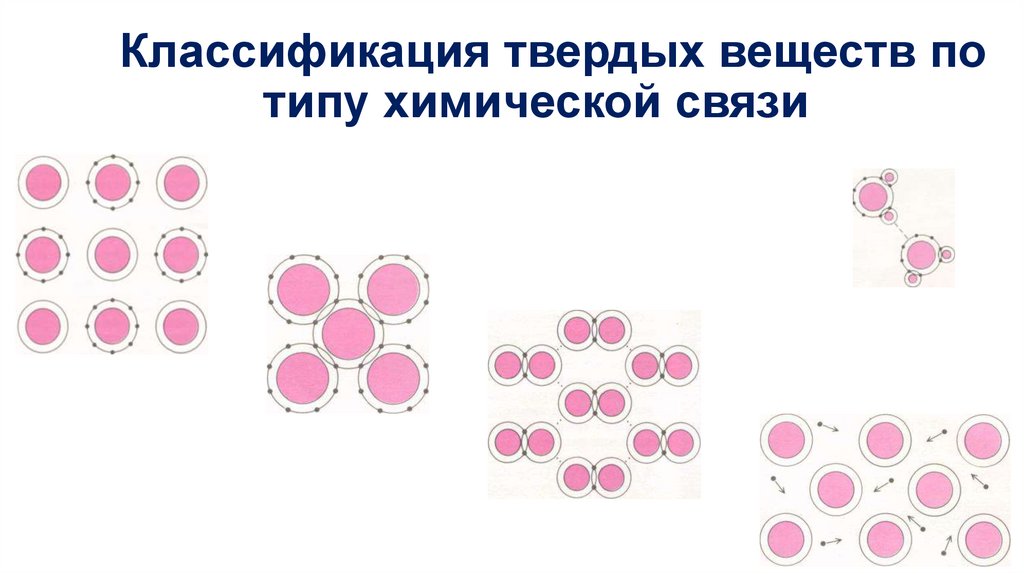
Классификация твердых веществ потипу химической связи
• вещества с металлической связью, как правило, это металлы,
сплавы и некоторые соединения, например, бориды, сульфиды и
т.д.;
• вещества с ковалентной связью - чаще всего это полупроводники
и некоторые типы диэлектриков;
• вещества с ионной связью - ионные кристаллы, являющиеся при
нормальных условиях диэлектриками;
• молекулярные кристаллы, характеризующиеся межмолекулярной
связью;
• вещества с промежуточным типом связи.
27.
Классификация твердых веществ потипу химической связи
28.
Химический и физический подход к описанию природытвердого вещества.
29.
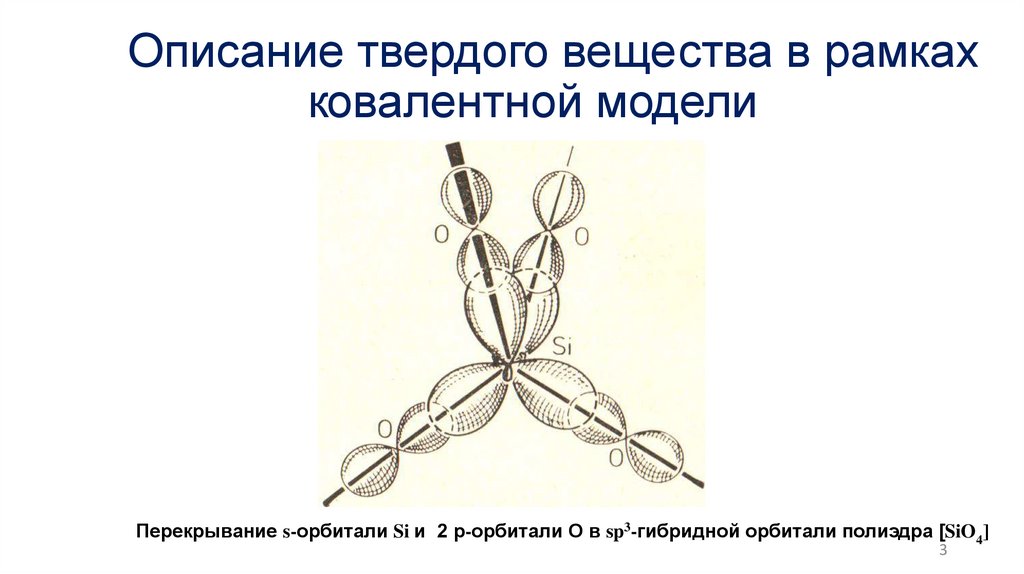
Описание твердого вещества в рамкахковалентной модели
Перекрывание s-орбитали Si и 2 р-орбитали О в sp3-гибридной орбитали полиэдра [SiO4]
3
30.
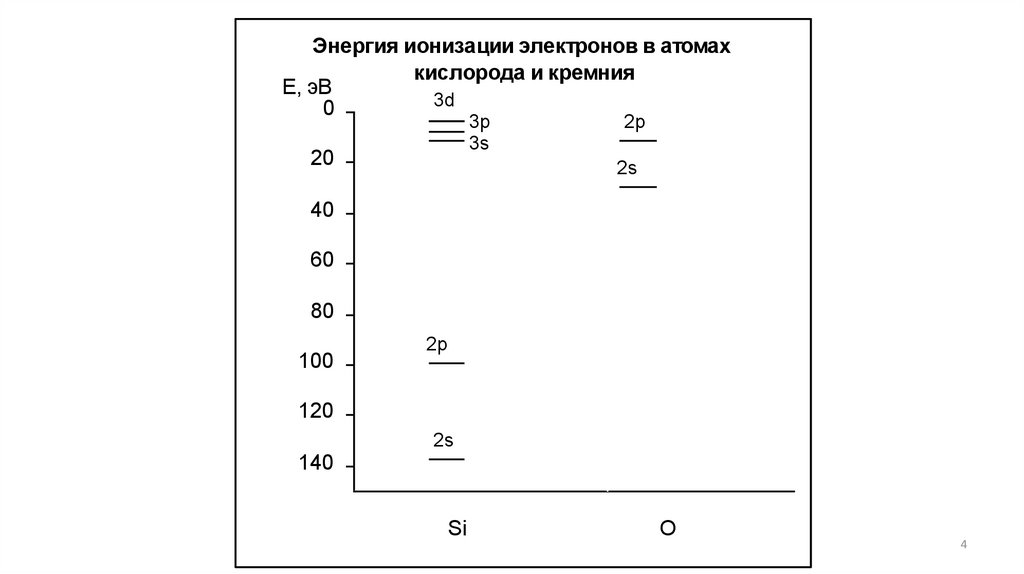
Энергия ионизации электронов в атомахкислорода и кремния
Е, эВ
3d
0
3p
3s
20
2p
2s
40
60
80
100
2p
120
140
2s
Si
O
4
31.
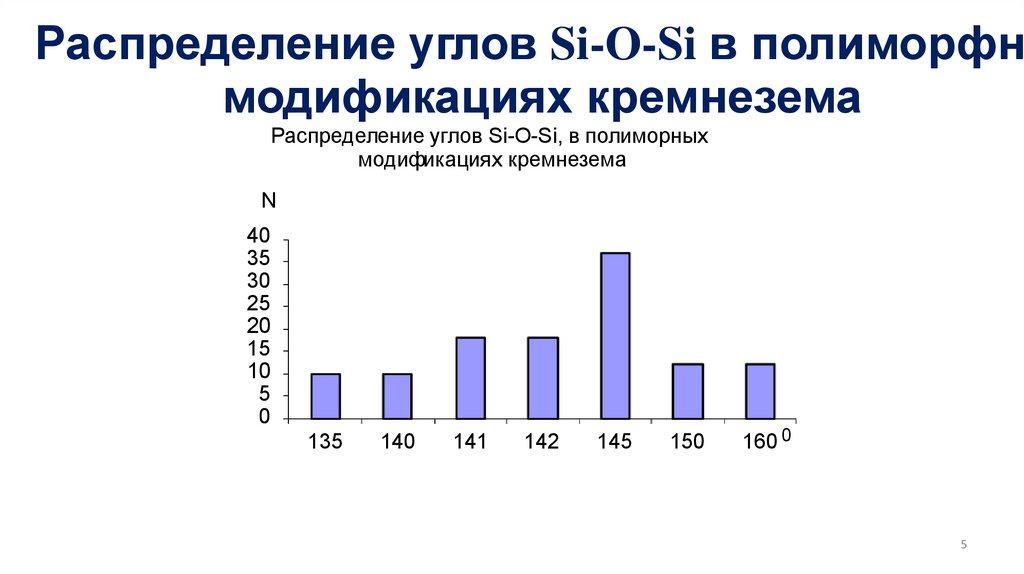
Распределение углов Si-O-Si в полиморфнымодификациях кремнезема
Распределение углов Si-O-Si, в полиморных
модификациях кремнезема
N
40
35
30
25
20
15
10
5
0
135
140
141
142
145
150
160 0
5
32.
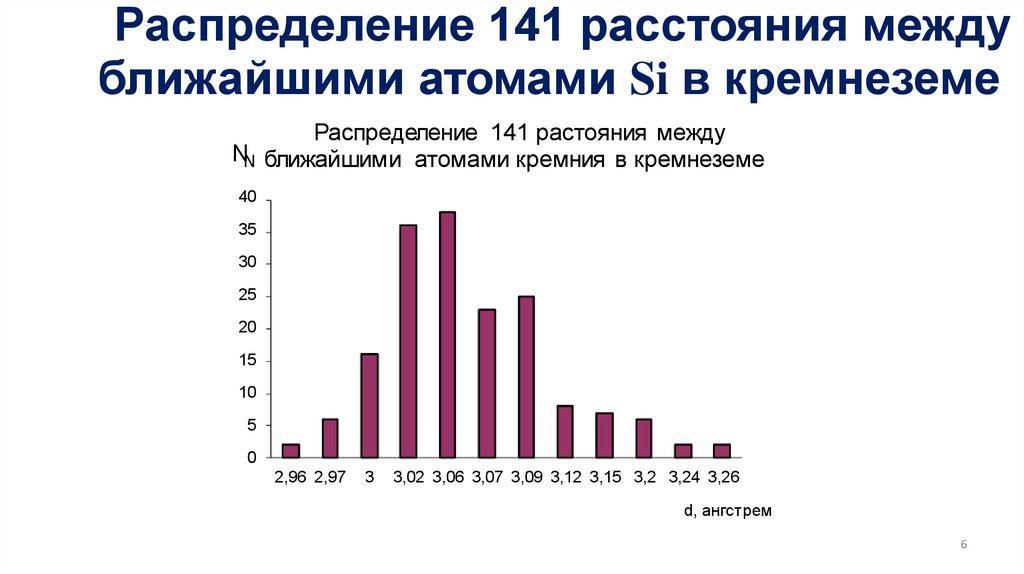
Распределение 141 расстояния междуближайшими атомами Si в кремнеземе
Распределение 141 растояния между
NN ближайшими атомами кремния в кремнеземе
40
35
30
25
20
15
10
5
0
2,96 2,97
3
3,02 3,06 3,07 3,09 3,12 3,15 3,2 3,24 3,26
d, ангстрем
6
33.
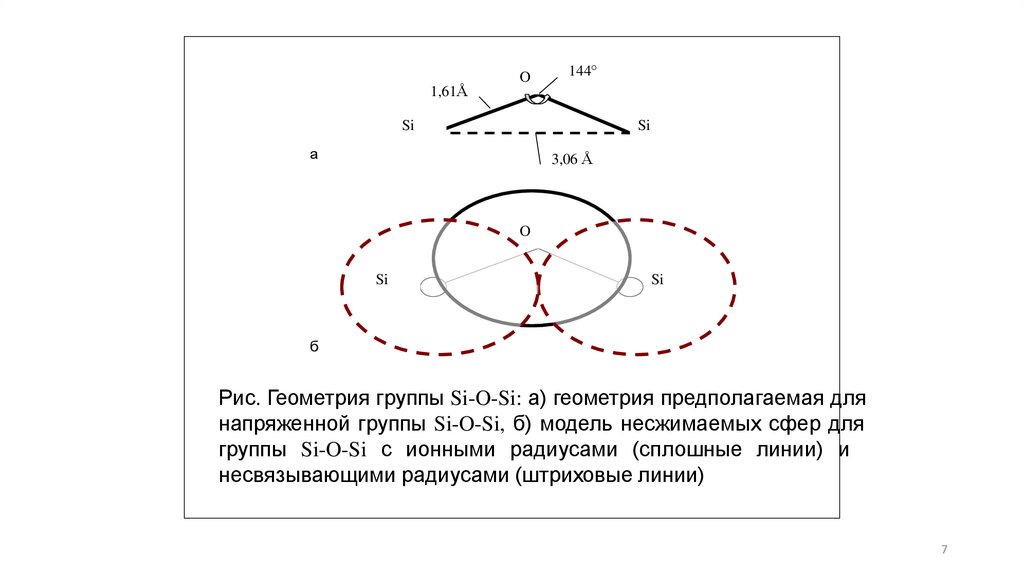
O144
1,61Å
Si
Si
а
3,06 Å
O
Si
Si
б
Рис. Геометрия группы Si-O-Si: а) геометрия предполагаемая для
напряженной группы Si-O-Si, б) модель несжимаемых сфер для
группы Si-O-Si с ионными радиусами (сплошные линии) и
несвязывающими радиусами (штриховые линии)
7
34.
Описание твердого вещества в рамках ионнмодели
Ионные радиусы по Полингу
rSi4+ = 0,41Å и
rO2- = 1,40 Å
rSi4+:rO2-=0,29
0,255 rкатион/rанион 0,414
(тетраэдрическая
координация)
Эффективные ионные радиусы кремния в тетраэдрических и
октаэдрических координациях равны 0,26 Å (4) и 0,407Å (6)
соответственно.
Радиус кислорода в силикатах составляет 1,37 Å.
Для этих значений отношение rSi4+:rO2- равно 0,19 и 0,29.
0,414 0,732
(октаэдрическая
0,255 0,414 (тетраэдрическая координация)
координация)
8
35.
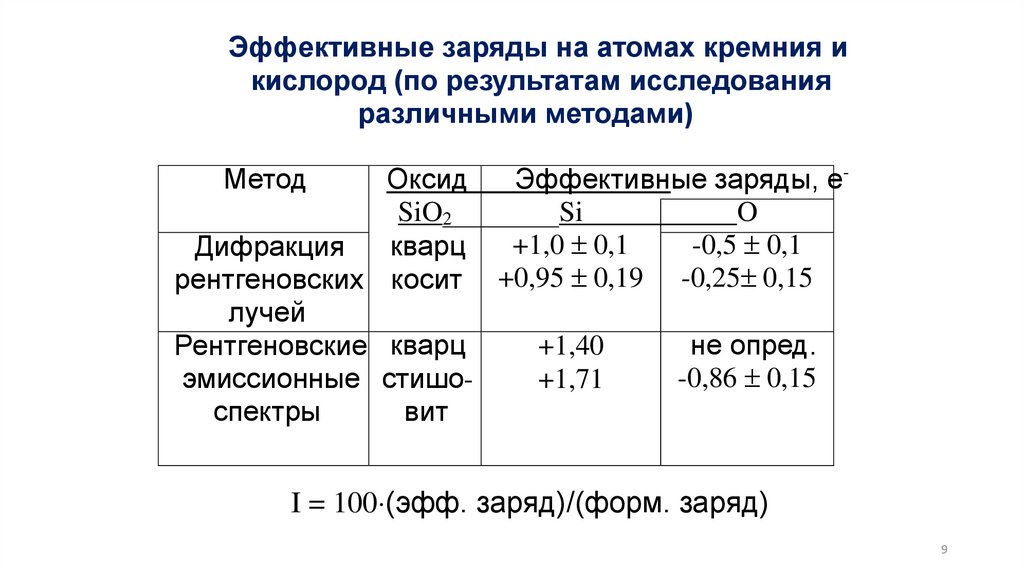
Эффективные заряды на атомах кремния икислород (по результатам исследования
различными методами)
Метод
Оксид
Эффективные заряды, еSiO2
Si
O
+1,0 0,1
-0,5 0,1
кварц
Дифракция
рентгеновских косит +0,95 0,19 -0,25 0,15
лучей
+1,40
не опред.
Рентгеновские кварц
-0,86 0,15
+1,71
эмиссионные стишоспектры
вит
I = 100 (эфф. заряд)/(форм. заряд)
9
36.
Понятие остова твердого телаС химической точки зрения остов – ненасыщенное высокомолекулярное
образование макроскопических размеров. Остов представляет собой
макрорадикал [Ш]n (n – количество свободных мест «свободных
валентностей»), а облекающие остов атомы или группы атомов –
функциональные группы А1, А2,…
10
37.
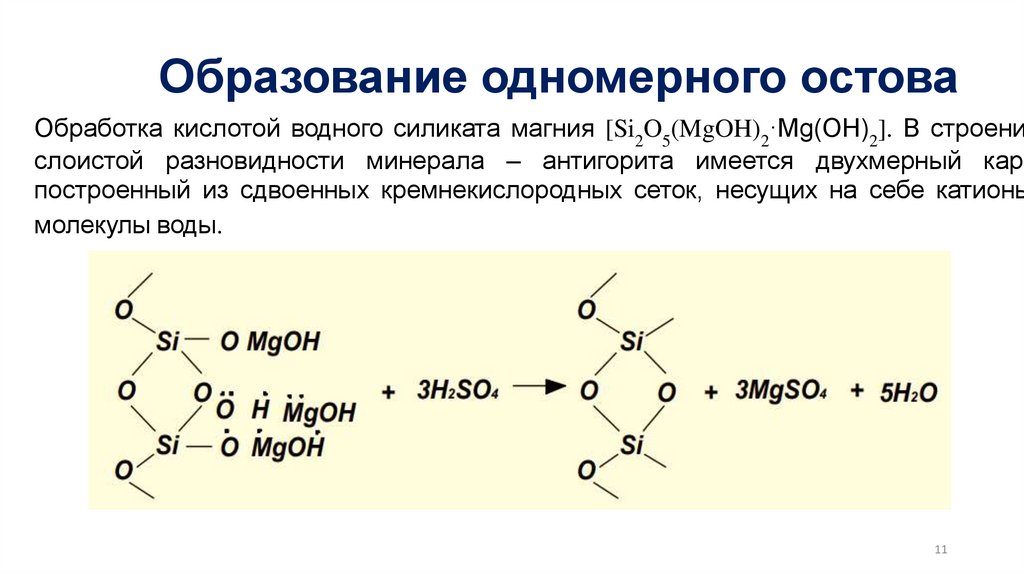
Образование одномерного остоваОбработка кислотой водного силиката магния [Si2O5(MgOH)2·Mg(OH)2]. В строени
слоистой разновидности минерала – антигорита имеется двухмерный карк
построенный из сдвоенных кремнекислородных сеток, несущих на себе катионы
молекулы воды.
11
38.
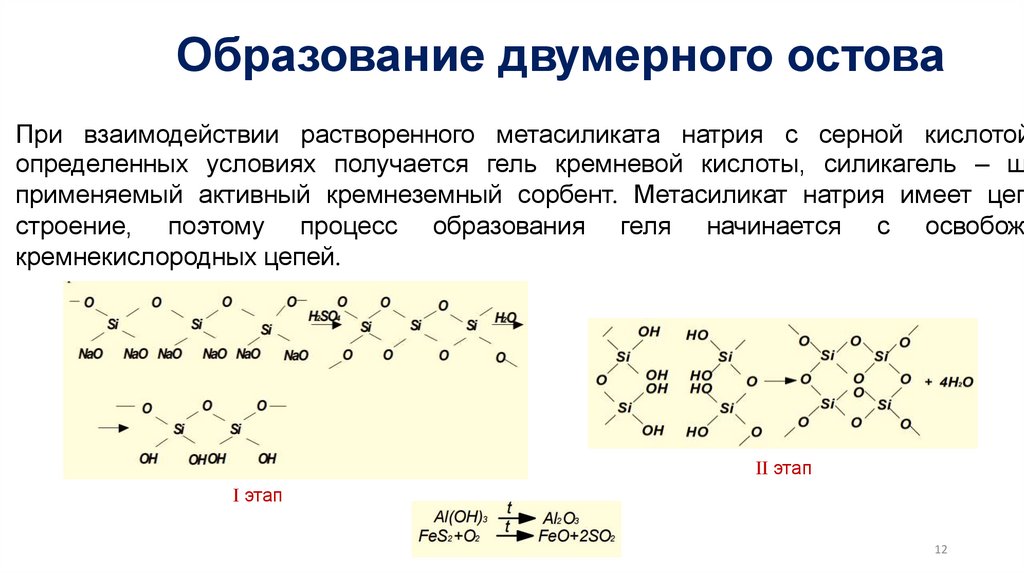
Образование двумерного остоваПри взаимодействии растворенного метасиликата натрия с серной кислотой
определенных условиях получается гель кремневой кислоты, силикагель – ш
применяемый активный кремнеземный сорбент. Метасиликат натрия имеет цеп
строение, поэтому процесс образования геля начинается с освобожд
кремнекислородных цепей.
II этап
I этап
12
39.
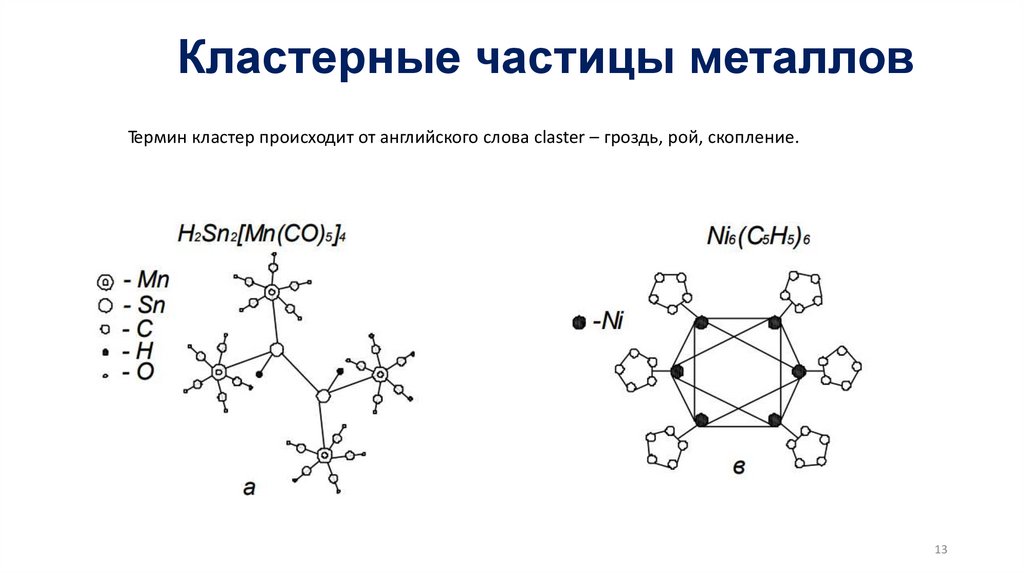
Кластерные частицы металловТермин кластер происходит от английского слова claster – гроздь, рой, скопление.
13
40.
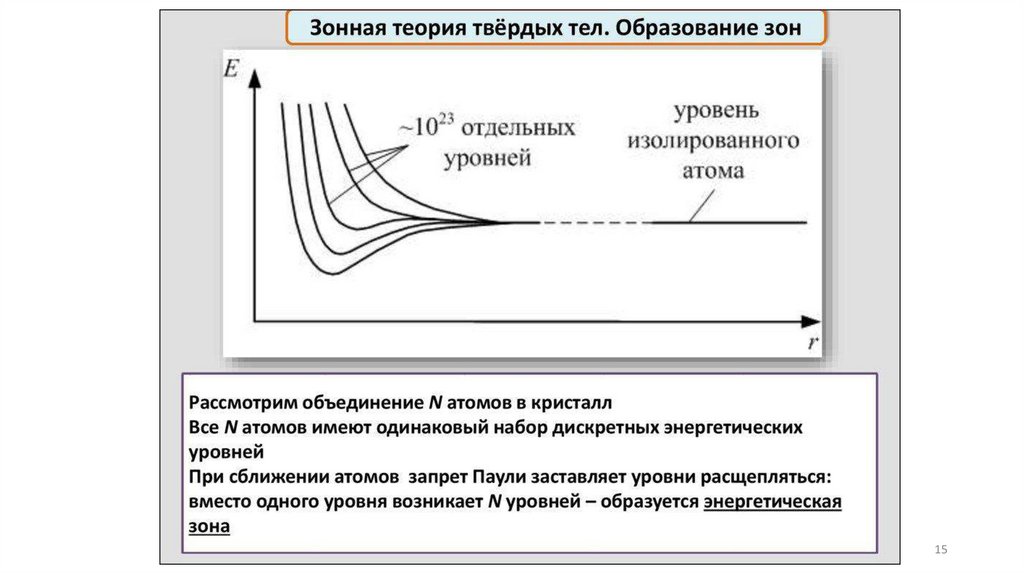
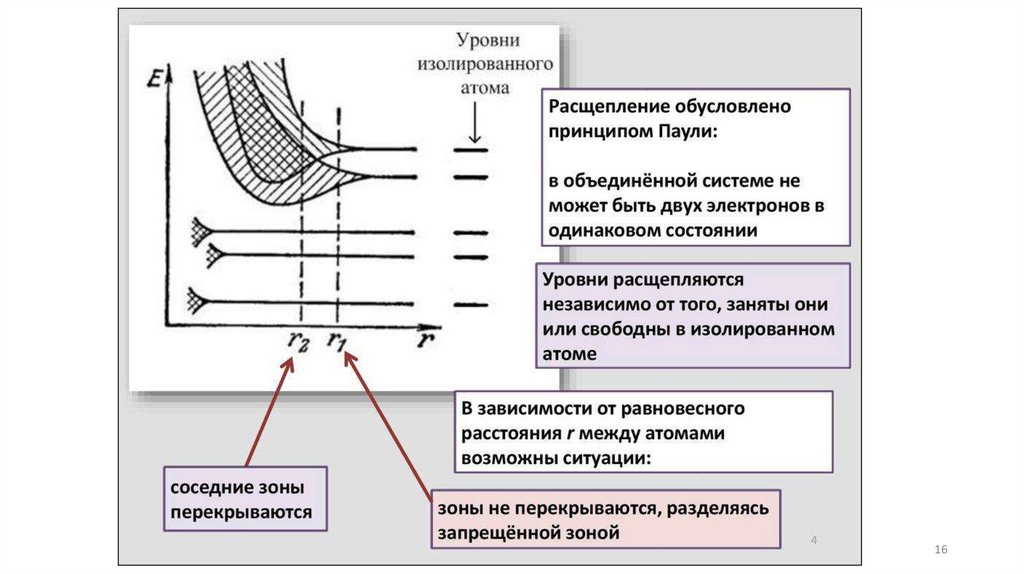
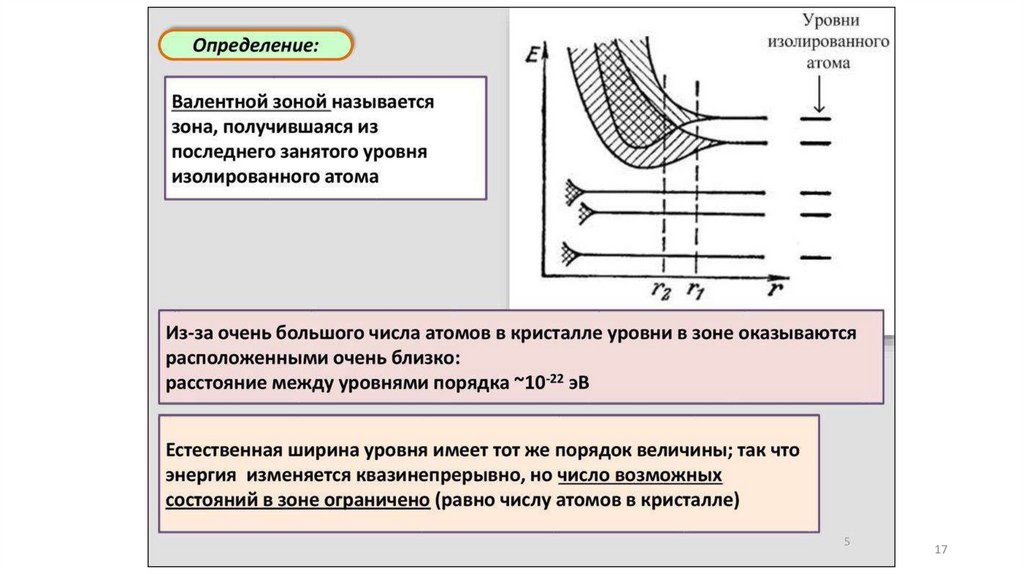
Физический подход и модель описанияприроды и свойств твердого вещества
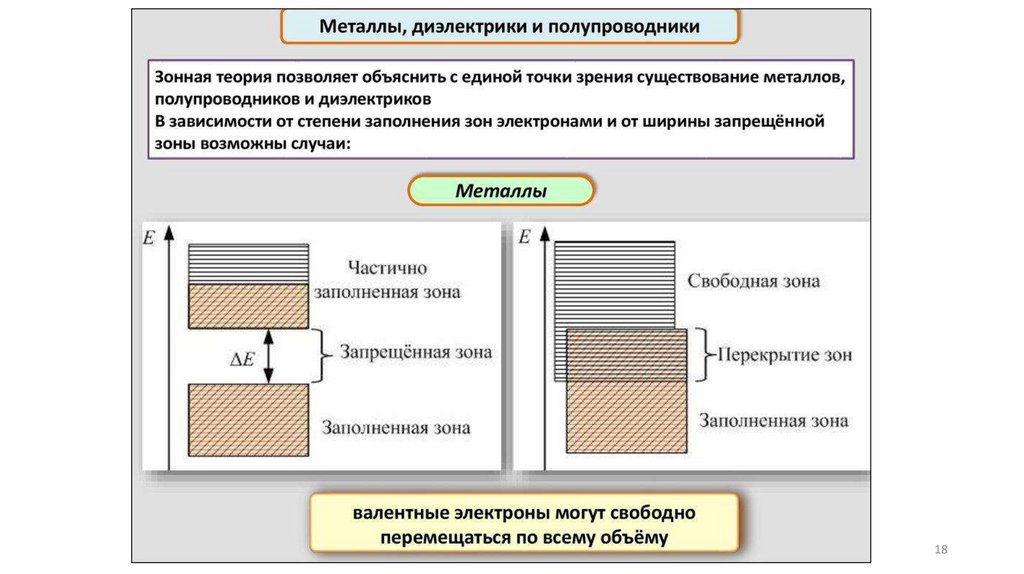
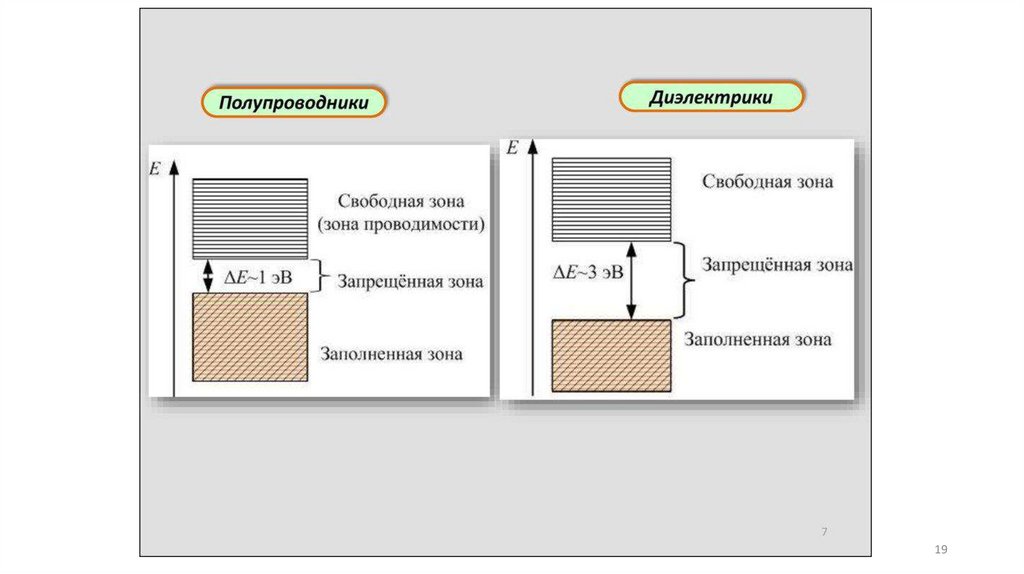
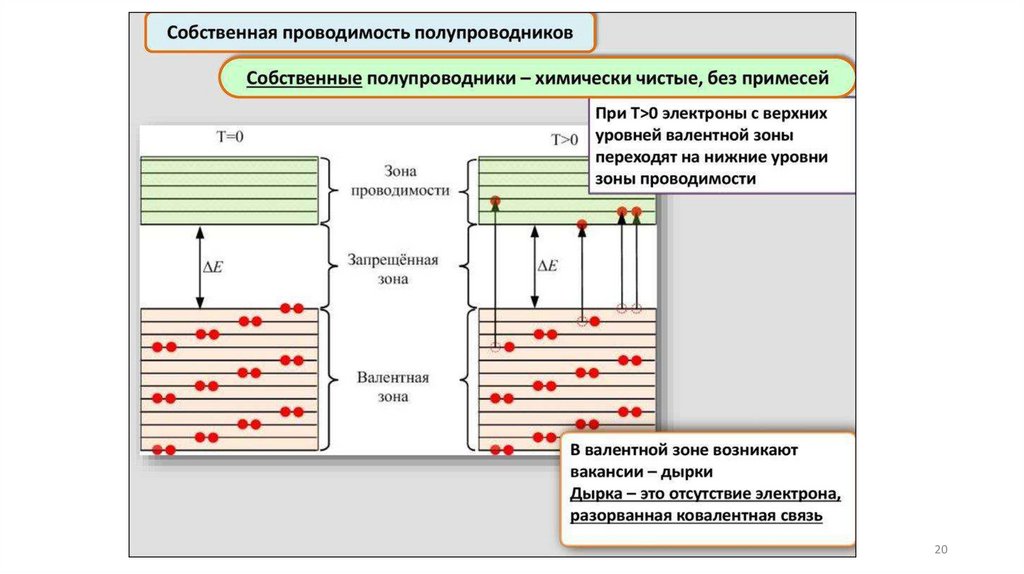
Зонная модель –квантовомеханическая теория движения электрон
в твердом теле
В соответствии с квантовой механикой свободные электроны могу
иметь любую энергию — их энергетический спектр непрерывен.
Электроны, принадлежащие изолированным атомам, имею
определённые дискретные значения энергии. В твёрдом тел
энергетический спектр электронов состоит из отдельных
разрешённых энергетических зон, разделённых зонами запрещённ
энергий.
14























 Химия
Химия








