Похожие презентации:
Классификация неорганических соединений (по составу)
1.
Классификациянеорганических соединений
(по составу)
2.
ВЕЩЕСТВО –то из чего состоит физическое тело
3.
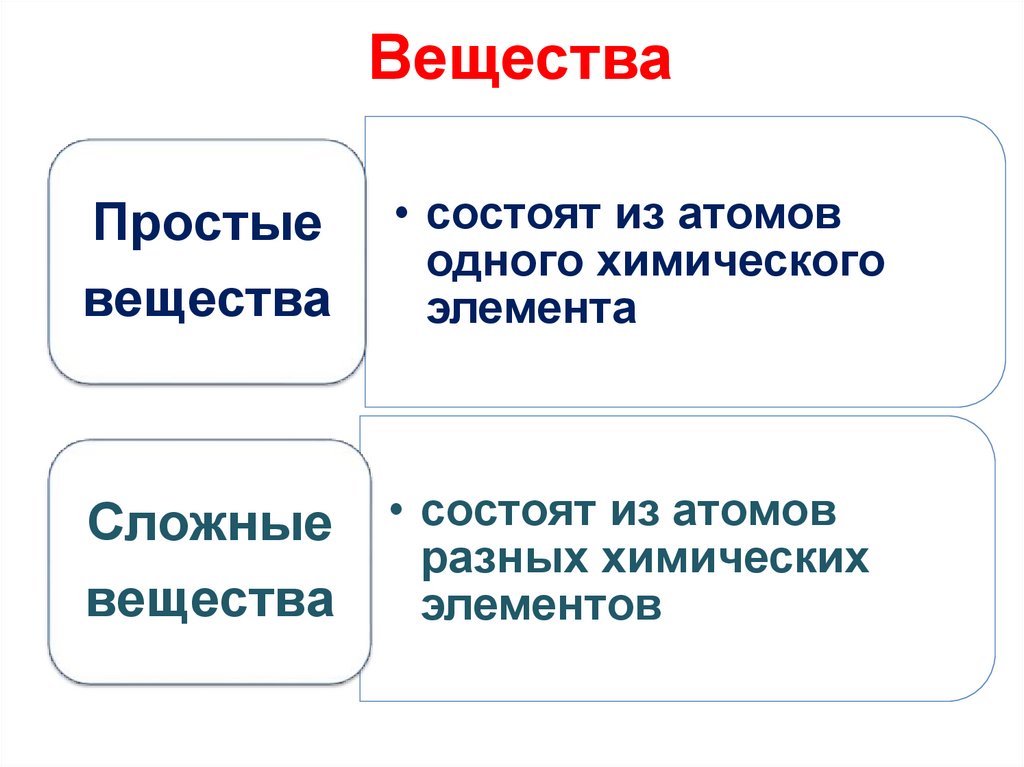
ВеществаПростые
вещества
• состоят из атомов
одного химического
элемента
Сложные • состоят из атомов
разных химических
вещества
элементов
4.
Простыевещества
МЕТАЛЛЫ – простые вещества,
образованные химическим
элементом – металлом
ПРИМЕР: Fe, Na, Ag, Hg…
НЕМЕТАЛЛЫ – простые вещества,
образованные химическим
элементом – неметаллом
ПРИМЕР: H2, O2, O3, S8, C, …
5.
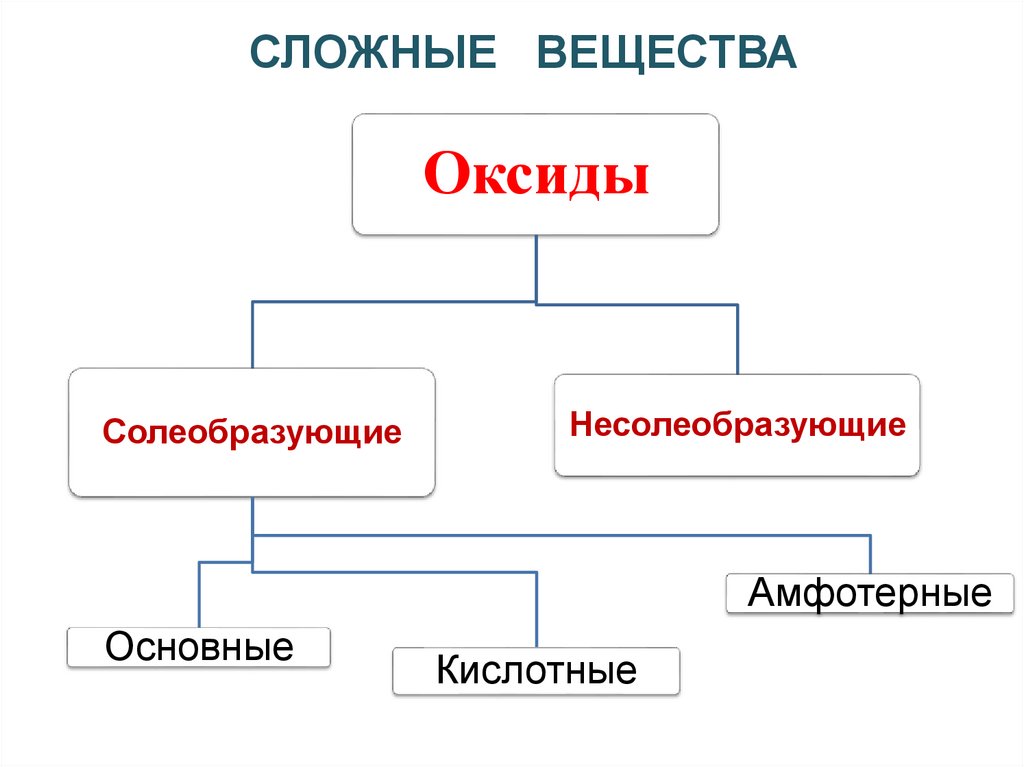
СЛОЖНЫЕ ВЕЩЕСТВАОксиды
- сложные вещества, состоящие из двух
химических элементов, один из которых
кислород.
II
Общая формула: ЭаOв
6.
СЛОЖНЫЕ ВЕЩЕСТВАОксиды
Солеобразующие
Несолеобразующие
Амфотерные
Основные
Кислотные
7.
СЛОЖНЫЕ ВЕЩЕСТВАНесолеобразующие оксиды
- оксиды, которые не взаимодействуют ни со
щелочами, ни с кислотами и не образуют
солей.
Их немного, в их состав входят неметаллы.
СО – оксид углерода (II), угарный газ
NO - оксид азота (II)
N2O - оксид азота (I), веселящий газ
8.
СЛОЖНЫЕ ВЕЩЕСТВАСолеобразующие оксиды
- оксиды, которые взаимодействуют с кислотами
или основаниями и образуют при этом соль и
воду.
9.
Солеобразующие оксидыОсновные Амфотерные Кислотные
II
ЭаOв
II
ЭаOв
II
ЭаOв
где Э – это
металлы с
валентностью
I или II
Кроме
ZnO, BeO
где Э – это
металлы с
валентностью
III или IV
А так же
ZnO, BeO
где Э – это
1) металлы с
валентностью
V, VI, VII
2) неметаллы
ПРИМЕР:
ПРИМЕР:
BaO – оксид бария
Na2O – оксид натрия
Al2O3 – оксид алюминия серы (VI)
СO2 – оксид
ZnO – оксид цинка
углерода (IV)
PbO2 Mn2O7 – оксид
оксид свинца ( IV)
ПРИМЕР:
SO3 – оксид
марганца (VII)
10.
СЛОЖНЫЕ ВЕЩЕСТВАОснования
- это сложные вещества, состоящие из атомов
металла и одной или нескольких гидроксогрупп
(-ОН)
ОБЩАЯ ФОРМУЛА
у
I
ПРИМЕР:
NaOH –
у
гидроксид натрия
Ba(OH)2 –
где у – число гидроксогрупп,
равное валентности металла (Ме) гидроксид бария
Ме(ОН)
У = I или II
КРОМЕ:
Zn(OH)2, Be(OH)2
11.
Классификация основанийпо растворимости в воде
Основания
хорошо растворимые и мало
растворимые в воде
ЩЁЛОЧИ
KOH, NaOH, Ca(OH)2,
Sr(OH)2
нерастворимые в воде
Cu(OH)2,
Mg(OH)2
12.
СЛОЖНЫЕ ВЕЩЕСТВААмфотерные гидроксиды
- это сложные вещества, состоящие из атомов
металла и одной или нескольких гидроксогрупп
(-ОН)
ОБЩАЯ ФОРМУЛА
у
I
ПРИМЕР:
Al(OH)3 –
у
гидроксид алюминия
Pb(OH)4 –
где у – число гидроксогрупп,
равное валентности металла (Ме) гидроксид свинца (IV)
Ме(ОН)
У = III или IV
А так же:
Zn(OH)2, Be(OH)2
13.
СЛОЖНЫЕ ВЕЩЕСТВАКислоты- это сложные вещества, состоящие
из атомов водорода соединенных с кислотным
остатком.
ОБЩАЯ ФОРМУЛА
I
х
НхКО
где х – число атомов водорода в
молекуле и валентность кислотного
остатка (КО)
14.
Кислоты (НхКО)Название кислоты
Формула кислоты
Серная кислота
Сернистая кислота
Азотная кислота
Азотистая кислота
Фосфорная кислота
Угольная кислота
Кремниевая кислота
Йодоводородная кислота
Бромоводородная кислота
Соляная кислота
Плавиковая кислота
Сероводородная кислота
ЗНАТЬ НАИЗУСТЬ!!!
H2SO4
H2SO3
HNO3
HNO2
H3PO4
H2CO3
H2SiO3
HI
HBr
HCl
HF
H2S
15.
Соответствие между солеобразующимиоксидами и кислотой, основанием и
амфотерным гидроксидом
16.
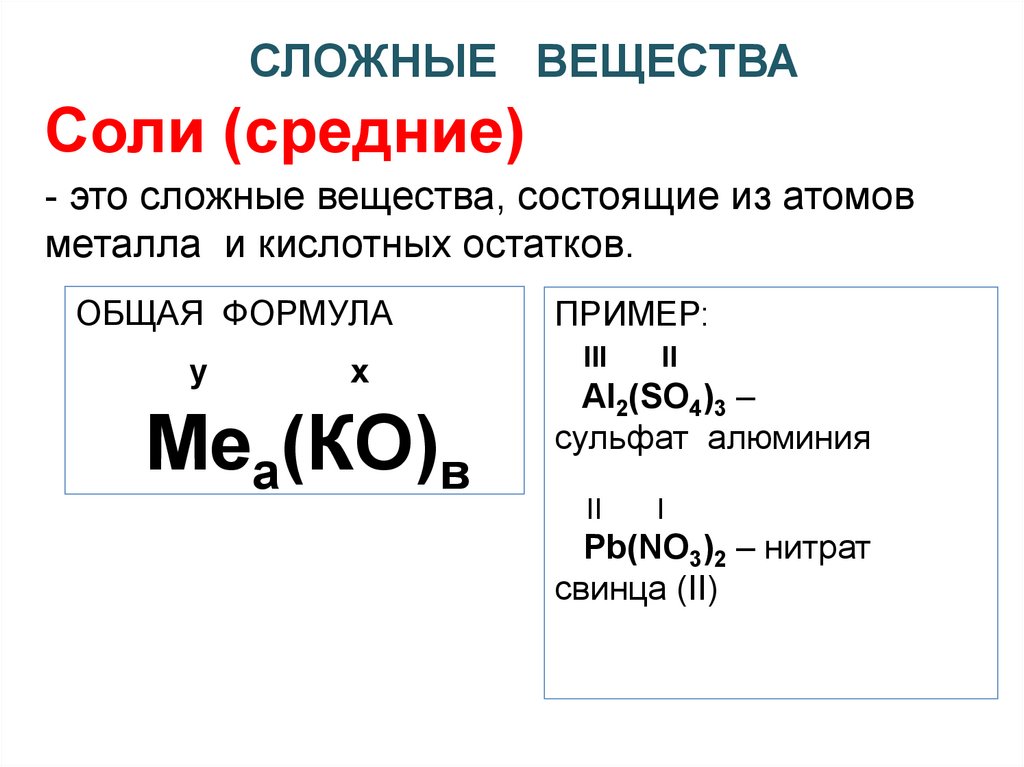
СЛОЖНЫЕ ВЕЩЕСТВАСоли (средние)
- это сложные вещества, состоящие из атомов
металла и кислотных остатков.
ОБЩАЯ ФОРМУЛА
у
х
Меа(КО)в
ПРИМЕР:
III
II
Al2(SO4)3 –
сульфат алюминия
II
I
Pb(NO3)2 – нитрат
свинца (II)
17.
Кислотныйостаток
SO4
SO3
NO3
NO2
PO4
CO3
SiO3
I
Br
Cl
F
S
Валентность
кислотного
остатка
II
II
I
I
III
II
II
I
I
I
I
II
Название
кислотного
остатка
сульфат
сульфит
нитрат
нитрит
фосфат
карбонат
силикат
йодид
бромид
хлорид
фторид
сульфид
ЗНАТЬ НАИЗУСТЬ!!!














 Химия
Химия








