Похожие презентации:
Общая характеристика ацетиленовых углеводородов. Занятие 28
1.
Занятие 28Общая характеристика
ацетиленовых
углеводородов
2.
СодержаниеМодуль 1. Понятие, распространение
ацетиленовых углеводородов (алкинов)
Модуль 2. Классификация и номенклатура
алкинов
Модуль 3. Физические свойства алкинов
Модуль 4. Химические свойства алкинов
Модуль 5. Применение и способы получения
алкинов
3.
Модуль 1. Понятие, распространение алкиновАлкины (ацетиленовые углеводороды) —
ациклические непредельные углеводороды,
содержащие одну тройную связь между
атомами углерода, образующие гомологический
ряд с общей формулой CnH2n-2
Атомы углерода при тройной связи находятся в
состоянии sp-гибридизации и имеют валентный
угол 180°.
Простейшим алкином является ацетилен
(C2H2).
⃰ Ацетилен был получен трижды: в 1836 г Эдмундом
Дэви(англ), при нагревании уксуснокислого калия с древесным
углём и последующей реакцией с водой образовавшегося
карбида калия; в 1862 г Ф. Вёлер (нем.) взаимодействие водой
на карбид кальция; в 1863 г химик М. Бертло (фр) пропуская водород над раскалёнными электрической
дугой графитовыми электродами. Именно он дал газу имя
«ацетилен» (от латинских слов acetum — «уксус» и
греческого иле — «дерево»).
В природе алкины практически не встречаются.
В некоторых видах грибов Basidiomycetes были
обнаружены в крайне малом количестве
соединения, содержащие полиацетиленовые
структуры.
Ацетилен обнаружен в атмосфере планетгигантов: Юпитера, Сатурна, Урана
Алкины обладают слабым наркозным
действием. Жидкие алкины вызывают судороги.
4.
Модуль 2. Классификация и номенклатура алкинов• По номенклатуре «IUPAC»,
названия алкинов
образуются от названий
соответствующих алканов
заменой суффикса «-ан» на
«-ин»; положение тройной
связи указывается арабской
цифрой.
• Терминальные алкины –
алкины, содержащие
концевую тройную связь.
Внутренние алкины –
алкины, содержащие тройную
связь внутри молекулы.
• Главная цепь должна
включать в себя тройные
связи, а нумерация
проводится так, чтобы они
получили наименьшие
номера.
5.
Модуль 3. Физические свойства алкинов• Низшие алкины (до С4 включительно) –
бесцветные газы. Средние алкины (до
С16) – бесцветные жидкости.
Высшие алкины (от С16 ) – твердые
вещества.
• Низшие алкины без запаха или слабым
запахом (ацетилен – с «чесночным»),
средние и высшие - с характерным
резким запахом.
• С ростом молекулярной массы
температуры кипения и плавления
повышаются.
• Наличие тройной связи в цепи приводит к
повышению температуры кипения,
плотности и растворимости их в воде.
• Алкины плохо растворимы в воде, но
хорошо растворимы во многих
органических растворителях.
• Алкины легче воды.
• Ацетилен взрывоопасен!
6.
Модуль 4. Химические свойства алкиновРеакции присоединения алкинов:
Окисление алкинов:
Горение алкинов:
2CH≡CH + 5O2 → 4CO2+ 2H2O.
Строение и свойства тройной связи
определяют характерные химические свойства
алкинов. Для алкинов характерны следующие
химические свойства:
• Реакции присоединения, протекающие по
нуклеофильному механизму:
• гидрирование — присоединение воды;
– галогенирование — присоединение
галогенов;
–гидрогалогенирование — присоединение
галогеноводородов.
•Наличие слабых кислотных свойств для
алкинов с концевой тройной связью. Такие
алкины способны образовывать соли при
взаимодействии с активными металлами.
•Реакции окисления и восстановления. Так,
алкины легко окисляются перманганатом
калия. В результате этой реакции образуются
карбоновые кислоты.
•Присоединение молекул водорода в
присутствии металлических
катализаторов.
7.
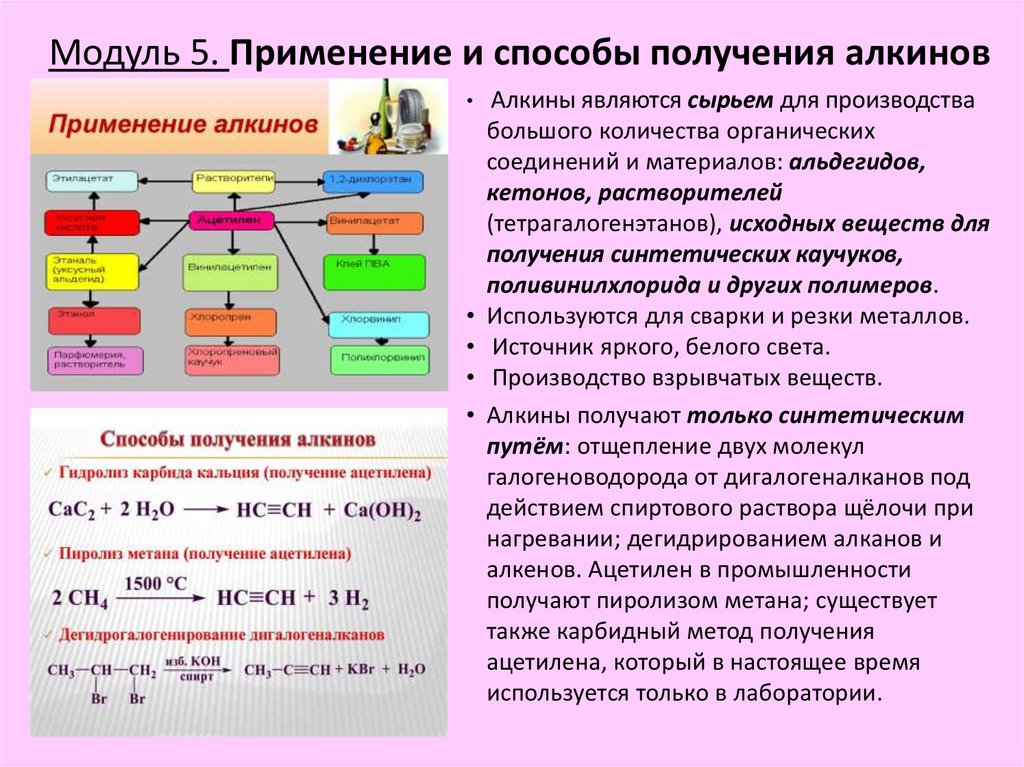
Модуль 5. Применение и способы получения алкиновАлкины являются сырьем для производства
большого количества органических
соединений и материалов: альдегидов,
кетонов, растворителей
(тетрагалогенэтанов), исходных веществ для
получения синтетических каучуков,
поливинилхлорида и других полимеров.
• Используются для сварки и резки металлов.
• Источник яркого, белого света.
• Производство взрывчатых веществ.
• Алкины получают только синтетическим
путём: отщепление двух молекул
галогеноводорода от дигалогеналканов под
действием спиртового раствора щёлочи при
нагревании; дегидрированием алканов и
алкенов. Ацетилен в промышленности
получают пиролизом метана; существует
также карбидный метод получения
ацетилена, который в настоящее время
используется только в лаборатории.






 Химия
Химия








