Похожие презентации:
Біоорганічна хімія як наука. Класифікація та будова біоорганічних сполук
1. 2021р. Лекція № 1 Біоорганічна хімія як наука. Класифікація та будова біоорганічних сполук
2.
1. Предмет і значення біоорганічної хімії2. Класифікація біоорганічних речовин
3. Ізомерія органічних сполук
Просторова будова та хімічний зв’язок в органічних
молекулах (ПСРС)
Будова галогенопохідних вуглеводнів та їх медико-біологічне
значення(ПСРС)
3.
– це наука, яка вивчає будову, властивостіта біологічну роль біоорганічних сполук,
які беруть участь в обміні речовин
організму людини
- вирішення на молекулярному рівні
фундаментальних загально-біологічних завдань, а
основне серед них – це проблема залежності
людини від зовнішнього оточення
4.
1.Біополімери – складні вуглеводи, білки, НК.2.Біорегулятори – вітаміни, гормони та інші
біологічноактивні речовини, лікарські препарати.
1. Будова карбонового скелету
2. Природа функціональної групи
5.
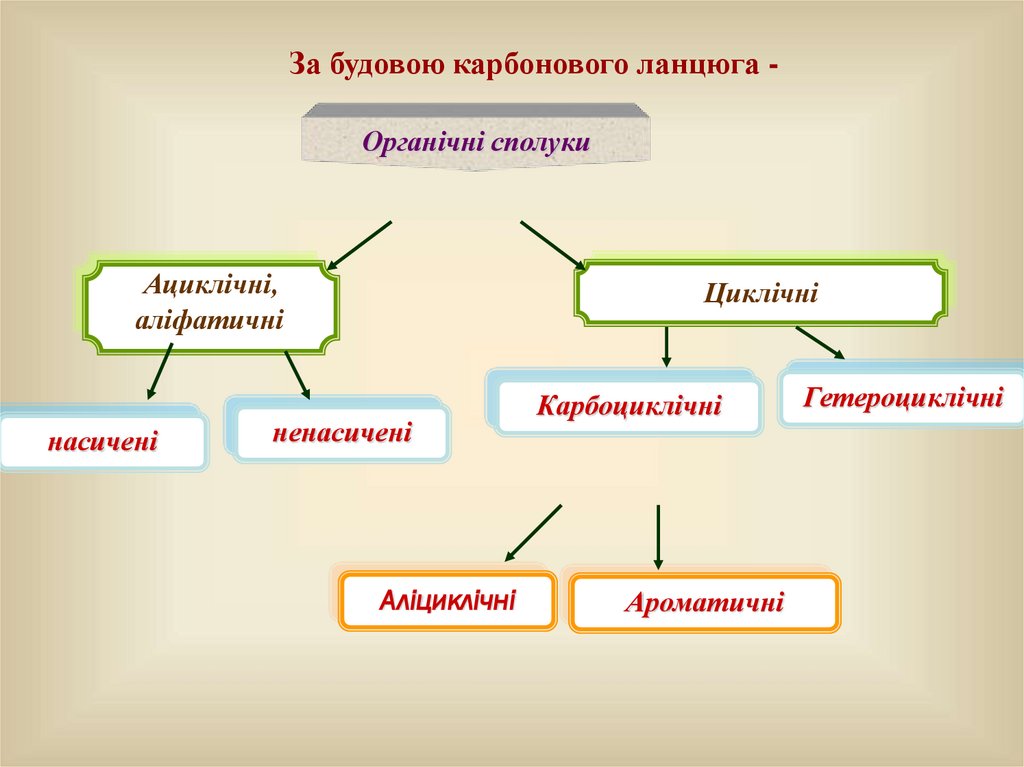
За будовою карбонового ланцюга Органічні сполукиАциклічні,
аліфатичні
насичені
Циклічні
ненасичені
Аліциклічні
Карбоциклічні
Ароматичні
Гетероциклічні
6.
За природою функціональної групи:Функціональна група та Класи органічних сполук
її назва
-ОН(гідроксильна)
Спирти, феноли
С=О(карбонільна)
Альдегіди і кетони
- СООН(карбоксильна)
Карбонові кислоти
- SO3H(сульфогрупа)
Сульфокислоти
- NO2 (нітрогрупа)
Нітропохідні
- NH2(аміногрупа)
Аміни
- CN(нітрильна)
Нітрили
7.
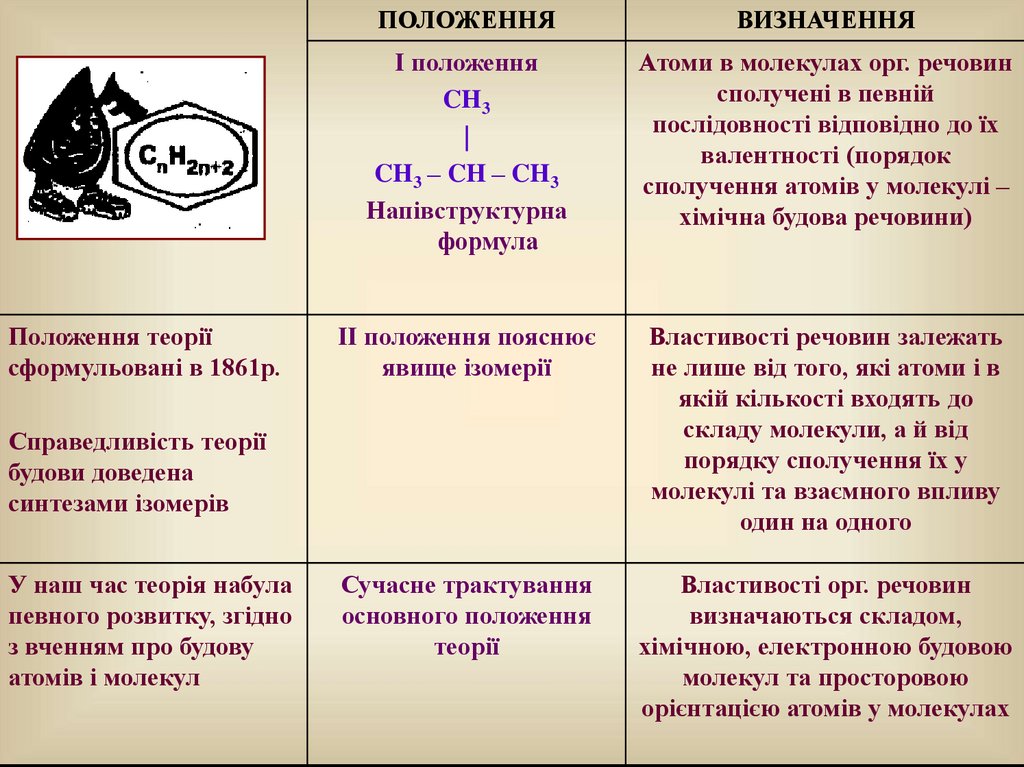
Положення теоріїсформульовані в 1861р.
ПОЛОЖЕННЯ
ВИЗНАЧЕННЯ
І положення
CH3
|
CH3 – CH – CH3
Напівструктурна
формула
Атоми в молекулах орг. речовин
сполучені в певній
послідовності відповідно до їх
валентності (порядок
сполучення атомів у молекулі –
хімічна будова речовини)
ІІ положення пояснює
явище ізомерії
Властивості речовин залежать
не лише від того, які атоми і в
якій кількості входять до
складу молекули, а й від
порядку сполучення їх у
молекулі та взаємного впливу
один на одного
Сучасне трактування
основного положення
теорії
Властивості орг. речовин
визначаються складом,
хімічною, електронною будовою
молекул та просторовою
орієнтацією атомів у молекулах
Справедливість теорії
будови доведена
синтезами ізомерів
У наш час теорія набула
певного розвитку, згідно
з вченням про будову
атомів і молекул
8.
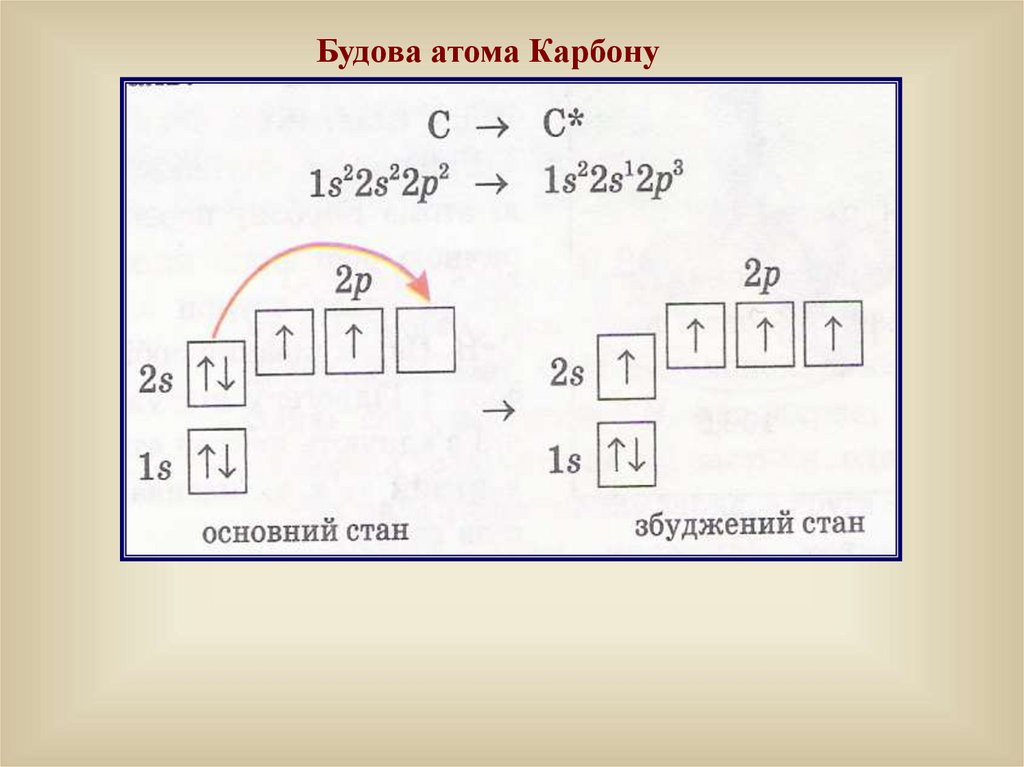
На відміну від неорганічних речовин органічні сполуки мають деякіхарактерні особливості:
а) атоми Карбону знаходяться у збудженому стані;
б) у Карбону число валентних електронів збігається з числом
валентних орбіталей; це – єдиний елемент, атоми якого
можуть з’єднуватись один з одним, утворюючи кільця і
ланцюги (нерозгалужені чи розгалужені)
в) зв’язок –С-С- ковалентний неполярний. зв’язки з іншими
елементами також переважно ковалентні, малополярні.
9.
Гомологічний ряд алканівЗагальна формула – СnН2n+2
10.
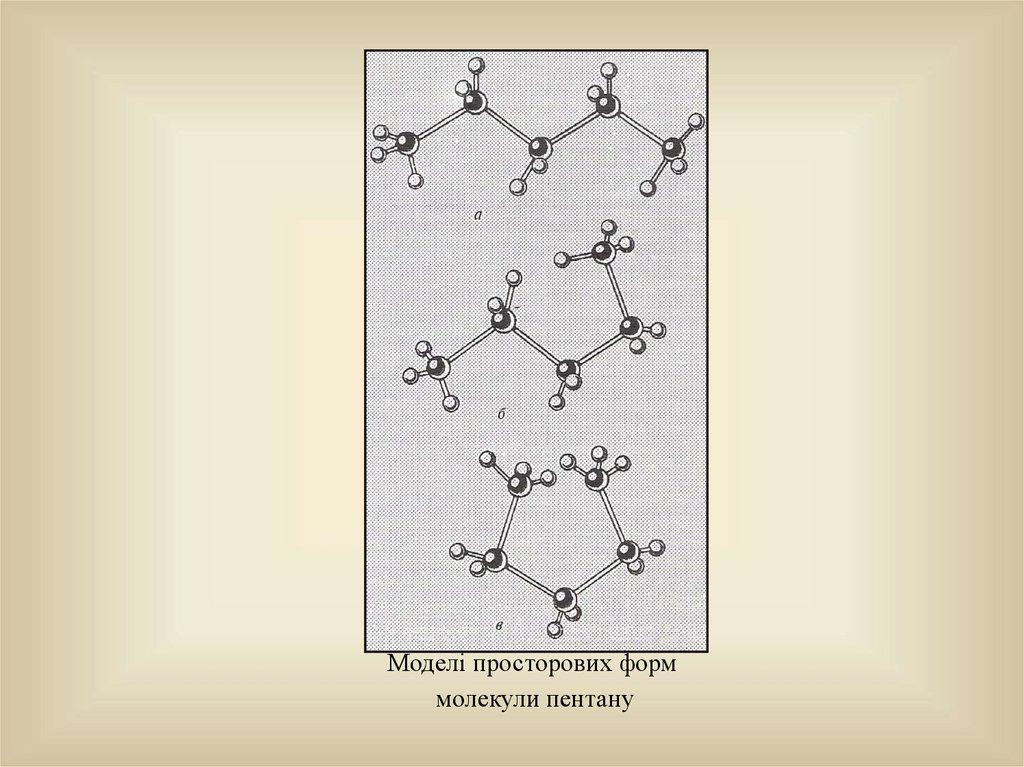
Моделі просторових форммолекули пентану
11.
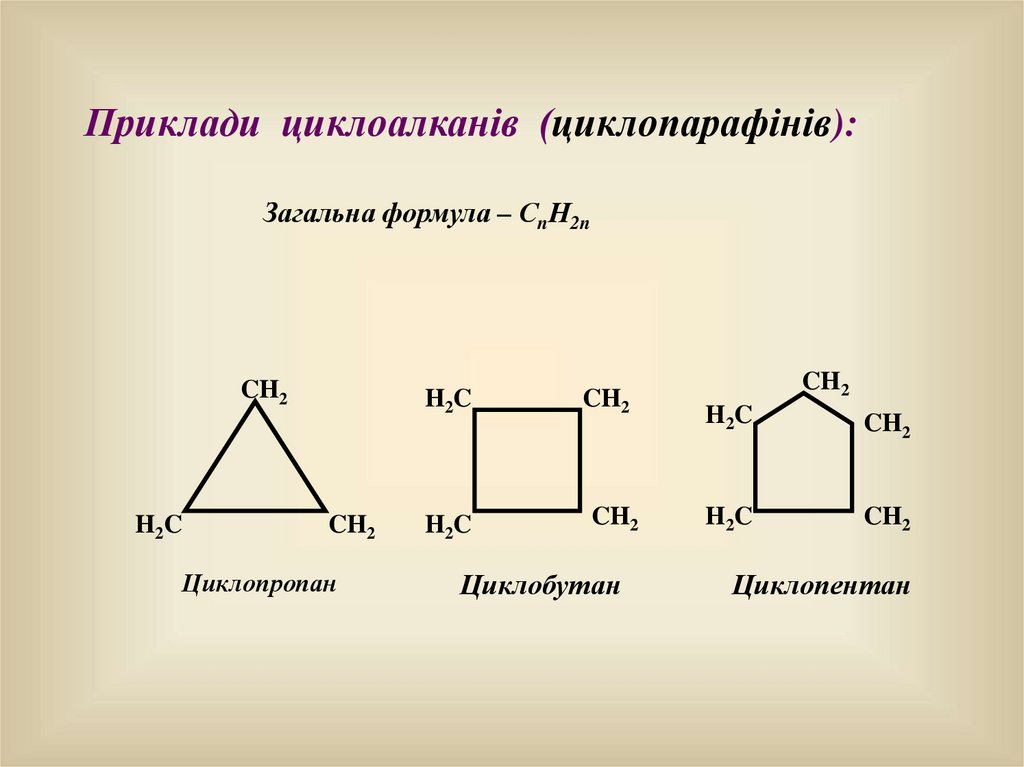
Приклади циклоалканів (циклопарафінів):Загальна формула – СnН2n
CH2
H2C
CH2
Циклопропан
H2C
CH2
H2C
CH2
Циклобутан
CH2
H2C
CH2
H 2C
CH2
Циклопентан
12.
Будова атома Карбону13.
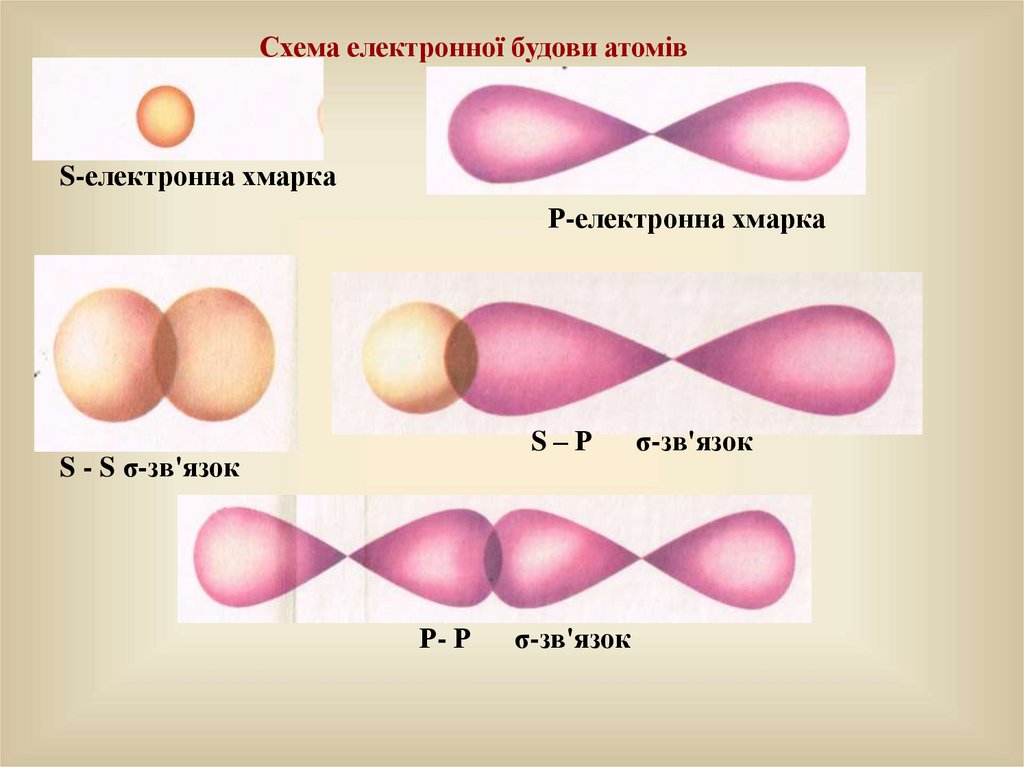
Схема електронної будови атомівS-електронна хмарка
Р-електронна хмарка
S–Р
S - S σ-зв'язок
Р- Р
σ-зв'язок
σ-зв'язок
14.
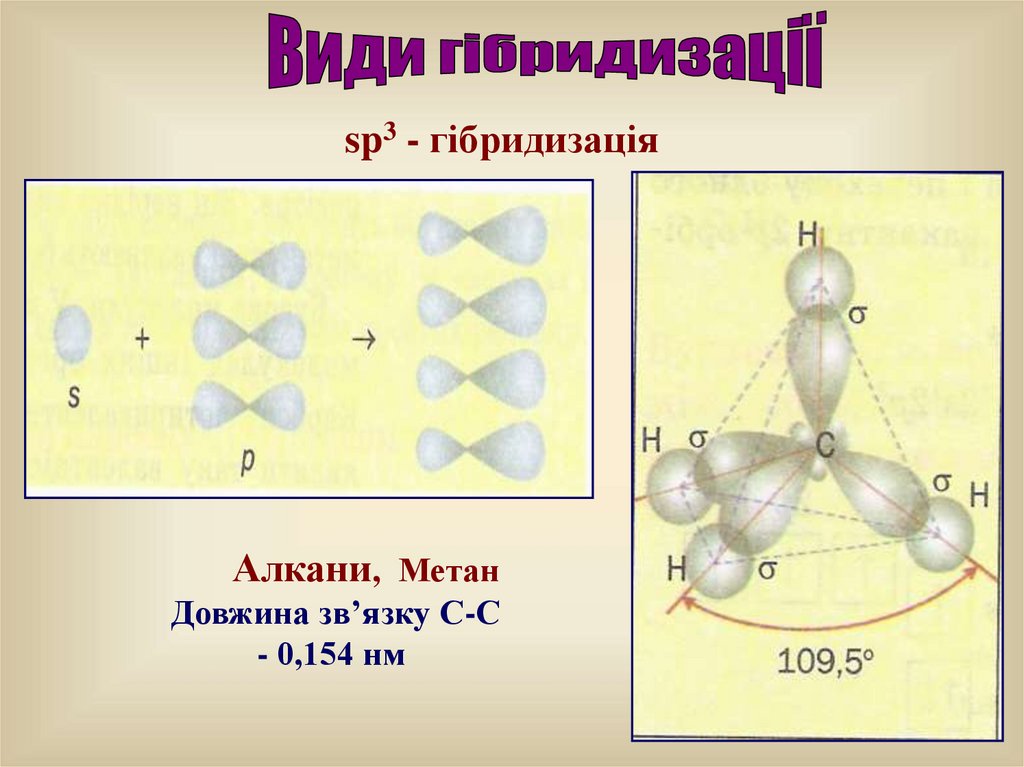
– вирівнювання взаємодіючих орбіталей різнихпідрівнів за формою та енергією.
Число гібридних орбіталей дорівнює числу
початкових орбіталей, що зазнали гібридизації.
Форми нових орбіталей відрізняються від тих, що
зазнали гібридизації.
15.
sp3 - гібридизаціяАлкани, Метан
Довжина зв’язку С-С
- 0,154 нм
16.
17.
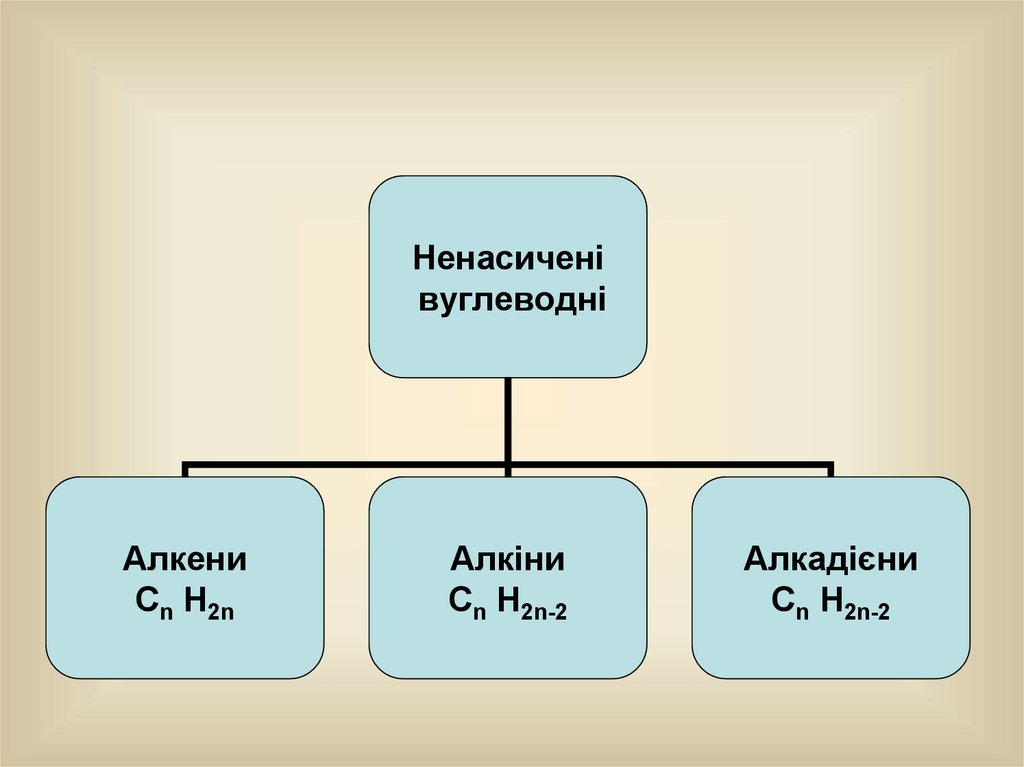
Ненасиченівуглеводні
Алкени
Сn Н2n
Алкіни
Сn Н2n-2
Алкадієни
Сn Н2n-2
18.
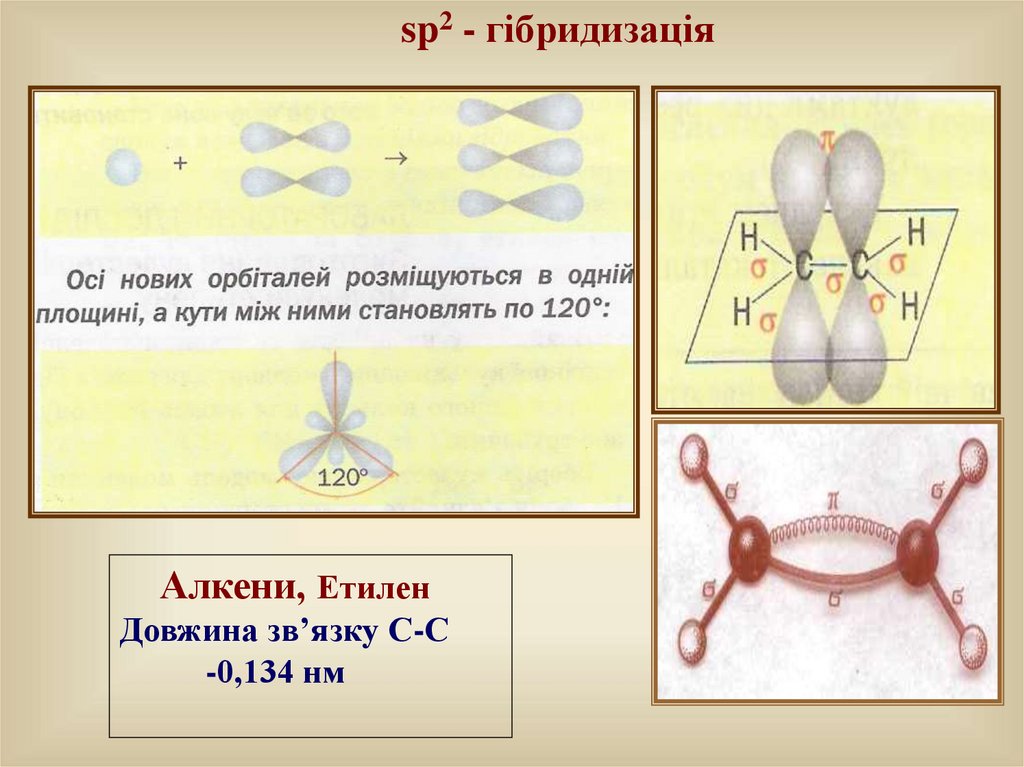
sp2 - гібридизаціяАлкени, Етилен
Довжина зв’язку С-С
-0,134 нм
19.
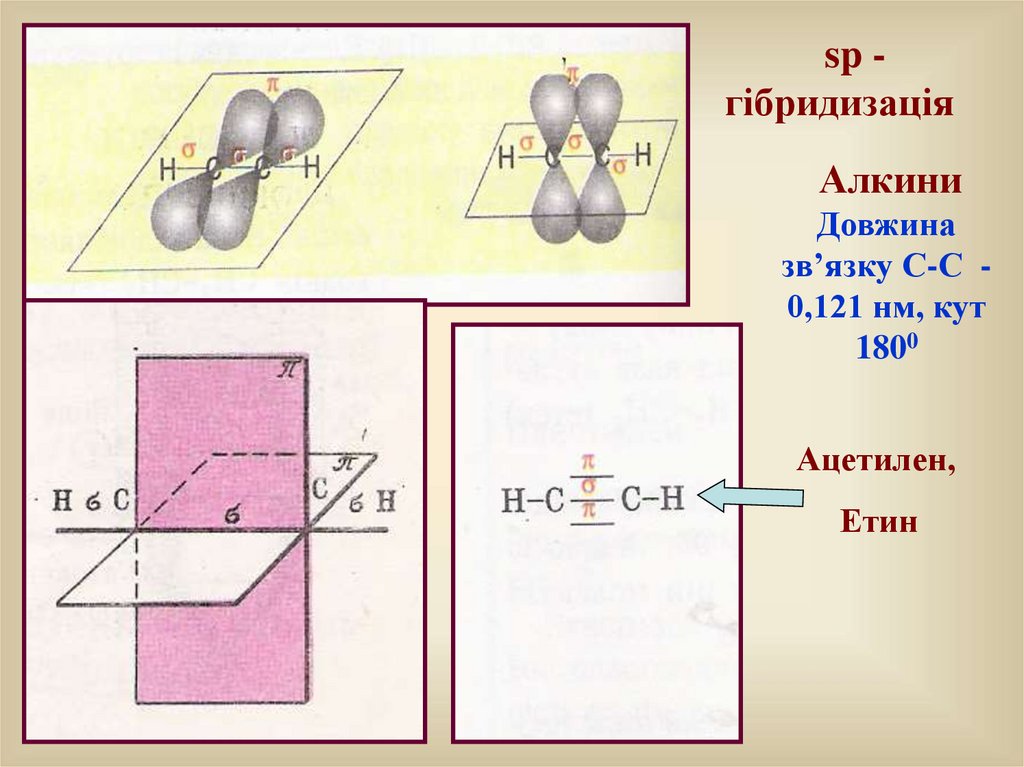
sp гібридизаціяАлкини
Довжина
зв’язку С-С 0,121 нм, кут
1800
Ацетилен,
Етин
20.
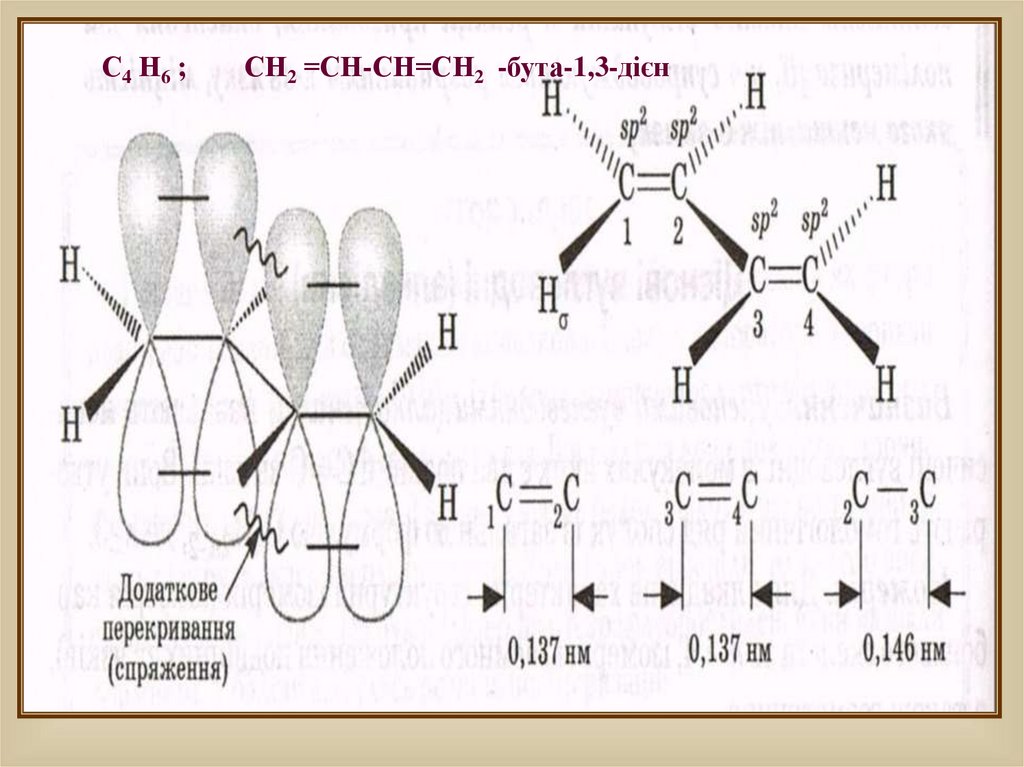
С 4 Н6 ;СН2 =СН-СН=СН2 -бута-1,3-дієн
21.
Алкільні радикали та їх утворенняНазва
вуглеводню
Метан
Формула
Назва радикалу Формула
СН4
Метил
СН3·, СН3-
Етан
С2Н6
Етил
С2Н5·, С2Н5-
Пропан
С3Н8
Пропіл
С3Н7·, С3Н7-
Бутан
С4Н10
Бутил
С4Н9·, С4Н9-
Пентан
С5Н12
Пентил, аміл
С5Н11·, С5Н11-
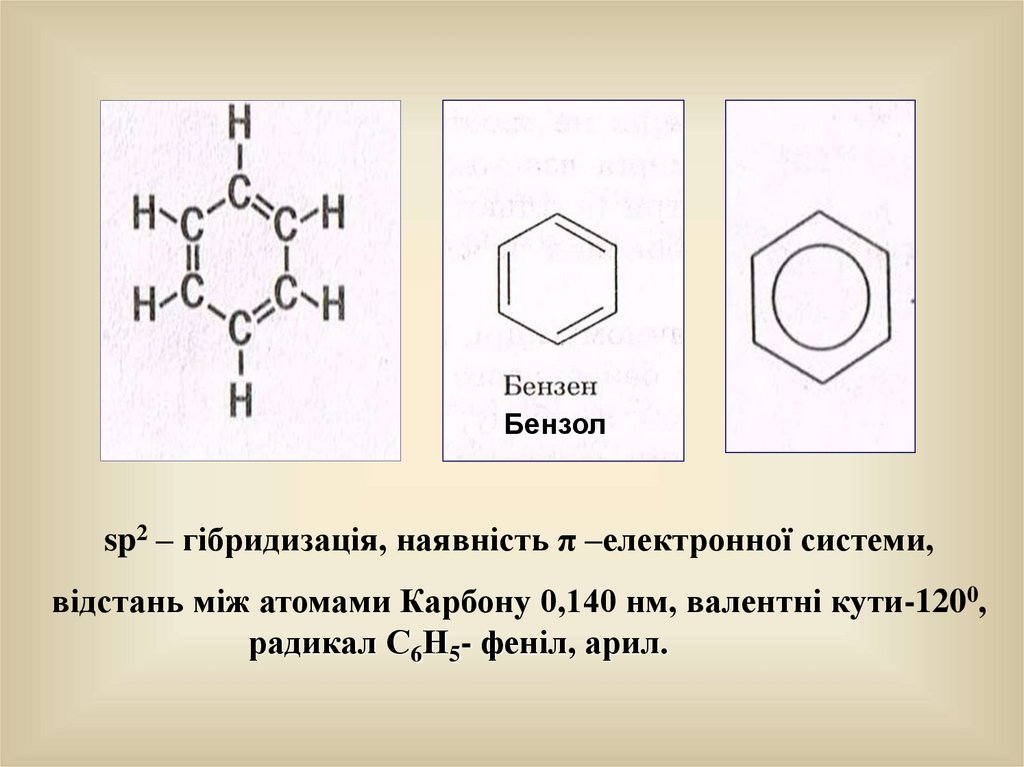
22.
Бензолsp2 – гібридизація, наявність π –електронної системи,
відстань між атомами Карбону 0,140 нм, валентні кути-1200,
радикал С6Н5- феніл, арил.
23.
1.Тривіальна(емпірична)2.Міжнародна IUPAK
Міжнародна(систематична) передбачає кілька
варіантів утворення назв органічних сполук.
Радикало-функціональна включає назву
радикалу та природу функціональної групи
певного класу органічних речовин.
СН3Br –метилбромід; С2Н5ОН-етиловий спирт.
24.
Замісники –електронодонорні та електроноакцепторні1роду (електронодонорні), або орто- і пара-орієнтанти
–NH2, -OH, –CH3 та інші радикали, -Cl, -Br, -J та сполуки, що
мають на одному з атомів неподілені пари електронів(NH3, NH2 –
R, Н2О, RОН).
ll роду(електроноакцепторні), або мета-орієнтанти
NO2 , -C≡N, SO3H, -CHO, -COOH.
-
25.
Основні правила складання назв по номенклатурі IUPAK.26.
Які речовини називають ізомерами?Два види ізомерії – структурна і просторова.
Структурна –
а) ізомерія карбонового скелету
б) ізомерія положення кратного зв’язку
або функціональної групи
с) ізомерія функціональних груп
27.
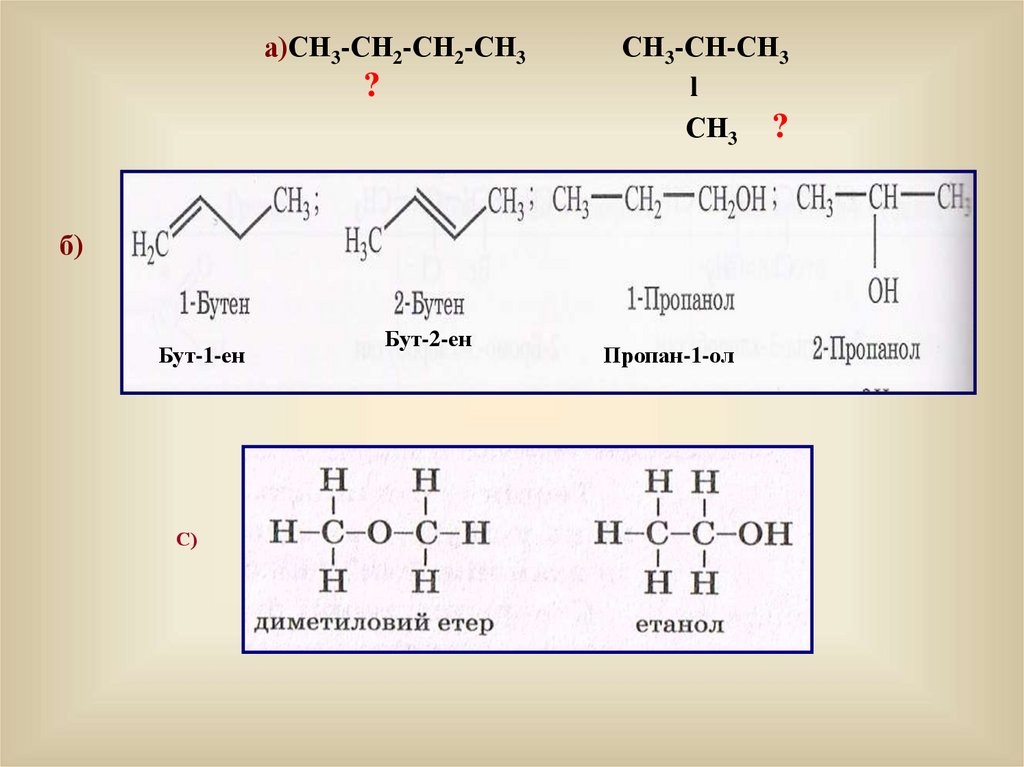
а)СН3-СН2-СН2-СН3?
СН3-СН-СН3
l
СН3 ?
б)
Бут-1-ен
С)
Бут-2-ен
Пропан-1-ол
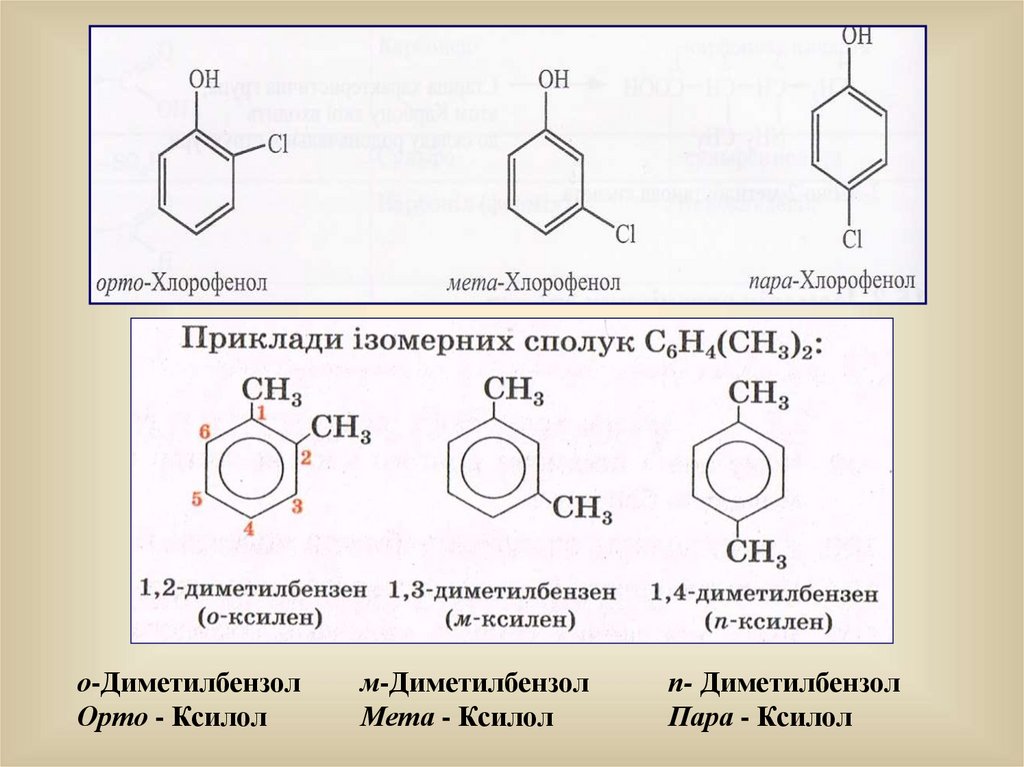
28.
о-ДиметилбензолОрто - Ксилол
м-Диметилбензол
Мета - Ксилол
п- Диметилбензол
Пара - Ксилол
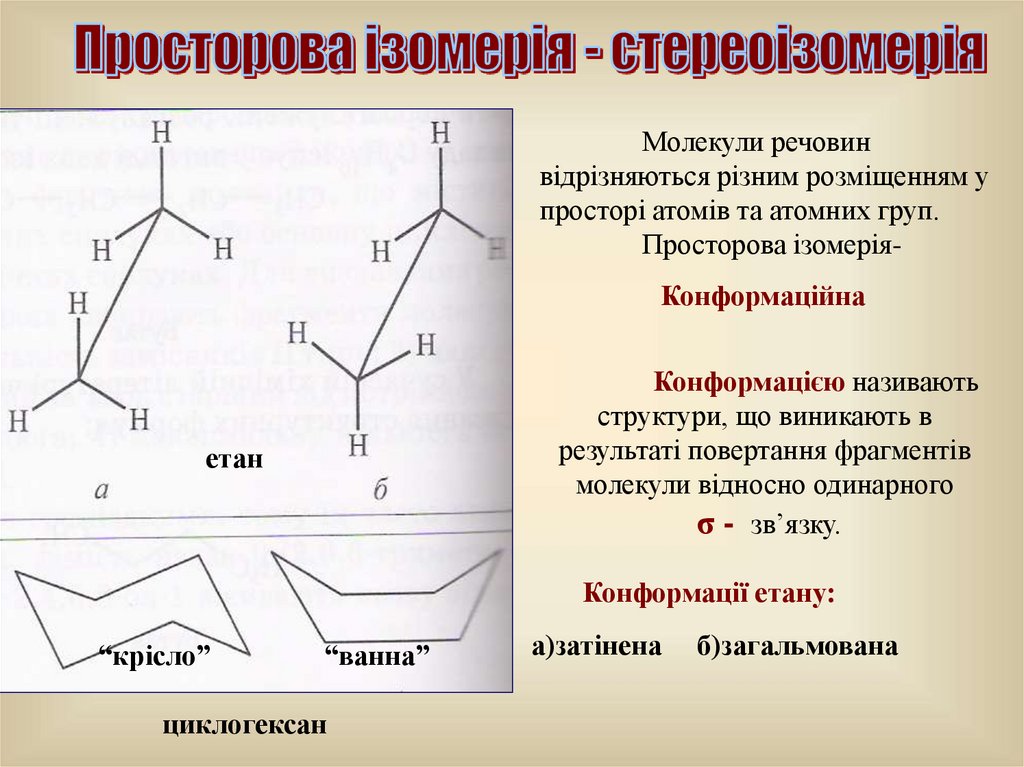
29.
Молекули речовинвідрізняються різним розміщенням у
просторі атомів та атомних груп.
Просторова ізомеріяКонформаційна
Конформацією називають
структури, що виникають в
результаті повертання фрагментів
молекули відносно одинарного
σ - зв’язку.
етан
Конформації етану:
“крісло”
“ванна”
циклогексан
а)затінена
б)загальмована
30.
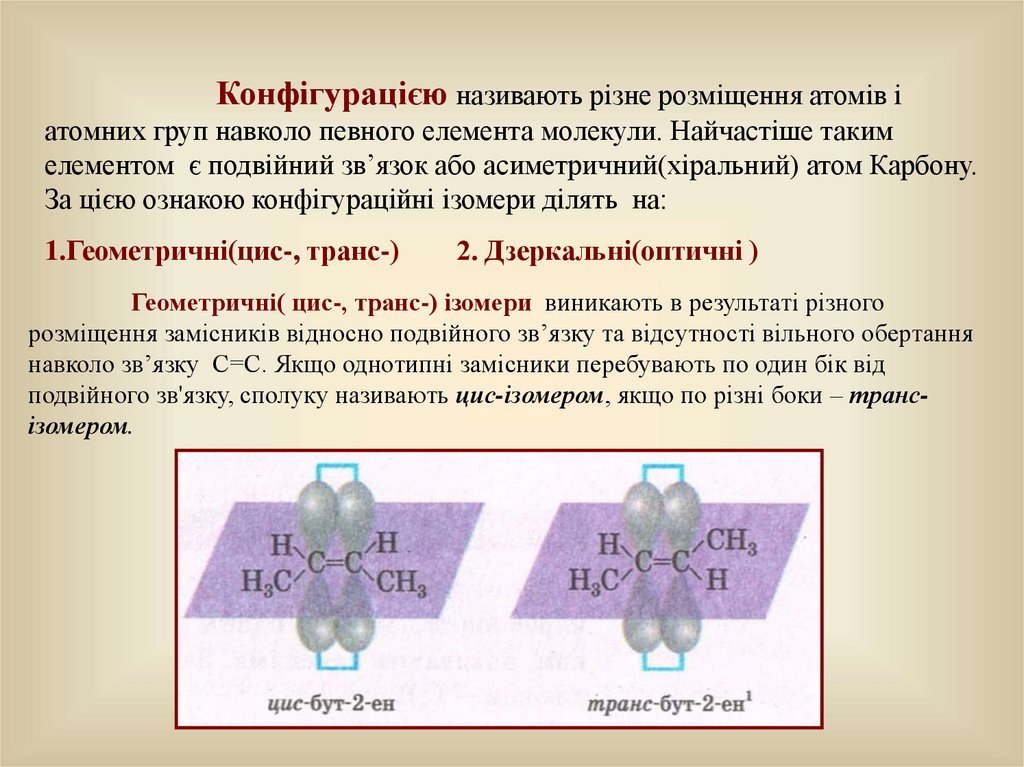
Конфігурацією називають різне розміщення атомів іатомних груп навколо певного елемента молекули. Найчастіше таким
елементом є подвійний зв’язок або асиметричний(хіральний) атом Карбону.
За цією ознакою конфігураційні ізомери ділять на:
1.Геометричні(цис-, транс-)
2. Дзеркальні(оптичні )
Геометричні( цис-, транс-) ізомери виникають в результаті різного
розміщення замісників відносно подвійного зв’язку та відсутності вільного обертання
навколо зв’язку С=С. Якщо однотипні замісники перебувають по один бік від
подвійного зв'язку, сполуку називають цис-ізомером, якщо по різні боки – трансізомером.
31.
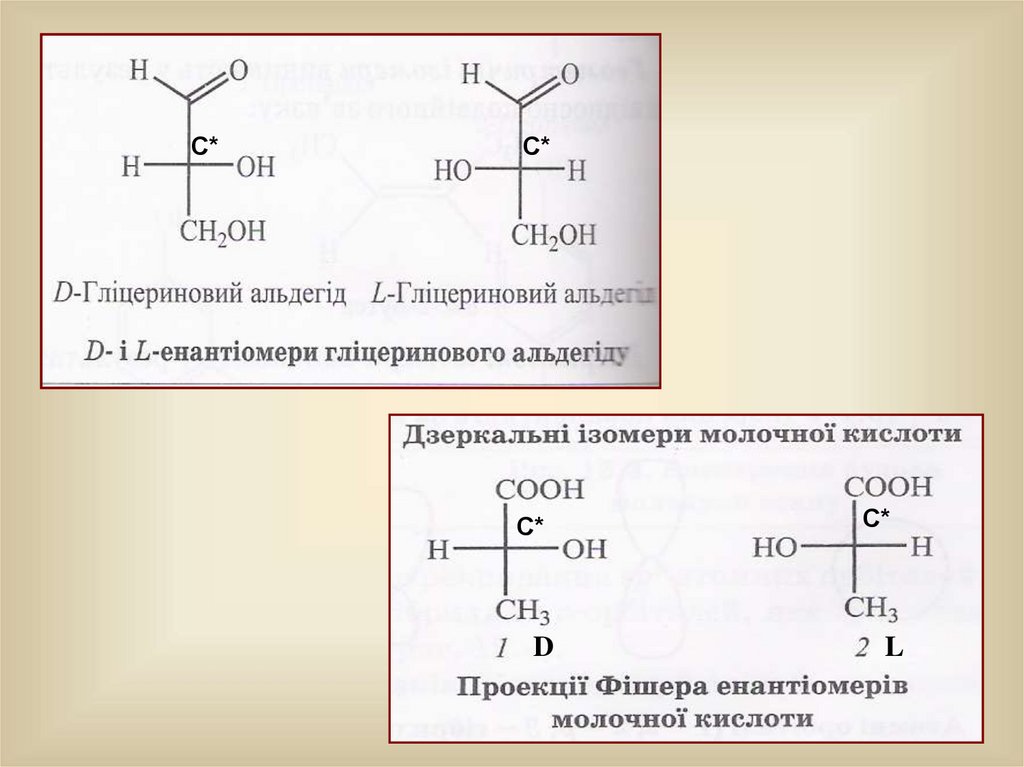
Дзеркальні ізомери виникають в результаті різного розміщенняелементів молекули навколо хірального атома Карбону (С*).
Хіральний-це атом, при якому всі чотири замісники є різними.
Дзеркальні ізомери називають енантіомерами. Вони
відрізняються один від одного як предмет і його дзеркальне відображення.
Правий і лівий стереоізомери дзеркально подібні між собою, але не сумісні, як
права і ліва рука, які не можна сумістити. Е Фішер запропонував для зручності
й простоти зображати стереоізомери проекційними формулами. За стандарт
було взято(+)-гліцериновий альдегід, якому була довільно приписана
конфігурація D –гідроксогрупа розміщена з правого боку від хірального атома
С*. Визначення конфігурації оптичних антиподів проводиться
експериментально.
Розглянемо будову гліцеринового альдегіду, формула якого С3Н6О3 :
С*
С*
32.
Сполуки, що містять асиметричний атом Карбону, є оптичноактивними.
Оптична активність – це здатність речовини обертати на
певний кут площину поляризації світла.
Так, один з енантіомерів гліцеринового альдегіду обертає
площину поляризації світла вправо, тому його називають Dгліцериновим альдегідом, а інший обертає площину поляризованого
світла – вліво, це
L – гліцериновий альдегід.
Стереоізомерія орг. сполук відіграє особливу роль в біохімії,
фармакології та медицині. Більшість орг речовин, які продукує організм у
процесах метаболізму, мають хіральну будову, пов’язану з
асиметричністю молекул. Фізіологічна активність багатьох лікарських
засобів тісно пов’язана з просторовою будовою. Явище оптичної
активності має велике біологічне значення, оскільки пов’язане з
асиметрією речовин, що входять до складу живих організмів
Гліцериновий альдегід взято як конфігураційний стандарт.
33.
С*С*
С*
С*
С*
С*
D
L
34.
Порівняння гомологічних рядів вуглеводнівГомологічний
ряд
Зв'язки в
молекулі
Суфікс у назві
Загальна ф-ла
вуглеводню
Алкани
Всі ординарні
(одинарні), –
-ан-
CnH2n+2
Циклоалкани
Одинарні,
замкнені в цикл
-ан-
CnH2n
Алкени
Один подвійний
зв'язок, =
-ен-
CnH2n
Алкіни
Один потрійний
зв’язок, ≡
-ін-
CnH2n-2
Алкадієни
Спряжений
зв′язок, = – =
- дієн
CnH2n-2
-ен-
CnH2n-6
Арени
Ароматичний
зв’язок
35.
Через трубку з нагрітим каталізатором (Al2O3)пропустили 200 г спирту й отримали 67,2 л (н.у.) етену.
Який відсоток спирту прореагував?
36.
1. Л.М.Миронович Біоорганічна хімія с.5-16.2. В.П.Музиченко Медична хімія с.339-349.
Реакційна здатність вуглеводнів та їхніх
похідних



















 Химия
Химия








