Похожие презентации:
Алюминий. Из истории открытия
1. АЛЮМИНИЙ
2. Из истории открытия
В период открытия алюминия металл был дороже золота.Англичане хотели почтить богатым
подарком великого русского химика
Д.И Менделеева, подарили ему
химические весы, в которых одна
чашка была изготовлена из золота,
другая - из алюминия. Чашка из
алюминия стала дороже золотой.
Полученное «серебро из глины»
заинтересовало не только учёных,
но и промышленников и даже
императора Франции.
3. АЛЮМИНИЙ. в природе только в составе соединений
По распространённости в природе занимает 1-есреди металлов и 3-е место среди элементов,
уступая только кислороду и кремнию.
4.
ПРИРОДНЫЕ СОЕДИНЕНИЯАЛЮМИНИЯ
Название соединения Формула
Каолинит (Глина)
Al2O3*2SiO2*H2O
Боксит
Al2O3*n H2O
Полевой шпат
K2O*Al2O3*6SiO2
Корунд, Рубин,
Сапфир
Al2O3
Нефелин
Na2O*Al2O3*2SiO2
5. ПРИМЕНЕНИЕ АЛЮМИНИЯ
6. Положение в Периодической системе
• Алюминий располагаетсяв 3 периоде, в главной
подгруппе 3 группы.
• Порядковый номер элемента –
13
• Относительная атомная масса –
27
• Алюминий – металл,
соединения которого обладают
амфотерными свойствами.
7.
2713
14
Al
13 – это заряд ядра (+Z),
- это число электронов (e -),
- это число протонов (p+)
27 – это атомный вес
элемента
14 – это число нейтронов (n0)
8. Строение атома алюминия
• Заряд ядра атома алюминия +13• В атоме 3 энергетических уровня
• Электронная оболочка атома алюминия содержит
s- и p-электроны
• На внешнем электронном уровне 3 электрона (2 –
спаренных s-электрона и 1 – неспаренный p-электрон)
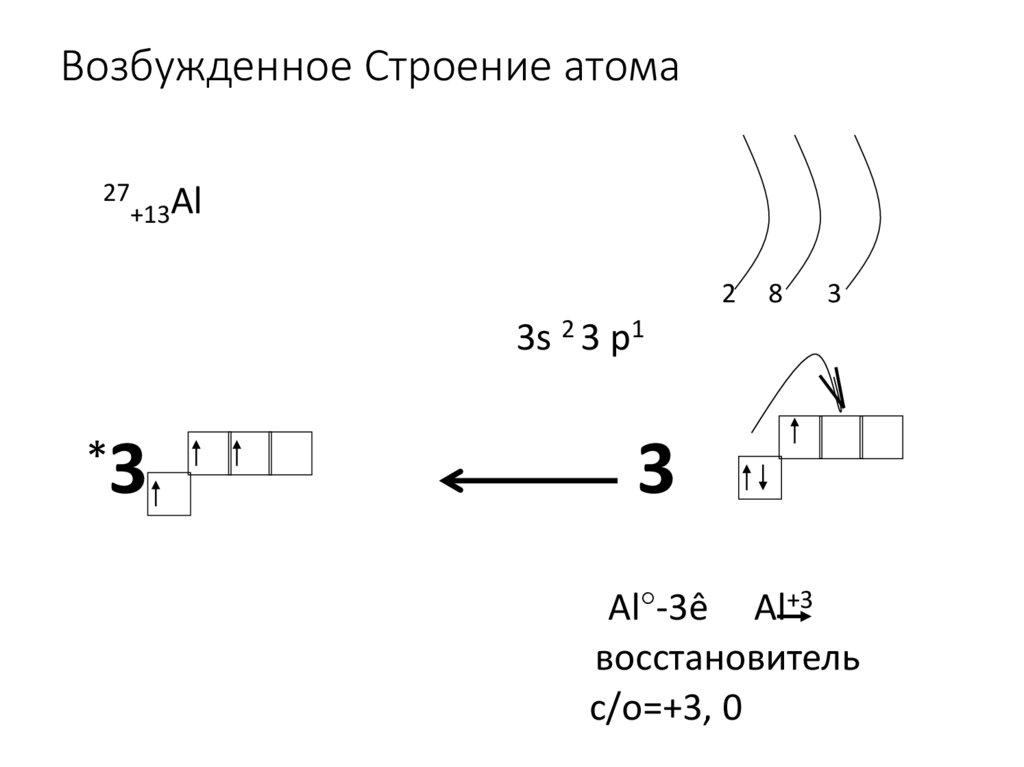
9. Возбужденное Строение атома
27+13Al
2
8
3
3s 2 3 p1
*
3
3
Al°-3ê Al+3
восстановитель
с/о=+3, 0
10. Физические свойства
• Металл серебристо-белого цвета,лёгкий,
плотность — 2,7 г/см³,
температура плавления +660 °C.
• Алюминий обладает
высокой электропроводностью
и теплопроводностью. Высокая
пластичность: прокатывается в
тонкий лист и даже фольгу.
• Особо чистый Аl хорошо
отражает солнечные лучи
11. Получение алюминия
• Впервые алюминий был получен датскимфизиком Гансом Эрстедом в 1825 году
действием амальгамы калия на хлорид
алюминия с последующей отгонкой ртути.
Название элемента образовано от
лат. aluminis — квасцы.
AlCl3 + 3K = 3KCl + Al
• В настоящее время алюминий получают
электролизом оксида:
эл.ток
2Al2O3 = 4Al + 3O2 – 3352 кДж
12. Химические свойства
•При нормальных условияхалюминий покрыт тонкой и
прочной оксидной плёнкой и потому
не реагирует с
классическими окислителями: с H2O
(t°);O2, HNO3 (без нагревания).
13. ВЗАИМОДЕЙСТВИЕ С ПРОСТЫМИ ВЕЩЕСТВАМИ
При обычных условиях• Взаимодействие с
кислородом:
4Al+ 3O2 =2Al2O3 +Q
• Взаимодействие с
галогенами :Cl, Br, I
(кроме фтора):
2Al+ 3Br2 =2AlBr3
При нагревании
2Al + 3F2 = 2AlF3
• Взаимодействие с
углеродом (карбид):
4Al+3C=Al4C3 (15001700°C)
• Взаимодействие с
серой:
2Al+3S= Al2S3 (150-170°C)
Взаимодействие с
азотом 2Al + N2 = 2AlN
14. Взаимодействие со сложными веществами
• Взаимодействие с водой (очищенный от оксиднойпленки)
2 Al +6H2O=2Al(OH)3 +3H2
• Взаимодействует с растворами кислот
2Al +6HCl= 2AlCl3 + 3H2
• Взаимодействует с едким натром (конц. щелочь)
2Al+ 2NaOH + 6H2O=2Na[Al(OH)4]+3H2
тетрагидроксоалюминат
натрия
15. Алюминий при обычных условиях не взаимодействует (пассивирует) с концентрированными H2SO4 и HNO3
16.
восстанавливает металлы из ихоксидов (алюминотермия):
•8Al + 3Fe3O4 = 4Al2O3 + 9Fe
•2Al + Cr2O3 = Al2O3 + 2Cr















 Химия
Химия








