Похожие презентации:
Основные сведения о строении атома
1.
ОСНОВНЫЕ СВЕДЕНИЯ ОСТРОЕНИИ АТОМА.
2.
В 1911 году Эрнест Резерфордпредложил планетарную модель
строения атома
Эрнест
Резерфорд
3.
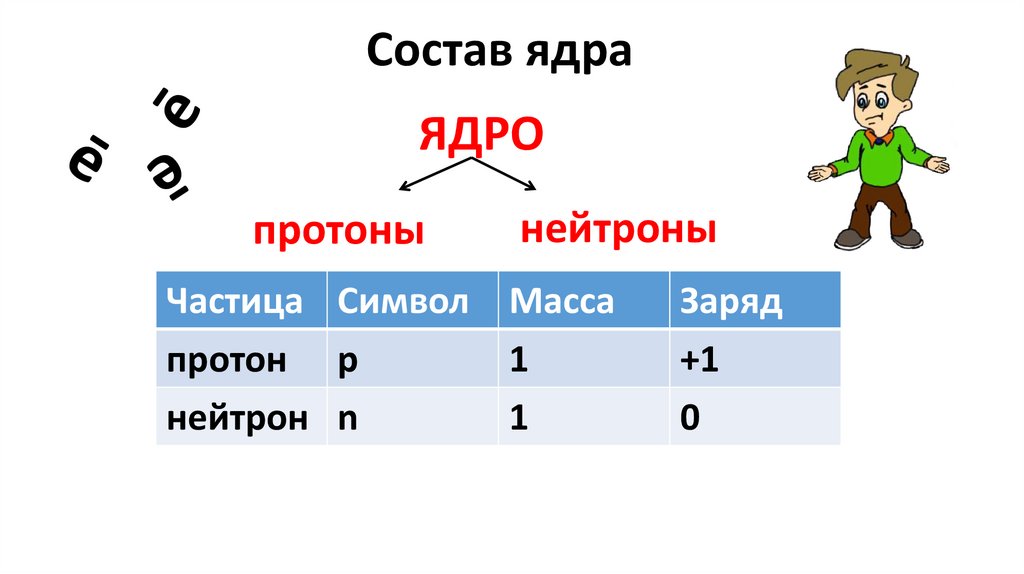
Состав ядраЯДРО
протоны
нейтроны
Частица Символ Масса
протон p
1
нейтрон n
1
Заряд
+1
0
4.
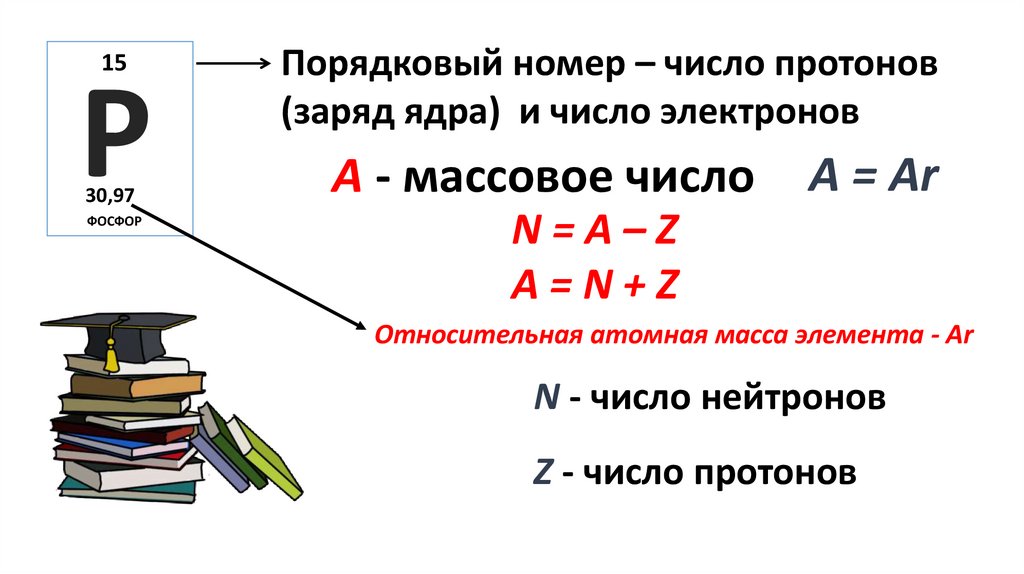
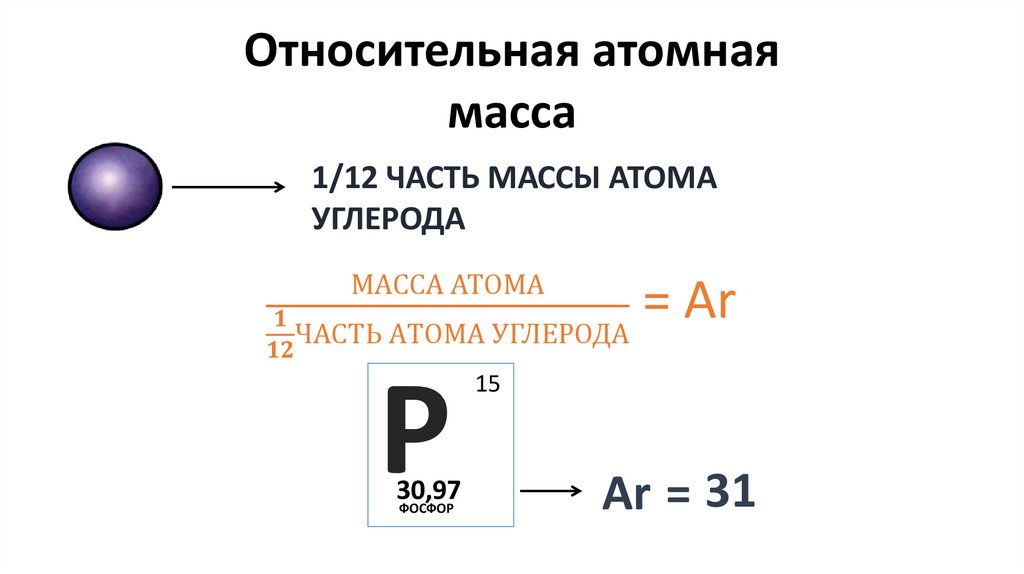
15Р
30,97
ФОСФОР
Порядковый номер – число протонов
(заряд ядра) и число электронов
А - массовое число
А = Ar
N=A–Z
А=N+Z
Относительная атомная масса элемента - Ar
N - число нейтронов
Z - число протонов
5.
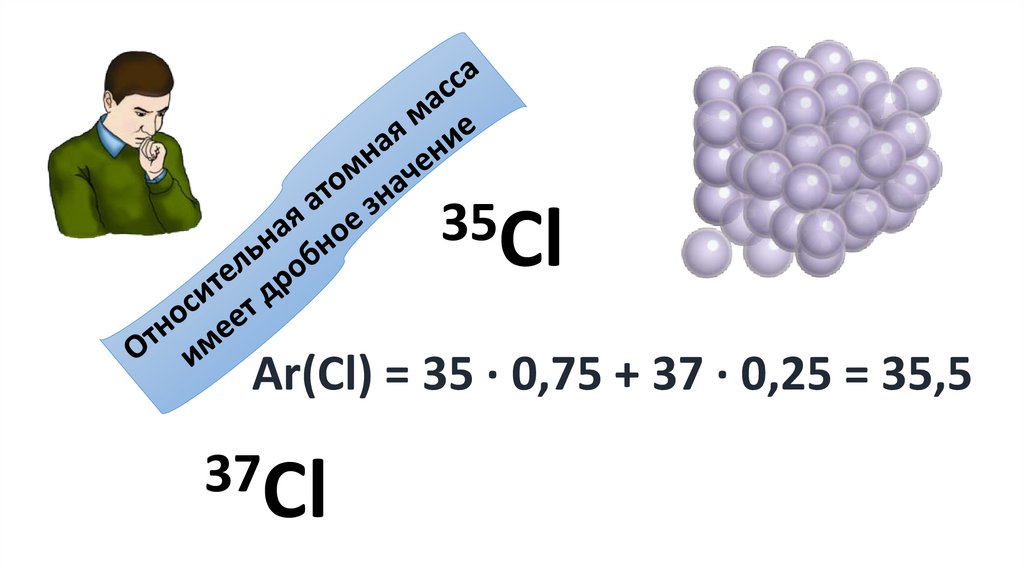
ИЗОТОПЫ - разновидности атомов одного итого же химического элемента, имеющие
одинаковый заряд ядра, но разное массовое
число
6.
ИЗОТОПЫ ВОДОРОДАПротий
Дейтерий
Тритий
7.
35ClAr(Cl) = 35 ∙ 0,75 + 37 ∙ 0,25 = 35,5
37Cl
8.
СТРОЕНИЕЭЛЕКТРОННЫХ
ОБОЛОЧЕК
АТОМА
9.
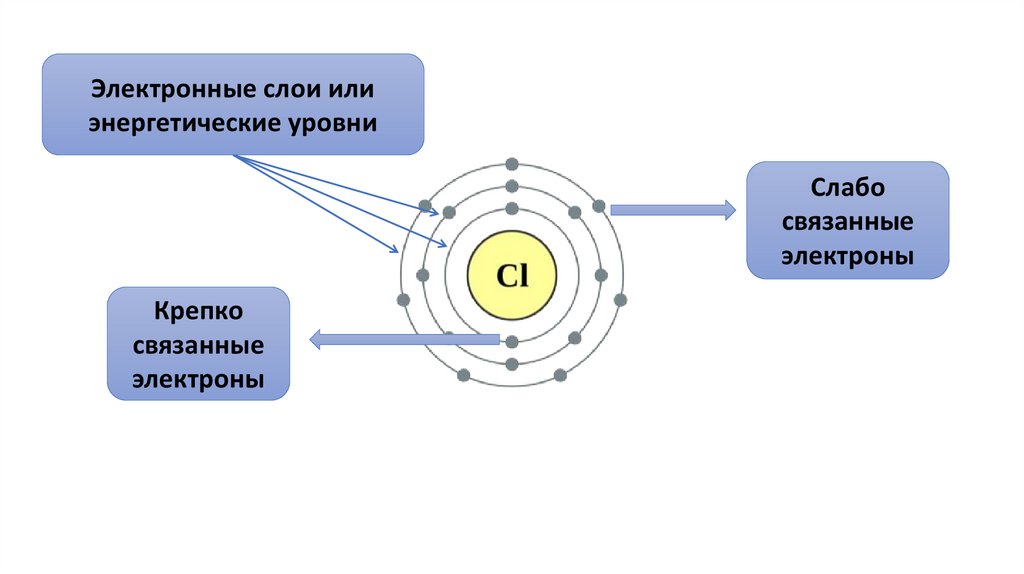
Электронные слои илиэнергетические уровни
Слабо
связанные
электроны
Крепко
связанные
электроны
10.
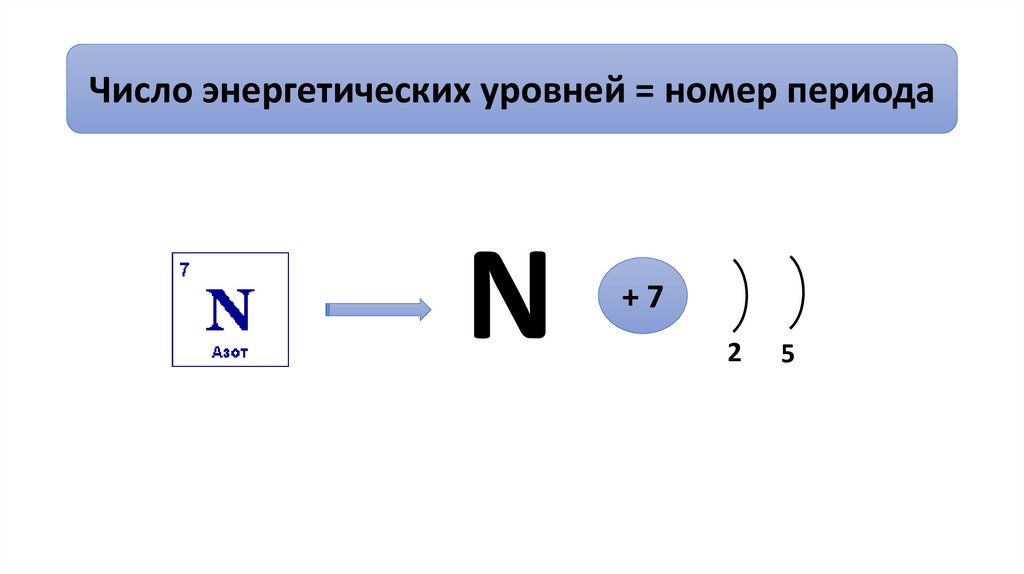
Число энергетических уровней = номер периодаN
+7
2
5
11.
Максимальное число электроновна энергетическом уровне
2 n2
n – номер периода
1 энергетический уровень: 2 ∙ 12 = 2 электрона
2 энергетический уровень: 2 ∙ 22 = 8 электронов
3 энергетический уровень: 2 ∙ 32 = 18 электронов
12.
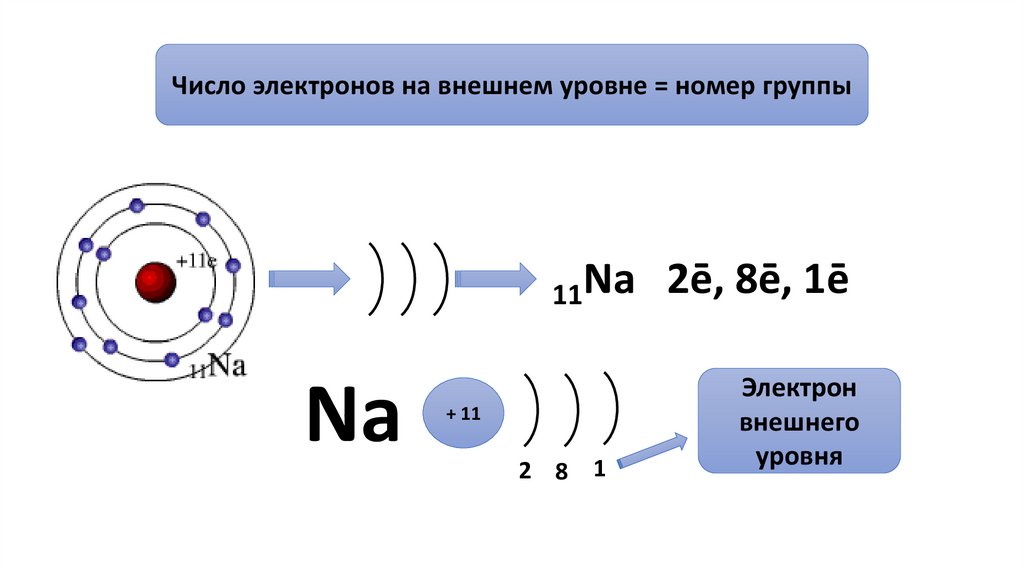
Число электронов на внешнем уровне = номер группы11Na
Nа
+ 11
2 8 1
2ē, 8ē, 1ē
Электрон
внешнего
уровня
13.
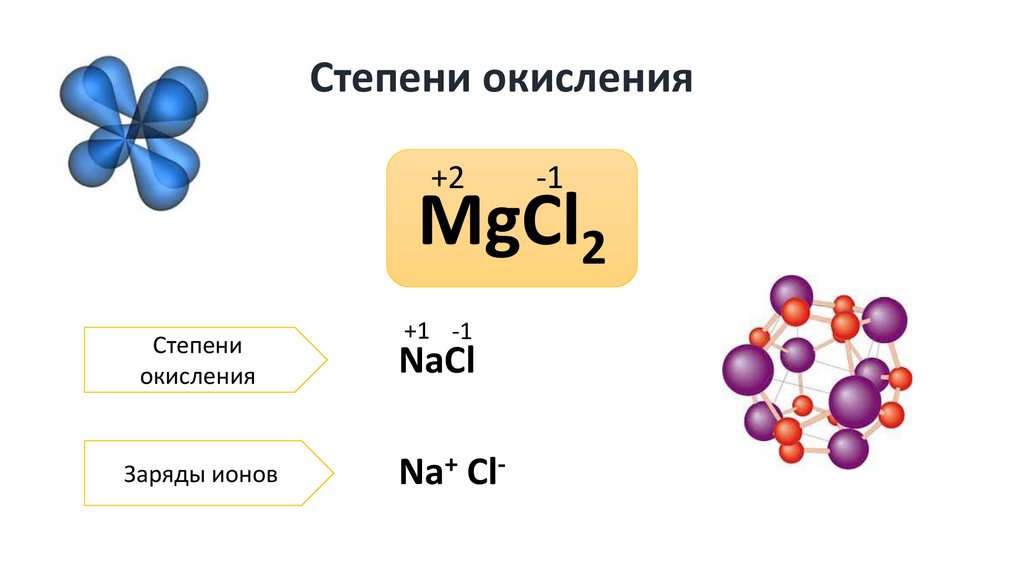
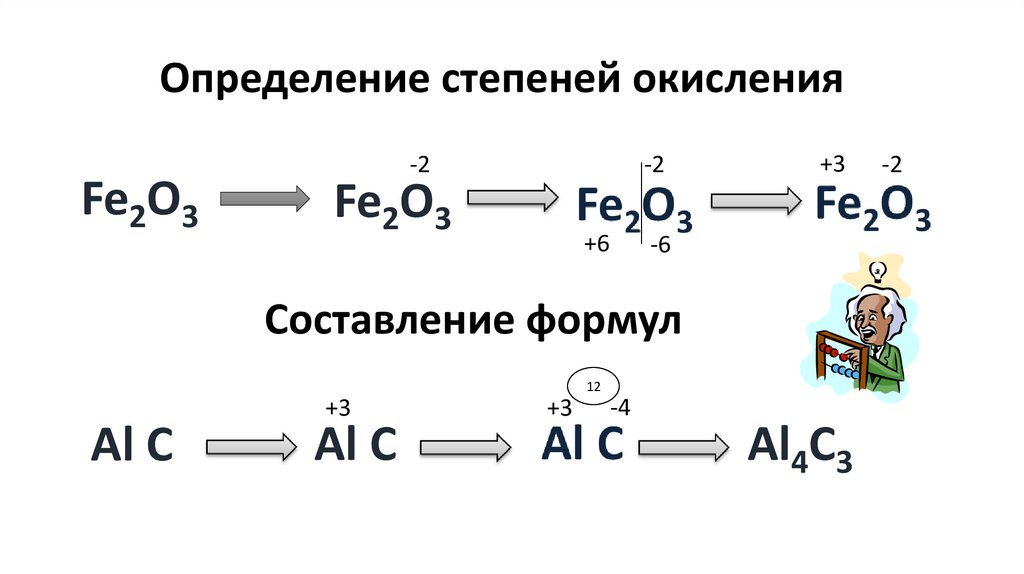
ХИМИЧЕСКАЯ ФОРМУЛА.ОТНОСИТЕЛЬНАЯ
АТОМНАЯ И
МОЛЕКУЛЯРНАЯ МАССА
14.
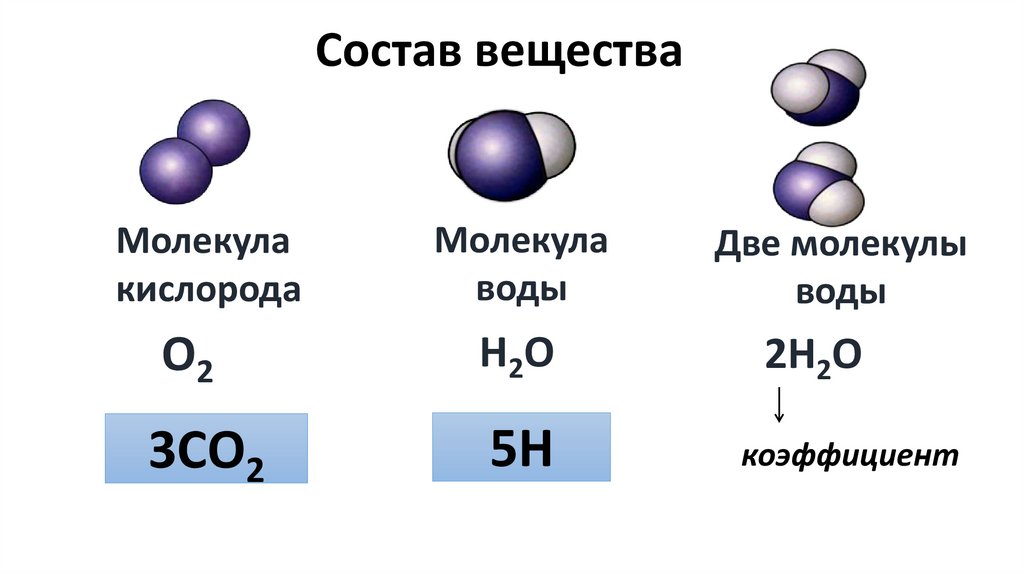
Состав веществаМолекула
кислорода
Молекула
воды
Две молекулы
воды
О2
Н 2О
2Н2О
3СО2
5Н
коэффициент
15.
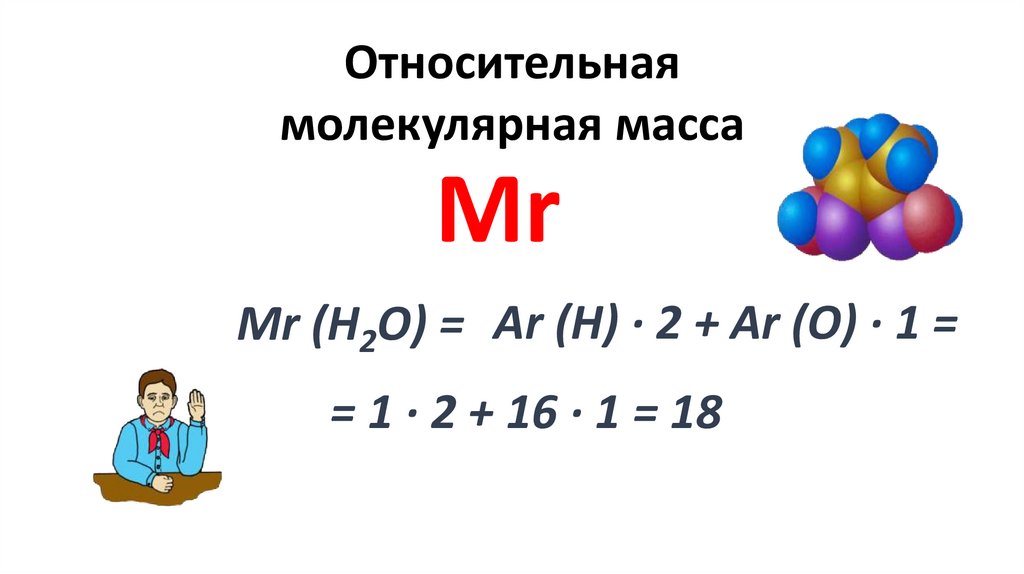
Относительная атомнаямасса
1/12 ЧАСТЬ МАССЫ АТОМА
УГЛЕРОДА
МАССА АТОМА

















 Химия
Химия








