Похожие презентации:
Особенности строения, реакционной способности и методы синтеза алкенов
1. ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА АЛКЕНОВ
12. Алкены
Алкенами называютсяненасыщенные углеводороды,
молекулы которых содержат
одну двойную связь.
СnН2n
олефины
2
3. Алкены
НоменклатураФормулы некоторых простейших алкенов
CH2 CH2
CH2 CH CH3
ýòè ë åí , ýòåí
ï ðî ï è ë åí , ì åòè ë ýòè ë åí , ï ðî ï åí
CH2 CH CH2 CH3
áóòè ë åí , ýòè ë ýòè ë åí , 1-áóòåí
CH3 CH CH CH3
ï ñåâäî áóòè ë åí , ñè ì .äè ì åòè ë ýòè ë åí ,
2-áóòåí
è çî áóòè ë åí , í åñè ì .äè ì åòè ë ýòè ë ýòè ë åí ,
2-ì åòè ë ï ðî ï åí
CH3 C CH3
CH3
3
4. Алкены
НоменклатураФормулы некоторых простейших алкенов
CH2 CH
CH2 CH CH2
CH3 C CH2
CH3 CH CH
CH3 CH CH CH2
âè í è ë , ýòåí è ë
àë ë è ë
è çî ï ðî ï åí è ë
ï ðî ï åí è ë
ê ðî òè ë
4
5. Алкены
Номенклатура1) в алкенах с неразветвленной цепью нумерацию
производят с того конца, ближе к которому находится
двойная связь. В названии алкана, соответствующего
этой родоначальной структуре, суффикс -ан
заменяется на –ен.
CH2 CH2
CH2 CH CH3
пропилен
этилен
CH3CH CHCH2CH2CH3
гексен-2
5
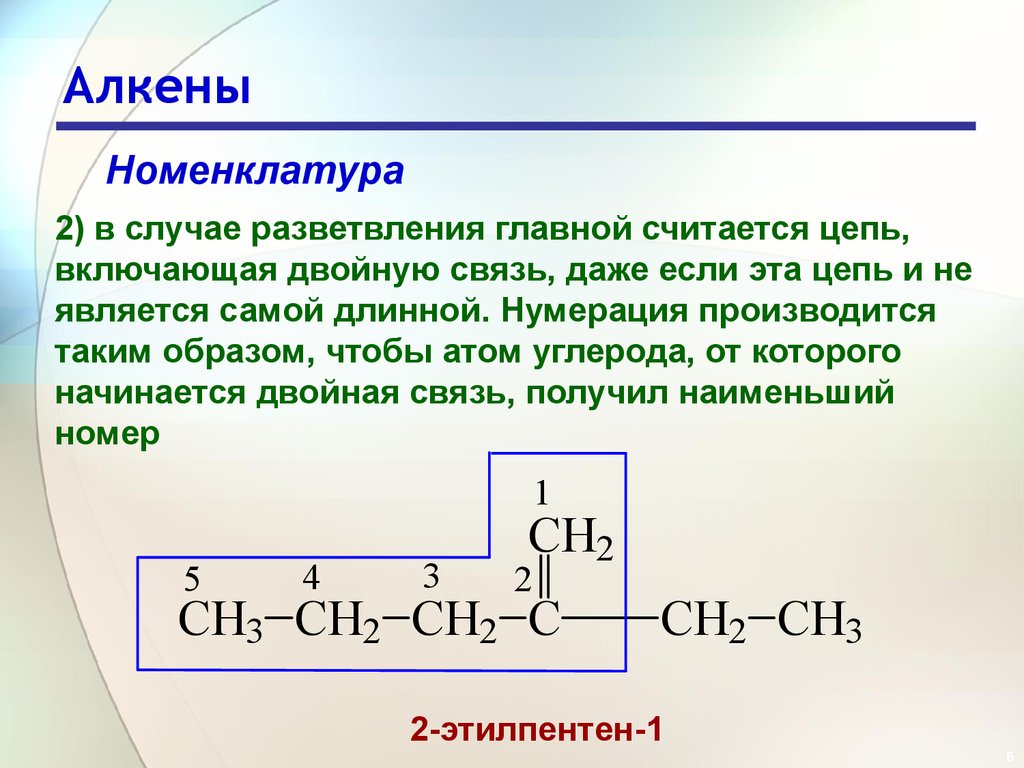
6. Алкены
Номенклатура2) в случае разветвления главной считается цепь,
включающая двойную связь, даже если эта цепь и не
является самой длинной. Нумерация производится
таким образом, чтобы атом углерода, от которого
начинается двойная связь, получил наименьший
номер
1
5
4
3
CH2
2
CH3 CH2 CH2 C
CH2 CH3
2-этилпентен-1
6
7. Алкены
Номенклатура3) Углеводородные заместители обозначаются
префиксом. Положение их указывается цифрой,
соответствующей номеру того атома углерода, у
которого находится заместитель. Заместители
перечисляются в алфавитном порядке. В случае
нескольких одинаковых углеводородных
заместителей перед их названием ставится
умножительная приставка ди-, три- и т. д.
7
8. Алкены
Способы полученияДегидратация спиртов
ÑH3CH2OH
H2SO4, H3PO4, кислые соли
о
400-500 С, Al2O3, Al+3
CH2 CH2
+
H2O
8
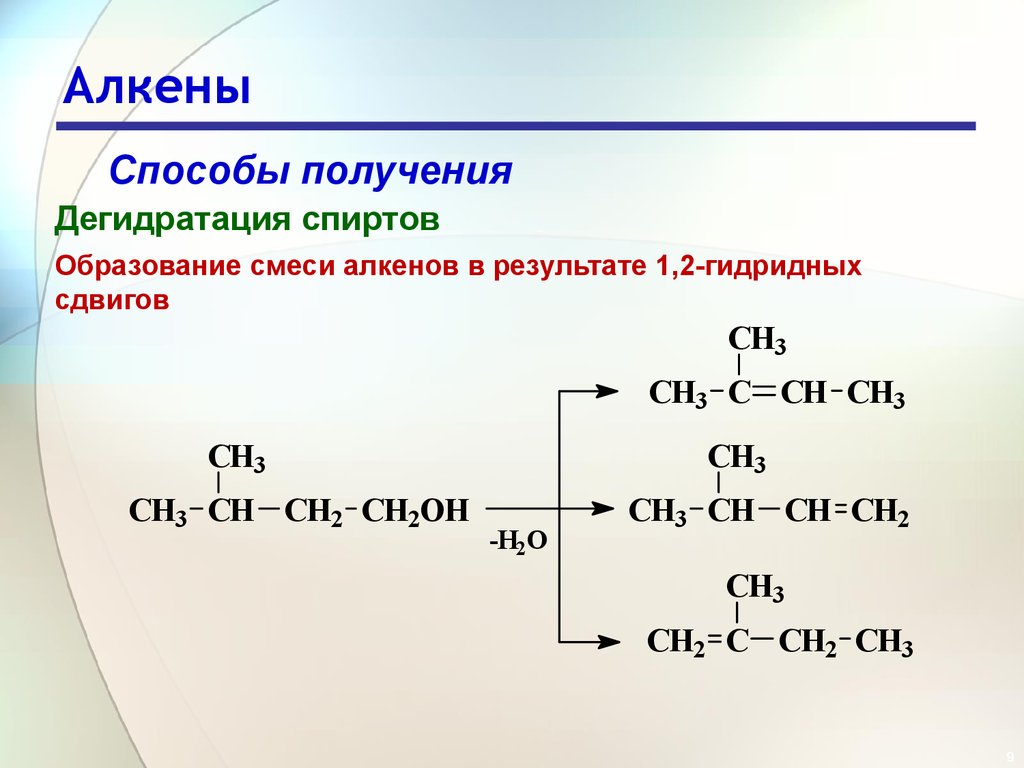
9. Алкены
Способы полученияДегидратация спиртов
Образование смеси алкенов в результате 1,2-гидридных
сдвигов
CH3
CH3 C CH CH3
CH3
CH3 CH CH2 CH2OH
CH3
-H2O
CH3 CH CH CH2
CH3
CH2 C CH2 CH3
9
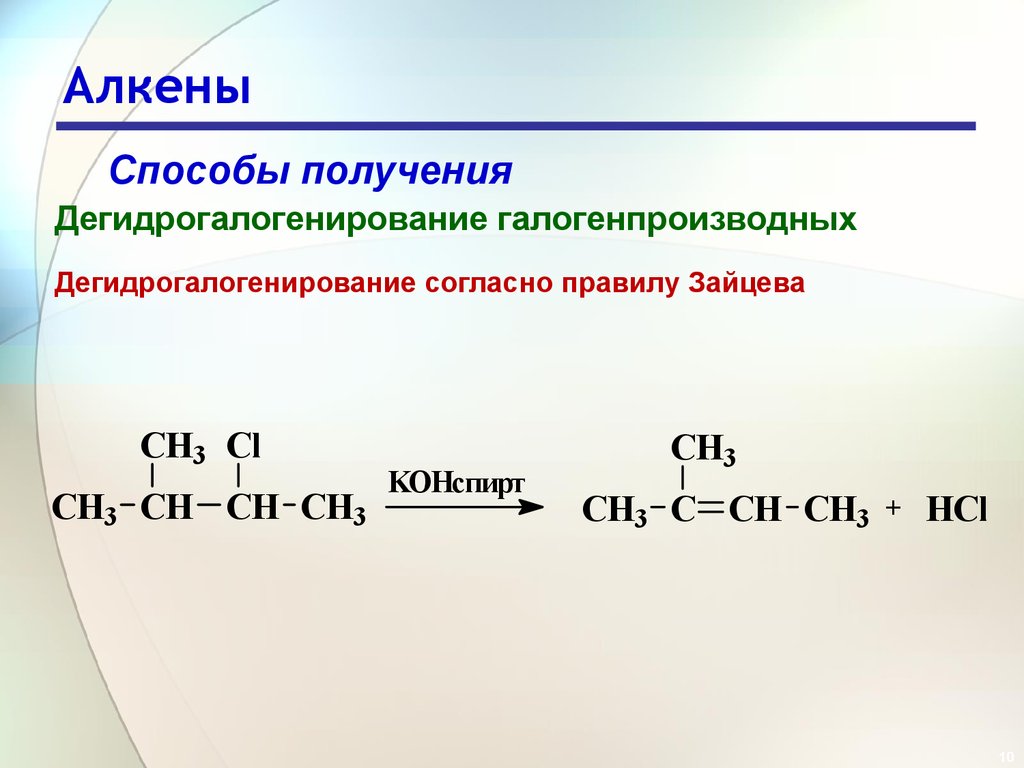
10. Алкены
Способы полученияДегидрогалогенирование галогенпроизводных
Дегидрогалогенирование согласно правилу Зайцева
CH3 Cl
CH3 CH CH CH3
KOHспирт
CH3
CH3 C CH CH3
+
HCl
10
11. Алкены
Способы полученияДегалогенирование дигалогенпроизводных
Cl
CH3
CH CH2Cl
+
Zn
CH3 CH CH2
+
ZnCl2
11
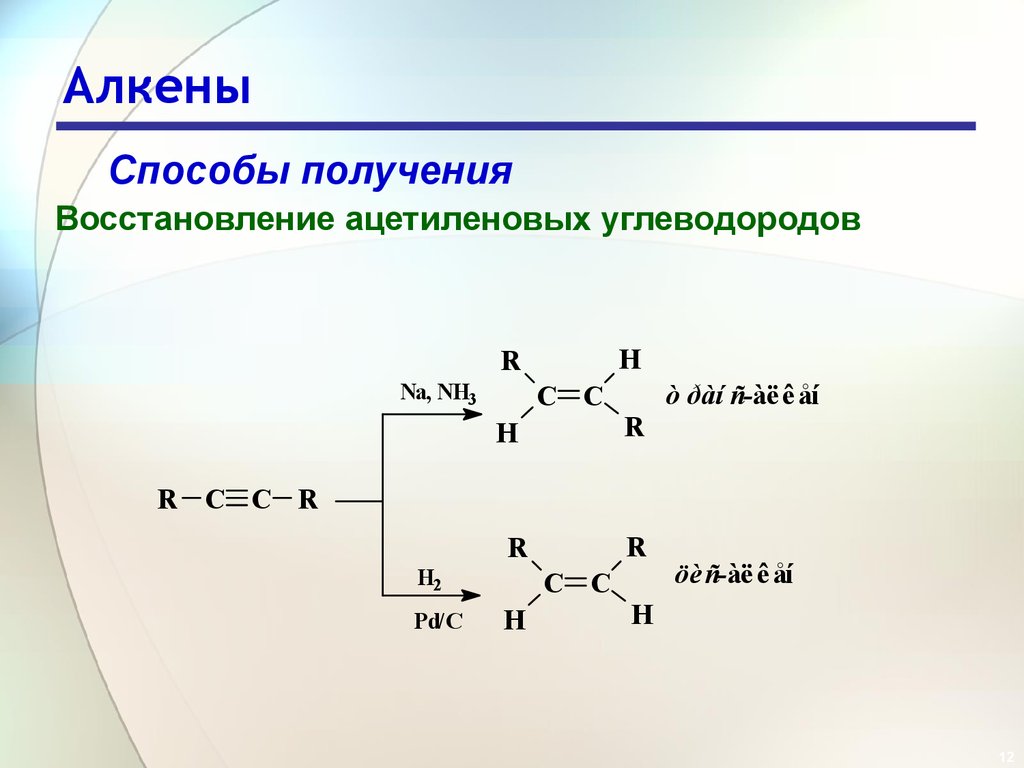
12. Алкены
Способы полученияВосстановление ацетиленовых углеводородов
H
R
Na, NH3
ò ðàí ñ-àë ê åí
C C
R
H
R C C R
R
R
H2
Pd/C
C C
H
öè ñ-àë ê åí
H
12
13. Алкены
Химические свойстваНаиболее типичные реакции, присущие алкенам
А. радикальное
присоединение
R CH CH2
Б. электрофильное
присоединение
В. радикальное
замещение
13
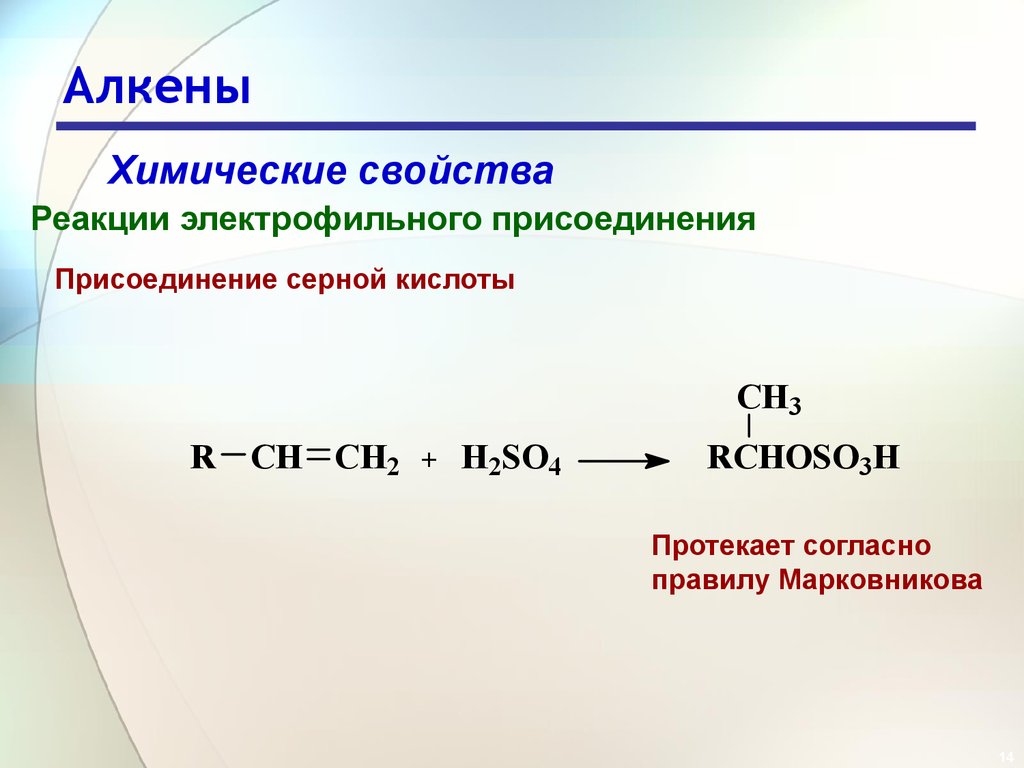
14. Алкены
Химические свойстваРеакции электрофильного присоединения
Присоединение серной кислоты
CH3
R CH CH2
+
H2SO4
RCHOSO3H
Протекает согласно
правилу Марковникова
14
15. Алкены
Химические свойстваРеакции электрофильного присоединения
Присоединение серной кислоты, различие в реакционной
способности алкенов
CH2 CH2
+
H2SO4(98%)
CH3CHOSO3H
CH3
CH3CH CH2
+
H2SO4(80%)
CH3
CH3 C CH2 + H2SO4(63%)
CH3CHOSO3H
CH3
CH3 C OSO3H
CH3
15
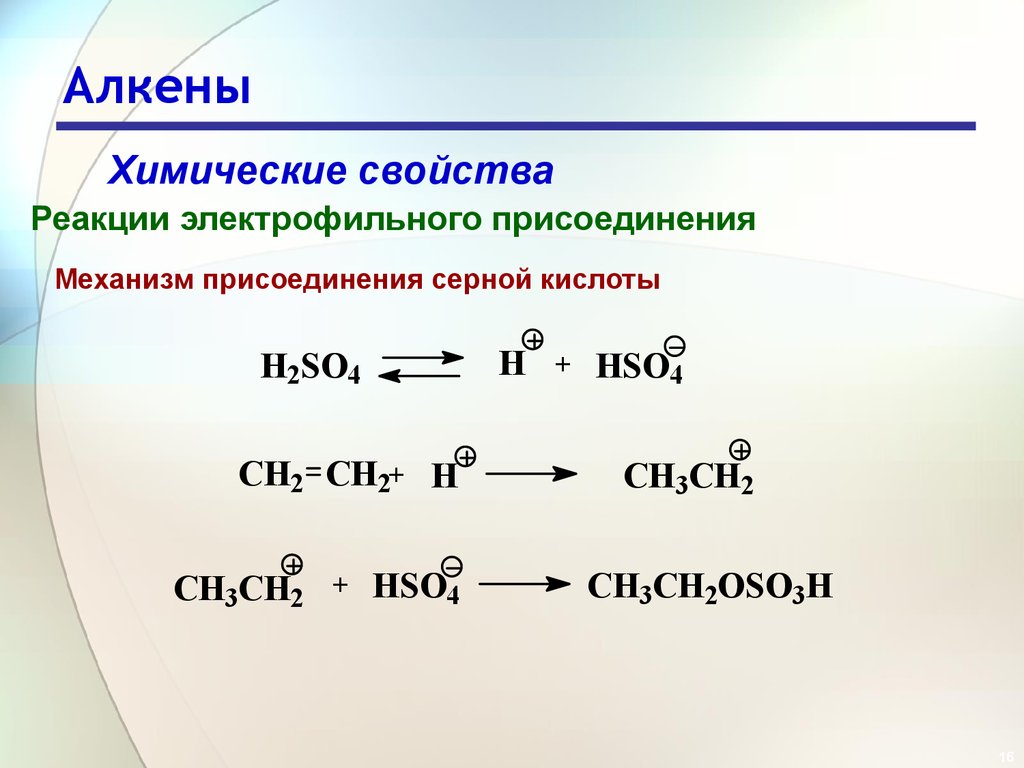
16. Алкены
Химические свойстваРеакции электрофильного присоединения
Механизм присоединения серной кислоты
H
H2SO4
CH2 CH2+ H
CH3CH2
+
HSO4
+
HSO4
CH3CH2
CH3CH2OSO3H
16
17. Алкены
Химические свойстваРеакции электрофильного присоединения
Ряд карбкатионов по устойчивости и легкости образования
CH3
C CH3
CH3 CH CH3
CH3CH2
CH3
17
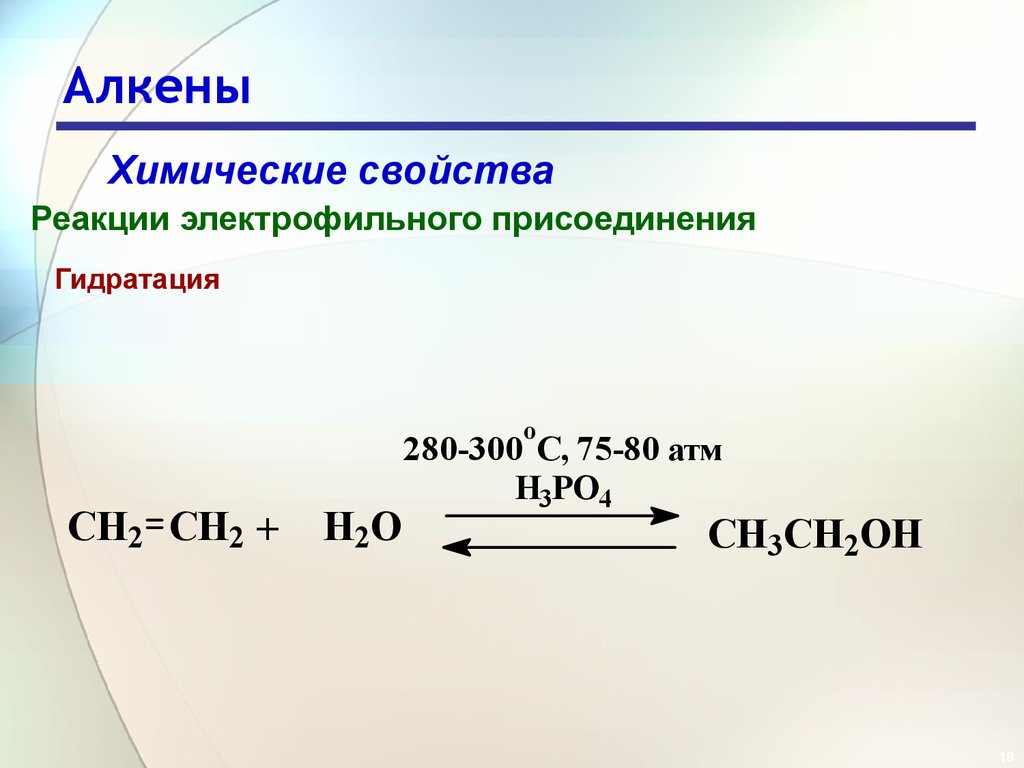
18. Алкены
Химические свойстваРеакции электрофильного присоединения
Гидратация
o
CH2 CH2 +
H2O
280-300 C, 75-80 атм
H3PO4
CH3CH2OH
18
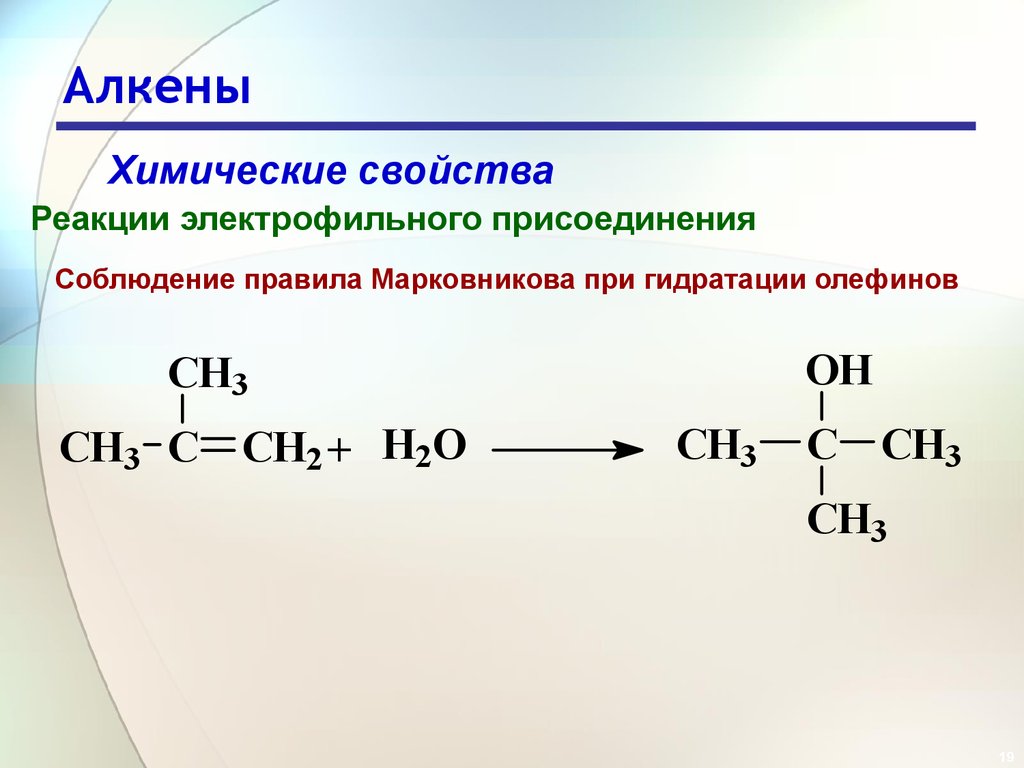
19. Алкены
Химические свойстваРеакции электрофильного присоединения
Соблюдение правила Марковникова при гидратации олефинов
OH
CH3
CH3 C CH2 + H2O
CH3
C CH3
CH3
19
20. Алкены
Химические свойстваРеакции электрофильного присоединения
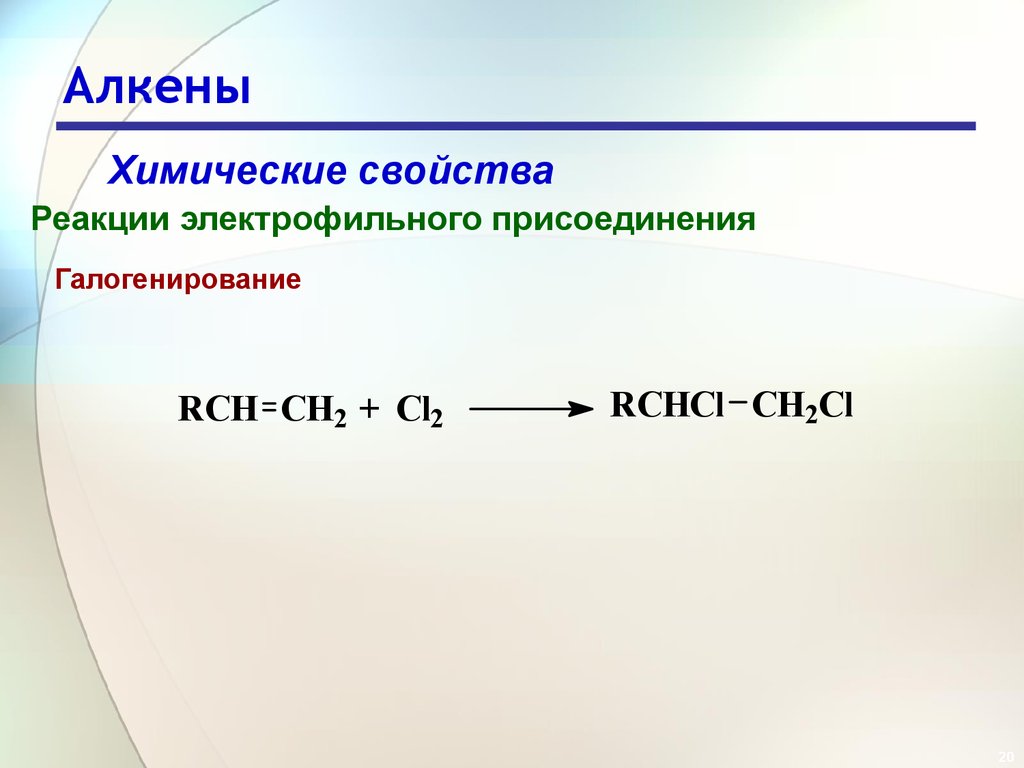
Галогенирование
RCH CH2 + Cl2
RCHCl CH2Cl
20
21. Алкены
Химические свойстваРеакции электрофильного присоединения
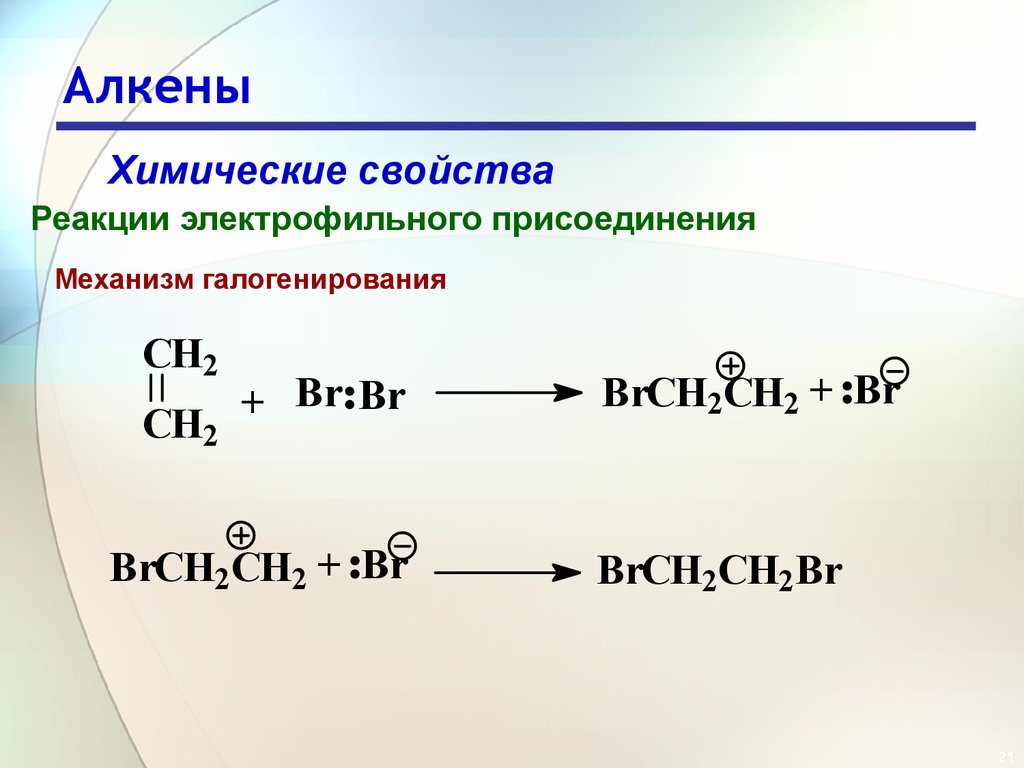
Механизм галогенирования
CH2
CH2
+ Br Br
BrCH2CH2 + Br
BrCH2CH2 + Br
BrCH2CH2Br
21
22. Алкены
Химические свойстваРеакции электрофильного присоединения
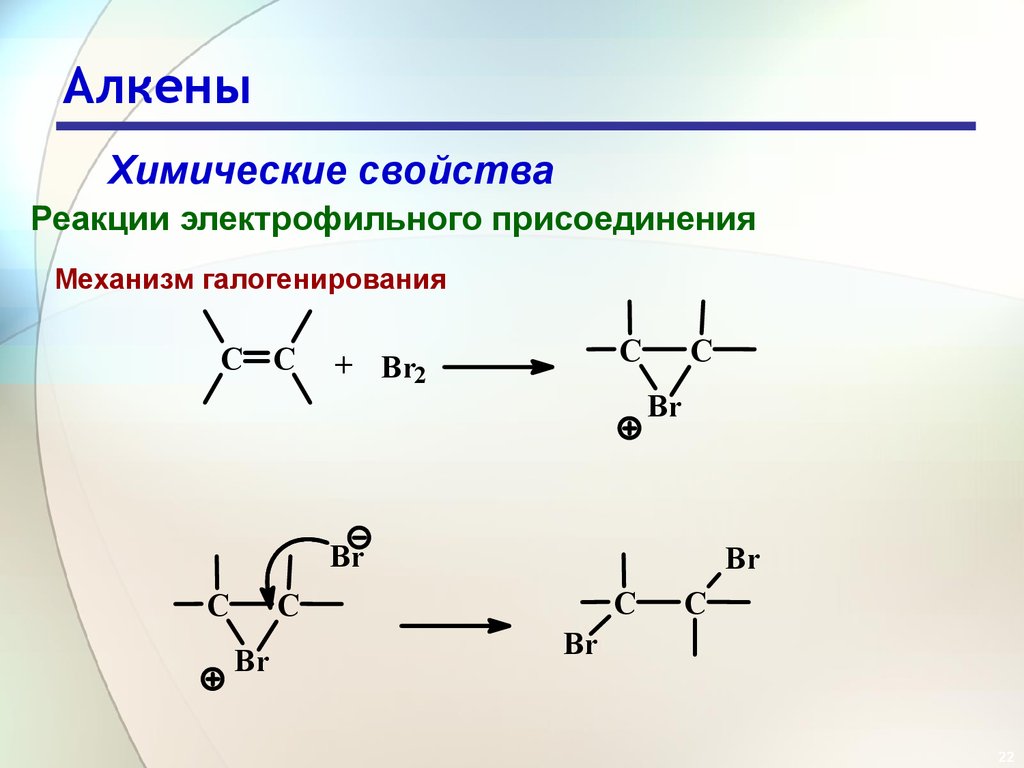
Механизм галогенирования
C C
C
+ Br2
C
Br
Br
C
Br
C
C
Br
C
Br
22
23. Алкены
Химические свойстваРеакции электрофильного присоединения
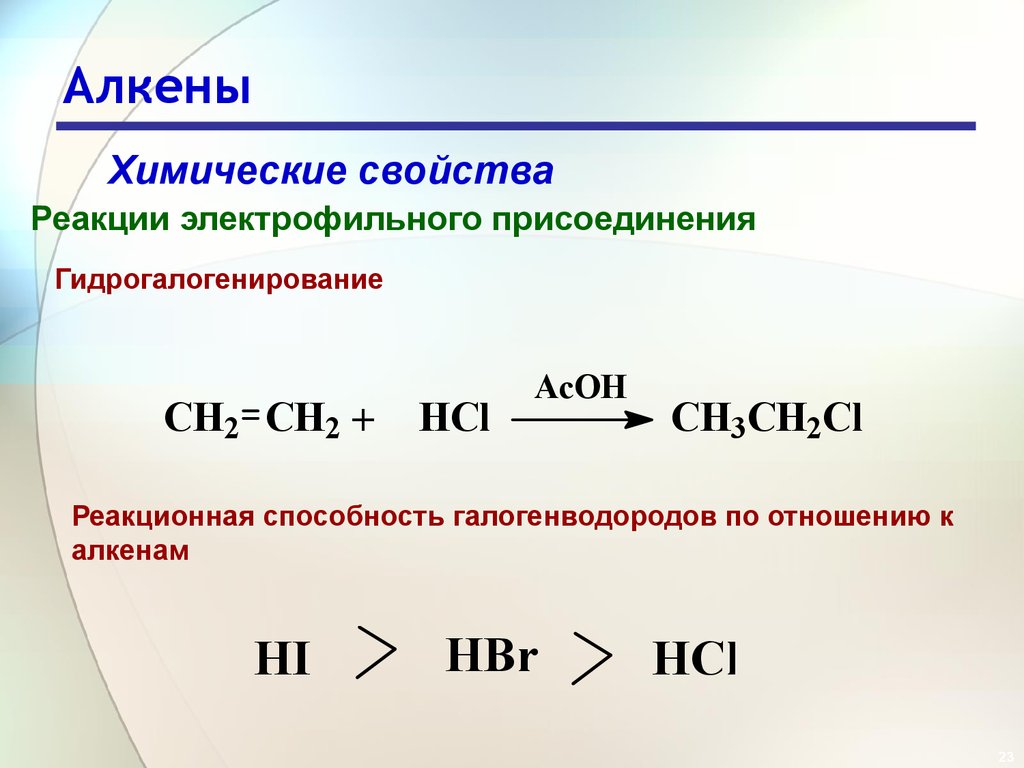
Гидрогалогенирование
CH2 CH2 +
HCl
AcOH
CH3CH2Cl
Реакционная способность галогенводородов по отношению к
алкенам
HI
HBr
HCl
23
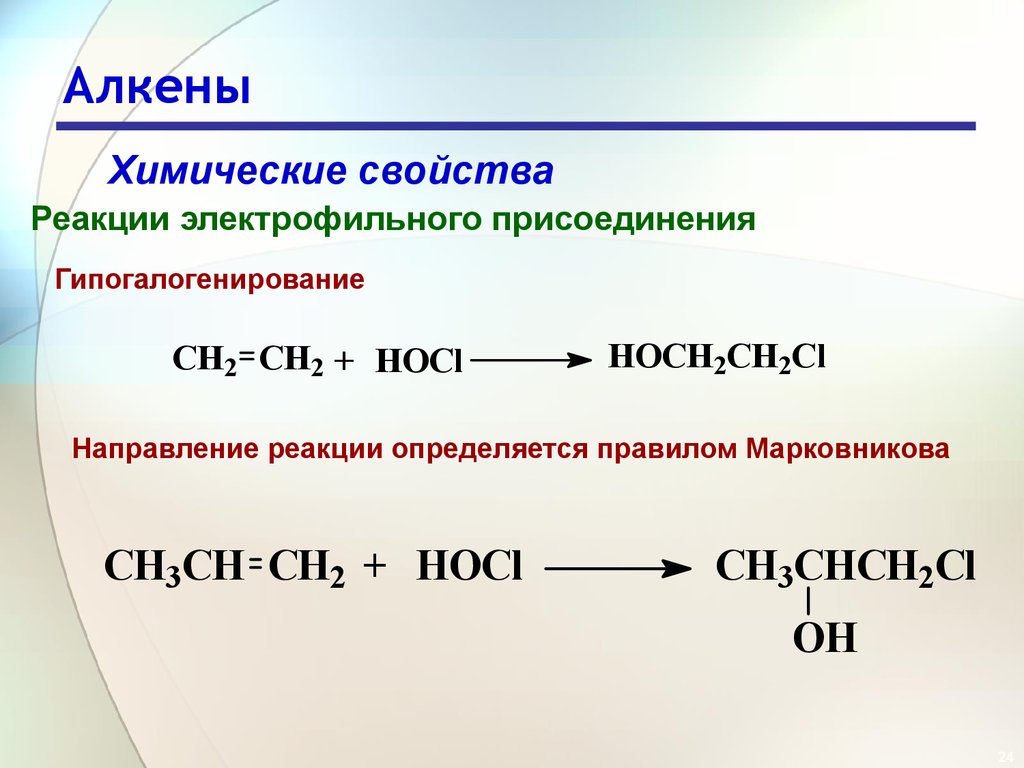
24. Алкены
Химические свойстваРеакции электрофильного присоединения
Гипогалогенирование
CH2 CH2 + HOCl
HOCH2CH2Cl
Направление реакции определяется правилом Марковникова
CH3CH CH2 + HOCl
CH3CHCH2Cl
OH
24
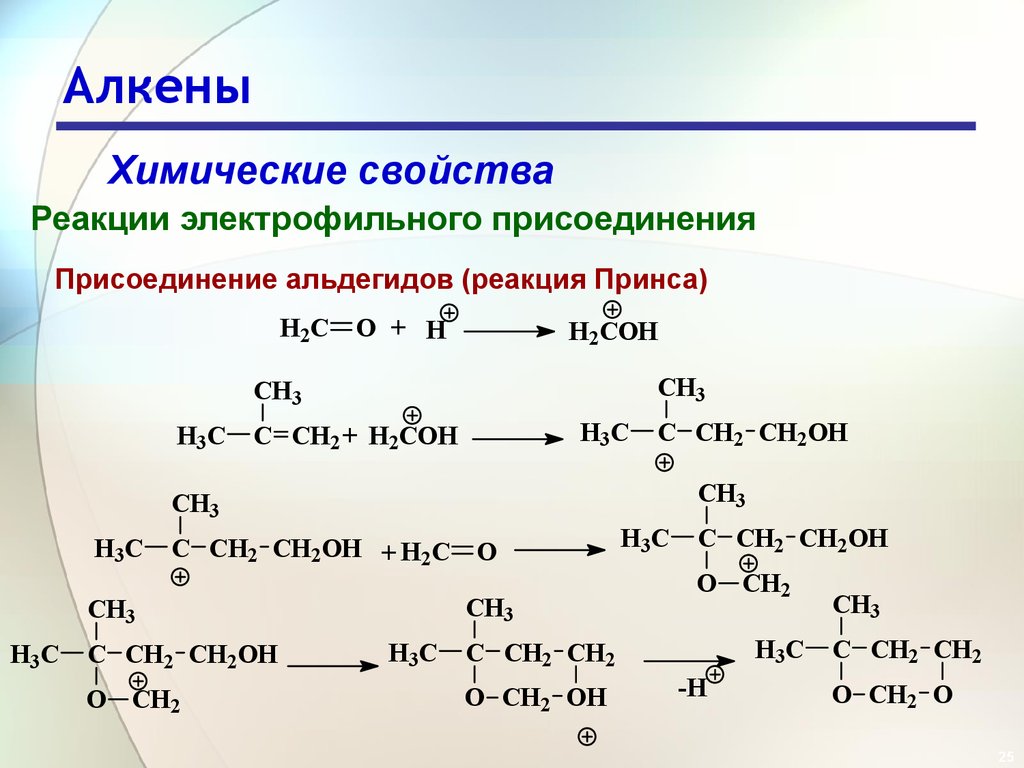
25. Алкены
Химические свойстваРеакции электрофильного присоединения
Присоединение альдегидов (реакция Принса)
H2C O + H
H2COH
CH3
CH3
H3C
H3C
C CH2 + H2COH
C CH2 CH2OH
CH3
CH3
H3C
C CH2 CH2OH + H2C O
CH3
CH3
H3C
C CH2 CH2OH
O CH2
H3C
H3C
C CH2 CH2OH
O CH2
H3C
C CH2 CH2
O CH2 OH
-H
CH3
C CH2 CH2
O CH2 O
25
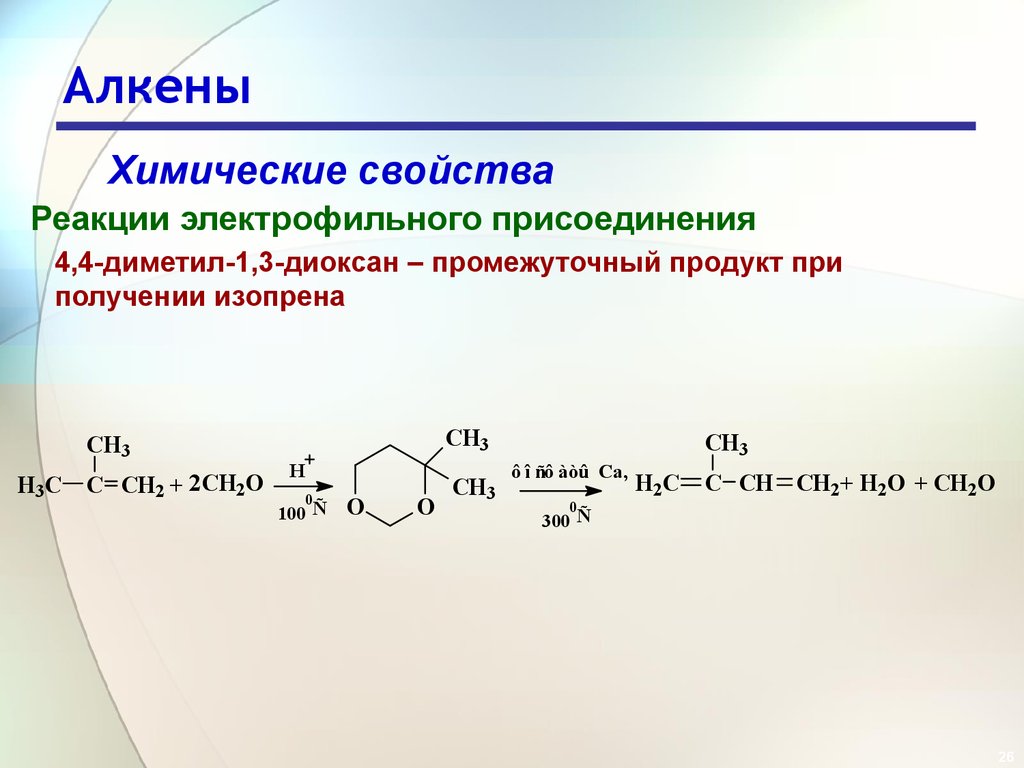
26. Алкены
Химические свойстваРеакции электрофильного присоединения
4,4-диметил-1,3-диоксан – промежуточный продукт при
получении изопрена
CH3
H3C
C CH2 + 2CH2O
CH3
H
0
100 Ñ
O
O
CH3
CH3
ô î ñô àòû Ca,
0
H2C
C CH CH2 + H2O + CH2O
300 Ñ
26
27. Алкены
Химические свойстваРеакции электрофильного присоединения
Присоединение алкенов (димеризация, полимеризация)
CH3
H3C
C CH2
H
H3C
CH3
CH3
CH3
CH3
C CH2
C CH2 + H3C
C CH
C CH3
CH3
CH3
27
28. Алкены
Химические свойстваРеакции электрофильного присоединения
Полимеризация этилена по Циглеру
C2H5
Al C2H5 + n CH2 CH2
C2H5
CH2CH2CH2CH2(CH2CH2)xC2H5
Al CH2CH2CH2CH2(CH2CH2)yC2H5
CH2CH2CH2CH2(CH2CH2)z C2H5
CH2CH2CH2CH2(CH2CH2)xC2H5
Al CH2CH2CH2CH2(CH2CH2)yC2H5
CH2CH2CH2CH2(CH2CH2)z C2H5
C2H5
CH2
CH(CH2CH2)xC2H5
Al C2H5 + CH2 CH(CH2CH2)yC2H5
C2H5
CH2 CH(CH2CH2)z C2H5
28
29. Алкены
Химические свойстваРеакции электрофильного присоединения
Оксосинтез (гидроформилирование)
o
100-200 C,
100-200 атм,
Ni, Co
ÑH3CH CH2 + CO + H2
ÑH3CH2CH2CHO
29
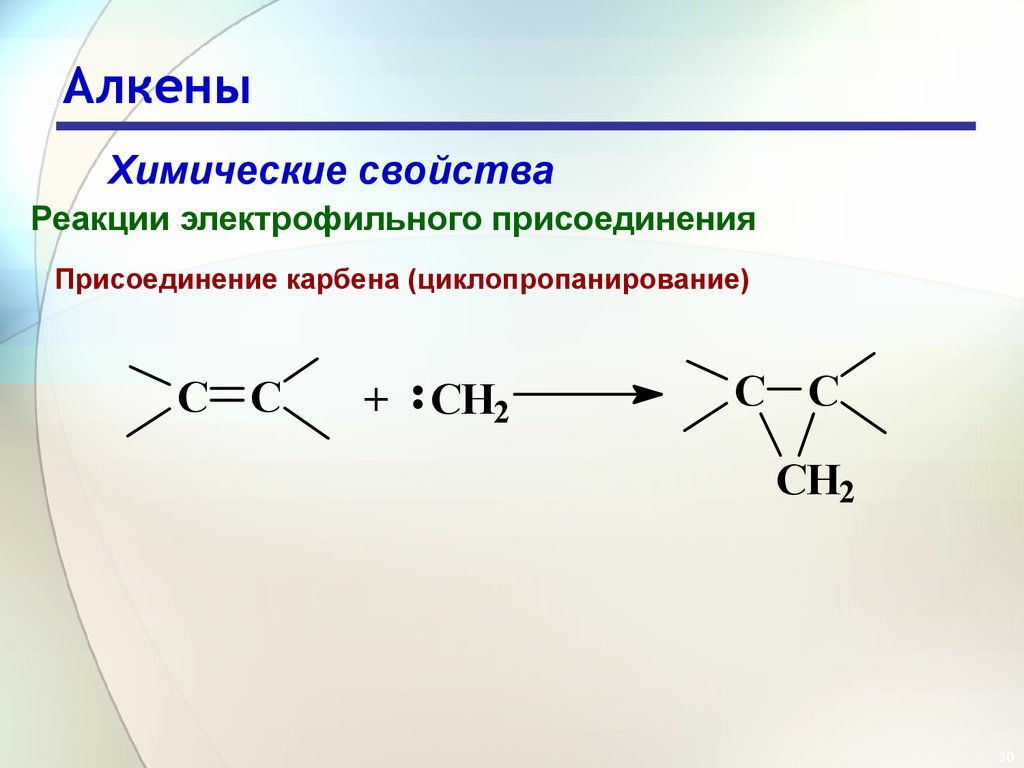
30. Алкены
Химические свойстваРеакции электрофильного присоединения
Присоединение карбена (циклопропанирование)
C C
+ CH2
C C
CH2
30
31. Алкены
Химические свойстваРеакции электрофильного присоединения
Присоединение карбена (циклопропанирование)
ÑH2N2 h
CHCl3 + ò ðåò .C4H9O
CCl3
CH2 + N2
ò ðåò .C4H9OH + CCl3
CCl2 + Cl
31
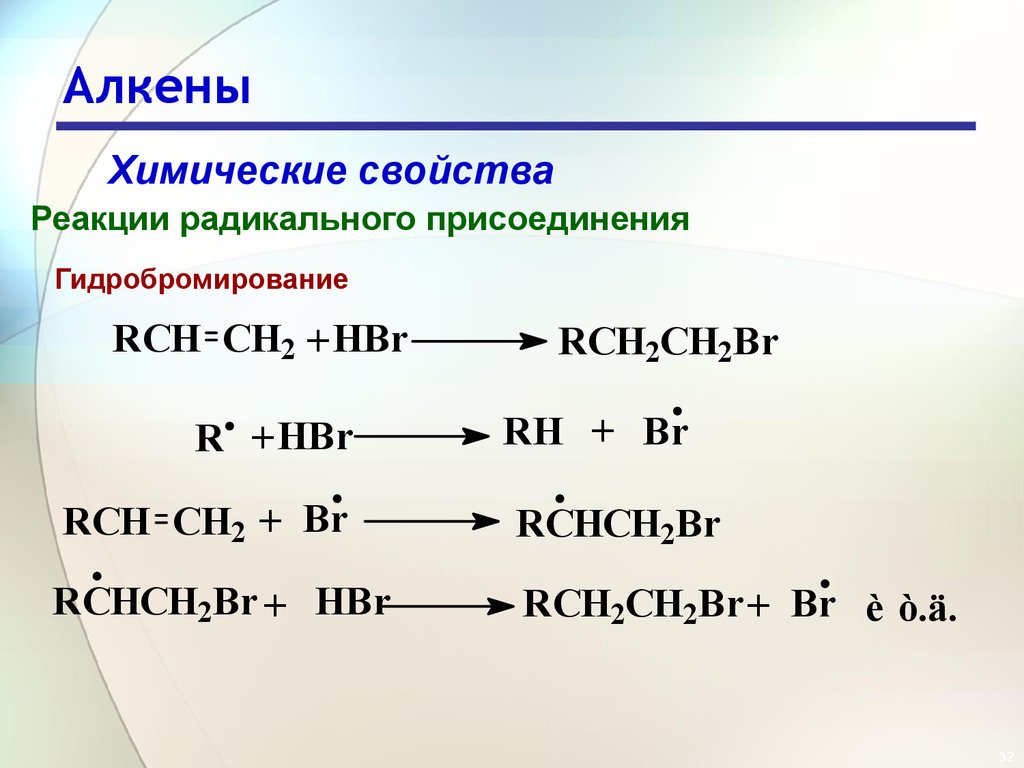
32. Алкены
Химические свойстваРеакции радикального присоединения
Гидробромирование
RCH CH2 + HBr
R + HBr
RCH2CH2Br
RH + Br
RCH CH2 + Br
RCHCH2Br
RCHCH2Br + HBr
RCH2CH2Br + Br è ò.ä.
32
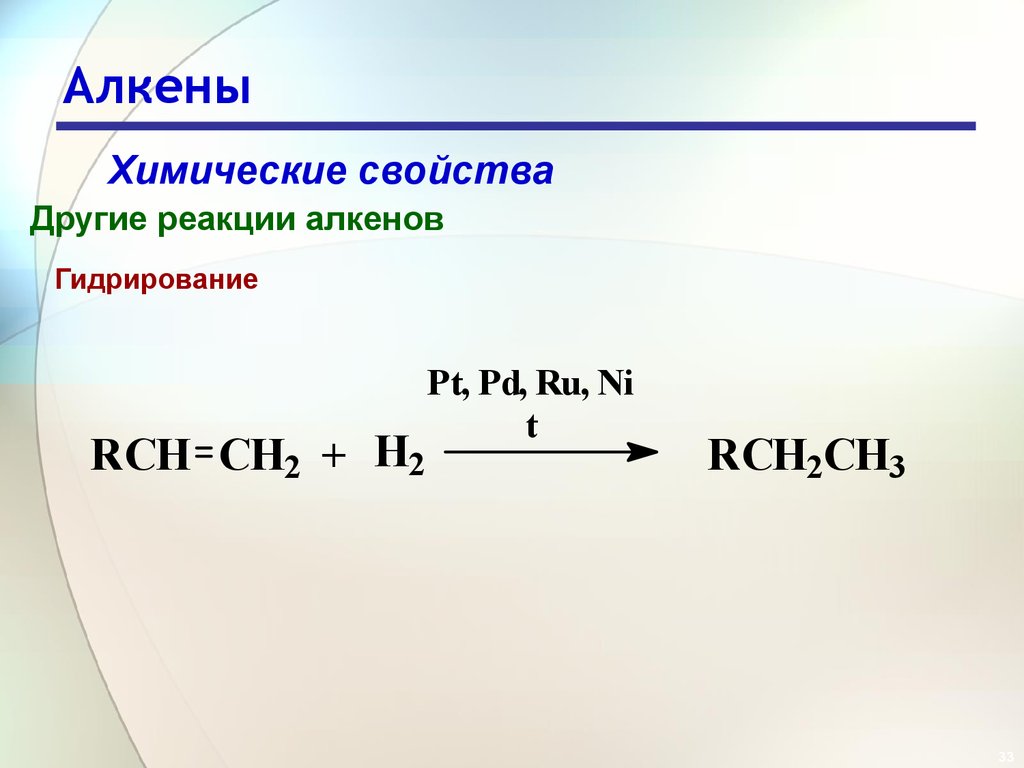
33. Алкены
Химические свойстваДругие реакции алкенов
Гидрирование
RCH CH2 + H2
Pt, Pd, Ru, Ni
t
RCH2CH3
33
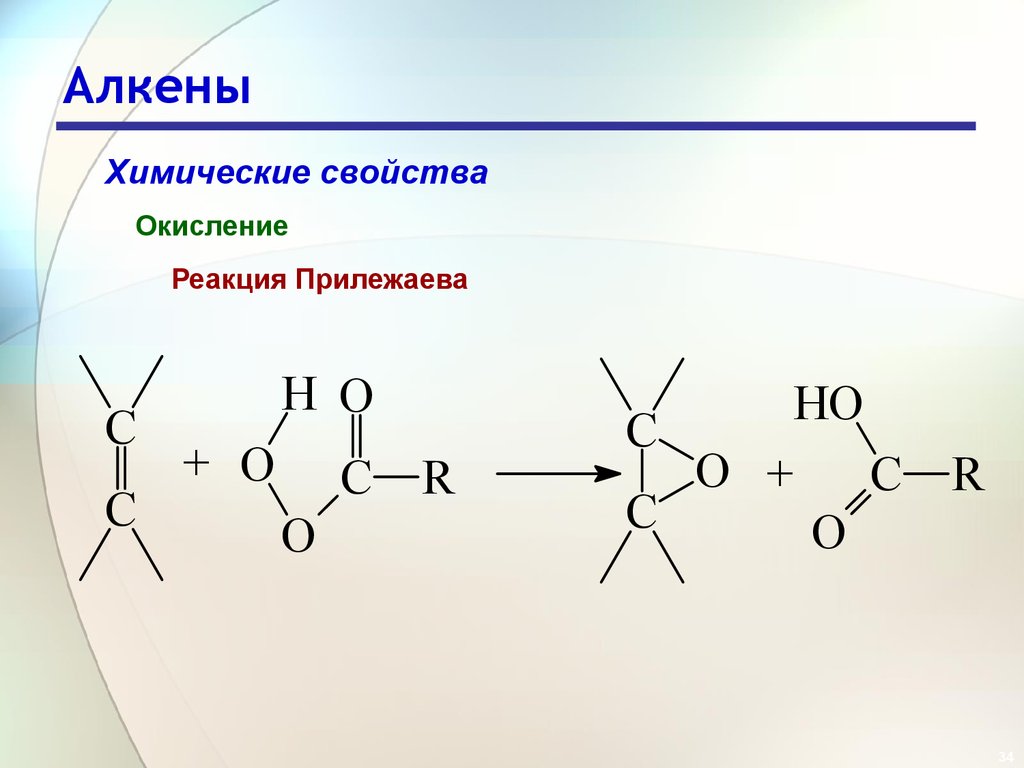
34. Алкены
Химические свойстваОкисление
Реакция Прилежаева
C
C
H O
+ O
C R
O
HO
C
O +
C
C
O
R
34
35. Алкены
Химические свойстваОкисление
Окисление по Вагнеру
3CH2 CH2 + 2KMnO4 + 4H2O
3CH2 CH2 + 2KOH + 2MnO2
OH OH
этилен
этиленгликоль
35
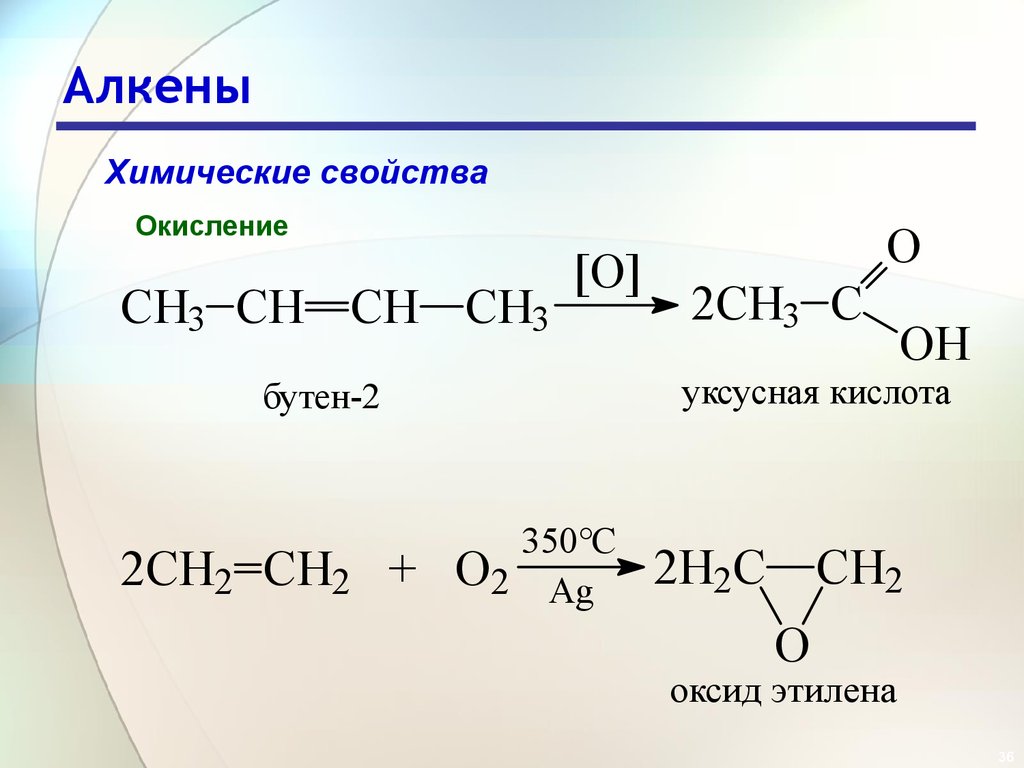
36. Алкены
Химические свойстваОкисление
CH3 CH CH CH3
[O]
2CH3 C
OH
уксусная кислота
бутен-2
2CH2 CH2 +
O
350°C
O2 Ag
2H2C CH2
O
оксид этилена
36
37. Алкены
Химические свойстваОкисление
Горение
C2H4 + 3O2 2CO2 + 2H2O
37
38. Алкены
Химические свойстваОкисление
Озонолиз
C C
C C
+O O O
O
озон
O O
C
C
O O
O
O
мольозонид
C
C
O
озонид
+
Zn (H )
C O + O C
O
38
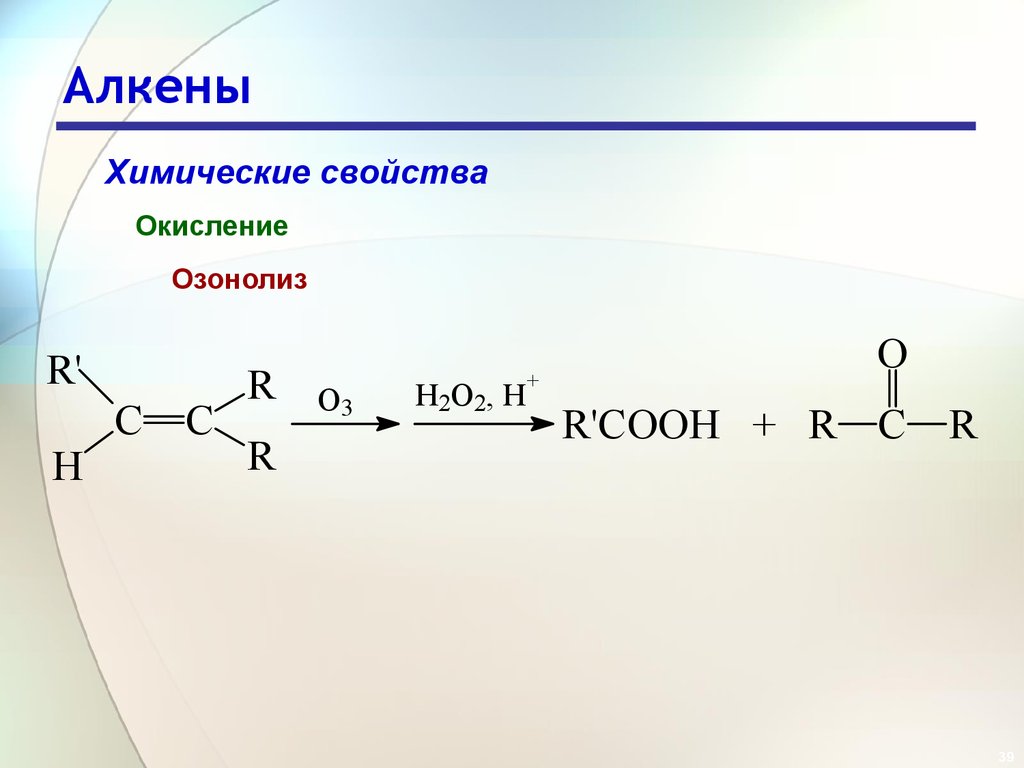
39. Алкены
Химические свойстваОкисление
Озонолиз
R'
H
C
C
R
R
O3
H2O2, H
+
O
R'COOH + R C R
39
40. Алкадиены
НоменклатураПредставители
CH2 CH CH CH2
äè âè í è ë , 1,3-áóòàäè åí
CH3
CH2 C CH CH2
CH3 CH CH CH CH2
è çî ï ðåí , 2-ì åòè ë -1,3-áóòàäè åí
ï è ï åðè ë åí , 1,3-ï åí òàäè åí
CH3
CH2 C C CH2
2,3-äè ì åòè ë -1,3-áóòàäè åí
CH3
40
41. Алкадиены
Методы полученияДивинил
o
ZnO, Al2O3, 370 C
CH3CH2OH
2CH3CHO
CH3CH CHCHO +H2
CH3CH CHCH2OH
CH3CHO +H2
CH3CH CHCHO +H2O
CH3CH CHCH2OH
CH2 CH CH CH2 +H2O
41
42. Алкадиены
Методы полученияИзопрен
CH3
CH3
CH3 CHCH2CH3
CH2 C CH CH2 + H2
-H2
CH3
CH2 C
CH3
CH3 C CH2 + 2CH2O
CH3
CH2 C CHCH3
CHCH3
CH3
+
H
0
100 Ñ
O
O
CH3
CH3
0
300 Ñ CH2
ô î ñô àòû Ña
C CH CH2 + CH2O+ H2O
4,4- äè ì åòè ë -1,3-äè î ê ñàí
42
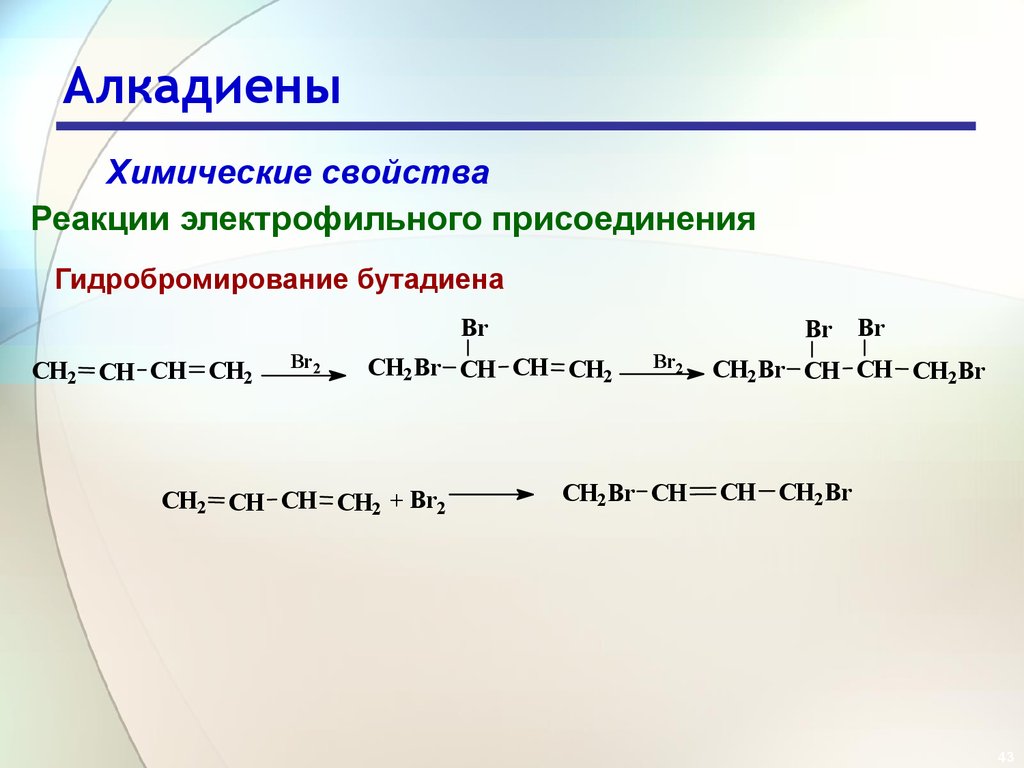
43. Алкадиены
Химические свойстваРеакции электрофильного присоединения
Гидробромирование бутадиена
Br
CH2 CH CH CH2
Br2
Br Br
CH2Br CH CH CH2
CH2 CH CH CH2 + Br2
Br2
CH2Br CH
CH2Br CH CH CH2Br
CH CH2Br
43
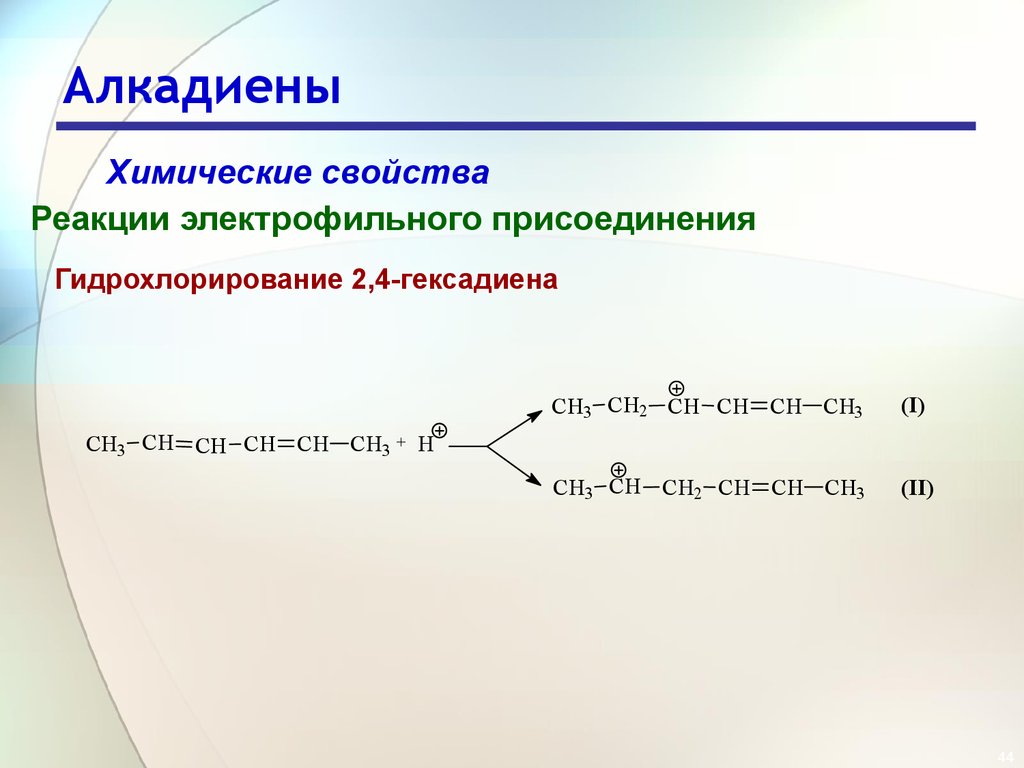
44. Алкадиены
Химические свойстваРеакции электрофильного присоединения
Гидрохлорирование 2,4-гексадиена
CH3 CH2 CH CH CH CH3
(I)
CH3 CH CH2 CH CH CH3
(II)
CH3 CH CH CH CH CH3 + H
44
45. Алкадиены
Химические свойстваРеакции электрофильного присоединения
Гидрохлорирование 2,4-гексадиена
CH2 CH CH3
CH2 CH CH2
CH2 CH CH2
CH2 CH CH2 + e
CH2 CH CH2
CH2 CH CH2
45
46. Алкадиены
Химические свойстваРеакции электрофильного присоединения
Гидрохлорирование 2,4-гексадиена
CH3 CH2 CH CH CH CH3
1
2
3
4
5
6
CH3 CH2 CH CH CH CH3
Cl
Cl
CH3 CH2 CH CH CH CH3
CH3 CH2 CH CH CH CH3
1
2
3
4
5
(III)
6
CH3 CH2 CH CH CH CH3
Cl
Cl
CH3 CH2 CH CH CH CH3
46
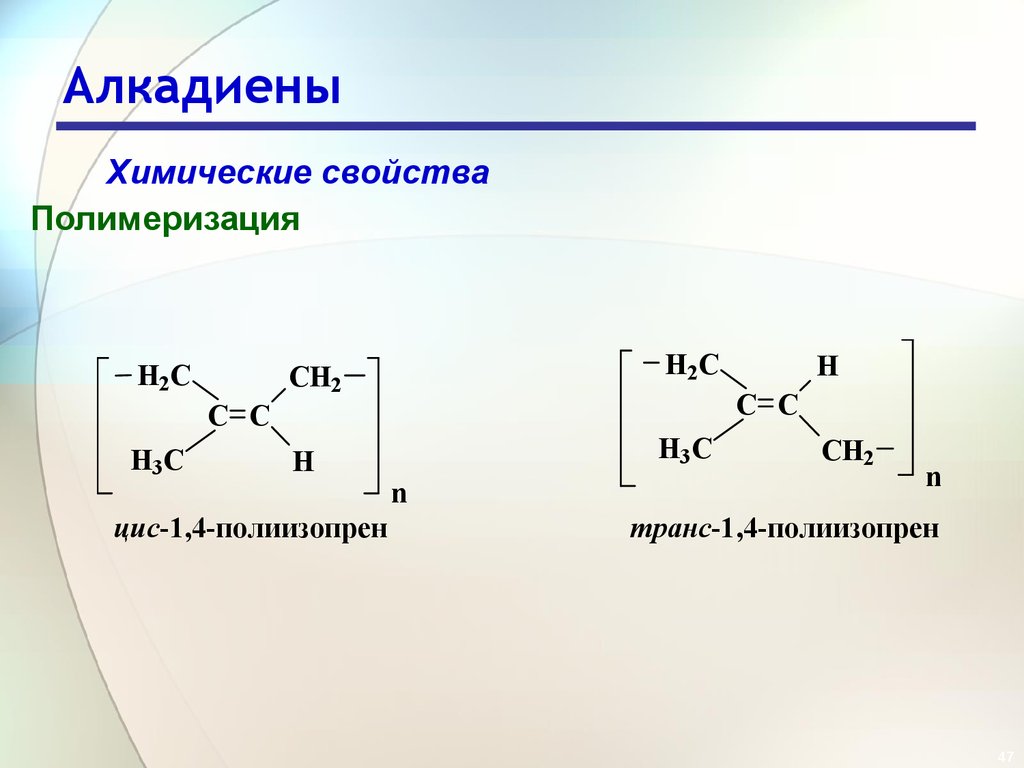
47. Алкадиены
Химические свойстваПолимеризация
H2C
CH2
H2C
H
H3C
C C
C C
H3C
цис-1,4-полиизопрен
H
n
CH2
n
транс-1,4-полиизопрен
47
48. Алкадиены
Химические свойстваРеакция Дильса-Альдера
CH2
CH
CH
CH2
O
CH C
+CH C O
O
O
C
C
O
O
48
























 Химия
Химия








