Похожие презентации:
Окислительно-восстановительные реакции
1. Окислительно-восстановительные реакции
ГБОУ ВПО ТюмГМА Минздрава РоссииКафедра аналитической и органической химии
Химия общая и неорганическая
Окислительновосстановительные реакции
Лекция для студентов 1 курса фармацевтического факультета
2. Классификация реакций
2Все химические реакции можно
разделить на 2 группы, в одних
реакциях степень окисления атомов
остается неизменной (обменные
реакции), а в других реакциях она
меняется – это окислительновосстановительные реакции.
Протекание их связано с переходом
электронов от одних атомов (ионов) к
другим.
2
3.
Процесс отдачи электронов окисление, сопровождается увеличениемположительной степени окисления или
уменьшением отрицательной. Процесс
принятия электронов - восстановление,
сопровождается уменьшением
положительной степени окисления или
увеличением отрицательной.
3
3
4.
Атомы, молекулы или ионы,присоединяющие электроны, называются
окислителями. Атомы, молекулы или ионы,
отдающие электроны, называются
восстановителями.
Окисление всегда сопровождается
восстановлением. Окислительновосстановительные реакции представляют
собой единство двух противоположных
процессов – окисления и восстановления.
4
5. Окислители это:
простые вещества, атомы которых обладаютбольшой величиной электроотрицательности. Это
элементы VII, VI, V групп главных подгрупп, из них
наиболее активные – фтор, кислород, хлор.
сложные вещества, катионы которых находятся в
высшей степени окисления.
Например: SnCl4, FeCl3, CuSO4.
сложные вещества, в анионах которых атом
металла или неметалла находятся в высшей
степени окисления
Например: К2Сr2O7, КМnO4, КNO3, H2SO4.
5
5
6. Восстановители- это:
Элементы I, II, III групп главных подгрупп. Например:Na, Zn, H2, Al.
Сложные вещества, катионы которых находятся в
низшей степени окисления. Например: SnCl2, FeCl2 .
Сложные вещества, у которых анионы достигают
предельной отрицательной степени окисления.
Например:
KI, H2S, NH3 .
Вещества, ионы которых находятся в промежуточных
степенях окисления могут быть как окислителем, так и
восстановителем Например: Na2SO3 .
Мерой восстановительных свойств служит величина
энергии ионизации (это энергия, необходимая для
6последовательного отделения электронов от атома.)6
7. Три типа окислительно-восстановительных реакций.
Три типа окислительновосстановительных реакций.- межмолекулярные,
- внутримолекулярные,
- диспропорционирования
- В межмолекулярных ОВР
элементы
окислитель и восстановитель находятся в
разных веществах. Например:
SnCl2 + 2FeCl3 → SnCl4 + 2FeCl2
2 Fe 3+ + e = Fe 2+
- восстановление
1 Sn 2+ - 2е = Sn 4+
- окисление
7
8.
Внутримолекулярныереакции
происходят с изменением степени
окисления разных атомов в одной и той
же молекуле. Например:
2 КClO3 → 2KCl + 3O2
2 Cl5+ + 6e = Cl 3 2О2- - 4е- = О2
8
- восстановление
- окисление
8
9. Реакции диспропорционирования
протекают с одновременнымуменьшением и увеличением
степени окисления атомов одного
и того же элемента.
3HNO2 → HNO3 + 2NO + H2O
2 N 3+ + e = N 2+ - восстановление
1 N 3+ - 2е = N 5+ - окисление
9
10. Влияние среды на характер протекания ОВР
- ОВР могут протекать в различныхсредах: в кислой (избыток Н3О+ - ионов),
нейтральной (Н2О) и щелочной (избыток
ОН- - ионов).
В зависимости от среды может
меняться характер протекания реакции
между одними и теми же веществами.
Среда влияет на изменение степени
окисления атомов.
10
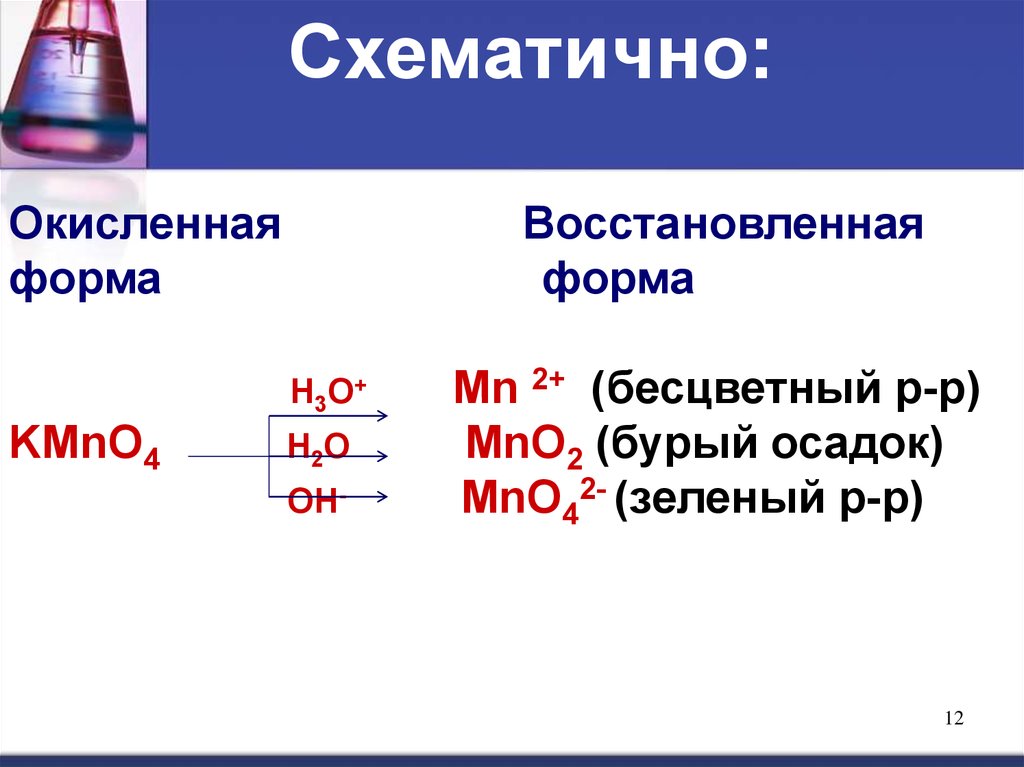
11. Рассмотрим несколько примеров.
KMnO4 (перманганат калия) являетсясильным окислителем, в сильнокислой
среде восстанавливается до ионов Мn2+,
в нейтральной среде - до MnO2 (оксида
марганца IV) и в сильно щелочной среде
- до МnО42- (манганат-иона).
1.
11
12.
Схематично:Окисленная
форма
Восстановленная
форма
Н3О+
KMnO4
Н2О
ОН-
Мn 2+ (бесцветный р-р)
MnO2 (бурый осадок)
МnО42- (зеленый р-р)
12
13. Окислительно- восстановительная двойственность пероксида водорода
Окислительно- восстановительнаядвойственность пероксида водорода
Пероксид водорода как окислитель.
Н –О
|
Н– O
Н+
+
ОН-
2Н2О
2ОН-
Н2О2 + 2Н3О+ + 2е = 4Н2О
Н2О2 + 2е = 2ОН-
Пероксид водорода как восстановитель.
Н –О
|
Н –O
13
Н+
O2 + 2Н3О+ ; Н2О2 - 2е + 2Н2О = O2 + 2Н3О+
+
ОН- O2 + 2Н2О;
Н2О2 + 2ОН- - 2е = O2 + 2Н2О
13
14. Окислительные свойства К2СrО4 и К2Сr2О7
3. Хромат калия К2СrО4 и дихромат калияК2Сr2О7 - сильные окислители. В кислых и
щелочных растворах соединения Сr(III) и
Сr(VI) существуют в разных формах.
Окисленная
Восстановленная
форма
форма
Cr2O72- + H3O+
2 Cr 3+
CrO42- + OHCr(OH)3, CrO2-, [Cr(OH)6]3
14
14
15. К2Сr2О7
1515
16. Метод электронно-ионного баланса (метод полуреакций).
Метод электронно-ионногобаланса (метод полуреакций).
Реакции, протекающие в кислой среде.
Правило: если реакция протекает в кислой
среде, то можно оперировать ионами Н3О+
(Н+) и молекулами воды. Ионы Н3О+ (Н+)
записывают в той части уравнения
полуреакции, где есть избыток кислорода,
молекулы воды записывают
соответственно в той части, где кислорода
нет или есть недостаток его. Причем
количество Н3О+ (Н+) берется в два раза
больше, чем количество избыточных атомов
16
кислорода.
17.
Пример 1.КМnO4 + Na2SO3 + H2SO4 = MnSO4 + K2SO4 + …
ок
вос
среда
Решение
2
MnO4- + 8H+ + 5e = Mn2+ + 4H2O
5
SО32- + Н2О – 2е = SО42- + 2Н+
2MnО4- +16H++5SО32-+5Н2О=2Mn2++8H2O+5SO42- +10H+
2КMnО4 + 5Nа2SО3 + 3Н2SО4 = 2MnSO4 + К2SO4 +5Na2SO4
+ 3H2O
КMnО4 –окислитель, вос-ся; Nа2SО3 –восстановитель, окис-ся
17
18. Пример 2.
Na2Cr2O7 + KBr + H2SO4 = Cr2(SO4)3 + Br2 + …ок.
вос.
среда
Решение.
1| Cr2O72- + 14H+ + 6e = 2Cr3+ + 7H2O
3| 2Br- - 2e = Br2
Cr2O72- + 14H+ + 6Br- = 2Cr3+ + 7H2O + 3Br2
Na2Cr2O7 + 6KBr + 7 H2SO4 = Cr2(SO4)3 + 3Br2 +
3 К2SO4 + Na2SO4 + 7H2O
Na2Cr2O7 - окислитель, восстанавливается;
18KBr - восстановитель, окисляется.
18
19. Реакции, протекающие в щелочной среде.
Правило: если реакция протекает вщелочной среде, то можно оперировать
ионами ОН- и молекулами воды. Ионы ОНзаписываются в той части уравнения
полуреакции, где есть недостаток
кислорода, молекулы воды записываются
соответственно в той части, где
кислорода больше. Причем, на каждый
недостающий атом кислорода записывают
два иона ОН-.
19
19
20. Пример 1.
Cr2O3 + KNO3 + KOH = K2CrO4 + KNO2 + …вос.
ок.
среда
Решение.
3 | NO3- + H2O + 2e = NO2- + 2OH1 | Cr2O3 + 10 OH- -6e = 2CrO4 2- + 5H2O
3NO3-+3H2O+Cr2O3+10OH-=3NO2-+6OH-+ 2CrO42- + 5 H2O
Cr2O3 + 3KNO3 + 4 KOH = 2 K2CrO4 + 3 KNO2 + 2 H2O
Cr2O3 - восстановитель, окисляется;
KNO3 - окислитель, восстанавливается.
20
21. Пример 2.
КMnО4 +Na2SO3 + KOH = K2MnO4 + Na2SO4 +ок.
вос.
среда
Решение.
…
2 | MnO4- + 1e = MnO4 21 | SO32- + 2OH- - 2e = SO4 2- + H2O
2MnO4- + SO3
2-
+ 2 OH- = 2 MnO4 2- + SO4 2- + H2O
2 KМnO4 + Na2SO3 + 2 KOH = K2MnO4 + Na2SO4 + H2О
21
22. Реакции, протекающие в нейтральной среде.
22Правило: если реакция протекает в нейтральной среде,
следует оперировать только молекулами воды. Причем
избыток кислорода в окислителе связывается молекулами
воды, за счёт ионов Н3О+ (Н+), на каждый избыточный атом
кислорода расходуется одна молекула воды, которая
ставится в левую часть уравнения полуреакции, в растворе
накапливаются ОН- - ионы и ставятся они в правую часть
уравнения полуреакции. Недостаток кислорода
восстановитель восполняет из молекул воды за счет ОН- ионов, на каждый недостающий атом кислорода расходуется
одна молекула воды, которая ставится в левую часть
уравнения полуреакции, в растворе накапливаются ионы
Н3О+ (Н+) и ставятся они в правую часть уравнения
полуреакции.
22
23. Пример 1.
KMnO4 + Na2SO3 + H2O = MnO2 + Na2SO4 + …ок.
вос.
Решение.
2 | MnO4- + 2H2O +3e = MnO2 + 4 OH3 | SO32- + H2O -2e = SO42- + 2 H+
2 MnO4-+4H2O+3SO32-+3H2O=2MnO2 +8OH- + 6H++ 3SO42
2KMnO4 +3Na2SO3 + H2O = 2 MnO2 + 3 Na2SO4 + 2 KOH
КMnО4–окислитель, вос-ся;
23
Nа2SО3–восстановитель, окис-ся
23
24. Пример 2.
MnSO4 + KMnO4 + H2O = MnO2 + K2SO4 + …вос.
ок.
среда
Решение.
2 | MnO4- + 2 H2O + 3e = MnO2 + 4 OH3 | Mn2+ + 2 H2O - 2e = MnO2 + 4 H+
2MnO4- +4H2O+3Mn2++6H2O=2MnO2+8OH-+3MnO2+12H+
3MnSO4+2KMnO4+2H2O=5MnO2+K2SO4+2H2SO4
MnSO4 - восстановитель, окисляется;
KMnO4 – окислитель, восстанавливается.
24
25.
Теория возникновенияравновесных электродных и
окислительно-восстановительных
потенциалов
Определение направления
окислительно-восстановительного
процесса
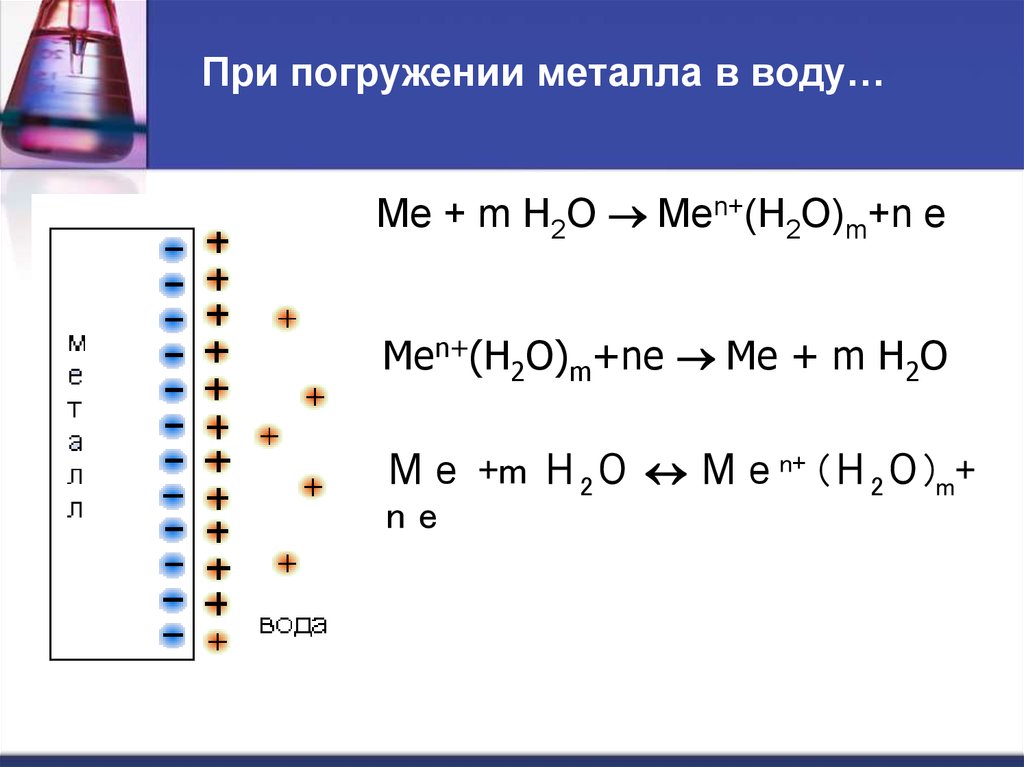
26. Механизм возникновения электродного потенциала
Ме Меn+ + n e27. При погружении металла в воду…
Ме + m Н2О Меn+(Н2О)m+n eМеn+(Н2О)m+ne Ме + m Н2О
Ме +m Н2О Меn+ (Н2О)m+
ne
28. Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом.
29. Если металл погрузить в раствор его соли, то процессы протекающие на границе «металл – раствор», будут аналогичными.
ZnCu
Для сравнения электродных
потенциалов различных
металлов выбирают
стандартные условия:
температура - 250 С, давление
- 101,3 кПа, активность
одноименного иона - 1 моль/л.
Разность потенциалов,
возникающая между
металлом и раствором в
таких условиях называется
стандартным электродным
потенциалом.
30. Стандартный электродный потенциал
31. Стандартный электродный потенциал (Е0)- это ЭДС гальванического элемента, составленного из данного электрода и электрода сравнения. В каче
Стандартный электродный потенциал (Е0)- это ЭДСгальванического элемента, составленного из данного электрода и
электрода сравнения. В качестве электрода сравнения
используют нормальный водородный электрод (нвэ):
H2 2H+ + 2e
Pt (H2) | 2H+
Н2
Платиновый электрод,
покрытый платиновым
порошком, в водном
растворе кислоты с
с(Н+) = 1 моль/л и
омываемый
газообразным водородом
(р = 1 атм)
при 298 К
32. Ряд стандартных электродных потенциалов металлов
LiBa
Na
Zn
Fe
Pb
-3,04
-2,90
-2,71
-0,76
-0,44
-0,13
Li+
Ba2+
Na+
Zn2+
Fe2+
Pb2+
H2
0
2H+
Cu
Ag
Au
+0,34
+0,80
+1,5
Cu2+
Ag+
Au3+
33.
Величина потенциала в реальных условияхрассчитывается по уравнению Нернста:
E Me n / Me E
0
Me n / Me
RT
ln a Me n
nF
Переходной множитель от ln к lg
RT
при 20 С :
2,303 0,058
F
RT
0
при 25 С :
2,303 0,059
F
0
E Me n / Me E
0
Me n / Me
0,059
lg a Me n
n
34.
E0
Men / Me
- стандартный электродный потенциал,
измеренный при стандартных условиях :
Т 298 К
aMen 1 моль/л
F 96500 Кл / моль
Дж
R 8,314
моль К
35. Если известен потенциал водородного электрода, можно рассчитать рН раствора:
E2 H / H E2
0
2H / H2
0,059 lg a H
=0
lg a H pH
pH
E2 H / H 0
2
0,059
36. Хлорсеребряный электрод (ХСЭ)
Ag, AgCl | KClЭлектрод второго рода
AgCl
KCl
Ag
При погружении в раствор
соли одноименного
аниона его потенциал
будет определяться
активностью аниона в
растворе.
37.
Ag Ag+ + e(1)
Ks
AgCl Ag+ + Cl-
(2)
KCl K+ + Cl-
(3)
Чем больше концентрация KCl, тем больше концентрация Cl- , тем
меньше растворимость AgCl и меньше концентрация Ag+. [Ag+] в этих
условиях очень мала и практически неопределяема. Потенциал,
возникающий на границе Ag|Ag+ определяется уравнением Нернста:
E х.с. Е
0
Ag
Ag
RT
ln a Ag
nF
38.
K s a Ag aCl ; a AgEх.с. Е
Eх.с. Е
0
Ag
0
Ag
Ag
Ag
Ks
aCl
RT K s
ln
nF aCl
RT
RT
ln K s
ln aCl
nF
F
0,222
E х.с. 0,222 0,059 lg a Cl
39. [Cl-] [Ag+] E х.с.
[Cl-] [Ag+] E х.с.Значение потенциала хлорсеребряного
электрода при разных концентрациях водного
раствора KCl при Т= 298 К
40. Гальванические элементы
ИзометаллическиеБиметаллические
41. Гальванический элемент (биметаллический)
Анод: Zn - 2e = Zn2+Катод: Cu2++2e = Cu
Zn + Cu2+ = Zn2+ + Cu
Граница раздела фаз
-Zn|ZnSO4||CuSO4 |Cu +
Устранен диффузионный
потенциал
р-р ZnSO4
р-р CuSO4
42. Мерой работоспособности ГЭ элемента является ЭДС или разность потенциалов электродов:
ЕГЭ Екатода Еанода;ЕГЭ Е
0
0
кат .
Е
0
если Е0Zn 2 / Zn 0,76 B ; ECu
0,34,
2
/ Cu
то, Е
0
ГЭ
0,34 ( 0,76) 1,1 B
0,059
E Zn 2 / Zn Е
lg a Zn 2
n
0,059
0
ECu2 / Cu ЕCu2 / Cu
lg a Cu2
n
0
Zn 2 / Zn
E ГЭ
0,059 a Cu2
1,1
lg
n
a Zn 2
0
ан.
43. Концентрационный гальванический элемент (изометаллический)
Анод: Zn Zn2+(0,1н) +2eКатод: Zn2+(1н) +2e Zn
Zn2+(1н) Zn2+(0,1н)
- Zn|Zn2+(0,1н)||Zn2+(1н)|Zn +
p-p ZnSO4 0,1 н (a1)
p-p ZnSO4 1 н (a2)
a1 < a 2
44.
E Zn 2 / Zn E0
Zn 2 / Zn
E Zn 2 / Zn E
0
Zn 2 / Zn
E ГЭ
0,059
lg a Zn 2 (a 2 )
n
0,059
lg a Zn 2 (a1 )
n
0,059 a 2
lg
n
a1
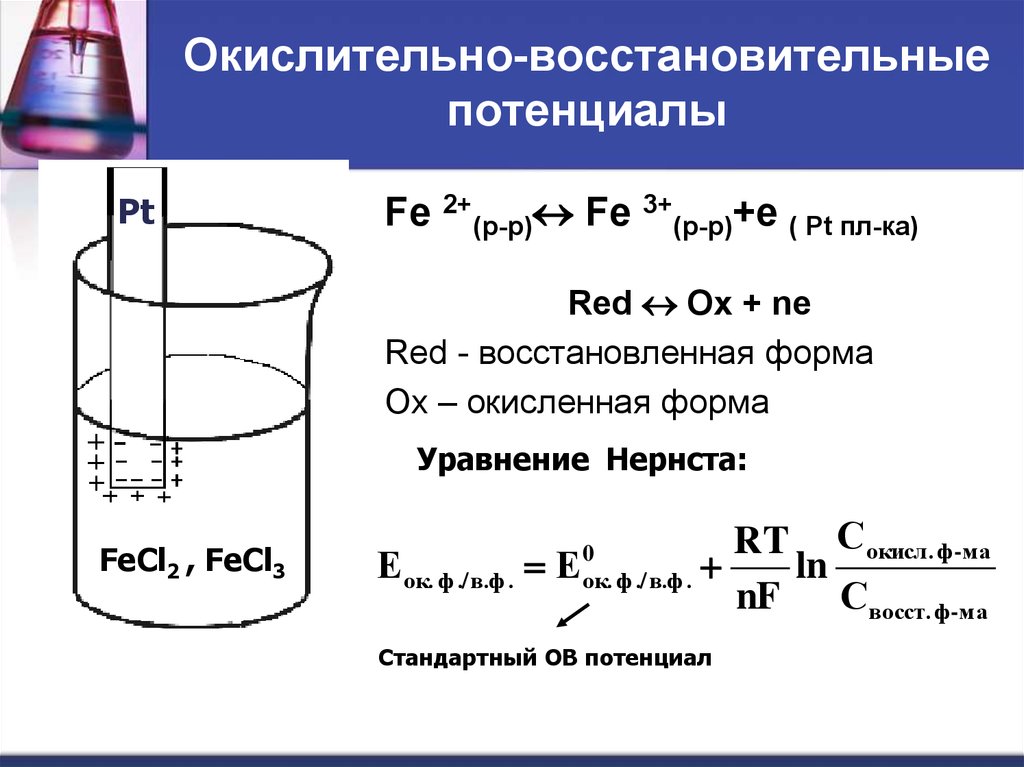
45. Окислительно-восстановительные потенциалы
PtFe 2+(р-р) Fe 3+(р-р)+е ( Pt пл-ка)
Red Ox + ne
Red - восстановленная форма
Ox – окисленная форма
Уравнение Нернста:
FeCl2 , FeCl3
Е ок. ф ./ в.ф . Е
0
ок. ф ./ в.ф .
RT Сокисл. ф-ма
ln
nF
Свосст. ф-ма
Стандартный ОВ потенциал
46. Вальтер Фридрих Герман Нернст (1864-1941)
47. ОВ потенциал зависит от:
температурыприроды окислителя и восстановителя
концентрации окисленной и
восстановленной форм
рН среды
48. Стандартный ОВ потенциал
ЭДС ГЭ, составленного из окислительновосстановительнойсистемы,
содержащей
окисленную и восстановленную формы в
концентрациях 1 моль/л и НВЭ – есть
стандартный ОВ потенциал данной ОВ
системы
49.
Если составить ГЭ из MnO4-/Mn2+ и (Pt),H2|2H+,то стандартный ОВ потенциал = +1,51 В.
MnO4- + 8H+ +5e Mn2+ + 4H2O
a(MnO4-)= a(Mn2+)=1 моль/л
а(H+)= 1 моль/л
50. В реальных условиях расчет ОВ потенциала системы MnO4-/Mn2+ производится по уравнению Нернста:
Е MnO / Mn 24
4
8
RT [ MnO ][ H ]
1,51
ln
2
5F
[ Mn ]
51.
Чем больше стандартный ОВпотенциал системы, тем в большей
степени выражены ее окислительные
свойства в стандартных условиях.
Например,
MnO4-/Mn2+
Fe3+/Fe2+
Sn4+/Sn2+
E0= 1,51 B
E0= 0,77 B
E0= 0,15 B
52. Критерии самопроизвольного протекания ОВ реакций
G 0G реакции Gпрод. Gисх . в.
G Аполезная Аэл.
Аэл. q E
q nF
Переносимый эл.
заряд
Эл. работа по
переносу электронов
Разность потенциалов
между электродами
Число электронов, переходящих в
элементарном акте ОВР
E Eок ля Ев ля
G nF E
если G 0, то E 0
53. Пример:
3Со / Co
2
E
0
( ок., в .)
1,84 В
Fe 3 / Fe 2 E (0ок., в.) 0,77 В
Со
3
окислитель
Fe
2
2
восстанови тель
Е Е
Е 0, следовательно, реакция протекает
0
ок.
Е
Co Fe
3
0
восс .
1,84 0,77 1,07
самопроизвольно слева направо
54. Глубина протекания ОВ реакций
А В С DK х. р.
[C ][ D ]
; G 0 RT ln K х. р.
[ A][ B ]
0
G
nF E
RT ln K х. р. nF E nF ( Eок0 л я Eв0 л я )
nF ( Eок0 л я Eв0 л я )
ln K х. р.
RT
ln K х. р. тем больше, чем больше разность Eок0 л я Eв0 л я ,
а K х. р. оценивает глубину протекания хим. реакции
55. Окислительно-восстановительные ГЭ
Окислительновосстановительные ГЭ56. 2KI + 2FeCl3 I2 + 2FeCl2+2КCl
2KI + 2FeCl3 I2 + 2FeCl2+2КCle
Pt
Pt
e
KI
2I- -2e I2
I2 | 2I-
e
FeCl3
Fe3++e Fe2+
Fe3+ | Fe2+
При замыкании цепи в
левом полуэлементе идет
процесс окисления - Iотдавая электроны
платине, превращаются в
I2, в результате пластинка
заряжается условно
отрицательно.
В правом полуэлементе
Fe3+ забирает электроны с
пластинки превращаясь в
Fe3+ , пластинка заряжается
условно положительно.
Система стремится
выровнять заряды на
пластинках за счет
перемещения электронов
по внешней цепи.
57. Ионоселективные электроды
58. Стеклянный электрод
R(Na+, Li+) + H+ R(H+) + Na+, Li+Стеклянный
корпус электрода
мембрана
раствор
мембрана
раствор
Ag AgCl, 0,1 M HCl стекло H+,раствор
1
2
3
стекл.= 1+ 2+ 3
Внутренний р-р
0,1 М НCl
1- потенциал внутреннего хлорсеребряного
электрода (const)
2- потенциал внутренней поверхности
стеклянной мембраны (const)
ХСЭ
3 - потенциал наружной поверхности
стеклянной мембраны (переменная)
1+ 2 = К
стекл.= К + 0,059 lg a(H+) или
Электродное стекло
(мембрана)
стекл.= К - 0,059 рН
59. Определение рН в лабораторном практикуме
К измерительномуприбору
ЭДС представленной цепи Ецепи:
Е цепи= Е х.с. – Е ст.
Ецепи= Е х.с. – К + 0,059рН
рН
Е цепи Е х .с. К
0,059
Е цепи const
0,059
60.
БЛАГОДАРЮ ЗАВНИМАНИЕ !
60
60




































![[Cl-] [Ag+] E х.с. [Cl-] [Ag+] E х.с.](http://cf.ppt-online.org/files/slide/t/t9qD5VBYTFRc8pCuNxPwnfr7AeLovsHGMkWIzl/slide-38.jpg)




















 Химия
Химия








