Похожие презентации:
Растворы. Квалификации химических веществ:
1. Растворы
к.х.н., доц. Губанов Александр Иридиевич2. Растворы вокруг нас
Все природные жидкости - растворы3. Существуют ли чистые вещества?
Квалификации химических веществ:
«Тех.» Техн. чистый. Не менее основного вещества70%
«Ч.» Чистый. >98%
«Ч.д.а.» Чистый для анализа. Около 98% в зависимости от
области применения.
• «Х.ч.» Химически чистый. >99%
• «Осч.» Особо чистый. >99.99%
4. Абсолютно чистых веществ нет!
Видишь суслика? — Нет. — И я не вижу. А он есть!5. Классификация растворов
• Истинные и коллоидные растворы• Растворы электролитов и неэлектролитов
– Растворы сильных и слабых электролитов
• Окрашенные и бесцветные растворы.
• И.т.д.
• Все классификации условны – растворы так
проще описывать.
6. Что такое раствор?
• Смесь, как минимум, двух веществ.• Чем отличается раствор от смеси?
– Однородный.
– Растворенное вещество не видно ни визуально,
ни под микроскопом.
– Частицы растворенного вещества свободно
перемещаются.
– Стабильный.
7. Что такое раствор?
• Фаза – однородная область пространства.• Фаза – область пространства, описываемая
единой термодинамической функцией.
• Компоненты (в термодинамике и химии),
независимые компоненты - химически
индивидуальные вещества, из которых
состоит термодинамическая система
8. Что такое раствор?
• Компонентами называют не общее числосоставляющих систему веществ, а такое их число,
которое достаточно для выражения состава любой
фазы системы.
• Так, в системе из CaO и СО2 образуется соединение
(карбонат кальция) по реакции CaO + CO2 = CaCO3. В
этой системе за независимые компоненты можно
принять CaO и CO2, а CaCO3 рассматривать как
продукт их соединения. С равным правом за
компоненты можно принять CaO и CaCO3, а
CO2 считать продуктом термической диссоциации
CaCO3.
9. Что такое раствор?
• Раствор – многокомпонентная однофазнаясистема.
• Чем раствор отличается от соединения и
смеси?
– Раствор углерода в железе – сталь.
– Соединение углерода с железом – карбид
железа (белый чугун)
– Смесь железа с углеродом – серый чугун.
10.
Типичные структуры железоуглеродистых сплавов. Сталь с 0,65%С (сетка феррита и перлит). Увеличено в 150 раз.
Цементит, Fe3C
Серый чугун с шаровидным графитом на
ферритной основе.
11. Примеры растворов и смесей
Рассол (свежеприготовленный)Питьевая вода
Водка
Золото 585 пробы
Дюралюминий
Березовый сок
Стекло
Иод
«Зеленка»
Белильная известь
Молоко
Нефильтрованное
пиво
Древесина
Кость
Кровь
Томатный сок
Мясной бульон
12. Коллоидные растворы
• Это смеси. Очень тонкие.• Растворы промежуточные между истинными растворами и взвесями с
размером растворенных частиц от 1 до 100 нм.
Растворенное вещество
растворитель
Газ
Жидкость
Твердое тело
Газ
-
Пар
Аэрозоль
Жидкость
Пена
Эмульсия
Суспензия
Твердое тело
Твердая пена
Гель
Смесь
• Коллоидные растворы либо не прозрачны, либо рассеивают свет.
13. Истинные растворы
• Истинные растворы – однофазные,термодинамически устойчивые системы,
неограниченно стабильные во времени.
• Прозрачные системы.
• Движущими силами образования
растворов являются:
– энтропийный ∆Sсмеш= -R(xlnA+(1-x)lnB)
– и энтальпийный факторы
∆H = ∆H(A-A) + ∆H(A-A) - ∆H(A-B).
14. Истинные растворы
• В химической практике наиболее важнырастворы, приготовленные на основе жидкого
растворителя. Именно жидкие смеси в химии
называют просто растворами. Наиболее
широко
применяемым
неорганическим
растворителем является вода. Растворы с
другими
растворителями
называются
неводными.
• Если растворитель твердое вещество – то
образуется твердый раствор. Мы их изучать не
будем.
15. Исинные растворы
• В конце XIX века в науке существовало 2 полярных взгляда наприроду растворов. Один (Менделеев) объяснял свойства растворов
образованием химических соединений растворителя с растворенным
веществом. Другой (Аррениус, Вант-Гофф) предлагал рассматривать
растворенное вещество как газ, частицы которого разделены
инертным растворителем.
• Сейчас очевидно, что во многих реальных растворах имеют место
специфические межмолекулярные взаимодействия, т.е. такие
взаимодействия, причиной которых являются химические свойства
конкретных молекул. Они не могут быть описаны с применением
какого-либо универсального потенциала, который пригоден во всех
случаях.
























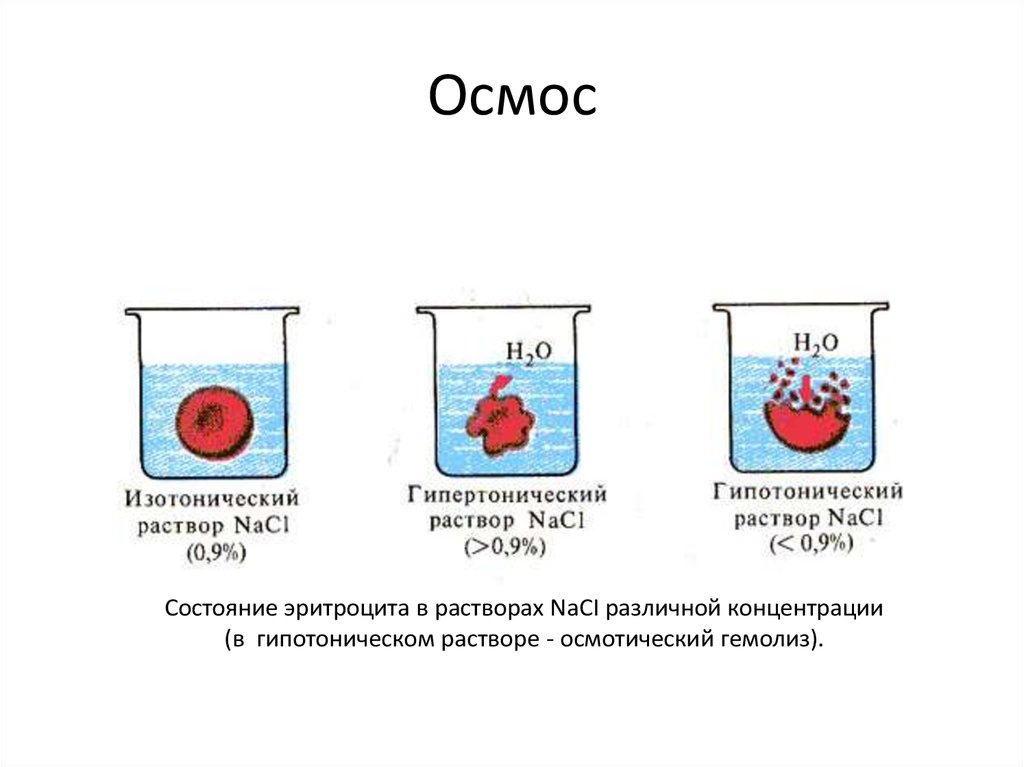

 Химия
Химия








