Похожие презентации:
Щелочноземельные металлы
1.
2.
Какие утверждения верны:У атомов металлов на внешнем уровне 1-3 электрона.
Металлы являются восстановителями и окислителями.
Для металлов характерна металлическая кристаллическая решетка.
Металлы обладают электропроводностью и теплопроводностью.
При взаимодействии с кислородом металлы принимают электроны.
Все металлы активно взаимодействуют с кислотами.
Металлы
Ag не
не взаимодействуют
взаимодействуют сс водой
водой даже
даже при
при нагревании.
нагревании.
Металлы Сu,
Сu, Au, Ag
Na, K относятся к щелочноземельным металлам.
3.
Щелочноземельныеметаллы
4. Цели урока:
1.2.
Изучить физические, химические
свойства
щелочноземельных
металлов;
Узнать
о
применении
щелочноземельных металлов и их
соединений.
5.
БериллийМагний
Барий
Радий
Кальций
Стронций
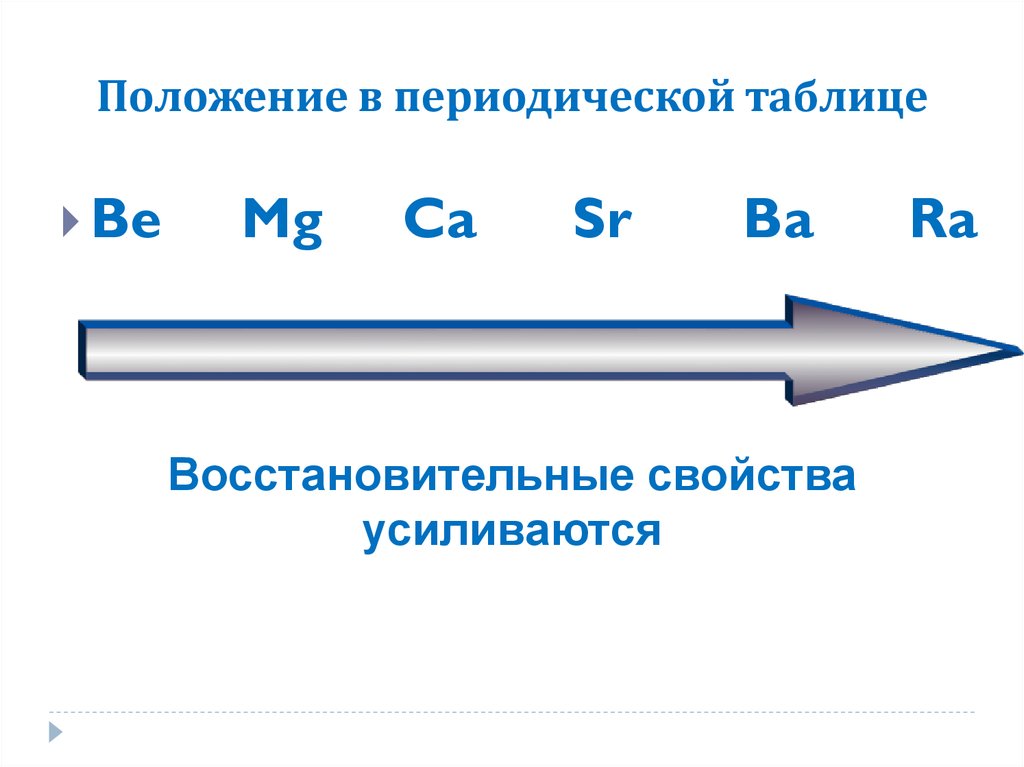
6. Положение в периодической таблице.
В периодической системе находятся в главной подгруппе IIгруппы.
Являются сильными восстановителями, отдают 2 ē, во всех
соединениях проявляют степень окисления +2.
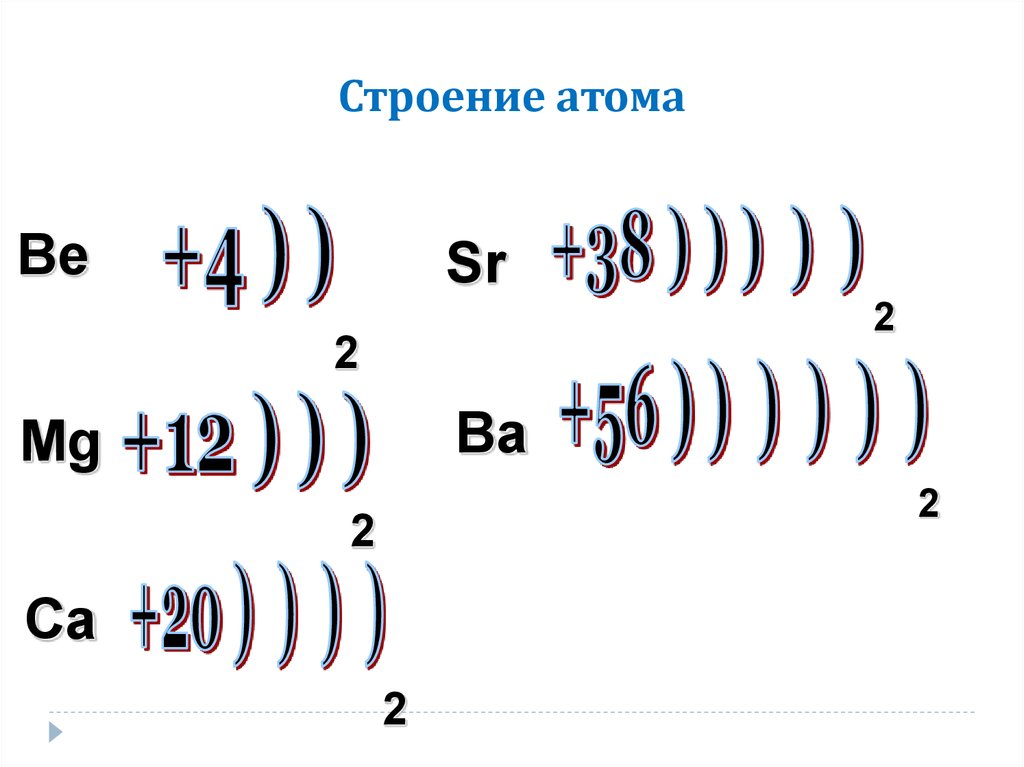
Общая конфигурация внешнего энергетического уровня nS²
Mg +12 )2ē)8ē)2ē
Ca +20 )2ē) 8ē) 8 ē)2ē
Sr +38 )2ē) 8ē)18 ē) 8ē)2ē
Ba +56 )2ē) 8ē) 18 ē) 18 ē) 8ē) 2ē
7. Положение в периодической таблице
BeMg
Ca
Sr
Ba
Восстановительные свойства
усиливаются
Ra
8. Строение атома
ВеSr
2
2
Ba
Mg
2
2
Ca
2
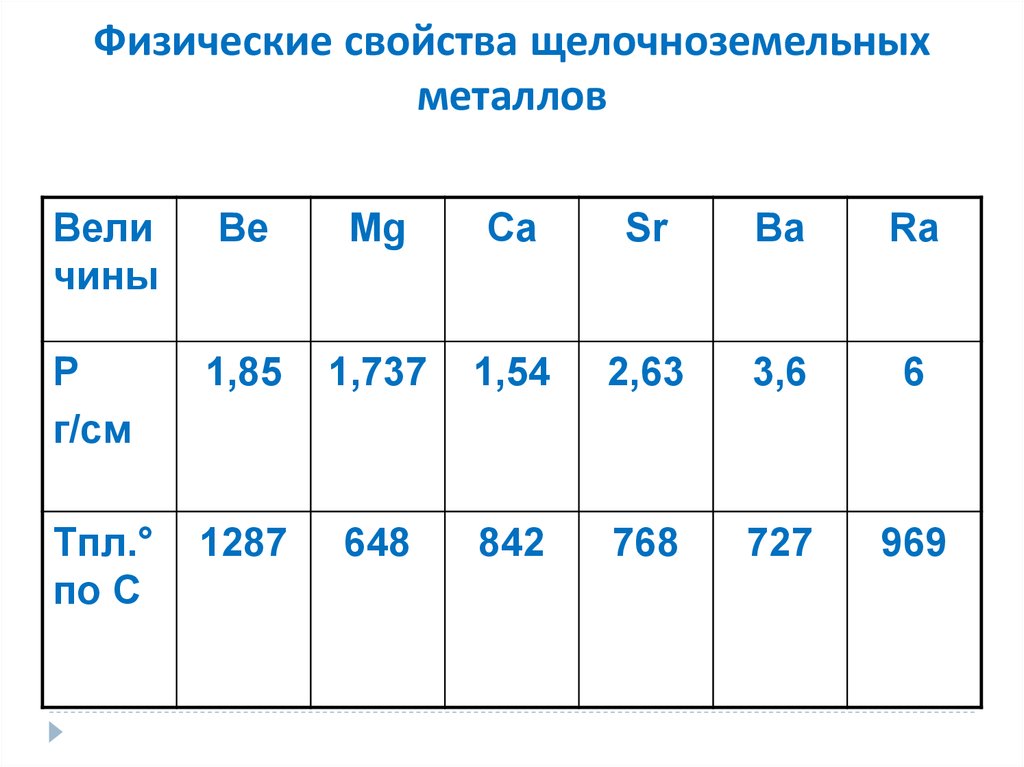
9. Физические свойства щелочноземельных металлов
Величины
Be
Mg
Ca
Sr
Ba
Ra
Ρ
г/см
1,85
1,737
1,54
2,63
3,6
6
Tпл.°
по С
1287
648
842
768
727
969
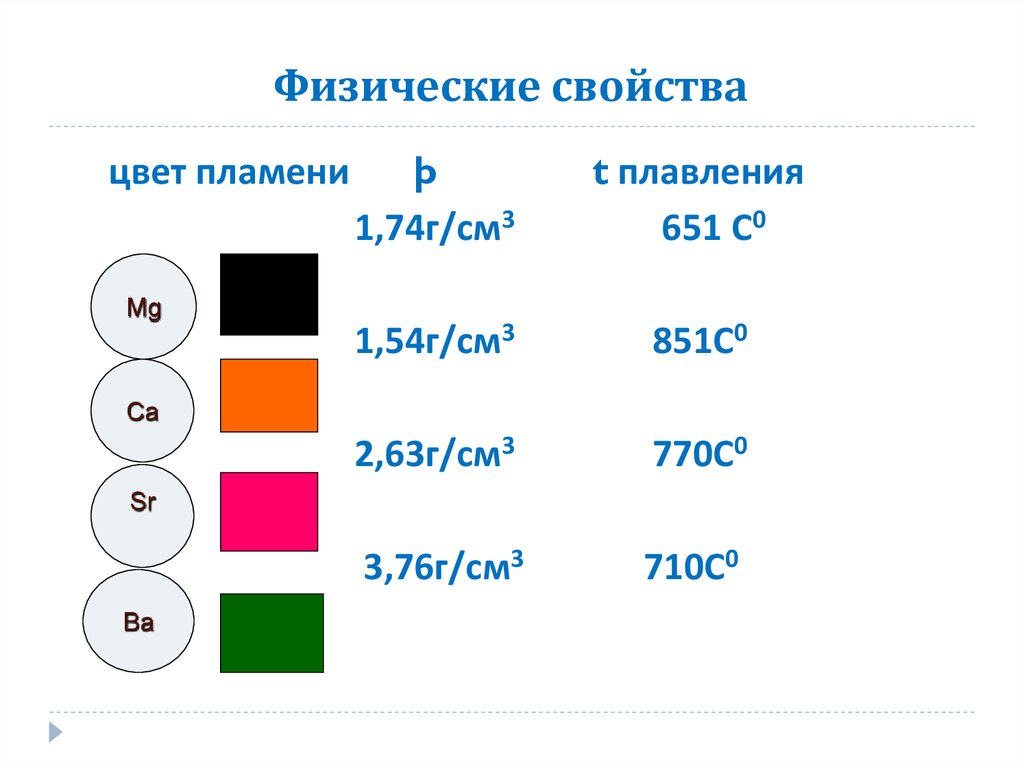
10. Физические свойства
цвет пламениMg
þ
1,74г/см3
t плавления
651 С0
1,54г/см3
851С0
2,63г/см3
770С0
3,76г/см3
710С0
Ca
Sr
Ba
11. Нахождение в природе
Бериллий: 3BeO • Al2O3 • 6SiO2 – бериллМагний: MgCO3 – магнезит
Кальций: CaCO3 • MgCO3 – доломит
KCl • MgSO4 • 3H2O – каинит
KCl • MgCl2 • 6H2O – карналлит
CaCO3 – кальцит (известняк, мрамор, мел.)
Ca3(PO4)2 – апатит, фосфорит
CaSO4 • 2H2O – гипс
CaSO4 – ангидрит
CaF2 – плавиковый шпат (флюорит)
Стронций: SrSO4 – целестин
SrCO3 – стронцианит
Барий: BaSO4 – барит
BaCO3 – витерит
12. Химические свойства
1.С простыми веществами(неметаллами)
2Me0 +O2 → 2Me+2O-2 - оксид
Me0 +H2 → Me+2H2 - гидрид
Me0 +Cl02 → Me+2Cl2 - хлорид
Me0 +S0 → Me+2S-2 - сульфид
2. Со сложными веществами
Me0 +2HCl → Me+2Cl2 + H2
Me0 +2HOH → Me+2(OH)2 +Н2
13. Соединения щелочноземельных металлов
Оксиды щелочноземельных металлов –МеО, имеютосновный характер, легко реагируют с оксидами неметаллов
с образованием соответствующих солей.
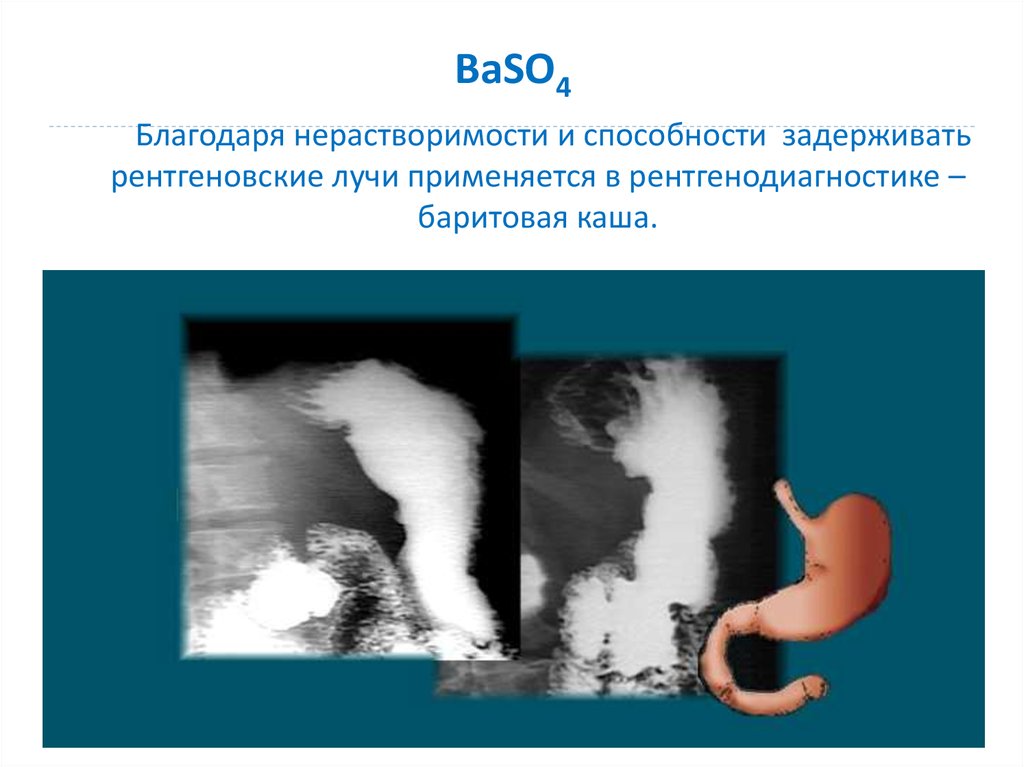
14. BaSO4
Благодаря нерастворимости и способности задерживатьрентгеновские лучи применяется в рентгенодиагностике –
баритовая каша.
15. Ca3(PO4)2
Входит в состав фосфоритов и апатитов, а также в составкостей и зубов. В организме взрослого человека содержится
1 кг Са в виде фосфата кальция.
16. CaCO3
Карбонат кальция – одно из самых распространённых наЗемле соединений. Его содержат горные породы – мел,
мрамор, известняк.
17. CaSO4∙ 2H2O
Встречается в природе в виде минерала гипса,представляющего собой кристаллогидрат. Используется в
строительстве, в медицине для наложения гипсовых повязок,
для получения слепков.
18. MgCO3
Широко применяется в производстве стекла, цемента,кирпича, а также в металлургии для перевода пустой породы
в шлак.
19. Са(ОН)2
Гидроксид кальция или гашёная известь с песком и водойназывается известковым раствором и широко используется в
строительстве. При нагревании разлагается на оксид и воду.
20.
21.
22.
Изучили физические свойства:все ЩЗ металлы имеют серебристый цвет,
кроме Sr и Ba, и мягкие, кроме Be;
Изучили, с чем реагируют ЩЗ металлы:
с кислородом,
галогенами, водородом,
серой, азотом, водою и с кислотами;
Узнали о применении ЩЗ металлов и их
соединений.
23.
Заполни пропуски!O2 = 2CaO
1) 2 Ca + …
2) 3 Be
…+…
N2 = Be3N2
H2
3) Mg + H…
2SO4 = MgSO4 + …
24. Домашнее задание
§13 стр 61.31,2 письменно2.
*Подготовить об истории открытии ЩЗ
металлов по вариантам:
I вариант – Be,
II вариант – Mg,
III вариант – Ca,
IV вариант – Sr,
V вариант – Ba,
VI вариант - Ra
1.



















 Химия
Химия








