Похожие презентации:
Спирти. Одноатомні насичені спирти (алканоли)
1. СПИРТИ
• Спирти похідні вуглеводнів, у молекулах якиходин або декілька атомів водню заміщені на
гідроксильну групу (-ОН).
Число гідроксильних груп визначає атомність
спиртів. Одноатомні спирти містять у молекулі
одну ОН-групу (С2Н5ОН), двоатомні - дві ОН-групи
(СН2ОН-СН2ОН), триатомні - три ОН групи (СН2ОНСНОН-СН2ОН).
2. ОДНОАТОМНІ НАСИЧЕНІ СПИРТИ (АЛКАНОЛИ)
• Їх загальна формулаR-ОН
• Залежно від природи вуглеводневого радикалу, з яким
зв’язана ОН-група, розрізняють первинні, вторинні та
третинні спирти.
СН3
│
СН3—СН2—ОН
СН3—СН—СН3
СН3—С—ОН
│
│
ОН
СН3
Первинний спирт Вторинний спирт Третинний спирт
3.
• За замісниковою номенклатурою назвуодноатомних насичених спиртів утворюють від
назви відповідного насиченого вуглеводню
(алкану) з додаванням закінчення -ол.
Головний ланцюг нумерується з того кінця,
ближче до якого міститься ОН-група.
• Широкого розповсюдження набули також
назви за радикало-функціональною
номенклатурою. Для утворення назви спирту
називають вуглеводневий залишок,
сполучений з ОН-групою, додають суфікс –
овий і слово спирт.
4.
ФормулаСН3 ОН
СН3-СН2-ОН
СН3-СН2-СН2-ОН
CH3-CH-CH3
Номенклатура
Замісникова
Радикало-функціональна
Метанол
Етанол
Метиловий спирт
(карбінол)
Етиловий спирт
1-Пропанол
Пропіловий спирт
2-Пропанол
Ізопропіловий спирт
1-Бутанол
Бутиловий спирт
2-Метил-1пропанол
Ізобутиловий спирт
2-Метил-2пропанол
трет-Бутиловий спирт
ОН
СН3-СН2-СН2-СН2-ОН
CH3-CH-CH2-ОН
СН3
СН3
CH3-C-ОН
СН3
5. МЕТОДИ ДОБУВАННЯ
МЕТОДИ ДОБУВАННЯ• До головних промислових методів добування
відносяться:
• гідратація алкенів,
• гідрування карбонільних сполук,
• реакція оксосинтезу,
• ферментативна переробка вуглеводів.
• Крім цього, існують лабораторні методи
одержання спиртів: гідроліз галогеноалкілів та
синтез за допомогою металоорганічних сполук.
6. ПРОМИСЛОВІ МЕТОДИ ДОБУВАННЯ
• Гідратація алкенівCH2 CH CH3 + H2O
H2SO4
o
80-90 C
3,5 мПа
CH3 CH CH3
OH
2-Пропанол
• Гідрування карбонільних сполук (альдегідів, кетонів, естерів)
Так, альдегіди утворюють первинні спирти:
O
R C
H
H2/Кат.
R-CH2-OH
Кетони утворюють вторинні спирти:
R C R
O
H2/Кат.
R CH R
ОН
7. Естери також утворюють первинні спирти (реакція Буво-Блана):
Естери також утворюють первинні спирти (реакція Буво-Блана):
R-C
O
H2/Кат.
O C2H5
Етиловий естер
карбонової кислоти
R-СН2-ОН
C2H5 ОН
Первинні спирти
• Гідрування оксиду вуглецю або оксосинтез
Суміш оксиду вуглецю і водню (синтез-газ) залежно від умов
процесу (природа каталізатора, температура, співвідношення
компонентів) може утворювати різні спирти:
CO + 2 H2
6CO + 12 H2
Co
o
t
ZnO
o
t
CH3OH
CH3 CH2 CH2 OH
CH3 CH CH3
OH
Суміш спиртів (синтол)
4 H2O
8. Синтез вищих спиртів
•Синтез вищих спиртівAl(C2H5)3
3n CH2 CH2
Al [(CH2 CH2)n C2H5]3
Триетилалюміній
O2
Al [ O ( CH2 CH2 )n C2H5]3 3 H2O
Al(OH)3
3 HO ( CH2 CH2 )n C2H5
Ферментативна переробка вуглеводів
Ферментативне розщеплення вуглеводів (спиртове бродіння) здавна
служить методом одержання етанолу:
Фермент
C6H12O6
Моносахарид
(глюкоза, фруктоза,
маноза)
2 C2H5OH
2 CO2
9. Сировиною можуть служити і полісахариди, які попередньо гідролізують до моноз:
(C6H10O5)nПолісахарид
(крохмаль)
n H2O H
Фермент
n C6H12O6
Моносазарид
(Глюкоза)
2n C2H5OH
2n CO2
10. ЛАБОРАТОРНІ МЕТОДИ ДОБУВАННЯ
• Гідроліз галогеноалкілівRCI + NaOH
R OH + NaCI
• Гідроборування – окиснення алкенів.
6 CH3 CH CH2
B2H6
2 B ( CH2 CH2 CH3)3
Трипропілборан
B ( CH2 CH2 CH3)3
3 H2O2
3 CH3 CH2 CH2 OH
1-Пропанол
H3BO3
11. ФІЗИЧНІ ВЛАСТИВОСТІ
• Спирти С1-С10- рідини, починаючи з С11 - тверді речовини.Одноатомні спирти С1-С3 змішуються з водою у будь-якому
співвідношенні. Розчинність у воді інших спиртів
зменшується з ростом довжини вуглецевого ланцюга в їх
молекулах.
Температура кипіння спиртів вища, ніж у алкілгалогенідів і
алканів з тим же числом вуглецевих атомів. Це
пояснюється наявністю водневих зв’язків між молекулами
спирту, які ведуть до утворення асоціатів.
H O
H O
H O
H O
R
R
R
R
12. ХІМІЧНІ ВЛАСТИВОСТІ
• Хімічні властивості спиртів визначаються наявністюполярних зв’язків О—Н та О—С, а також неподілених
електронних пар кисню. Причому полярність зв’язку О—Н
значно вища, ніж зв’язку С—О.
о
106
Н3С
О
2
Н
Н
1
Н3С
О
13. Кислотно-основні властивості спиртів
• Кислотно-основні властивості спиртівЗв’язок ОН у спиртах досить полярний, тому спирти дисоціюють з
утворенням протонів, через що вони проявляють кислотні властивості.
R О Н
R О
Н
або
RO
H
Кислотність спиртів підтверджується взаємодією їх з лужними металами
(К, Na, тощо). При цьому утворюються алкоголяти, R—ОNa.
2ROH + 2 Na
2RONa + H2
У водному середовищі алкоголяти легко гідролізують, тому одержати їх
взаємодією спирту з лугом неможливо
R—ONa + H2O
R—OH + NaOH
Однак, спирти є слабшими кислотами, ніж вода і їх кислотність
зменшується в ряді: первинний > вторинний > третинний.
14.
Поряд з кислотними властивостями, спирти проявляють основнівластивості за рахунок наявності на атомі кисню двох неподілених пар
електронів (за теорією Льюїса основи - це донори електронів).
Основність спиртів, на відміну від кислотності, зростає від первинних
до третинних.
Спирти доволі легко протонуються з утворенням алкоксоніевих йонів.
Утворені алкоксонієві йони можуть легко відщеплювати воду,
перетворюючись у карбокатіони
R О Н
Основа Льюїса
HHal
H
R О Н
Hal
R
H2O
Hal
Алкоксонієвий
йон
Таким чином, спиртам характерні амфотерні властивості: слабка
кислотність або основність будуть переважати, залежно від природи
спирту. Крім того, наявність неподілених пар електронів на атомі
кисню надає їм нуклеофільності. Особливо сильні нуклеофіли
алкоксианіони R—O–, які утворюються при дисоціації алкоголятів .
15. Заміщення гідроксильної групи на галоген
• Заміщення гідроксильної групи на галогенПри взаємодії спиртів з HCl, HBr тощо, відбувається заміщення НО-групи
на галоген:
С2Н5—ОН + НСІ
С2Н5—СІ + Н2О
Легше всього вступають у реакцію третинні спирти за механізмом SN1
СН3
СН3 С ОН
СН3
Н
СН3 Н
СН3 С
О Н
СН3
Повільно
СН3
СН3
С
H2O
потім вторинні і нарешті первинні (механізм SN2):
СН3
Cl
Швидко
СН3
СН3 С Cl
СН3
16. Механізм SN2
H+
CH3 O H + H
H
CH3 О Н + Cl
CH3 О Н
Алкоксонієвий
катіон
СІ
Н
Н
C
О H
Н
Н
Перехідний стан
(SN2)
Н
СІ C
Н + Н2О
Н
17. Взаємодія з галогеннуклеофілами PCl5, PCl3, SOCl2, також веде до утворення алкілгалогенідів з майже кількісним виходом:
С2Н5—ОН + РСІ5С2Н5—СІ + РОСІ3 + НСІ
Оксохлорид
фосфору
18. Реакція утворення естерів (ацилювання спиртів)
• Реакція утворення естерів (ацилювання спиртів)При взаємодії спиртів з органічними кислотами утворюються естери,
які можна розглядати як похідні спиртів, у яких атом водню ОН-групи
замінено на залишок кислоти -ацил.
1
O
Н O R
RC
OH
Н
H2O
O
1
RC
О R
Естер
Ацилювання спиртів кислотами називають естерифікацією.
Естерифікація протікає у присутності каталізаторів – сильних
мінеральних кислот (конц.H2SO4, H3PO4 тощо). Реакція естерифікації –
оборотна. Зворотна реакція називається гідролізом естеру.
19. Дегідратація спиртів (реакція Е)
• Дегідратація спиртів (реакція Е)Реакцією дегідратації зі спиртів отримують алкени та алкадієни.
Дегідратація протікає при нагріванні спирту з концентрованою
сульфатною або фосфатною кислотами (а також АІ2О3,.кислих солей
цих кислот та ін.).
Встановлено, що легше дегідратуються третинні спирти, тоді вторинні і
далі первинні .
СН3
СН3 С ОН
Н
СН3
СН3 С
СН3
H2O
СН2
В результаті міжмолекулярної дегідратації утворюються етери:
C2H5O H + HO C2H5
H+
C2H5 O C2H5 + H2O
Діетиловий етер
20. Окиснення спиртів
Окиснення спиртів
Спирти окиснюються за допомогою KMnO4, K2Cr2O7, CrO3 або О2 в
присутності Сu.
Первинні спирти утворюють альдегіди. Останні можуть в умовах
реакції окиснюватися до карбонових кислот:
СН3 СН2 ОН
О
О
CH3 C
H2O
Н
Оцтовий альдегід
О
О
CH3 C
OН
Оцтова кислота
Вторинні спирти утворюють кетони:
Н3С
Н3С
О
CН-OН
2-Пропанол
H2O
СН3
С=О
СН3
Диметилкетон (2-Пропанон)
(ацетон)
Третинні спирти окиснюються важко з розривом зв’язку С-С та з
утворенням суміші кислот і кетонів
21. ОДНОАТОМНІ НЕНАСИЧЕНІ СПИРТИ (АЛКЕНОЛИ, АЛКІНОЛИ)
Ненасиченими називаються такі спирти, у яких гідроксильна ОН-групазв’язана з атомом вуглецю ненасиченого вуглеводня. Їх назви за
замісниковою номенклатурою складаються з назви вуглеводня і
суфікса -ол.
Нумерацію головного ланцюга починають з того кінця, ближче до
якого знаходиться ОН-група.
Назви за радикало-функціональною номенклатурою утворюються
аналогічно до назв насичених спиртів .
CH2=CН-ОН
Етенол або Вініловий спирт
CH2=CН-СН2-ОН
2-Пропен-1-ол або Аліловий спирт
СН С-СН2-ОН
2-Пропін-1-ол
22. Найпростіший представник - вініловий спирт у вільному вигляді не існує, тому що спирти з гідроксильною групою при вуглеці з
подвійним зв’язком нестійкі і ізомеризуються в альдегіди і кетони(правило А.П.Ельтекова-Ерленмейєра).
Натомість етери і естери вінілового спирту стійкі і застосовуються для
одержання полімерів, наприклад:
CH2 CН O C4H9 або CH2 CН O C CH3
Вінілбутиловий етер
Вінілацетат
Аліловий спирт використовують для одержання гліцеролу, акролеїну,
акрилової кислоти. Етери алілового спирту застосовують для одержання
пластичних мас.
Пропаргіловий спирт використовують в органічному синтезі.
23. Спирти Назарова - третинні вінілацетиленові (енінові) спирти, одержують за реакцією Фаворського
СН3CH2 CН С СH
С=О
СН3
Безводний КОН
CH2 CН С С C ОH
СН3
Вінілацетилен Ацетон
Спирт Назарова
Спирти Назарова здатні до реакцій полімеризації з утворенням
високоякісних універсальних клеїв.
СН3
24. ДВОАТОМНІ НАСИЧЕНІ СПИРТИ (ГЛІКОЛІ АБО АЛКАНДІОЛИ)
Двоатомні насичені спирти або гліколі - це спирти з двомагідроксильними групами при різних вуглецевих атомах.
• За систематичною замісниковою номенклатурою для утворення назви
гліколя до назви відповідного алкану додають закінчення -діол і
вказують місце груп ОН в головному ланцюзі. За радикалофункціональною номенклатурою назви діолів утворюють додаючи до
назви відповідного двохвалентного радикала, що зв’язаний з двома
ОН-групами, суфіксу - гліколь.
• Слід відзначити, що гліколі з двома ОН-групами при одному атомі
вуглецю не існують тому, що такі продукти одразу втрачають воду і
перетворюються в альдегіди або кетони.
Н
CH3 C ОH
ОН
H2O
CH3 C
О
H
25.
ФормулаНоменклатура IUPAC
Замісникова
Радикалофункціональна
HO-CН 2-СН2-ОН
Етандіол
Етиленгліколь
СН3 С Н СН 2
ОН ОН
1,2-Пропандіол
α-Пропіленгліколь
HO-CH2-CH 2-CH 2-ОН
1,3-Пропандіол
β-Пропіленгліколь
триметиленгліколь
HO-CH2-CH 2-CH 2-СН2-ОН
1,4-Бутандіол
γ-Бутиленгліколь
тетраметиленгліколь
СН2 С Н СН 2 CH 3
ОН ОН
1
СН3
2
3
1,2-Бутандіол
α -Бутиленгліколь
2-Метил-1,2-пропандіол
α -Ізобутиленгліколь
2,3-Диметил-2,3бутандіол
(Пінакон)
CH 2 C CH 3
ОН ОН
СН3 СН3
CH 3 C
С CH 3
ОН ОН
26. СПОСОБИ ДОБУВАННЯ
• Гідроліз дигалогенопохіднихСІ-СН2-СН2-СІ
+2 Н2 О
НО-СН2-СН2-ОН
-2 НСІ
• Гідратація органічних оксидів (епоксидів )
CН2-СН2
НОН
Н
CН2-СН2
ОН ОН
О
• Окиснення алкенів водним розчином KMnO4 (реакція Вагнера).
CH2=CH2
KMnO4
H2O
CH2
CH2
OH
OH
Етиленгліколь
Як окиснювач може застосовуватись пероксид водню Н2О2:
27. ФІЗИЧНІ ВЛАСТИВОСТІ
• Гліколі мають більшу в’язкість і киплять при вищихтемпературах, ніж одно атомні спирти з тим же числом
вуглецевих атомів, внаслідок наявності досить сильних
водневих зв'язків. Вони краще розчиняються у воді, ніж
одноатомні спирти.
28. ХІМІЧНІ ВЛАСТИВОСТІ
За своїми хімічними властивостями вони аналогічні одноатомнимспиртам. Однак, наявність двох гідроксильних груп надає їм ряд
специфічних властивостей.
• Кислотні властивості гліколів
Завдяки наявності другої ОН-групи, що проявляє -І-ефект, кислотність
гліколів вища, ніж одноатомних спиртів (особливо гліколів з
гідроксильними групами при сусідніх атомах вуглецю). Такі гліколі, на
відміну від спиртів, вже здатні реагувати з гідроксидами лужних
металів утворюючи відповідні гліколяти.
СН2 ОН
СН2 ОН
СН2 ОNa
NaOH
H2O
СН2 ОН
Натрій
гідрогенгліколят
NaOH
СН2 ОNa
H2O
СН2 ОNa
Натрій
гліколят
29. З гідроксидами важких металів, наприклад (СuОН)2 такі гліколіз утворюють комплексні сполуки (хелати), у яких поряд з
ковалентнимзв’язком Сu—О є донорно-акцепторний зв’язок Сu :О.
Н
CН2-ОН
CН2-ОН
Cu(OH)2
НО-CH2 -2H О
2
CН2-О
НО-CH2
CН2-О
Cu
Н
О СН2
О СН2
• Утворення етерів та естерів
СН2 ОН
СН2 ОН
HO C2H5
H
H2O
СН2 О C2H5
СН2 ОН
2-Етоксиетанол
(Етилцелозольв)
C2H5OH
H2O
СН2 О C2H5
СН2 О C2H5
1,2-Диетоксиметан
30. Естери утворюються при естерифікації гліколів мінеральними або органічними кислотами:
СН2 ОНHONO2
СН2 ОН
HONO2
СН2 О NO2
2H2O
СН2 О NO2
• Реакції дегідратації
Внутрішньомолекулярна дегідратація
CН2 CН2
ОН
ОН
Н
-H2О
О
CН2= CН
ОН
CH3
C
Н
31.
CН2-СН2-CН2ОН
ОН
Н
, 280оС
CH2-CH2-CH2-СН2
ОН
CН2=CН СН2ОН
-H2О
ОН
Н
, 280оС
-H2О
СН2
СН2
СН2
СН2
О
Тетрагідрофуран
o
CH2-CH2-CH2-СН2
ОН
Кат., t
ОН - 2H2О
CH2 CH CH CH2
1,3-Бутадієн
32. Міжмолекулярна дегідратація
• У випадку міжмолекулярної дегідратації можуть утворюватисьлінійні гідроксиетери або циклічні етери:
НО-СН2-СН2-ОН + НО-СН2-СН2-ОН
НО-СН2-СН2-О-СН2-СН2-ОН
-Н 2О
Н2С
Н2С
ОН
ОН
НО
НО
Діетиленгліколь
О
СН2
H2SO4, t
Н2С
СН2
СН2
-2H2О
Н2С
СН2
o
О
Діоксан
(циклічний етер)
33. ТРИАТОМНІ НАСИЧЕНІ СПИРТИ (АЛКАНТРИОЛИ)
Спирти, що містять три гідроксильні групи, називаютьсятриатомними. Їх загальна формула - СnН2n-1(OH)3. За
систематичною номенклатурою їх називають так само, як і
гліколі, замінюючи суфікс -діол на –триол. Найбільш
розповсюдженим в природі є триатомний спирт 1,2,3пропантриол, який частіше називають гліцерол або
гліцерин.
CН2 CH СН2
ОН ОН ОН
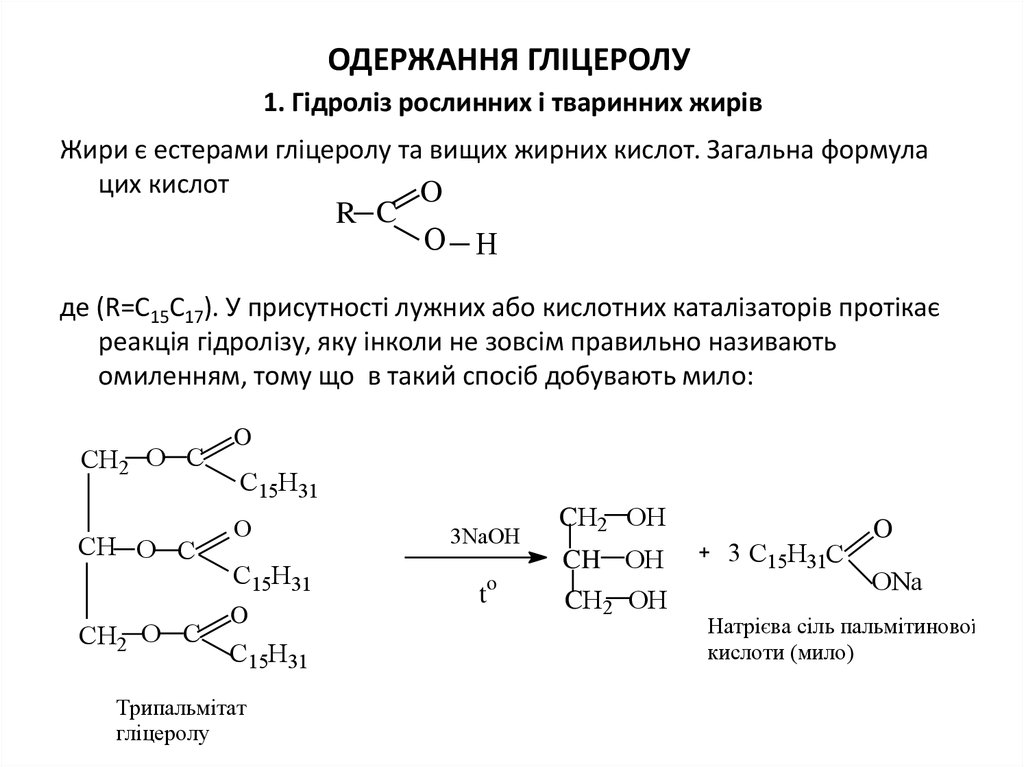
34. ОДЕРЖАННЯ ГЛІЦЕРОЛУ 1. Гідроліз рослинних і тваринних жирів
ОДЕРЖАННЯ ГЛІЦЕРОЛУ1. Гідроліз рослинних і тваринних жирів
Жири є естерами гліцеролу та вищих жирних кислот. Загальна формула
цих кислот
O
R C
О H
де (R=C15C17). У присутності лужних або кислотних каталізаторів протікає
реакція гідролізу, яку інколи не зовсім правильно називають
омиленням, тому що в такий спосіб добувають мило:
СН2
О С
СН О С
СН2 О С
O
С15Н31
О
С15Н31
O
С15Н31
Трипальмітат
гліцеролу
3NaOH
o
t
CН2 ОН
CH ОН
CН2 ОН
3 С15Н31С
O
ОNa
Натрієва сіль пальмітинової
кислоти (мило)
35. З пропену (головний промисловий метод одержання синтетичного гліцеролу)
Через алілхлорид.СН2 СН СН2СІ
+5%NaOH
-NaCI
Алілхлорид
+HOH
-HCI
+HOCI
СН2 СН СН2 ОН
CН2-СН-СН2
СІ ОН ОН
(CI2+ H2O)
Аліловий спирт
CН2-СН-СН2
ОН СІ ОН
Монохлоргідрини
гліцеролу
CН2-СН-СН2
ОН ОН ОН
Інколи застосовують оприєднання до алілового спирту пероксиду водню:
CН2=CН СН2 ОН
НO ОН
70оС
Кат.
CН2 СН CН2
ОН
ОН ОН
36.
СН2 СН СН3О2,Сu
о
270 С
СН2 СН С
Акролеїн
О
Відновлення
Н
СН2 СН СН2 ОН
Н2О2
СН2(ОН) СН(ОН ) СН2ОН
ФІЗИЧНІ ТА ХІМІЧНІ ВЛАСТИВОСТІ
Гліцерол за своїми властивостями нагадує гліколі. Це в’язка
висококипляча рідина. Він гігроскопічний і добре розчиняється у воді.
• 1. Кислотні властивості
• За кислотністю гліцерол перевищує гліколь внаслідок взаємного
індуктивного впливу (-І-еф.) трьох гідроксильних груп. Так, з
гідроксидами важких металів утворюються комплексні сполуки гліцерати:
Н
Н
CН2 ОН
CH ОН
CН2 ОН
CН2-О
НО CН2
Cu(OH)2
Н О CH
Н О CН2
2 H2O
CН О
СН2-ОН
Cu
О СН2
О СН
НО СН2
Мідь гліцерат
(синього кольору)
37. 2. Утворення естерів
Практичне значення має повний естер гліцеролу та нітратної кислоти тринітрат гліцеролу, що застосовується у виробництві вибуховихречовин і ліків (1% р-н - серцеві ліки, просочена ним деревинна тирса
або інфузорна глина - динаміт):
CН2 ONO2
CH ONO2
CН2 ОН
CH ОН
CН2 ОН
3НО-NO2
3Н2О
CН2 ONO2
Тринітрат гліцеролу
Взаємодією гліцеролу з карбоновими кислотами або їх ангідридами
О
також одержують відповідні естери:
CН2 ОН
О
CH ОН
CН2 ОН
3НО С СН3
Н
o
t
3 Н2О
CН2 О С СН3
О
CH О С СН3
О
CН2 О С СН3
38. 3. Дегідратація гліцеролу
У присутності водовідщеплюючих засобів або каталізаторів принагріванні протікає реакція дегідратації гліцеролу:
CН2 CH CН2
ОН
ОН ОН
+ о
Н
,t
-2Н2О
CН2=С CH
ОН
CН2=CH С
Гліцерол використовується в виробництві пластичних мас
нітрогліцерину в текстильній промисловості, в шкіропереробній
галузі,– при виправці шкір і наданні їм мякості; в харчовій
промисловості та при виробництві парфюмерно-косметичних засобів.
О
Н





































 Химия
Химия








