Похожие презентации:
Термодинамическая система
1.
Лекция 92. Молекулярная физика
2.3. Термодинамика
Равновесный процесс. Внутренняя энергия. Работа.
Круговой процесс. Теплота. Теплоемкость. Первое
начало термодинамики. Уравнение теплового
баланса. Теплота плавления, парообразования,
сгорания топлива. Значения теплоемкости при
изопроцессах. Уравнение Майера. Адиабатический
процесс. Политропические процессы.
2.
Термодинамическая системаТермодинамической системой называется совокупность
макроскопических (состоящих из очень большого числа частиц)
тел, обменивающихся энергией как между собой (друг с другом), так
и с внешними телами. Пример: газ в цилиндре под поршнем.
Равновесное состояние
Равновесное состояние – при котором все параметры системы
имеют определенные значения, не изменяющиеся со временем.
Неравновесное состояние
Состояние, при котором хотя бы один из параметров системы не
имеет определенного значения, называется неравновесным.
Термодинамический процесс
Термодинамический процесс – переход системы из одного
состояния в другое.
Равновесный процесс
Бесконечно медленный процесс состоит из последовательности
равновесных состояний. Такой процесс можно считать
равновесным (квазистатическим), так как параметры системы
успевают выровняться по всей системе
Равновесные процессы обратимы!
3.
Внутренняя энергияВнутренней энергией системы называется сумма кинетических
энергий хаотического движения всех молекул и потенциальных
энергий взаимодействия всех молекул друг с другом.
Внутренняя энергия идеального газа
Вся внутренняя энергия идеального газа представляет собой
кинетическую энергию теплового движения (потенциальная энергия
взаимодействия молекул для идеального газа равна нулю).
Внутренняя энергия одноатомного газа прямо пропорциональна его
абсолютной температуре, массе газа, и обратно пропорциональна
его молекулярному весу.
Многоатомный газ:
3
m
3m
U E N kT N A
RT
2
2
Круговой процесс (цикл)
i m
U
RT
2
Процесс, при котором система возвращается в исходное
положение, называется круговым, или циклом.
U 0
Если система совершает круговой процесс (цикл), то
ее внутренняя энергия возвращается в исходное состояние.
4.
Изменение внутренней энергииИзменение внутренней энергии системы в термодинамике может
происходить двумя способами:
1) за счет передачи системе тепла от окружающих ее тел;
2) за счет совершения этими телами работы над системой.
Работа в термодинамике
Работой в термодинамике называется процесс обмена энергией
между системой и окружающими ее телами вследствие изменения
взаимного расположения взаимодействующих тел.
A 0 если тело совершает работу над окружающими телами, и
A 0 если тела совершают работу над системой.
Работа при расширении газа
Газ в сосуде с поршнем, расширившись и сдвинув
поршень, совершит работу:
A 0
V const
pV
m
RT
dA F dx p S dx pdV
p const
A p V
A
A p(V2 V1 )
m
R T
m
R(T2 T1 )
V2
pdV
V1
5.
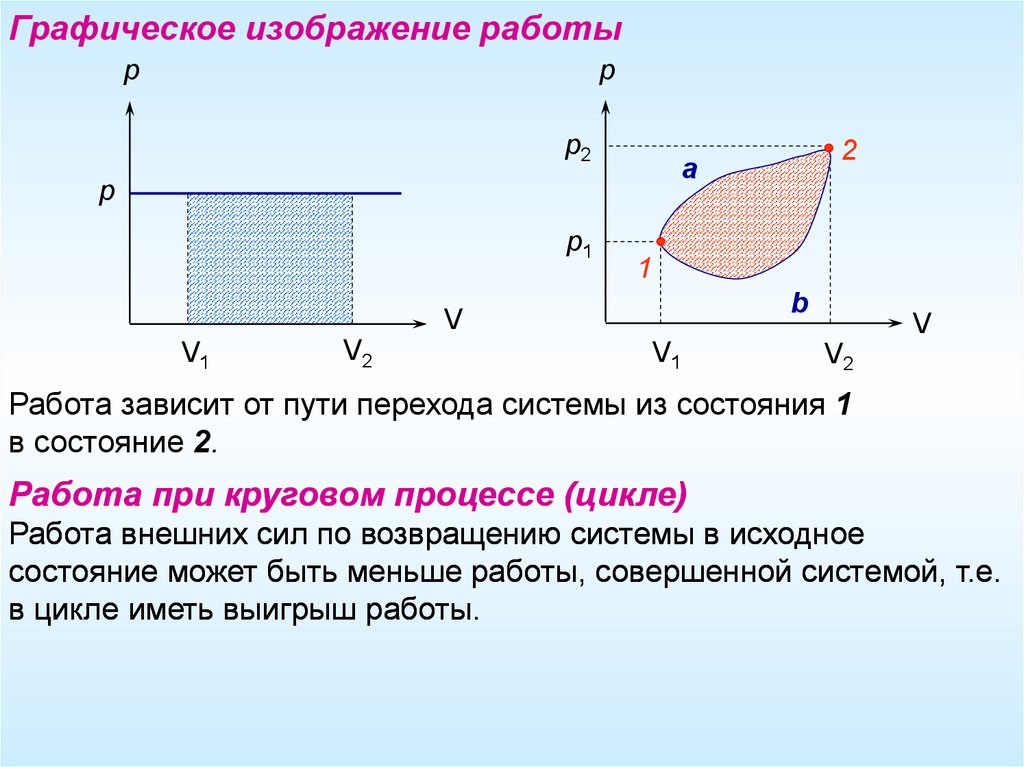
Графическое изображение работыр
р
р2
р
р1
1
b
V
V1
V2
2
a
V1
V
V2
Работа зависит от пути перехода системы из состояния 1
в состояние 2.
Работа при круговом процессе (цикле)
Работа внешних сил по возвращению системы в исходное
состояние может быть меньше работы, совершенной системой, т.е.
в цикле иметь выигрыш работы.
6.
ТеплоотдачаТеплоотдачей или теплообменом называется процесс обмена
энергией между системой и окружающими ее телами без
совершения работы только вследствие изменения внутренней
энергии этих других тел.
Теплота
Энергия, отдаваемая или получаемая системой в процессе
теплообмена, называется количеством тепла (теплотой).
Q 0 если система получает тепло (нагревается), и
Q 0 если система отдает тепло (охлаждается).
Калория
Калория — внесистемная единица тепла, численно равная
количеству тепла, необходимого чтобы нагреть 1 г воды на 1 °С (от
19,5 °С до 20,5 °С). 1 кал = 4,18 Дж.
Теплоемкость
Теплоемкостью тела называют скалярную физическую величину,
характеризующую связь между количеством сообщаемого системе
тепла и изменением ее температуры.
Различают полную, удельную и молярную теплоемкость.
7.
Полная теплоемкостьПолная теплоемкость тела численно равна количеству тепла,
необходимого для повышения температуры тела на 1 градус.
Удельная теплоемкость
dQ
Cпол н
dt
dQ Cполн dt
Удельная теплоемкость вещества численно равна количеству
тепла, необходимого для повышения температуры единицы массы
вещества на 1 градус.
dQ
Молярная теплоемкость
c
m dt
dQ c m dt
Молярная теплоемкость вещества численно равна количеству
тепла, необходимого для повышения
dQ
dQ
С
c
температуры 1 моля вещества на 1 градус.
dt m
Теплоемкость газов
dt
Теплоемкость газов зависит от характера процесса, при котором
система получает тепло. Различают:
С p (при p const )
– теплоемкость при постоянном давлении
СV (при V const )
– теплоемкость при постоянном объеме
– теплоемкость при постоянной температуре СT (при T const )
8.
Теплоемкость жидкостей и твердых телЖидкие и твердые тела расширяются при нагревании
незначительно, поэтому их Сp и СV практически не различаются.
Первое начало термодинамики
Первым началом термодинамики называется закон сохранения
энергии, распространенный на тепловые явления.
Изменение внутренней энергии системы при переходе ее из одного
состояния в другое равно сумме работ внешних сил и количества
теплоты, переданного системе.
U Q A
dU dQ dA
(работа со знаком "–", потому что совершается над системой).
Или:
Q U A
dQ dU dA
Количество теплоты, переданное системе, идет на изменение ее
внутренней энергии и на совершение системой работы над
внешними телами.
9.
Первое начало термодинамикиU Q A
Q U A
Следствия из первого начала термодинамики:
1) Изолированная система
Если система изолирована (теплота ей не передается и работа
над ней не совершается), то ее внутренняя энергия остается
неизменной (сохраняется).
A 0
U 0
Q 0
2) Принцип эквивалентности тепла и работы
При круговом процессе система не может совершать работу без
подвода тепла извне, или совершать работу большую, чем
подводимое к ней тепло.
A Q
U 0
3) Вечный двигатель первого рода
Если тепло к системе не подводится, то работа может быть
совершена только за счет убыли внутренней энергии.
Q 0
A U
Невозможен вечный двигатель первого рода, т.е. устройство,
которое совершало бы работу без подвода энергии извне!
10.
Первое начало термодинамикиU Q A
Q U A
4) Замкнутая система тел
Замкнутой системой тел называется такая система, которая не
обменивается ни энергией, ни веществом с окружающей средой.
Внутренняя энергия замкнутой системы изменится
не может!
n
U U1 U 2 U n U i 0
i 1
Если никакой работы внутри системы не совершается (все тела
неподвижны), то:
Q U 0
A 0
Уравнение теплового баланса
Алгебраическая сумма количеств теплоты, отданных и полученных
в замкнутой системе участвующими в теплообмене неподвижными
n
телами, равна нулю.
Q Q1 Q2 Qn Qi 0
Q 0
i 1
m1c1 ( t1 ) m2c2 ( t2 ) mn cn ( tn ) 0
θ – температура, установившаяся после наступления теплового
равновесия.
11.
Плавление / кристаллизацияПлавлением называется переход вещества из твердого в жидкое
состояние. Обратный процесс называется кристаллизацией.
Удельная теплота плавления / кристаллизации
Удельной теплотой плавления называется количество теплоты,
необходимое для превращения при температуре плавления 1 кг
кристаллического вещества в жидкость.
Q m
При кристаллизации жидкости такое же точно
количество теплоты выделяется.
пл
Qкр m
Парообразование / конденсация
Парообразованием (испарением, кипением) называется переход
вещества из жидкого состояния в газообразное. Обратный процесс
называется конденсацией.
Удельная теплота парообразования / конденсации
Удельной теплотой парообразования называется количество
теплоты, необходимое для превращения при постоянной
температуре 1 кг жидкости в пар.
Q rm
пар
При конденсации пара такое же точно
количество теплоты выделяется.
Qкон r m
12.
Удельная теплота сгорания топливаУдельной теплотой сгорания топлива называется количество
теплоты, выделяющееся при сгорании 1 кг топлива. Q
qm
сгор
Теплоемкость при постоянном объеме
При изохорном процессе:
A p V 0
СV
Q U A U
dQ
dT
V const
dU
dT
Теплоемкость при постоянном давлении
При изобарном процессе: dQ dU dA dA p dV m R dT R dT
dQ
Сp
dT
p const
d (U A) dU
dA
RdT
СV
СV R
dT
dT dT
dT
Уравнение Майера
С p СV R
Универсальная газовая постоянная – физическая величина,
численно равная работе расширения одного моля идеального газа
в изобарном процессе при нагревании его на 1 градус.
13.
СpCV R
R
1
CV
CV
CV
Введем отношение теплопроводностей:
CV
R
1
i
U RT
2
При изохорном процессе:
СV
dQ
dT
V const
dU
dT
dU СV dT
i
i 2
С p СV R R R
R
2
2
i
dU R dT
2
i
СV R
2
Сp
i 2
CV
i
Адиабатический процесс
Адиабатическим (адиабатным) называется процесс, при котором
отсутствует теплообмен с окружающей средой
Q 0
(в теплоизолированной системе).
Q U A
A U
СQ 0
При адиабатическом процессе газ совершает работу только за счет
уменьшения своей внутренней энергии. К адиабатическим можно
отнести все быстро протекающие процессы.
14.
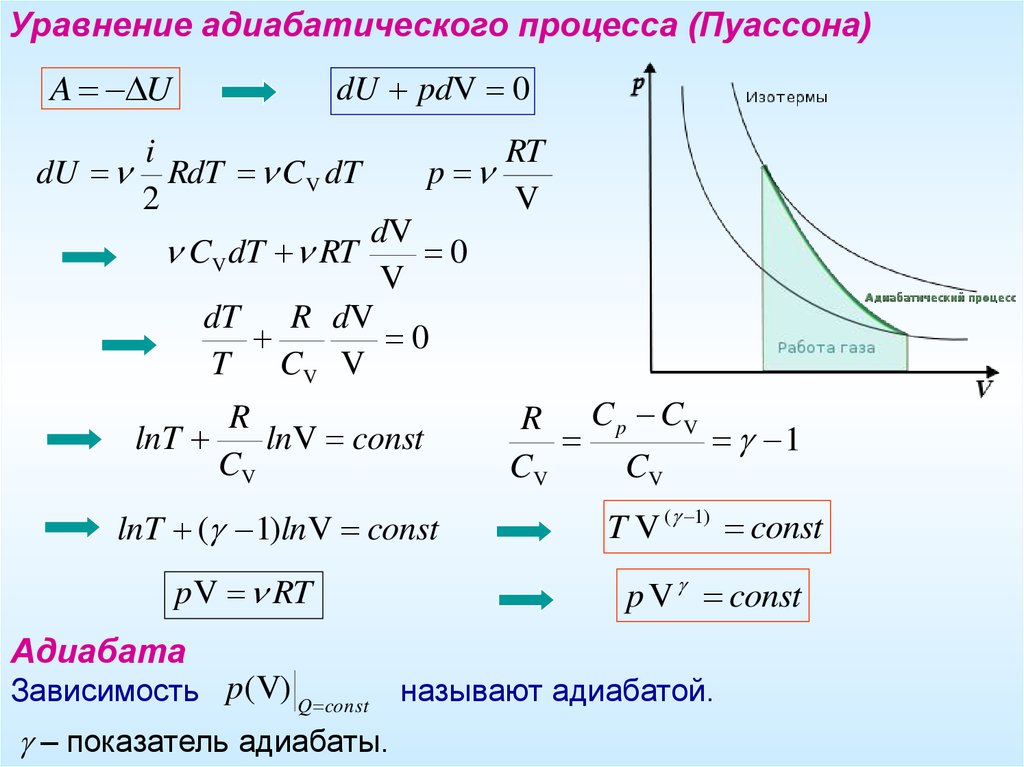
Уравнение адиабатического процесса (Пуассона)A U
dU pdV 0
i
dU RdT CV dT
2
RT
p
V
dV
CV dT RT
0
V
dT
R dV
0
T CV V
R
lnT
lnV const
CV
lnT ( 1)lnV const
p V RT
R C p CV
1
CV
CV
T V ( 1) const
p V const
Адиабата
Зависимость p(V) Q const
– показатель адиабаты.
называют адиабатой.
15.
Политропический процессПолитропическими называются процессы, в ходе которых
теплоемкость остается постоянной.
С const
p V n const
T V ( n 1) const
n
Политропа
C Cp
C CV
Зависимость p(V) С const называют политропой.
n – показатель политропы.
Изопроцесс:
p = const
T = const
Q = const
V = const
n:
0
1
C:
Cp
0
CV













 Физика
Физика








